埃罗替尼对肾上腺皮质癌SW13细胞系增殖及凋亡的影响及其机制研究
2015-07-26徐烈雨廉建坡陈东宁赵菊平吴瑜璇沈周俊
徐烈雨,廉建坡,陈东宁,祝 宇,赵菊平,吴瑜璇,沈周俊,宁 光
(上海交通大学医学院附属瑞金医院:1.泌尿外科;2.内分泌科 上海 200025)
肾上腺皮质癌恶性程度高,病程进展迅速,早期诊断较困难;目前针对肾上腺皮质癌的发病机制尚未阐明,尤其对于进展期暂时缺乏有效的治疗手段。表皮生长因子受体(epiderminal growth factor receptor,EGFR)是一种跨膜糖蛋白,主要由膜外配体结合区、单链跨膜区及高度保守的膜内酪氨酸激酶区组成;其相关信号通路涉及细胞生长、分化、增殖、凋亡等多方面。已有的研究表明在肾上腺皮质癌肿瘤中EGFR呈过表达,同时EGFR高表达也提示皮质癌肿瘤的恶性分型以及预后不良[1-2];体外实验也验证抑制EGFR信号通路后能促进ACC细胞系凋亡,起到一定程度的抑制作用。
埃罗替尼(Erlotinib)是一类EGFR小分子抑制剂;其对肾上腺皮质癌细胞尚不明确。本文将重点观察埃罗替尼对肾上腺皮质癌SW13细胞系信号通路、增殖、凋亡和细胞周期的影响,并探讨其可能的作用机制。
1 材料与方法
1.1 主要材料①细胞:人肾上腺皮质癌细胞株SW13购自上海中科院细胞库;②药物:埃罗替尼购自美国Selleck公司;③试剂:ERK、mTOR、p-ERK、p-mTOR抗体(CST公司,美国),DMEM 高糖培养基及新生肽牛血清(Gibco公司,美国),碘化丙叮(PI)、四甲基偶氮唑(MTT)、DMSO(Sigma公司,美国);④仪器:流式细胞仪 LSRII(BD Bioscience),各种规格培养皿(Corning Costar,美国)。
1.2 细胞培养SW13细胞系接种于96孔板(MTT)或者6cm培养皿(流式细胞仪和蛋白检测),DMEM基质,10%胎牛血清(体积分数)以及1%的双抗,37℃、5%CO2恒温孵箱常规培养,当细胞密度达到70%~80%左右用于MTT或者流式试验。
1.3 MTT法检测细胞活力取对数生长期SW13细胞以6.0×103/孔密度接种于96孔板,每组设置5个复孔,分别于加相应浓度药物(1、2.5、5、10、25、50、125μmol/L)后12、24、48、72h后测定细胞活力,加入200μL/孔10%MTT,避光37℃恒温孵箱培养4h后吸去培养基中 MTT,然后加入100μL/孔DMSO,室温摇床放置10min,与酶标仪测定各孔吸光值(570nm),绘制细胞生长曲线。实验重复3次,按下述公式计算细胞存活率,细胞存活率(%)=(实验组A-空白组 A)/(阴性组 A-空白组 A)×100%。
1.4 细胞凋亡检测 将处于对数生长期的SW13细胞以3.5×105/孔密度接种于6孔板,加入相应浓度药物(5、20μmol/L)后24h收集细胞,用无 EDTA的胰酶处理消化SW13细胞系,14 000r/min×5min离心后去上清,加入Binding缓冲液60μL/孔重悬,制成单细胞悬液;加入3.8μL FITC-AnnexinV混匀静置10min,再加入3.8μL PI混匀后室温避光反应10min。上机前每孔各加入Binding缓冲液120μL,混匀与流式细胞仪上机,检测细胞凋亡情况;重复3次实验。
1.5 细胞周期测定将处于对数生长期的细胞以3.5×105/孔密度接种于6孔板,加入相应浓度药物后24h收集细胞,按照周期试剂盒测定标准流程操作,使用BD流式细胞仪分析软件,重复3次实验。
1.6 蛋白检测收集相应浓度药物处理的SW13细胞,分别加入 RIPA、Cocktail、PMSF(体积比100∶10∶1),冰上裂解30min,后4℃12 000r/min离心30min,收集上清液后于酶标仪BCA定量后以4×Loading液99℃煮沸5min,于-20℃保存。取蛋白于10%的SDS聚丙烯酰胺凝胶中电泳,100V恒压转膜120min后以3%BSA封闭1h后,一抗(3%BSA稀释1∶1 000)4℃孵育过夜;PBST洗涤三次后与相应种属二抗(3%BSA稀释1∶10 000)孵育1 h后机器显影,每次实验重复3次。
1.7 统计学分析应用SPSS 17.0统计分析软件,结果以±s表示,使用配对t检验来分析两群细胞之间的差异,P<0.05认为差异有统计学意义,以Graphpad Prism 5.0软件作图。
2 结 果
2.1 埃罗替尼呈浓度-时间相关地抑制SW13细胞增殖通过MTT实验结果显示,培养12、24、48、72 h后,1~125μmol/L浓度的埃罗替尼分别可以抑制SW13细胞增殖,各组与12h处理组相比均有统计学差异。其中,作用24h时,1μmol/L埃罗替尼约抑制20%左右的SW13活力,当浓度增加到25 μmol/L时,抑制率可达50%,提示埃罗替尼可以呈剂量相关地抑制细胞增殖;同样,当25μmol/L埃罗替尼处理12h时,其抑制率约为45%,但当作用时间增加到48h时,抑制率可达70%,进一步证实埃罗替尼抑制增殖效率与时间相关 (图1)。

图1 通过MTT实验检测一定浓度和时间的埃罗替尼可以抑制SW13细胞增殖24、48、72h与12h结果比较,**P<0.01
2.2 埃罗替尼可以诱导SW13细胞凋亡流式细胞检测结果显示,处理24h后,空白组、5μmol/L组、20μmol/L埃罗替尼处理组早期凋亡率(AnnexinV+/PI-)分别为(1.62±0.21)%、(3.35±0.46)%及(13.49±0.48)%,与空白组对比,分别增加约2倍及8.5倍,提示有效治疗浓度的埃罗替尼可以诱导SW13细胞凋亡;而晚期凋亡率(AnnexinV+/PI+)三组分别为(0.98±0.14)%、(0.71±0.11)%、(4.80±0.58)%,提示高浓度埃罗替尼可以促进细胞坏死凋亡(图2,表1)。

图2 通过AnnexinV-PI流式检测埃罗替尼可以诱导SW13细胞凋亡

表1 埃罗替尼诱导SW13细胞凋亡
2.3 埃罗替尼对SW13细胞周期无影响通过PI细胞周期实验显示,空白组、5μmol/L组、20μmol/L埃罗替尼组处理24h后,细胞周期无明显改变,G1期均约为70%左右,而G2期则为25% 左右,S期为5%~7%左右,统计学无差异(图3),提示埃罗替尼对SW13细胞周期无明显影响。
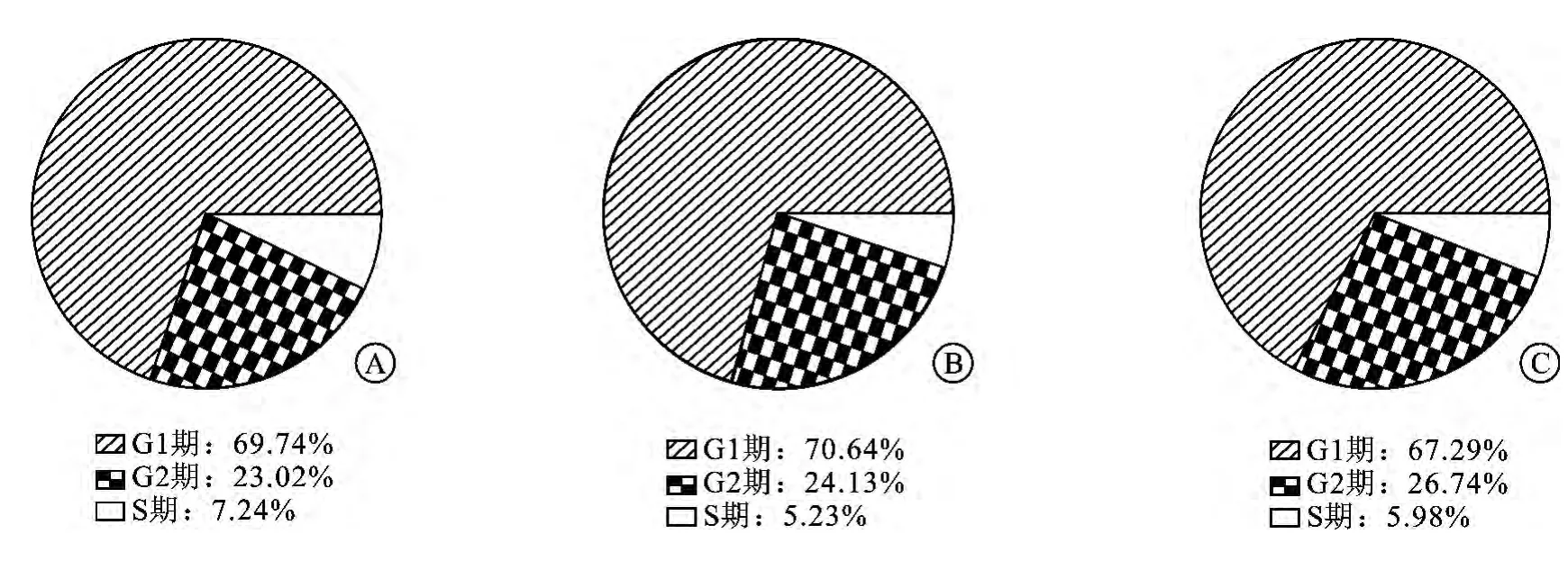
图3 埃罗替尼对SW13细胞周期无影响
2.4 埃罗替尼对EGFR下游信号通路蛋白表达的影响,抑制p-ERK蛋白表达水平,不影响p-mTOR通过Western blot检测EGFR下游信号通路蛋白表达水平,发现空白组、5μmol/L组、20μmol/L埃罗替尼组处理24h后埃罗替尼能够显著降低ERK磷酸化表达水平,并呈剂量相关性;而同样,另一条EGFR下游通路mTOR通路则无明显改变 (图4);提示埃罗替尼主要通过ERK通路影响细胞增殖及凋亡。

图4 埃罗替尼影响EGFR下游mTOR及ERK通路水平
3 讨 论
肾上腺皮质癌(adrenocortical carcinoma,ACC)是起源于肾上腺组织的恶性肿瘤,发病率低,病死率高[3];ACC的临床诊断主要依靠影像学及内分泌检查,确诊则需依靠病理检查,总体看来肾上腺皮质癌治疗预后不佳。目前尚无有效的治疗方法,对于部分病例,临床上外科手术切除可以作为主要治疗方法;除此之外,对于进展期ACC,米托坦联合细胞毒性药物等为其一线治疗方案,但总体治疗效果依然有限,肿瘤分期Ⅳ期或者术后复发的ACC患者5年生存率不足5%[4-5];但是如不施行保守治疗,进展期患者平均生存期仅为3~9个月[6]。
表皮生长因子受体生理情况下可以诱导正常的有丝分裂反应、促进细胞分化、迁移与内环境稳定等,而其表达异常亦与恶性肿瘤细胞增殖、粘附、血管形成、转移等密切相关,一直是抗肿瘤分子靶向治疗做深入的热点之一。配体通过与EGFR结合导致其二聚体话,激活了RAS/MAPK、PI3K等多条信号转导通路,EGFR可以通过这些通路调节细胞分化、增加细胞侵袭力、促进血管生成等。人们已经在多种实体瘤如乳腺癌、结直肠癌、膀胱癌、肾癌中检测到EGFR的过表达[7];同样,ADAM 等[2]通过对161例 ACC标本进行免疫组化染色发现,超过90%的ACC肿瘤组织EGFR表达强阳性,而33例肾上腺腺瘤中32例表达阴性,另外5例正常肾上腺组织表达全部阴性。
埃罗替尼是一种小分子靶向治疗肿瘤药物,可以特异性地抑制EGFR信号转导通路,最早于2004年11月经美国FDA批准用于一线化疗失败的局部晚期或转移性非小细胞肺癌的治疗,2006年引进国内。当应用于肾上腺皮质癌SW13细胞系时,可以明显地呈浓度-时间相关地抑制肿瘤细胞增殖(图1),当作用24h时,埃罗替尼的IC50为20.51μmol/L,当浓度增加到50μmol/L时,已能够大约抑制70%;而当作用72h时,即便1μmol/L的埃罗替尼已能够抑制约60%的细胞活力。
同时,我们进一步通过流式细胞学技术,试图探讨埃罗替尼是否还可以通过影响细胞凋亡及周期来抑制肿瘤增殖,图2可以看出与空白组对比,5μmol/L埃罗替尼可使SW13早期凋亡率增加约2倍;当浓度增加到20μmol/L时,SW13细胞早期凋亡率可达13.49%,增加8.5倍;同样的现象也发生在晚期凋亡/坏死的比率上,验证一定治疗剂量的埃罗替尼可以呈浓度相关地诱导SW13细胞早期凋亡、促进细胞坏死。除此之外,通过观察细胞周期实验,我们发现埃罗替尼并不能有效地影响SW13细胞周期,可能提示埃罗替尼抑制肿瘤增长可能与细胞周期无关(图3)。
EGFR主要通过RAS/MAPK及PI3K/mTOR两条信号通路来调节肿瘤细胞生长、分化等,因此我们推测EGFR小分子抑制剂埃罗替尼可能通过这两条通路来影响SW13细胞增殖,通过上述两种浓度的埃罗替尼处理SW13细胞24h后检测ERK、mTOR磷酸化及总蛋白的表达量,我们发现埃罗替尼可以明显地降低ERK蛋白磷酸化水平,提示其可能通过RAS/ERK信号通路来抑制SW13细胞增殖(图4)。另一方面,治疗剂量的埃罗替尼并不能影响mTOR蛋白磷酸化水平,其原因可能是两方面:①MORGILLO等[8]曾报导埃罗替尼在非小细胞肺癌细胞系中能同时抑制RAS/ERK及PI3K两条通路的激活,从而抑制相应细胞系增殖;但埃罗替尼可能在SW13细胞系中不通过PI3K/mTOR信号通路抑制细胞增殖,而仅仅通过RAS这条信号通路;②SW13细胞经埃罗替尼处理后,可能出现了PI3K/mTOR信号通路的补偿激活,既往研究亦多次报导IGF1R与EGFR 之间的交联存在[8-9]。
虽然本实验发现了EGFR小分子抑制剂埃罗替尼对于肾上腺皮质癌SW13细胞系的抑制增殖、促进凋亡等作用,但既往人们尝试将吉非替尼单用、埃罗替尼联合吉西他滨应用于临床治疗时,并未获得较好的缓解率[10-11],可能提示单用EGFR抑制剂并不能获得良好的治疗效果;另外,本实验结果提示EGFR下游信号通路可能存在与其他生长因子下游通路之间的交联,并结合其他报道[9],提示将来可能将EGFR抑制剂与其他相关酪氨酸激酶抑制剂联用能达到一定的治疗效果。
本研究通过体外应用埃罗替尼作用于肾上腺皮质癌SW13细胞系,从细胞增殖、凋亡、周期及信号通路等多个角度研究埃罗替尼对于ACC肿瘤的影响,揭示了埃罗替尼抑制SW13细胞肿瘤增殖的作用,为临床进一步将EGFR抑制剂药物联合其他靶向治疗药物应用于肾上腺皮质癌治疗提供了相关的理论依据。
[1]SAMNOTRA V,MEMOLI V A,ERNSTOFF M S,et al.Primary adrenocortical tumors:EGFR,c-Kit and Her-2/neu receptor staining patterns[C]//ASCO Annual Meeting Proceedings,J clihic Onco,2005,23(16Suppl):4770.
[2]ADAM P,HAHNER S,HARTMANN M,et al.Epidermal growth factor receptor in adrenocortical tumors:analysis of gene sequence,protein expression and correlation with clinical outcome[J].Modern Pathology,2010,23(12):1596-1604.
[3]GOLDEN SH,ROBINSON KA,Saldanha I,et al.Prevalence and incidence of endocrine and metabolic disorders in the United States:a comprehensive review[J].J Clinic Endocrinol &Metabol,2009,94(6):1853-1878.
[4]ICARD P,GOUDET P,CHARPENAY C,et al.Adrenocortical carcinomas:surgical trends and Conclusions of a 253-patient series from the French Association of Endocrine Surgeons study group[J].Worl J Surg,2001,25(7):891-897.
[5]ALLOLIO B,FASSNACHT M.Adrenocortical carcinoma:clinical update[J].J Clinic Endocrinol & Metabol,2006,91(6):2027-2037.
[6]SCHTEINGART D E,DOHERTY G M,GAUGER P G,et al.Management of patients with adrenal cancer:recommendations of an international consensus conference[J].Endocrine-Related Cancer,2005,12(3):667-680.
[7]BASELGA J.Why the epidermal growth factor receptor?The rationale for cancer therapy[J].Oncologist,2002,7(Supple 4):2-8.
[8]MORGILLO F,WOO J K,KIM E S,et al.Heterodimerization of insulin-like growth factor receptor/epidermal growth factor receptor and induction of survivin expression counteract the antitumor action of erlotinib[J].Cancer Res,2006,66(20):10100-10111.
[9]OLIVEIRA S,SCHIFFELERS R M,STORM G,et al.Crosstalk between epidermal growth factor receptor-and insulinlike growth factor-1receptor signaling:implications for cancer therapy[J].Current cancer drug targets,2009,9(6):748-760.
[10]SAMNOTRA V,VASSILOPOULOU-SELLIN R,FOJO A T,et al.A phase II trial of gefitinib monotherapy in patients with unresectable adrenocortical carcinoma(ACC)[C]//ASCO Annual Meeting Proceedings,J Clinic Onco,2007,25(18Suppl):15527.
[11]QUINKLER M,HAHNER S,WORTMANN S,et al.Treatment of advanced adrenocortical carcinoma with erlotinib plus gemcitabine[J].J Clinic Endocrinol & Metabol,2008,93(6):2057-2062.
