昆虫内生真菌Alternariasp.次级代谢产物研究
2015-07-25张清清郭玲芝陈剑锋郭志勇
张清清 郭玲芝 陈剑锋 邹 坤 郭志勇
(三峡大学 生物与制药学院 天然产物研究与利用湖北省重点实验室,湖北 宜昌 443002)
昆虫内生菌因其宿主的特殊环境,已经证明可以产生骨架新颖的活性次级代谢产物,因而昆虫内生真菌正成为天然产物新的源泉[1-3].本实验室对神农架地区的几株昆虫内生菌Alternariasp.、Paraconiothyriumbrasiliense、Penicilliumoxalicum等的次级代谢产物进行了初步研究,分离得到一系列环肽类、呋喃酮类、聚酮类等化合物,并测定了它们的药理活性[4-7].
本文继续对采自神农架地区的粉蝶科菜粉蝶(PierisrapaeLinne)的内生真菌Alternariasp.的次级代谢产物进行研究,通过各种色谱技术和现代波谱技术分离并鉴定了4个化合物,确定为4个混源萜类化合物,并测定了这4个化合物的酪氨酸激酶的抑制活性.
1 实验部分
1.1 仪器和试剂
X Series 2质谱仪,美国Thermo Fisher Scientific;Ultimate 3000型DIONEX高效液相色谱仪,美国DIONEX;高压灭菌器,上海巴玖实业有限公司;Ultrashied TM 400MHZ型核磁共振仪,瑞士Bruker;显微熔点仪(未校正),天津市分析仪器厂.培养基的配制见参考文献[4].
1.2 菌种的分离、纯化及鉴定
菌株分离方法见文献[4],菌株由三峡大学微生物学博士涂璇副教授鉴定.
1.3 菌种的发酵
保藏菌株接种至PDA平皿,培养8d,转移至PDB培养基中为种子液,继续培养5d,后接入SDB液体培养基中,100瓶,摇床160r/min,恒温28℃培养20d.
1.4 代谢产物的提取与分离
发酵结束,分离发酵液和菌丝体,发酵液用乙酸乙酯萃取3次,浓缩得浸膏10.2g,以硅胶柱层析分离,流动相:氯仿-甲醇,梯度洗脱,得7个馏分段(Ⅰ-Ⅶ).Ⅶ中的馏分经 HPLC制备(乙腈-水40%∶60%,v∶v)得到化合物1(6mg)、2(5mg)、3(7mg)和4(10mg).

图1 化合物1-4的结构
2 化合物的结构鉴定
化合物1:黄色油状物,分子式:C21H30O4,ESIMS m/z:347[M + H]+.1H NMR(CDCl3,400 MHz)δH:3.97(s,H-1a),3.92(s,H-1b),1.61(s,H-2′),5.21(t,J=7.0Hz,H-3),2.00(m,H-4a),1.91(m,H-4b),1.36(m,H-5),1.90(s,H-6),0.97(s,H-6′),5.30(brs,H-8),2.46(m,H-9a),2.62(m,H-9b),1.42(s,H-10′),2.82(m,H-11),2.16(m,H-12a),2.69(m,H-12b),4.36(m,H-15),1.94(m,H-16a),2.22(m,H-16b),2.26(m,H-17a),2.62(m,H-17b);13C NMR(CDCl3,100MHz)δC:68.8(C-1),135.3(C-2),13.7(C-2′),125.0(C-3),24.9(C-4),34.7(C-5),30.9(C-6),19.8(C-6′),150.0(C-7),119.7(C-8),45.2(C-9),89.4(C-10),23.6(C-10′),47.1(C-11),14.9(C-12),107.9(C-13),170.7(C-14),66.7(C-15),28.8(C-16),33.6(C-17),197.0(C-18);以上波谱数据,参照文献[8],基本一致,确定该化合物为Tricycloalternarene 2a.
化合物2:黄色油状物,分子式:C21H30O4,ESI-MS m/z:347[M + H]+.1H NMR(CDCl3,400 MHz)δH:3.98(s,H-1a),3.95(s,H-1b),1.61(s,H-2′),5.23(t,J=7.0Hz,H-3),2.03(m,H-4a),1.98(m,H-4b),1.48(m,H-5a),1.32(m,H-5b),2.20(s,H-6),0.97(s,H-6′),5.32(br s,H-8),2.43(m,H-9a),2.58(m,H-9b),1.44(s,H-10′),2.79(m,H-11),2.16(m,H-12a),2.73(m,H-12b),2.36(m,H-15a),2.52(m,H-15b),1.74(m,H-16a),2.29(m,H-16b),4.02(m,H-17);13C NMR(CDCl3,100MHz)δC:68.8(C-1),135.3(C-2),13.7(C-2′),125.4(C-3),24.9(C-4),34.7(C-5),31.1(C-6),20.2(C-6′),150.0(C-7),119.9(C-8),45.1(C-9),88.8(C-10),23.2(C-10′),46.5(C-11),14.9(C-12),105.1(C-13),172.9(C-14),27.8(C-15),29.5(C-16),71.0(C-17),197.7(C-18);以上波谱数据,参照文献[9],基本一致,确定该化合物为Tricycloalternarene 2b.
化合物3:黄色油状物,分子式:C21H30O3,ESIMS m/z:331[M + H]+.1H NMR(CDCl3,400 MHz)δH:1.63(s,H-1),1.54(s,H-2′),5.03(t,J=7.0Hz,H-3),1.8l(m,H-4),1.28(m,H-5),1.90(m,H-6),0.95(d,H-6′),5.35(br s,H-8),2.43(m,H-9a),2.58(m,H-9b),1.44(s,H-10′),2.55(m,H-12),4.29(m,H-15),1.93(m,H-16a),2.17(m,H-16b),2.53(m,H-17);13C NMR(CDCl3,100MHz)δC:25.7(C-1),131.6(C-2),17.7(C-2′),124.5(C-3),25.9(C-4),34.9(C-5),32.3(C-6),20.2(C-6′),151.0(C-7),119.8(C-8),44.9(C-9),88.5(C-10),23.7(C-10′),46.6(C-11),15.3(C-12),108.1(C-13),171.3(C-14),66.5(C-15),28.9(C-16),33.6(C-17),196.2(C-18);以上波谱数据,参照文献[10],基本一致,确定该化合物为 Tricycloalternarene 3a.
化合物4:黄色油状物,分子式:C21H30O3,ESIMS m/z:331[M + H]+.1H NMR(CDCl3,400 MHz)δH:1.68(s,H-1),1.56(s,H-2′),4.97(t,J=7.0Hz,H-3),2.53(m,H-4),5.23(t,J=7.0 Hz,H-5),1.65(s,H-6′),2.78(m,H-7),1.83(m,H-8),1.86(m,H-9a),2.18(m,H-9b),1.37(s,H-10′),1.97(m,H-11),2.15(m,H-12a),2.33(m,H-12b),4.41(m,H-15),2.04(m,H-16a),2.29(m,H-16b),2.35(m,H-17a),2.67(m,H-17b);13C NMR(CDCl3,100MHz)δC:25.6(C-1),131.5(C-2),17.6(C-2′),123.2(C-3),26.5(C-4),127.3(C-5),133.9(C-6),18.3(C-6′),41.8(C-7),25.(C-8),37.8(C-9),87.8(C-10),22.8(C-10′),43.4(C-11),15.9(C-12),107.9(C-13),167.2(C-14),66.1(C-15),28.9(C-16),33.4(C-17),197.4(C-18);以上波谱数据,参照文献[11],基本一致,确定该化合物为Tricycloalternarene F.
3 化合物的药理活性
近年来,EGFR,VEGFR,c-Met等都已成为肿瘤治疗的新靶点[12],因此本文采用均相时间分辨荧光技术,使用HTRF®KinEASE®TK试剂盒测定了所得化合物对三种受体酪氨酸激酶(EGFR,VEGFR-1,c-Met)的抑制活性.设计阳性组、阴性组、空白组和给药组四个组,三种受体酪氨酸激酶的阳性药分别为Erlotinib、Pazopainib和BMS-777607.阳性药给药浓度和化合物1-4的给药浓度均为200nM,每个浓度2个复孔,测试结果表明(见表1),化合物3和4对三种酪氨酸激酶(EGFR,VEGFR-1,c-Met)具有较强的抑制活性.
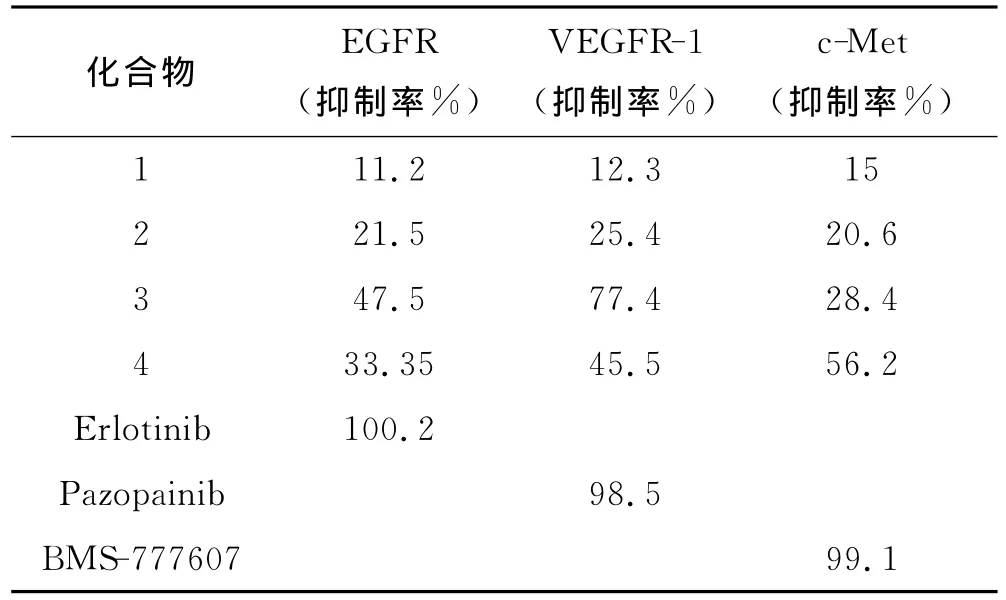
表1 化合物1-4对受体酪氨酸激酶的抑制活性
4 结 语
本实验前期从Alternariasp.中分离得到7个化合物,包括4个环肽类化合物和3个聚酮类化合物[4].本文继续对该菌株的次级代谢产物进行研究,得到4个系列混源萜类化合物,并首次初步测定了Tricycloalternarene类化合物的受体酪氨酸激酶的抑制活性,测试结果表明,化合物3和4对三种酪氨酸激酶具有较强的抑制活性,为该类混源萜类化合物的活性研究开辟了一条新的途径.
[1] Ashforth E J,Fu C Z,Liu X Y,et al.Bioprospecting for Antituberculosis Leads from Microbial Metabolites[J].Nat Prod Rep,2010,27(11):1709-1719.
[2] 黄大卫.新世纪的中国昆虫系统学[J].昆虫学报,2003,46(1):90-95.
[3] 戈惠明,谭仁祥.共生菌-新活性天然产物的重要来源[J].化学进展,2009,21(1):30-46.
[4] 郭玲芝,刘呈雄,徐 帮,等.一株昆虫内生真菌Alternariasp.次级代谢产物研究[J].化学研究与应用,2014,26(2):306-310.
[5] Liu C X,Wang L,Chen J F,et al.Paraconfuranones A-H,Eight New Furanone Analogs from the Insect-Associated Fungus Paraconiothyrium Brasiliense MZ-1[J].Magn Reson Chem,2015,53(4):317-322.
[6] 汪 蕾,胡圣璋,刘呈雄,等.共生真菌巴西类壳小圆孢中环二肽类代谢产物研究[J].化学研究与应用,2014,26(9):1478-1482.
[7] 徐 帮,邹坤,郭玲芝,等.中华剑角蝗共生真菌Penicillium oxalicum中苯并吡喃酮二聚体类化合物的研究[J].天然产物研究与开发,2014,26(4):517-520.
[8] Kono Y,Gardner J M,Suzuki Y,et al.Studies on Host-selective Toxins Produced by a Pathotype ofAlternariaCitri Causing Brown Spot Disease of Mandarins.[J].Agric Biol Chem,1986,50(6):1597-1606.
[9] 袁 琳,黄文忠,赵沛基.云南美登木内生真菌Alternariasp.Ly81中的混合萜类化合物的研究[J].中国药学杂志,2013,48(21):1823-1826.
[10]Liebermann B,Ellinger R,Günther W,et al.Tricycloalternarenes Produced byAlternariaAlternata Related to ACTG-toxins[J].Phytochem,1997,46(2):297-303.
[11]Wang Q X,Bao L,Yang X L,et al.Tricycloalternarenes F-H:Three New Mixed Terpenoids Produced by an Endolichenic Fungus Ulocladium sp.using OSMAC Method[J].Fitoterapia,2013,85:8-13.
[12]车文军,李志裕,尤启冬,等.抗肿瘤药物新靶点与新药研究[J].药学进展,2007,31(6):247-253.
