热加工食品中呋喃的生成机制
2015-07-25梁宇航吕晓玲
张 颖,梁宇航,张 健,吕晓玲
(1. 食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457;2. 工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457)
热加工食品中呋喃的生成机制
张 颖1,梁宇航1,张 健2,吕晓玲1
(1. 食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457;2. 工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457)
呋喃是一种常见于热加工食品中的环状烯醚,对人体具有潜在的致癌性,国际癌症研究机构(IARC)已将其定义为“2B”类致癌物.尽可能降低热加工食品中的呋喃含量,可有效提升食品的安全性,而阐明热加工食品中呋喃的形成机制,则是调控其中呋喃含量的前提和基础.为此,从热加工食品中呋喃生成的分子路线与影响因素两个方面入手,较为全面地综述了近年来有关呋喃形成机制的相关研究,深入分析和总结了现有研究的不足,并提出了相应的解决方案.
呋喃;热加工食品;生成机制
1 确认前体及前体转化的分子路线
1.1 糖类转化生成呋喃
糖类,又称碳水化合物(carbohydrate),是多羟基醛或多羟基酮及其缩聚物和某些衍生物的总称,一般由碳、氢、氧3种元素所组成,主要分为4大类:单糖、双糖、低聚糖和多聚糖.1979年Maga等[8]曾指出:糖类的热降解反应是呋喃生成的一种重要途径;Limacher等[9]对己糖进行了碳组标记技术(carbon module labeling,CAMOLA)实验,发现己糖类生成呋喃主要有两种途径:一种是由糖类自身的C链进行环化等一系列反应生成,一种是在丙氨酸、苏氨酸或丝氨酸等氨基酸存在的条件下,由C2链或C3链的糖碎片进行重组而得,而在糖类降解过程中生成的甲酸和乙酸也验证了C1或C2链的裂解.
在有氨基酸存在时,Locas等在2004年通过CAMOLA技术发现单糖类生成呋喃的途径主要有4种(见图1[10]).
A:通过美拉德反应生成1-脱氧邻酮醛糖,再经过α-二羰基裂解反应将C1-C2链与C3-C6链断开生成丁醛糖,再经过环化反应及脱水等反应生成呋喃;
B:直接由反醛醇裂解反应生成丁醛糖,再按照A途径生成呋喃,A、B两种途径生成的呋喃均为C3-C6链框架;
C:经过脱水反应和反醛醇裂解反应将C1-C4链与C5-C6链断开,生成2-脱氧-3-酮基丁醛糖,再经过脱水环化反应和还原反应生成呋喃;
D:经过α-二羰基裂解反应将C1链与C2-C6链断开,生成3-脱氧-邻酮醛糖,再由氧化反应和脱羧反应去掉C6,生成2-脱氧丁醛糖,最后经过脱水生成呋喃.
需要说明的是:A、B两种途径生成的丁醛糖经过环化和脱水后生成3-呋喃酮和2(5H-)呋喃酮,其中3-呋喃酮经过还原反应和进一步脱水后可以生成呋喃,而2(5H-)呋喃酮则不能生成呋喃.但是Märk等[11]研究发现赤藓糖即丁醛糖生成呋喃的量很少,因此这条途径发生的可能性也较小,所以这些途径机制仍需要进一步进行实验验证.
相应地,五碳糖也可单独生成呋喃,不过在有氨基酸存在的条件下生成量更多.五碳糖可以通过与氨基酸反应或者进行C3链上的脱水反应生成3-脱氧戊酮糖,进而通过α-二羰基裂解反应生成2-脱氧丁醛糖.
1.2 抗坏血酸转化生成呋喃
维生素C(ascorbic acid),又名L-抗坏血酸,是一种水溶性维生素.虽然维生素C在人体中含量极少,但却是人体骨骼、血管等发育所必需的,因此需要每日补充一定量的维生素C.维生素C有两种活性结构:抗坏血酸及其氧化衍生物脱氢抗坏血酸,因此经常将抗坏血酸与脱氢抗坏血酸含量之和表示为维生素C的含量.
抗坏血酸作为一种常用的抗氧化剂,其本身也是呋喃的一种重要前体物.抗坏血酸很容易被氧化成脱氢抗坏血酸;脱氢抗坏血酸被水解为2-二酮古洛糖酸,再经过脱羧反应与α-二羰基裂解生成丁醛糖进而生成呋喃.但在大部分无氧热解条件下,抗坏血酸并不能被氧化为2-二酮古洛糖酸,而是通过水解和β-消除反应后,再经过脱羧反应生成3-脱氧戊酮糖,按照核糖的分解途径(α-二羰基裂解)生成2-脱氧丁醛糖.2-脱氧丁醛糖并非像其他丁醛糖衍生物一样需要几步还原反应,而是可以直接生成呋喃[10].因此,在无氧热解条件下,抗坏血酸与脱氢抗坏血酸相比,是一种更为有效的呋喃前体物.在有氧热降解条件下,则会有相反的情况:例如在高压热加工条件下,脱氢抗坏血酸的呋喃生成量要比抗坏血酸的呋喃喃生成量高出10倍左右[12].Limacher等[13]发现在水溶液环境中,脱氢抗坏血酸在pH为7时比抗坏血酸生成的呋喃量要多,但在pH为4时差距不大.这表明抗坏血酸衍生物生成的呋喃量很大程度取决于反应体系的条件.
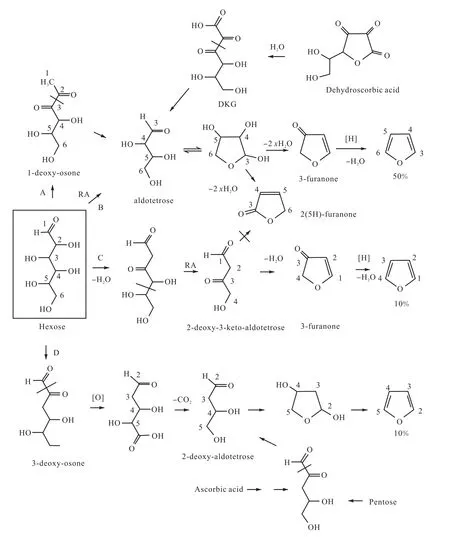
图1 由碳组标记技术标记的单糖类生成呋喃的4种反应途径Fig. 1 4 pathways of CAMOLA labeled monosaccharide generated furan
由于在食品体系中抗坏血酸很易被氧化为脱氢抗坏血酸,因此一般情况下两者经常共存并相互影响.Owczarek-Fendor等[14]发现,抗坏血酸与脱氢抗坏血酸的比例变化对于呋喃的生成反应并没有太大的影响,当脱氢抗坏血酸单独存在时生成的呋喃量会有明显降低,这为上文中无氧热解条件下抗坏血酸是更为有效的呋喃前体物的观点提供了依据.
相关文献[11]表明,相同量的单一抗坏血酸与添加了其他呋喃前体物如糖类、氨基酸或脂肪酸的抗坏血酸相比,抗坏血酸单独生成的呋喃量要多很多;甚至将呋喃的各直接前体物组合在一起的模拟体系都会比只含抗坏血酸的模拟体系的呋喃生成量要少.另外,在干热条件下,脱氢抗坏血酸通过环化反应以半缩酮的形式存在,进而可以有效防止呋喃的生成.
1.3 氨基酸转化生成呋喃
氨基酸是含有氨基和羧基的一类有机化合物的通称.氨基酸也是呋喃的一种重要前体物,只是其单独生成的呋喃量没有抗坏血酸和糖类多.在没有还原糖等其他呋喃前体物存在时,某些氨基酸可通过热降解反应生成羟基乙醛与乙醛,再由羟醛缩合反应生成丁醛糖衍生物,进而生成呋喃,例如丝氨酸、半胱氨酸.Locas等[10]的研究表明:不是所有氨基酸都可以单独生成呋喃,苏氨酸、丙氨酸和天门冬氨酸在降解过程中只能生成乙醛,还需要还原糖提供羟基乙醛才可以生成呋喃.同时Locas等通过CAMOLA将丝氨酸的3个碳原子分别进行标记发现:丝氨酸可以通过一系列反应(包括A、B、C、D)生成乙醛与羟基乙醛,为呋喃的前体物质提供来源(见图2[10]).

图2 由CAMOLA标记的氨基酸生成乙醛和羟基乙醛反应途径Fig. 2 Pathways of CAMOLA labeled amino acid to produce acetaldehyde and glycolaldehyde
A:通过脱羧反应除去C1链,由C2-C3链生成乙醇胺,再脱去一个氨分子生成乙醛;
B:经过脱水与去氨基反应生成丙酮酸,然后脱羧反应除去C1链并由C2-C3链生成乙醛;
C:经过B途径生成的丙酮酸与乙醇胺反应、与亚胺异构反应,以及脱水缩合生成羟基乙醛;
D:直接进行斯特雷克(Strecker)氨基酸反应脱去C1链生成羟基乙醛.
以上4种途径生成的乙醛和羟基乙醛,通过醇醛缩合反应生成相应的丁醛糖衍生物之后,再由环化与脱水反应生成呋喃;而由前文所述可知,丝氨酸生成的呋喃中4个碳原子均来自于C2与C3链,这也间接验证了呋喃前体羟醛缩合反应机理的正确性.
1.4 脂肪酸转化生成呋喃
脂肪酸(fatty acid)是由碳、氢、氧3种元素组成的一种有机化合物.按照碳氢链饱和与不饱和的不同可以分为3类:饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)与多不饱和脂肪酸(PUFA).在模拟体系下的研究表明,只有多不饱和脂肪酸,如亚油酸和亚麻酸等可以在加热条件下生成呋喃[12],并且随着脂肪酸氧化程度的提高,呋喃的生成量相应也会呈现增加的趋势.Owczarek-Fendor等[15]在研究淀粉基质中脂肪氧化对呋喃生成的影响实验中发现,脂肪酸的成分与氧化程度对于呋喃生成量影响很大.如果氧化的油脂含有α-亚麻酸,则产生呋喃的量很显著,过氧化值和产生的呋喃的量没有明确的相关性,但是在豆油中,随着氧化程度的增加,呋喃的生成量显著升高.另外Blank[16]的报道发现,等量的亚油酸生成的呋喃量要比亚麻酸多4倍左右,同时氯化铁的存在可以催化呋喃的生成.两者的甘油三酸酯生成的呋喃量相差不多,只有加入氯化铁之后,比游离的脂肪酸更易生成呋喃.
多不饱和脂肪酸的氧化反应是生成呋喃的主要途径.一般情况下,多不饱和脂肪酸的氧化是通过活性氧的非酶作用或者脂氧合酶的酶促反应生成脱氢过氧化物(见图3[10]),再经过过渡金属离子的催化进行裂解反应生成不同的裂解产物,尤其是性质活泼的醛类,如4-羟基-2-丁烯醛,再经环化与脱水反应生成呋喃.Sayre等[17]研究发现,5-戊基呋喃作为脂质酸败氧化的一种化学指示物,与4-羟基-2-壬烯醛(4-HNE)的生成有关;而4-羟基-2-壬烯醛是4-羟基-2-丁烯醛的高级同系物,并且在酸性条件下的4-HNE乙醇溶液经过回流可以生成呋喃.Gérard-Monnier等[18]也验证了这一结论.

图3 多不饱和脂肪酸氧化生成呋喃的反应途径Fig. 3 Pathways of furan generation through polyunsaturated fatty acid oxidation
1.5 类胡萝卜素转化生成呋喃
类胡萝卜素是一类脂溶性天然色素的总称,是普遍存在于动植物、真菌、藻类和细菌中的色素.主要包括β-胡萝卜素和γ-胡萝卜素.类胡萝卜素和抗坏血酸都是常用的抗氧化剂,同时类胡萝卜素也被认为是呋喃的一种前体物[12].Owczarek-Fendor等[19]的研究发现,在不饱和脂肪酸的氧化过程中,β-胡萝卜素的加入对于呋喃的生成有比较明显的促进作用.新鲜的油脂中加入β-胡萝卜素与未加入β-胡萝卜素相比,呋喃的生成量较多;但当β-胡萝卜素与油脂混合在一起再进行氧化后,生成的呋喃量与油脂氧化后再加入β-胡萝卜素相比要多.这也验证了β-胡萝卜素本身也可能是呋喃的一种前体物质.同时由Owczarek-Fendor等已得的结果表明,新鲜的β-胡萝卜素与其氧化中间产物之间,对于呋喃的生成量多少似乎有着某种竞争关系.
然而,类胡萝卜素作为呋喃的一种前体物质,关于它对呋喃生成反应的影响研究并没有太多的相关报道.类胡萝卜素作为一种抗氧化剂在添加到油脂中的氧化过程中,由于反应的复杂性和条件的不确定性,并不清楚中间产物的主要反应机理和途径;与单糖、抗坏血酸和氨基酸的研究深度相比,类胡萝卜素还是只停留在原料基础上得知是呋喃的前体物质,没有对其具体途径进行实验分析和推测.
2 明确转化途径影响因素
食品的加工过程按照温度的不同可以分为热加工与冷加工两大类.呋喃多在食品的热加工过程中产生,尤其在咖啡、果蔬肉类罐头、奶粉等罐装食品中含量较多.结合上文中呋喃的5种前体物的具体生成途径可以发现,食品原料的热加工过程中的pH、加热时间和温度、加工方式等都可以明显地促进糖类美拉德反应的进行和脂肪酸等物质的氧化,是生成呋喃的重要影响因素.
2.1 pH的影响
在热加工过程的食品体系中,由于食品原料的特性,pH一般在中性与酸性之间.研究表明在其他因素条件不变的情况下,pH由低到高变化时,一些前体物质的呋喃生成量会受到不同的影响,但具体如何影响呋喃的生成目前还没有充足的理论来证明.Owczarek-Fendor等[15]的研究表明在含有糖类和糖醇类的模拟体系中,随着pH的升高,糖类和糖醇类的裂解和烯醇化反应会导致呋喃生成量的增加,例如乳糖、葡萄糖、果糖.Limacher等[9]的研究也发现在pH为7时所测糖类的呋喃生成量均比pH为4时要多;然而,对于蔗糖则是相反的情况:Fan[20]发现在pH为3时,蔗糖的呋喃生成量显著高于pH为6时的情况,这与Limacher等[9]的研究结果很相似.这可能是由于蔗糖在酸性条件下水解为葡萄糖和果糖,进而促进了呋喃的生成.
对于抗坏血酸来说,较低的pH反而会促进呋喃的生成.Owczarek-Fendor[14]研究发现:随着pH由3.5升至6.5,在含有抗坏血酸盐的淀粉基质模型体系中,呋喃的生成量降低了1/3~1/6.Limacher等[13]在关于抗坏血酸在食品模拟体系中呋喃生成的研究中也发现,在pH为7时,抗坏血酸本身生成呋喃的量极少,并不是一种有效的前体物质;而在pH为4时则很容易生成呋喃.Fan等[21]也在其他模型体系中发现了相似的pH影响效果.
2.2 缓冲溶液类型的影响
除了pH对食品体系呋喃的产生具有影响之外,模拟体系中缓冲溶液的类型也是一种潜在的影响因素.在相同pH的条件下,加入缓冲溶液与不加入缓冲溶液的模拟体系生成的呋喃量是不同的.
在含有糖类和抗坏血酸的模拟体系中加入磷酸盐缓冲溶液或柠檬酸缓冲溶液会促进呋喃的生成,有相关文献[22]表明这两种缓冲溶液对于呋喃的生成有类似的促进作用,随着缓冲液浓度的提高,呋喃的生成量也随之增加.但其中具体的反应机制和途径目前还不太清楚,需要进一步的研究探索.不过,磷酸盐离子对于糖类降解和美拉德反应的刺激作用已有相关文献的研究报道[23-24].
2.3 温度与时间的影响
在罐装食品的热加工过程中,原料蒸煮、高温灭菌等加工过程都需要较高的温度,而温度的高低对食品中美拉德反应以及脂肪酸、氨基酸等物质的氧化降解有着非常明显的影响.Owczarek-Fendor等[14]的研究数据也证实了呋喃的生成量与加热温度有着正相关关系,尤其是在抗坏血酸存在的条件下.一些婴儿食品为了保证杀菌彻底以及尽量延长货架期,长时间的高温杀菌以及抗坏血酸的加入都会间接促进呋喃的生成.
Fan等[21]的研究发现,在90,℃下对苹果醋进行加热10,min只有极少量的呋喃生成,而在120,℃加热相同时间则生成了约3,ng/mL的呋喃,与加热温度呈明显的线性关系.Owczarek-Fendor等[14]的研究也发现了类似的温度-呋喃关系,同时在加热时间的实验中,在样品中心达到目标温度之前并无明显的呋喃生成量,而持续加热到20~40,min时呋喃的生成量明显增多.
为了保证食品的质量安全,同时尽可能防止营养物质的流失,食品的加工温度通常在90~120,℃范围内[25],而在这一温度段加热很少的时间就可以生成大量的呋喃.因此,寻求更为合适的食品热加工条件对于减少加工过程的呋喃污染情况是十分重要的,尤其对于婴儿罐装食品类更需引起重视.
2.4 热加工方式的影响
我国传统的食品热加工方式通常为蒸、煮、煎、炒、油炸、炖等,而高温油炸和高温烘焙对于呋喃的生成影响非常明显.在加工过程中,油脂等有机物的高温裂解反应或者燃烧不完全都会产生更多的呋喃类物质.
Limacher等[9]通过将相同的前体物质分别置于高温烘焙(200,℃)模拟体系和高压蒸煮(120,℃)模拟体系中进行实验,发现高温烘焙产生的呋喃量在40.2~2,051,µmol/mol,而高压蒸煮产生的呋喃量在0.66~326,µmol/mol;可以看出,相同的前体物在高温烘焙和高压蒸煮的条件下产生的呋喃量差异性非常明显.
在真实食品方面,咖啡、面包和肉类等食物也常利用高温烘焙和烧烤的方式进行加工.La Pera等[26]利用HS-SPME-GC-MS技术对不同源产地的烘焙咖啡粉中的呋喃含量进行了检测,呋喃含量高达57.3~587.3,ng/g;Petisca等[27]对不同烘焙速度的咖啡粉中呋喃含量进行了研究,发现随着烘焙速度的提高,呋喃类衍生物的含量会逐渐增多;Arisseto等[28]测得在经过烘焙后咖啡样品中的呋喃含量在911~5,852,ng/g,而在未烘焙的绿色咖啡豆中没有检测出呋喃;另外,一些肉类制品的高温加工过程除了可以生成呋喃类衍生物之外,还会有丙烯酰胺等其他有毒成分的生成.以上这些研究报道表明,高温烘焙相对于其他加工方式更易致使呋喃的生成.
3 展 望
危害物呋喃的前体物质有氨基酸、碳水化合物、抗坏血酸类和脂类物质等[29-34].然而,并非所有的氨基酸都可单独反应生成呋喃,有些氨基酸必须和碳水化合物进行美拉德反应才可生成呋喃[29],对此我们的认识还不够,我们并未总结出规律性的结论.有报道称己糖、戊糖、四碳糖甚至三碳糖(甘油醛)都能产生呋喃[35],然而除了己糖和戊糖,研究其他糖的很少,仅有个别报道.鉴于呋喃骨架本身就有4个碳原子,三碳糖不可能作为呋喃的唯一前体,还有1个碳原子来源于何处?除了上述前体化合物外,个别报道称核黄素和类黑精亦能产生呋喃[26],这些还有待进一步证实.因为13C标记的葡萄糖种类较为齐全,既有全部标记的也有C1位、C2位或C6位标记的,所以人们对葡萄糖单独存在时的热降解或与氨基酸共同存在时的美拉德反应途径的研究[34]相对最为透彻;而13C标记的抗坏血酸缺乏全标记的产品,因此某些反应过程只能推断[33].除了葡萄糖和抗坏血酸,人们对氨基酸和脂类生成呋喃的过程认识的更少,多数反应途径都是在前人对氨基酸和脂类物质热氧化或分解的研究基础上,结合有机化学知识的推断,缺乏碳标记氨基酸和脂肪酸的呋喃形成机理研究.对呋喃转化途径影响因素的研究多是在简单的模拟系统中,对单条形成途径进行的单因素研究[12,32-33,36].未见同时考虑多因素对单转化途径的协同作用,亦未见多因素对不同转化途径中反应速率的影响,更缺乏相关的动力学研究,难以进行呋喃含量的控制和预测.
早期的研究虽然取得了很大的成绩,真实食品体系的复杂性远超简单的模拟体系,食品组分、外源添加物和加工过程的多样性,使得呋喃产生过程更为复杂多变.事实上,很多学者已经证实,将模拟体系中呋喃形成的研究结论应用于解释真实食品中呋喃含量的变化时,往往出现很大偏差,因此必须谨慎[33-34].因为食品加工过程中呋喃的产生具有动态性、实时性、非线性以及不确定性等复杂特点,所以在研究加工过程中呋喃的形成机制时,必须要正确认识和把握这种多层次的复杂性,由简至繁(一元模拟体系—多元模拟体系—真实食品体系),由微观到宏观(分子路线—影响因素—构建模型)研究其中呋喃的形成机制,才能全面综合反映呋喃与其产生底物以及加工过程之间的互动关系.
[1] International Agency for Research on Cancer,WHO. IARC monographs on the evaluation of carcinogenic risks to humans:Dry cleaning,some chlorinated solvents and other industrial chemicals[R]. IARC,1995,63:393.
[2] US Food and Drug Administration. Office of plant and dairy foods:Exploratory data on furan in food [EB/OL]. 2004. http://www. cfsan. fda. gov.
[3] European Food Safety Authority. Report of the scientific
panel on contaminants in the food chain on provisional findings of furan in food[R]. EFSA Journal,2004,a, 137:1-20.
[4] European Food Safety Authority. Report of the contam panel on provisional findings on furan in food[R]. 2004,b,http://www. efsa. europa. eu.
[5] Jestoi M,Järvinen T,Järvenpää E,et al. Furan in the baby-food samples purchased from the Finnish markets:Determination with SPME-GC-MS[J]. Food Chemistry,2009,117(3):522-528.
[6] 刘平,薛颖,金庆中,等. 顶空气相色谱-质谱法测定婴幼儿食品中的呋喃[J]. 色谱,2008,26(1):35-38.
[7] 何碧英,孙健,柳洁,等. 顶空气相色谱-质谱法测定食品中呋喃[J]. 中国卫生检验杂志,2009,19(12):2790-2792.
[8] Maga J A,Katz I. Furans in foods[J]. Critical Reviews in Food Science & Nutrition,1979,11(4):355-400.
[9] Limacher A,Kerler J,Davidek T,et al. Formation of furan and methylfuran by Maillard-type reactions in model systems and food[J]. Journal of Agricultural and Food Chemistry,2008,56(10):3639-3647.
[10] Locas C P,Yaylayan V A. Origin and mechanistic pathways of formation of the parent furan:A food toxicant[J]. Journal of Agricultural and Food Chemistry,2004,52(22):6830-6836.
[11] Märk J,Pollien P,Lindinger C,et al. Quantitation of furan and methylfuran formed in different precursor systems by proton transfer reaction mass spectrometry[J]. Journal of Agricultural and Food Chemistry,2006,54(7):2786-2793.
[12] Becalski A,Seaman S. Furan precursors in food:A model study and development of a simple headspace method for determination of furan[J]. Journal of AOAC International,2005,88(1):102-106.
[13] Limacher A,Kerler J,Conde-Petit B,et al. Formation of furan and methylfuran from ascorbic acid in model systems and food[J]. Food Additives and Contaminants,2007,24(S1):122-135.
[14] Owczarek-Fendor A,De Meulenaer B,Scholl G,et al. Furan formation from vitamin C in a starch-based model system:Influence of the reaction conditions[J]. Food Chemistry,2010,121(4):1163-1170.
[15] Owczarek-Fendor A,De Meulenaer B,Scholl G,et al. Furan formation in starch-based model systems containing carbohydrates in combination with proteins,ascorbic acid and lipids[J]. Food Chemistry,2012,133(3):816-821.
[16] Blank I. Furan in Processed Foods;Bioactive Compounds in Foods[M]. New York:Blackwell Pub Professional,2008.
[17] Sayre L M,Arora P K,Iyer R S,et al. Pyrrole formation from 4-hydroxynonenal and primary amines[J]. Chemical Research in Toxicology,1993,6(1):19-22.
[18] Gérard-Monnier D,Erdelmeier I,Régnard K,et al. Reactions of 1-methyl-2-phenylindole with malondialdehyde and 4-hydroxyalkenals. Analytical applications to a colorimetric assay of lipid peroxidation[J]. Chemical Research in Toxicology,1998,11(10):1176-1183.
[19] Owczarek-Fendor A,De Meulenaer B,Scholl G,et al. Furan formation from lipids in starch-based model systems,as influenced by interactions with antioxidants and proteins[J]. Journal of Agricultural and Food Chemistry,2011,59(6):2368-2376.
[20] Fan X T. Formation of furan from carbohydrates and ascorbic acid following exposure to ionizing radiation and thermal processing[J]. Journal of Agricultural and Food Chemistry,2005,53(20):7826-7831.
[21] Fan X T,Huang L H,Sokorai K J B. Factors affecting thermally induced furan formation[J]. Journal of Agricultural and Food Chemistry,2008,56(20):9490-9494.
[22] Huang X S,Duan H Y,Barringer S A. Effects of buffer and temperature on formation of furan,acetic acid and formic acid from carbohydrate model systems[J]. LWT -Food Science and Technology,2011,44(8):1761-1765.
[23] Adams A,De Kimpe N. Chemistry of 2-acetyl-1-pyrroline,6-acetyl-1,2,3,4-tetrahydropyridine,2-acetyl-2-thiazoline,and 5-acetyl-2,3-dihydro-4H-thiazine:Extraordinary Maillard flavor compounds[J]. Chemical Reviews,2006,106(6):2299-2319.
[24] Rizzi G P. Role of phosphate and carboxylate ions in Maillard browning[J]. Journal of Agricultural and Food Chemistry,2004,52(4):953-957.
[25] 王允圃,刘玉环,阮榕生,等. 食品热加工与非热加工技术对食品安全性的影响[J]. 食品工业科技,2011,32(7):463-467.
[26] La Pera L,Liberatore A,Avellone G,et al. Analysis of furan in coffee of different provenance by head-space solid phase microextraction gas chromatography-mass spectrometry:Effect of brewing procedures[J]. Food Additives and Contaminants,2009,26(6):786-792.
[27] Petisca C,Pérez-Palacios T,Farah A,et al. Furans and other volatile compounds in ground roasted and espresso coffee using headspace solid-phase microextraction:Effect of roasting speed[J]. Food and Bioproducts Processing,2013,91(3):233-241.
[28] Arisseto A P,Vicente E,Ueno M S,et al. Furan levels in coffee as influenced by species,roast degree,and brewing procedures[J]. Journal of Agricultural and Food Chemistry,2011,59(7):3118-3124.
[29] Arisseto A P,Vicente E,Furlani R P,et al. Occurrence of furan in commercial processed foods in Brazil[J]. Food Additives and Contaminants,2012,29(12):1832-1839.
[30] Egle J L Jr,Gochberg B J. Respiratory retention and acute toxicity of furan[J]. American Industrial Hygiene Association Journal,1979,40(4):310-314.
[31] Burka L T,Washburn K D,Irwin R D. Disposition of[14C]furan in the male F344 rat[J]. Journal of Toxicology and Environmental Health,1991,34(2):245-257.
[32] National Toxicology Program. Toxicology and carcinogenesis studies of furan(CAS No. 110-00-9)in F344-N rats and B6C3Fl mice(gavage studies)[J]. National Toxicology Program Technical Report Series,1993,402:1-286.
[33] 冯新昌,李拥军. 食品中吠喃的检测方法研究进展[C]//西北地区第七届色谱学术报告会暨甘肃省第十二届色谱年会论文集. 兰州:中国化学会,甘肃省化学会,2012:26-28.
[34] 封丽红,蔡海霞,吴伟. 气相色谱顶空进样方法的改进[J]. 山西建筑,2010,36(4):203-204.
[35] Altaki M S,Santos F J,Galceran M T. Analysis of furan in foods by headspace solid-phase microextraction:Gas chromatography-ion trap mass spectrometry[J]. Journal of Chromatography A,2007,1146(1):103-109.
[36] Yaylayan V A. Precursors,formation and determination of furan in food[J]. Journal für Verbraucherschutz und Lebensmittelsicherheit,2006,1(1):5-9.
责任编辑:周建军
The Mechanism of Furan Formation in Heat-processed Food
ZHANG Ying1,LIANG Yuhang1,ZHANG Jian2,LÜ Xiaoling1
(1. Key Laboratory of Food Nutrition and Safety,Ministry of Education,College of Food Engineering and Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China;2. Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
Furan is a cyclic enol ether which commonly exists in heat processed food. It has been classified as “possibly carcinogenic to humans” in group 2B by the International Agency for Research on Cancer(IARC). Reducing the furan content in heat processed food as much as possible can effectively improve food safety and elucidating the mechanism of furan formation in heat processed food is the premise and basis of the regulation of furan content in foods. Therefore,on the basis of the molecular route and influential factors of furan formation in thermally processed foods,we give a comprehensive overview of relevant researches on furan formation mechanism in recent years,thoroughly analysed and summarizedthe inadequacies of existing researches,and then proposed a corresponding solution.
furan;heat-processed food;formation mechanism
TS207.3 文献标志码:A 文章编号:1672-6510(2015)01-0001-08
10.13364/j.issn.1672-6510.20140034
呋喃(furan),分子式为C4H4O,是一种小分子环状烯醚,具有无色、芳香、亲脂和易挥发(沸点31,℃)的特性[1].很久以前,人们就在多种食品中发现了呋喃的存在,然而直到1995年,国际癌症研究机构(IARC)发现呋喃是鼠的强致癌物,并将呋喃归类为可能使人类致癌的“2B”类致癌物后[2],人们才逐渐认识到呋喃的危害性.2004年,美国食品药品监督管理局(FDA)发布数据显示,在很多经过加热处理的食品中检出了危害物呋喃[3];之后,欧盟食品安全局(EFSA)等也都报道从11大类的受检食品中发现了呋喃[4].鉴于食品中存在的呋喃可能会引起潜在的消费恐慌,2005年9月1日,FDA出台了行动纲要,对食品中呋喃的暴露情况及其对人体的潜在影响进行深入研究.通过研究,FDA与EFSA的科研人员发现含有呋喃的食品几乎都经过热加工处理,其含量高的食品则大多是罐装食品[3,5].
人们已经认识到,要提升热加工食品的安全性,必须尽可能降低其中的呋喃含量,而阐明食品中呋喃的形成机制,则是调控热加工食品中呋喃含量的前提和基础,意义深远.在2010年之前,除了寥寥几篇关于食品中呋喃检测的文章[6-7]外,国内关于“食品中呋喃的形成机制”的报道极为少见.相比而言,国外学者围绕“食品中危害物呋喃”做了更多的研究工作.因为人们对危害物呋喃的重视始于2004年,所以大量的呋喃相关报道都出现在2004年以后,内容主要涉及食品中呋喃的检测方法、毒理学评估、暴露监测、行为效应和形成机制等方面.因为食品基质成分复杂,相态各异,且加工方式多样,对食品中危害物呋喃的生成、释放、消长和定量都有很强的干扰,所以现有的关于“呋喃形成机制”的研究多是在简化的一元(单一前体)或二元(两种前体)模拟体系中,模拟烧烤或蒸煮(灭菌)条件进行的,所取得的研究进展主要包含以下两个方面.
2014-03-19;
2014-07-10
国家自然科学基金资助项目(31201354,31101275)
张 颖(1978—),女,天津人,高级实验师;通信作者:吕晓玲,教授,lxling@tust.edu.cn.
