不同盐度下凡纳滨对虾扰动作用对沉积物
2015-07-21熊莹槐王芳钟大森
熊莹槐++王芳++钟大森
摘要:采用室内培养方法,研究了三个盐度水平下(盐度分别为5‰,20‰,35‰)凡纳滨对虾的扰动作用对沉积物-水界面NH+4-N、NO-3-N、NO-2-N和SRP通量的影响。结果显示:凡纳滨对虾在三个盐度下都可以促进沉积物NH+4-N的释放,但是促进效果不相同,总体表现为盐度越高促进作用越明显;盐度为5‰时对虾对沉积物NO-3-N释放的促进作用最低,但对NO-2-N释放的促进作用最高;盐度为20‰时对虾对沉积物NO-3-N和NO-2-N释放的促进作用均较高,且对沉积物NO-3-N释放的促进作用是三个盐度水平下最高的。实验的前8 d各盐度下对虾对SRP的促进效果没有显著差异,而实验持续到15 d后高盐度组对虾的促进作用比低盐度组显著。
关键词:凡纳滨对虾;盐度;扰动作用;沉积物-水界面;营养盐通量
研究发现,底栖动物通过摄食、排泄排遗、挖掘、避敌等活动对沉积物-水界面产生各种影响,最终影响沉积物-水界面间营养盐的迁移和转化[1-3]。不同底栖动物扰动作用产生的效果和方式也不尽相同,Zhang等[4]发现河蚬(Corbicula fluminea)可以促进沉积物耗氧和沉积物氮磷营养盐释放,Fanjul等[5]发现张口蟹(Neohelice granulata)可以促进沉积物-水界面的氨化、硝化和反硝化作用,Nizzoli等[6]发现沙蚕(Nereis spp.)可以促进沉积物释放NH+4-N和SRP,但却抑制沉积物NO-3-N的释放。
凡纳滨对虾(Litopenaeus vannamei)是我国重要的水产养殖品种,其肉质鲜美,生长迅速,且适盐范围广,可以在淡水、半咸水和海水中养殖[7]。20世纪80年代凡纳滨对虾刚被引进中国时主要是在海水池塘进行养殖[8],随着养殖规模的不断扩大和凡纳滨对虾淡水养殖技术的提高,凡纳滨对虾在内陆淡水池塘的养殖日渐兴起,据统计2012年我国淡水养殖凡纳滨对虾产量约为69万t,而海水养殖凡纳滨对虾产量约为76万t,两者产量已非常接近[9]。关于凡纳滨对虾在淡水池塘中的扰动作用研究有零星报道(Zhong等[10]),但关于不同养殖盐度下对虾的生物扰动作用有何异同却未见报道。本实验设计了三种盐度梯度,研究了凡纳滨对虾在不同盐度条件下扰动作用对沉积物-水界面营养盐通量的影响,以期为不同盐度下的养殖水体水质调控提供参考。
1材料与方法
1.1实验设计与方法
实验于2013年8-9月在青岛市国家海洋科研中心进行。对虾适应实验室条件后,取500 尾对虾,每天换水时加入适量海水升高盐度2‰~3‰逐渐驯化至盐度35‰。另分别取500 尾对虾,每天换水时加入适量淡水降低盐度2‰~3‰逐渐驯化至盐度5‰和20‰。对虾驯化至目标盐度后继续饲养30 d至实验开始。驯化期间的养殖用水为砂滤自然海水和曝气的自来水,其他养殖条件与暂养期间的相同。
实验在18个圆柱形PVC容器中进行(底面半径为12 cm,高为35 cm)。实验设5‰,20‰,35‰三个盐度处理组(分别用S5,S20,S35表示)每个盐度处理组又分为对虾组和对照组,对虾组中每个容器内放入4尾凡纳滨对虾,湿体重为(07±0.1) g,对照组中不放对虾,每一组均为3个重复。凡纳滨对虾放入容器前,在每个容器中铺入8 cm厚底泥,底泥取自附近养殖池塘,清水冲洗使其充分湿润,拣去其中石块及杂物,经搅拌混匀过筛(16目)后平铺入各个容器内。底泥铺好后,各组注入相应盐度的实验用水,然后放入对虾,用孔径为0.4 cm的网将容器口封好,防止对虾跳出。每个容器设一个气石,连接到300 W的小型充气泵,实验期间始终充气,气石处于水体表面,不使其对沉积物有影响。实验期间各处理组仅投喂少量的对虾饲料,且投喂量相同,实验期间不换水。实验期间如发现有对虾死亡或者蜕皮,则立即取出并补充规格相近的对虾。
1.2样品的采集与测定
对虾放入容器后的第二天开始取样,视为第1 d,其后每隔7 d取样一次,共取样五次。每次取样时将容器口上的网小心揭开,换上配套制作的PVC盖子,盖子内表面安装有搅拌子,其可在盖子外表面上电动机的带动下以50 r/min的速度进行匀速转动。搅拌子启动后即可开始培养实验,培养时间为4 h,培养前、后取水样50 mL用0.45 μm滤膜过滤,保存于30 mL白色聚乙烯塑料瓶中,在-20 ℃下冷冻保存,用于测定NH+4,NO-3,NO-2和SRP的含量。
NH+4含量用纳氏试剂法测定,NO-3含量用酚二磺酸法测定,NO-2用镉柱还原法测定, 可溶性磷酸盐( SRP) 用钼蓝法测定。营养盐通量计算公式如下[11-12]:
F=ΔC·VA·Δt
式中F为营养盐通量(μmol·m-2·d-1或mmol·m-2·d-1) ;V为上覆水的体积(m3);A为容器的横截面积(m2);Δt为培养时间(d);ΔC表示培养前后培养器营养盐浓度的变化。
1.3数据统计分析
采用SPSS13.0软件(SPSS 13.0 for Windows, SPSS Inc., Richmond, CA, USA)进行数据统计分析。首先用各盐度处理组下对虾组的通量值减去对照组的通量值,得到各盐度下凡纳滨对虾对沉积物-水界面通量影响的净值,然后不同取样时间和各盐度处理组间对虾影响的净值先进行ANOVA分析,然后进行Duncan多重比较,方差分析前先进行方差齐性检验,以P<0.05作为差异显著水平。
2结果
2.1不同盐度水平下沉积物-水界面NH+4-N通量
不同盐度下凡纳滨对虾对沉积物-水界面NH+4-N通量的影响随时间的变化如图1,其变化范围为(13.51±1.25)~(56.95±2.08) mmol· m-2·d-1。由图可知,三种盐度下对虾均可促进沉积物NH+4-N的释放。实验第1 d时三种盐度下对虾的影响没有显著差异 (P>0.05),到实验持续到第8 d时S35组对虾对沉积物NH+4-N释放的促进作用显著高于其他两组,而S20组对虾的促进作用也要显著高于S5组(第15 d除外)(P<0.05)。
图1各组NH+4-N通量随时间的变化
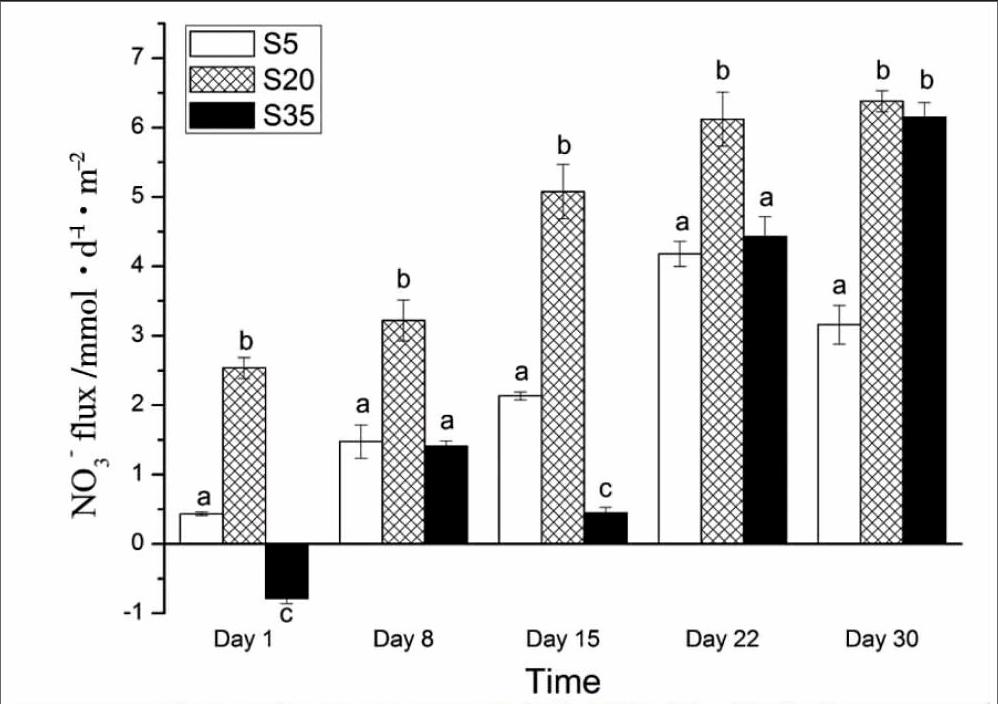
2.2不同盐度水平下沉积物-水界面NO-3-N通量
不同盐度下凡纳滨对虾对沉积物-水界面NO3--N通量的影响随时间的变化如图2,其变化范围为(-0.78±0.07)~(6.38±0.15) mmol ·m-2·d-1。从图2可以看出,除第1 d时S35组对虾促进沉积物NO-3-N吸收外,各盐度下对虾均表现为促进沉积物NO-3-N释放。实验期间S20组对虾对沉积物NO-3-N释放的促进作用均要显著高于其他两组 (P<0.05)(实验持续到第30 d时与S35组无显著差异 (P>0.05))。第1 d和第15 d时S5组对虾对沉积物NO-3-N释放的促进作用显著高于S35组,到第30 d时则是S35组更高 (P<0.05)。
图2各组NO-3-N通量随时间的变化
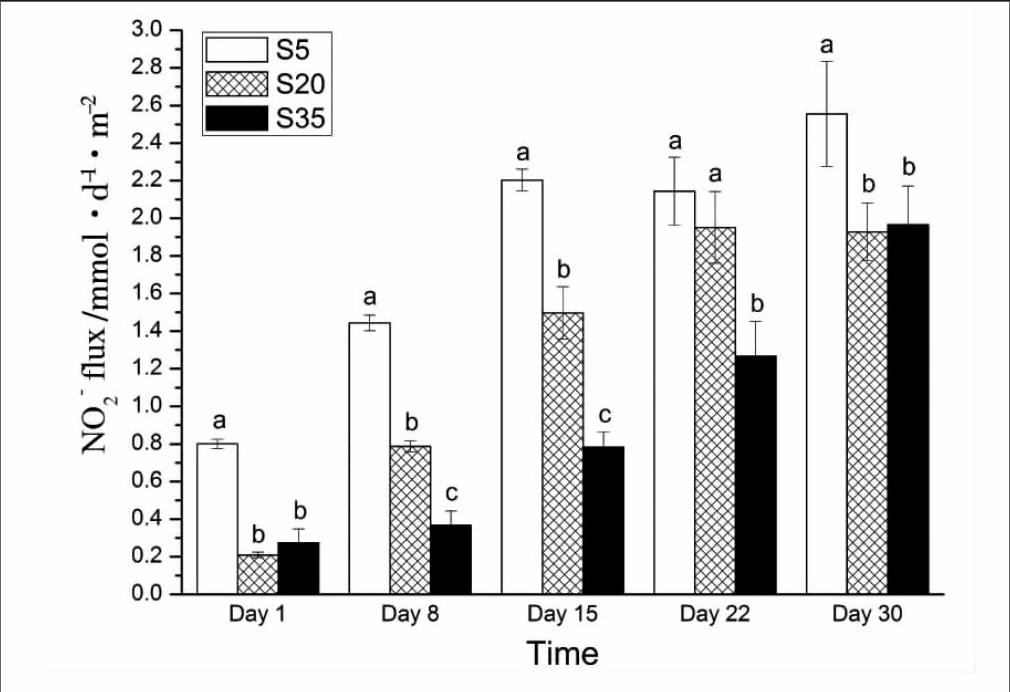
2.3不同盐度水平下沉积物-水界面NO-2-N通量
不同盐度下凡纳滨对虾对沉积物-水界面NO-2-N通量的影响随时间的变化如图3,各盐度下对虾均促进沉积物NO-2-N的释放,其变化范围为(0.21±0.01)~(2.56±0.26) mmol· m-2 ·d-1。实验期间S5组对虾对沉积物NO-2-N释放的促进作用始终显著高于其他两组 (P<0.05)(第22 d时与S20组无显著差异)。第1 d和第30 d时S20组和S35组无显著差异 (P>0.05),其他各次取样时S20组对虾对沉积物NO-2-N释放的促进作用要显著高于S35组 (P<0.05)。
图3各组NO-2-N通量随时间的变化
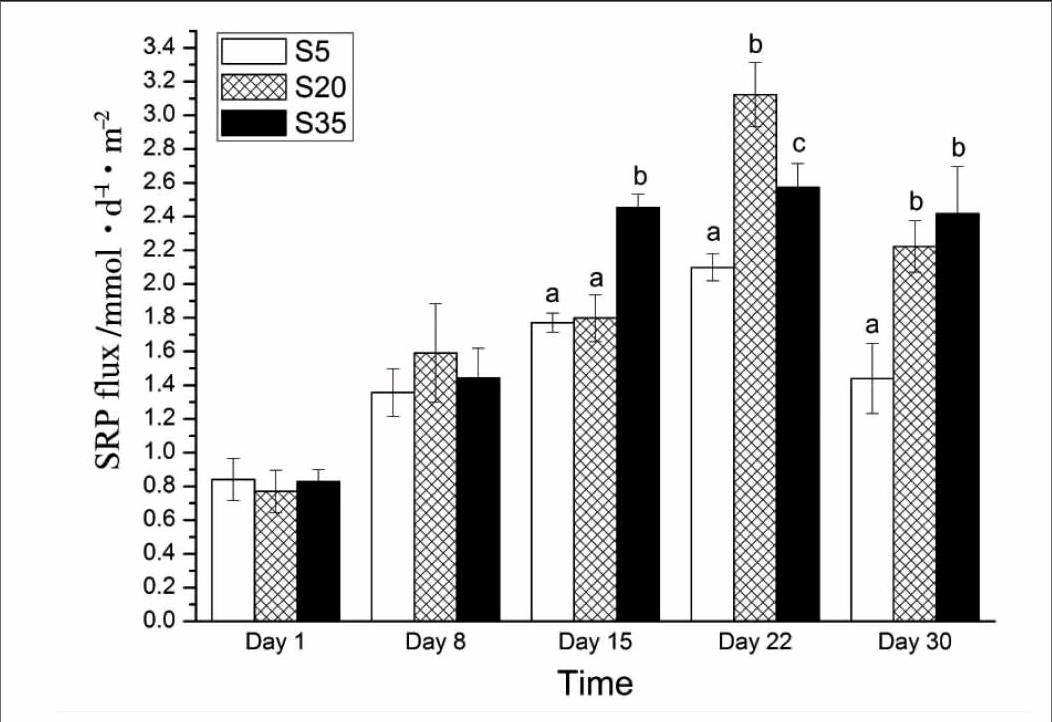
2.4不同盐度水平下沉积物-水界面SRP通量
不同盐度下凡纳滨对虾对沉积物-水界面SRP通量的影响随时间的变化如图4,各盐度下对虾均促进沉积物SRP的释放,其变化范围为(0.77±0.12)~(3.12±0.19)mmol·m-2·d-1。第1 d和第8 d时各盐度组对虾对沉积物SRP释放的促进作用无显著差异 (P>0.05),实验持续到第15 d后S35组对虾的促进作用即显著高于S5组,第22 d开始S20组也显著高于S5组 (P>0.05)。
图4各组SRP通量随时间的变化
3讨论
很多研究发现底栖动物的活动会对沉积物-水界面营养盐通量造成影响,且不同类型的底栖生物其造成的影响也不尽相同,而同一种生物在不同盐度下对沉积物-水界面通量的影响则鲜有报道。Zhong等[10]发现凡纳滨对虾在水体盐度为5‰的池塘中可促进沉积物耗氧和沉积物氮磷营养盐释放,本实验也发现凡纳滨对虾在5‰,20‰,35‰三种盐度下都可以促进沉积物-水界面沉积物营养盐释放,但是三种盐度下的促进效果并不相同,作者分析可能与不同盐度下凡纳滨对虾的活力、代谢速率等不同有关。
Zhong等[10]发现在池塘混养条件下凡纳滨对虾可以促进沉积物NH+4-N的释放,本实验中凡纳滨对虾在三种盐度下也都可以促进沉积物NH+4-N的释放,但是促进效果却不相同,总体表现为盐度越高促进作用越明显。有研究发现海水中的阴离子可中和NH+4-N的极性,与其形成离子对,从而降低沉积物颗粒对NH+4-N的吸附能力,加速沉积物NH+4-N的释放[13],因此,盐度降低NH+4-N从沉积物中析出的能力也相应减弱,且盐度越高水中的Na+、K+等离子也会增多,可以将沉积物中的NH+4-N置换出来[14];另外,在高盐度下硝化作用受到抑制[15],这些都可以造成沉积物-水界面有较高的NH+4-N浓度梯度,在凡纳滨对虾的搅动下,NH+4-N则更加容易向上覆水释放,所以盐度越高凡纳滨对虾扰动引起沉积物NH+4-N释放越明显。
NO-3-N和NO-2-N是水中氮元素循环的重要形态,其既是硝化作用的产物,又是反硝化作用和硝酸盐氨化作用的反应底物[16],且可被浮游植物直接吸收利用,同时这两种形态也可互相转化。其中,NO-2-N是一种具有潜在毒性的无机氮化合物,会影响到养殖生物的生理机能[17],故NO-3-N和NO-2-N在沉积物-水界面的扩散迁移对水质变化起着非常重要的作用。本实验中三种盐度下凡纳滨对虾都可以促进沉积物NO-3-N和NO-2-N的释放,但促进效果却不相同。盐度为5‰时对虾对沉积物NO-3-N释放的促进作用最低,但其对NO-2-N释放的促进作用却最高;盐度为20‰时对虾对沉积物NO-3-N和NO-2-N释放的促进作用均较高,且其对沉积物NO-3-N释放的促进作用是三种盐度下最高的。分析认为:随着盐度的升高,凡纳滨对虾粪便中所含NO-3-N的量也逐渐升高[18],所以盐度为5‰时沉积物表面因粪便沉降而积累的NO-3-N是最少的,另外NO-3-N和NO-2-N两种形态处于动态平衡中,溶氧降低时NO-2-N则会增多,盐度为5‰时沉积物-水界面耗氧最多(待发表数据),会造成溶氧降低,NO-3-N会大量向NO-2-N转化,所以最终盐度为5‰时对虾会促进沉积物NO-2-N的大量释放,但对沉积物NO-3-N释放的促进效果却不如其他两种盐度显著。盐度为20‰时对虾的活性最高,其运动对沉积物表面的搅动作用最强烈,所以盐度为20‰时对虾的促进作用又要高于盐度35‰。因此,盐度可以通过影响对虾排泄排粪、呼吸耗氧以及生物活性来影响沉积物-水界面NO-3-N和NO-2-N的形态变化和界面通量。
磷是水体中重要的限制性营养元素之一,磷的多寡会影响到水中浮游植物的生长[19],过多和过少的磷都会影响水体的生态平衡,沉积物既可以作为水体中磷的源也可以作为磷的汇,所以沉积物-水界面磷的迁移扩散会直接影响到水体中磷的含量。在池塘混养条件下,当凡纳滨对虾养殖密度为56尾/m2时,凡纳滨对虾的扰动作用会促进沉积物SRP的释放[10]。本实验中,对虾的养殖密度为88.5尾/m2,实验期间对虾在各盐度下也均可以促进沉积物SRP的释放。实验开始的前8 d各盐度下对虾的促进效果没有显著差异,到了15 d后高盐度组对虾的促进作用则要比低盐度组显著,这可能因为盐度升高时,水中Cl-,SO42-,OH-,Br-等离子数量增加,其会与沉积物中PO43-发生交换,使SRP更容易向上覆水扩散,所以在对虾的搅动下,高盐度组的沉积物SRP释放速率更高。
综上所述,凡纳滨对虾在盐度为5‰~35‰ 的水体中均可以促进沉积物-水界面沉积物营养盐释放,但促进效果有所不同,这可能与不同盐度下对虾的活力和代谢不同,以及不同盐度下水体离子种类和数量的不同有关等。盐度为5‰时对虾对沉积物-水界面耗氧和沉积物NO-2-N释放的促进作用最高,目前淡水和盐碱地低盐度水体养虾规模日趋增加,在养殖过程中应注意底部水体的增氧,避免缺氧和NO-2-N含量过高对养殖生物造成危害。
参考文献:
[1] Aller, R C. Transport and reactions in the bioirrigated zone. The benthic boundary layer, 2001, 5: 269-301
[2] Ritvo, G., Kochba, M., Avnimelech, Y. The effects of common carp bioturbation on fishpond bottom soil. Aquaculture, 2004, 242: 345-356
[3] Meysman, F. J. R., Middelburg, J. J., Heip, C. H. R. Bioturbation: a fresh look at Darwin's last idea. Trends Ecol. Evo., 2006, 21: 688-695
[4] Zhang, L., Shen, Q., Hu, H., Shao, S., Fan, C. Impacts of Corbicula fluminea on oxygen uptake and nutrient fluxes across the sediment-water interface. Water, Air, Soil Pollute, 2011, 220: 399-411
[5] Fanjul, E., Bazterrica, M. C., Escapa, M., María, A. G., Oscar, I. Impact of crab bioturbation on benthic flux and nitrogen dynamics of Southwest Atlantic intertidal marshes and mudflats. Estuarine, Coastal Shelf Sci., 2011, 92: 629-638
[6] Nizzoli D, Bartoli M, Cooper M, et al. Implications for oxygen, nutrient fluxes and denitrification rates during the early stage of sediment colonization by the polychaete Nereis spp. in four estuaries. Estuarine, Coastal Shelf Sci, 2007, 75(1): 125-134
[7] Bray WA, Lawrence AL, Leung-Trujillo JR. The effect of salinity on growth and survival of Penaeus vannamei, with observations on the interaction of IHHN virus and salinity. Aquaculture, 1994, 122(2): 133-146
[8] Wyban J. White shrimp boom continues. Global Aquaculture Advocate, 2002, 12: 18-19
[9] 国家统计局,《中国农村统计年鉴2012》,中国统计出版社,2012
[10] Zhong D, Wang F, Dong S, et al. Impact of Litopenaeus vannamei bioturbation on nitrogen dynamics and benthic fluxes at the sediment–water interface in pond aquaculture [J]. Aquaculture International, 2014: 1-14
[11] Kim, D. H., Matsuda, O., Yamamoto, T. Nitrification, denitrification and nitrate reduction rates in the sediment of Hiroshima Bay, Japan. J. Oceanogr., 1997, 53: 317-324
[12] Zheng, Z. M., Dong, S. L., Tian, X. L., Wang, F., Gao Q. F., Bai, P. F. Sediment-water fluxes of nutrients and dissolved organic carbon in extensive sea cucumber culture ponds. Clean: Soil Air Water, 2009, 37: 218-224
[13] 张兴正,陈振楼,邓焕广,等.长江口北支潮滩沉积物——水界面无机氮的交换通量及季节变化[J]. 重庆环境科学, 2003, 25(9): 31-34
[14] Gardner W S, Seitzinger S P, Malczyk J M. The effects of sea salts on the forms of nitrogen released from estuarine and freshwater sediments: Does ion pairing affect ammonium flux [J]. Estuaries, 1991, 14(2): 157-166
[15] 邹高龙,李小明,李启武,等.盐度变化对SBR中硝化作用的动态影响研究[J].环境工程学报,2009,3(4):595-600
[16] Hargreaves, J. A. Nitrogen biogeochemistry of aquaculture ponds. Aquaculture, 1998, 166: 181-212
[17] Jensen, F. B. Nitrite disrupts multiple physiological functions in aquatic animals. Comp. Biochem. Physiol., Part A: Mol. Integr. Physiol., 2003, 135: 9-24
[18] Jiang D H, Lawrence A L, Neill W H, et al. Effects of temperature and salinity on nitrogenous excretion by Litopenaeus vannamei juveniles [J]. Journal of Experimental Marine Biology and Ecology, 2000, 253(2): 193-209
[19] Sharpley, A. N., Chapra, S. C., Wedepohl, R., Sims, J. T., Daniel, T. C., Reddy, K. R. Managing agricultural phosphorus for protection of surface waters: Issues and options. Journal of Environmental Quality, 1994, 23, 437-451
Impact of Litopenaeus vannamei bioturbation on benthic fluxes
at the sediment-water interface in different salinities
XIONG Yinghuai, WANG Fang*, ZHONG Dasen
(The Key Laboratory of Mariculture Ministry of Education, Ocean University of China, Qingdao 266003, China)
Abstract:To explore the effect of shrimps' bioturbation on nutrient fluxes at the sediment-water interface in different salinities, three treatments were set in this research (the water salinity were 5, 20 and 35 );The benthic fluxes of NH4+-N, NO-3-N, NO-2-N, and soluble reactive phosphorus (SRP) were measured. The results showed that L. vannamei promoted NH+4-N releasing in all treatments, and the effect grew stronger with the increase in water salinity. In S5, L. vannamei had the strongest promoting effect on NO-2-N releasing, but the weakest promoting effect on NO-3-N releasing. While in S20, L. vannamei had the strongest promoting effect on NO-3-N releasing. There was no significant difference in the SRP fluxes among the treatments before 8d, while the SRP releasing was more significantly stimulated in higher salinity since 15 d.
Key words:Litopenaeus vannamei;salinity;bioturbation;sediment-water interface;
(收稿日期:2015-04-28;修回日期:2015-05-05)
