双酚A类同系物的雌激素效应及对MCF-7细胞的毒性
2015-07-19雷炳莉张凯琼
文 育,雷炳莉,康 佳,张凯琼,许 洁
(上海大学环境与化学工程学院环境污染与健康研究所,上海 200444)
双酚A类同系物的雌激素效应及对MCF-7细胞的毒性
文 育,雷炳莉,康 佳,张凯琼,许 洁
(上海大学环境与化学工程学院环境污染与健康研究所,上海 200444)
双酚A(bisphenol A,BPA)及其类似物作为聚碳酸酯的主要合成原料,一直是环境污染的重要问题,其环境分布及人体暴露是当今科学研究的热点.为评估环境中BPA类物质的毒性效应,采用MTT比色法检测了7种BPA类同系物对人雌激素受体(estrogen receptor,ER)缺失乳腺癌细胞MCF-7(ER–)增殖活性的影响.通过检测细胞乳酸脱氢酶(lactate dehydrogenase,LDH)露出率评估了目标物对MCF-7细胞膜的损伤,结果表明,在0.01~1.00µmol/L浓度范围内,受试化合物对MCF-7细胞的毒性较小,LDH少量露出;而在10和100µmol/L浓度下,细胞增殖受到显著抑制,细胞膜通透性显著改变,LDH大量露出.同时采用ER基因双杂交酵母实验检验了这几种BPA类同系物的雌激素效应大小,通过Logistic模型对曲线进行了拟合,并以模型估算的半数透导活性(EC50)评估了7种BPA类同系物的雌激素效应活性,其大小依次为TDP>BPAF>4Cl-BPA>BPC>BPA>BPE>BPAP.这说明其雌激素效应机制可能是通过和ER结合而产生的.
双酚A类同系物;雌激素效应;MCF-7细胞;细胞毒性
许多免疫调查及实验研究已经证实了环境中存在的内分泌干扰化合物(endocrine disrupting contaminants,EDCs)和人类健康及野生生物异常之间的因果关系[1-2].典型的内分泌干扰物双酚A(bisphenol A,BPA)类同系物是世界上生产量最大化学品之一,年产量超过36亿kg. BPA类同系物是一种重要的有机化工原料,作为环氧树脂、聚碳酸酯塑料以及阻燃剂等产品添加剂,被广泛应用于罐头内包装、食品包装材料、牙科填充剂、医疗设备、婴儿用品等塑料行业生产中[3-5].这些制品在长期使用或者高温、碱性条件下,BPA类同系物都会缓慢释放到周围环境中,并且很容易在环境中积累,通过水、空气、土壤和食品等对周围生物产生影响[6-7].由于BPA被广泛应用于日常使用的塑料制品中,因此目前有超过80个生物监测研究结果暗示,人类已广泛地暴露于BPA中[8-9].大量的动物实验结果暗示,即使是低水平地暴露在BPA中也会对人体产生不利的健康效应[8,10-11].美国成年人群的糠尿病和心血管疾病也与高浓度地暴露在BPA中存在很大的关联[12].因此,BPA类同系物已受到广泛的关注并引起人们的争议.美国食物和药物机构于2012年7月立法禁止在婴儿奶瓶和儿童饮水杯中添加BPA[13].由于BPA在日用品中已被许多国家和组织立法禁止使用[13-15],因此BPA类同系物如BPAF, BPF等被发展作为BPA的替代品,使用在环氧树脂、塑料、食品包装袋等制品中[16-17].但是目前就BPA类同系物对人体健康的毒理学效应研究还比较少[18-19].此外BPA是一个具有弱雌激素效应的化合物,其内分泌干扰作用是通过和体内雌激素受体(estrogen receptor,ER)结合而显示的.目前BPA类同系物在人体血液、尿液、组织和其他液体中已被监测到[20-23],并且比BPA更难生物降解[24],但对它们是否具有类似于BPA的毒性效应、雌激素效应以及其雌激素效应的作用途径仍然不是很清楚.
细胞毒性实验是生物学评价体系中最重要的检测指标之一,是体外检测待测物质暴露于受试生物后所产生的生理生化反应变化的重要手段,已被广泛应用于评价化合物及环境样品的健康毒性效应[7,18,25].对雌激素效应的筛选方法主要有受体结合活性法、细胞增殖法(E-Screen)[26]、重组受体/报告(reporter)基因表达培养细胞[27]、酵母法及双杂交(two-hybrid)酵母法[28]等,其中ER基因双杂交酵母法因其具有培养简单、所需时间短、特异高、检测限低.能对雌激素类化合物的雌激素效应进行快速筛查等优点而逐渐受到人们的青睐.
为了评估BPA类同系物的毒性效应及雌激素效应,本研究通过MCF-7细胞增殖实验、细胞膜损伤实验及ER基因双杂交酵母实验检测了目标化合物的雌激素效应及对MCF-7细胞的毒性效应.研究结果可为进一步研究该类化合物的毒性作用机理提供基础数据.
1 材料与方法
1.1 目标化合物
目标化合物为BPA和BPA类同系物,共7种,包括购自百灵威科技有限公司的BPA、4,4-亚乙基双苯酚(BPE)和4,4-(1-苯乙基)双酚(BPAP)、4,4-(1-甲基亚乙基)双(2-甲基苯甲醚)(BPC),以及购自上海梯希爱化成工业有限公司的四氯双酚A(4Cl-BPA)和4,4-硫代二苯酚(TDP).所有药品的纯度都大于98%,系列梯度浓度均溶解于DMSO(Sigma,USA)中备用.
1.2 MTT实验
MTT比色法常用于直接检测细胞代谢活性.乳腺癌MCF-7细胞,购于无锡博慧斯生物医药科技有限公司.在长期培养过程中,由于基因微卫星不稳定、缺失突变等原因,阳性乳腺癌细胞会逐渐演变为阴性细胞,此处标记为MCF-7细胞(ER–).MCF-7(ER–)细胞培养于含10%胎牛血清、100 U/L青霉素、100 U/L链霉素的含10%酚红的RMPI-1640完全培养基中(Hyclone公司),并于37◦C,5%CO2恒温培养箱中孵育生长.细胞呈贴壁状态,待细胞生长至80%~90%时传代.所有实验全部选择对数生长期的细胞.实验中采用无酚红的RPMI-1640培养基为暴露培养基.在实验之前先用无酚红的RPMI-1640培养基培养细胞24 h,使细胞体内原有的雌激素水平降到最小值.
将处于对数生长期的细胞接种于96孔板中,接种量为100µL/孔,细胞密度为4 000~6 000个/孔,于培养箱中培养20 h.然后换成无酚红的培养基培养24 h,再分别暴露于不同的BPA类化合物中24,48,72 h,之后弃废液,加入MTT,4 h后再弃废液,加入150µL DMSO,用酶标仪于490 nm波长处测定OD值,

式中,ODs为样品的OD值,ODc为对照的OD值.
1.3 乳酸脱氢酶检测方法
乳酸脱氢酶(lactate dehydrogenase,LDH)是存在于细胞浆内参与糖酵解最后一步,即丙酮酸和乳酸相互转化时的一种催化酶.作为细胞受损的一种标志性蛋白,在正常情况下,LDH存在于细胞浆内,不能透过细胞膜.当细胞受到损伤时,细胞膜通透性改变,LDH就从细胞内释放至培养液中,并在其催化乳酸生成丙酮酸的过程中,使氧化型辅酶I变成还原型辅酶,后者通过递氢体吩嗪二甲酯硫酸盐还原氯化硝基四氮唑蓝形成甲基化合物,通过光谱吸收检测产物吸收值来衡量细胞受损程度.
将处于对数生长期的细胞接种于24孔板中,接种量为600µL/孔.隔天换成无酚红培养基培养24 h,再暴露于不同的BPA类化合物中24 h之后取上清液进行实验.实验根据LDH测试盒(南京建成生物工程研究所)说明书进行.最后用酶标仪于440 nm波长处测定OD值,

式中,ODd为测定的OD值,ODt为标准品的OD值,ODb为空白样品的OD值,标准品浓度为2 mmol/L.
1.4 ER基因双杂交酵母实验
ER基因双杂交酵母实验主要用来检测能与ER竞争的类似物、抗雌激素化合物和环境样品的类似物、抗雌激素活性.雌激素效应的测定方法可参照文献[29],具体的实验材料与仪器如下:O-nitrophenol-β-D-galactopyranoside(ONPG),购自东京化成;17β-雌二醇(E2,阳性对照)、无氨基酵母氮源和氨基酸,购自美国Sigma公司;溶解酶Zymolyase(20 T),购自日本生化学工业;双杂交酵母基因工程菌株Y190,日本大坂大学西川淳一教授惠赠送;BIO-RAD 550酶标仪和DMSO(ACS级),购自AMRESCO.取在30◦C条件下培养了14~16 h的酵母菌50µL加入装有200µL培养基的1.5 mL的EP管中,再添加2.5µL的样品溶液(DMSO溶解液),震荡摇匀.置于DNA混合器上培养4 h(30◦C).移取150µL上清液于96孔酶标板中,在595 nm波长下测定菌液的OD值.余下的溶液以12 000 r/min离心5 min.弃去上清液后,加入200µL含1 mg/mL Zymolyaser的Z bu ff er溶液.震荡混匀后,静置反应20 min(30◦C),加入100µL 1 mol/L的Na2CO3溶液使反应停止.于12 000 r/min离心5 min,吸取上清液150µL于96孔酶标板中,分别于414和570 nm波长下测定OD值.ONPG活性的计算公式如下:

式中,t为加入ONPG后的反应时间(min),v为菌液体积(0.05 mL).
2 结果与讨论
2.1 MTT结果
MCF-7细胞在体外长期培养后会发生ER丢失现象[30],但细胞形态并未改变,且与正常乳腺癌细胞有相同的生物学活性.有研究发现,MCF-7(ER–)细胞生长速度更快,在小鼠体内成瘤的速度也更快,可能与其增殖依赖于MCF-7(ER+)细胞不同的信号通路有关[7].本实验以MCF-7(ER–)作为指示细胞,用MTT法快速检测了该细胞的增殖活性,结果如图1所示.可见,BPA类同系物在低浓度时对MCF-7细胞的增殖表现出了一定的促进作用,与空白对照相比,虽然存在显著性差异,但其增殖比率基本都低于1.6倍.BPA类同系物的促增殖效应随剂量变化不明显,但BPAP,BPAF和TDP均表现出了一定的时间效应依赖关系,即随着暴露时间的延长,其增殖效应也增强.这说明BPA类同系物在低浓度下具有一定的雌激素效应,并且其雌激素效应的强弱与暴露时间存在一定的关系.BPA的MTT实验只进行了24 h,没有表现出对MCF-7细胞的促增殖效应.BPA及其同系物基本在暴露浓度为10或100µmol/L时,表现出了对MCF-7细胞的毒性效应.当暴露浓度为100µmol/L时,其增殖比率基本都在0.4以下,当暴露时间为72 h时,其对MCF-7细胞的毒性效应要强于暴露时间为24 h时.张帅帅等[7]研究了5种BPA类同系物对MCF-7细胞的增殖抑制率,同样得出了在10-5和10-4µmol/L时表现出毒性效应的结果.这说明受试BPA类同系物除了BPE,均在低浓度时表现为促进细胞增殖,在高浓度时抑制细胞增殖的毒性效应,说明BPA类同系物与BPA类似,具有促细胞增殖效应,其促进细胞增殖的途径可能与乳腺癌细胞的增殖信号通路有关[31].雌激素类化合物可通过与核受体途径(如nER)和膜受体途径(如GPR30)结合而调节细胞的转录,如促进细胞的增殖、抑制细胞的凋亡等[32-33].已有研究发现,BPAF可通过ER信号通路和GPR30信号通路调节途径促进行乳腺癌细胞T47D和MCF-7细胞的增殖[34-35].因此,本研究虽然使用的是MCF-7(ER–)细胞,但其增殖效应可以通过膜受体途径(GPR30)产生,具体的促增殖效应信号转导通路需要通过相关靶蛋白及靶基因的表达来进一步验证.
2.2 LDH结果
细胞膜通透性的改变是许多毒性物质作用于细胞膜时一种常见的早期反应,因此细胞培养液中LDH活性的高低可间接地反映受试物的毒性大小[36].通过检测培养液中的LDH值可以反映目标化合物对MCF-7细胞膜损伤的程度(见图2).从MTT实验结果得出,当暴露浓度大于1µmol/L之后,BPA类同系物就已经开始产生细胞毒性效应,且在暴露浓度为100µmol/L时细胞基本趋于死亡.因此,LDH实验浓度选择在1~100µmol/L范围内.由图2可见,这几种化合物基本都是在低浓度(0.1,1,10µmol/L)时LDH露出率较低,而在25,50和100µmol/L时,除BPE外,其他几种化合物的LDH露出率均较高,并且呈现出一定的剂量效应依赖关系;在任何一个暴露浓度下,BPE对MCF-7细胞的LDH露出率基本没有影响.从MTT实验结果也可以发现,BPE在暴露时间为24 h时,对MCF-7细胞的毒性效应较小,说明细胞膜损伤较小,因此LDH的露出率较低.MTT和LDH实验结果的联合应用已被很好地应用于检测有毒物质对受试细胞的毒性效应,二者在结果上互为印证[36-37],为进一步研究细胞凋亡、增殖、分化等生物学效应的机制机理提供了更为可靠的基础数据.本研究中LDH的露出率结果同样能够很好地解释MTT的实验结果.

图1 不同浓度的BPA类同系物对MCF-7细胞增殖的毒性效应Fig.1 Proliferation toxicity of BPA analogues on MCF-7 cells
图2 不同浓度的BPA类同系物对MCF-7细胞膜损伤的影响Fig.2 In fl uence of BPA analogues on MCF-7 cell membrane damage
2.3 目标化合物的雌激素效应结果
用双杂交酵母法所测得的阳性对照物质E2的剂量效应如图3所示.可以看出,当E2浓度为0.625µmol/L时,其作用活性达到最高值,且在此浓度后进入平台期.图4描述了不同BPA类同系物的ER基因双杂交酵母实验检测结果.可见,E2和BPA类同系物都具有雌激素效应,只是E2的雌激素效应更强.使用Logistic模型对曲线进行拟合,得出了各物质的EC50值(见表1),其中E2的EC50值为0.12µmol/L(此为外暴露浓度,若按内暴露浓度计算,其EC50值为1.2 nmol/L,与使用类似方法得出的0.25和0.201 nmol/L值在同一个数量级[38-39].总体上来说,BPA类同系物的EC50值要比E2小3~4个数量级.从EC50值上可以判断,其雌激素活性大小分别为TDP>BPAF>4Cl-BPA>BPC>BPA>BPE.由于BPAP在测定的浓度范围内没有表现出雌激素效应,因此没有计算出有效的EC50值.本实验同时计算了各种物质的相对作用活性,并以E2最高作用活性(0.625µmol/L时的作用活性)的5%,10%,20%和30%时对应的各物质的浓度来表示,将其表示为REC5,REC10,REC20和REC30,结果如表1所示.可以看出:以REC5为基准,相对活性大小为TDP>BPAF>BPA>4Cl-BPA>BPC>BPE;以REC10为基准,相对活性大小为TDP>BPAF>BPA>BPC>4Cl-BPA>BPE;以REC20和REC30为基准,相对活性大小均为TDP>BPAF>BPA>BPC>BPE>4Cl-BPA.可以看出,在这几种情况下,TDP的相对活性均最高,其次为BPAF和BPA.而BPC,BPE,4Cl-BPA的相对活性根据REC值的不同而不同.这些结果同样也与MTT实验结果一致.通过这种相对活性的方法,可以更直观地比较各种BPA类同系物在不同浓度下雌激素活性的强弱.已有研究表明,BPA的弱雌激素效应是通过与体内雌激素受体(如ER受体和GPR30受体)结合而产生的[38,40].本研究结果说明,BPA类同系物的雌激素效应可能类似于BPA,也是通过与ER结合而显示.BPA类同系物对MCF-7(ER–)细胞表现出较弱的增殖效应,也在一定程度上印证了这一点.
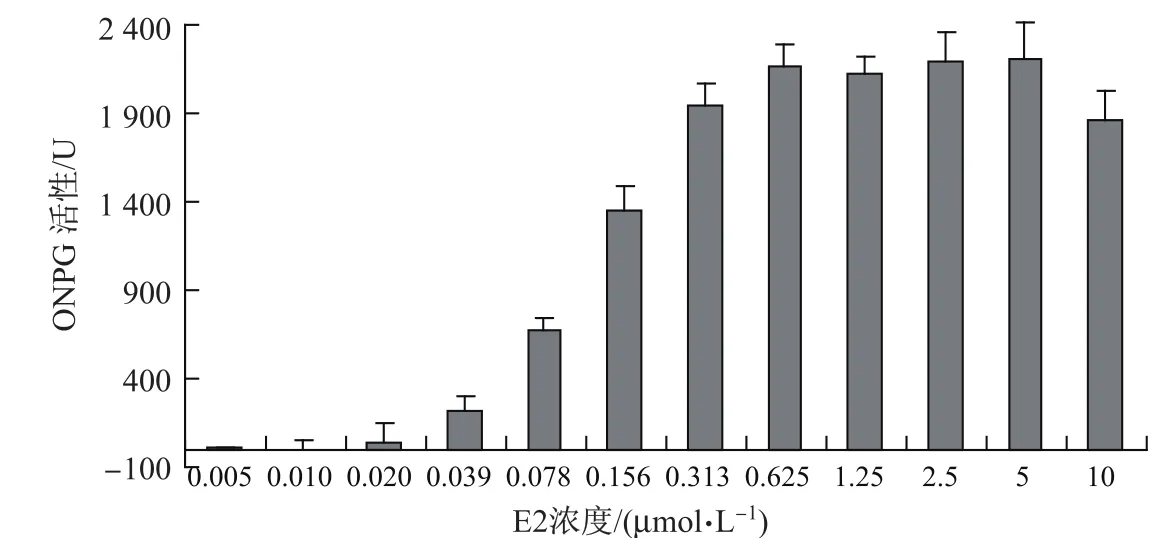
图3 不同浓度的E2诱导的ONPG活性Fig.3 Activities of ONPG induced by E2
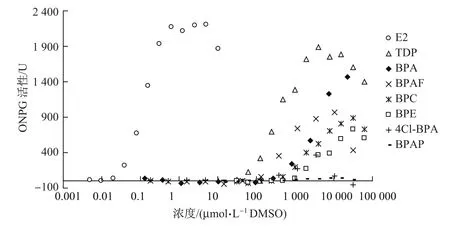
图4 不同浓度的BPA类同系物诱导的ONPG活性Fig.4 Activities of ONPG induced by BPA analogues
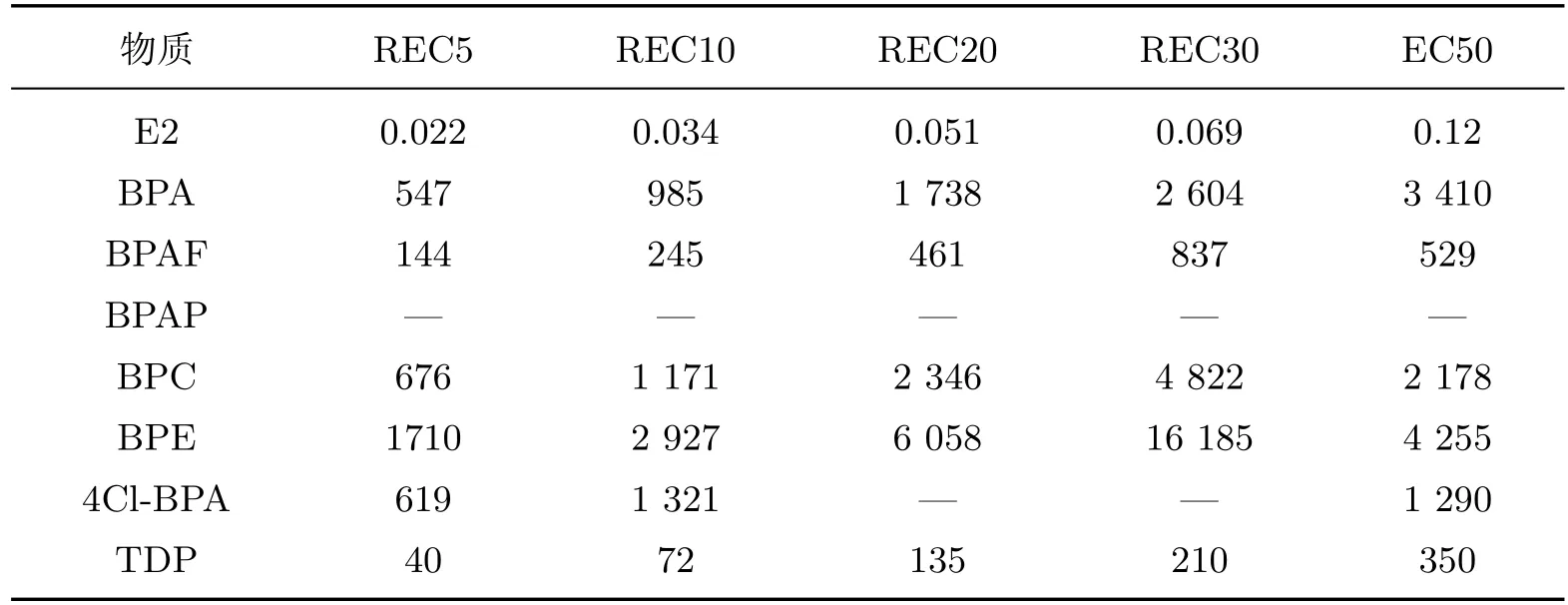
表1 BPA类同系物的雌激素活性Table 1 Estrogenic activities of BPA analogues (µmol·L-1)
3 结论
(1)BPA类同系物在低浓度时对MCF-7(ER–)细胞的增殖具有较弱的促进作用,在高浓度时表现出毒性效应.LDH实验结果能够很好地解释BPA类同系物对MCF-7细胞的MTT实验结果.
(2)人ER基因双杂交酵母实验结果表明,BPA类同系物与BPA一样具有雌激素受体效应,说明BPA类同系物可能类似于BPA,其雌激素效应机制可能是通过与ER结合而显示的.
致谢 本研究的酵母实验是在北京大学胡建英教授课题组完成的,在此表示感谢!
[1]HUANG Y Q,WONG C K,ZHENG J S,et al.Bisphenol A(BPA)in China:a review of sources, environmental levels,and potential human health impacts[J].Environment International,2012, 42:91-99.
[2]JOBLING S,TYLER C R.Endocrine disruption in wild freshwater fi sh[J].Pure and Applied Chemistry,2003,75:2219-2234.
[3]VANdENBERG L N,COLBOM T,HAYES T B,et al.Hormones and endocrine-disrupting chemicals:low-dose e ff ects and nonmonotonic dose response[J].Endocrine Reviews,2012,33:378-455.
[4]SCHMIdT J,KOTNIK P,TRONTELj J,et al.Bioactivation of bisphenol A and its analogs(BPF, BPAF,BPZ and DMBPA)in human liver microsomes[J].Toxicology in Vitro,2013,27:1267-1276.
[5]刘红玲,刘晓华,王晓蓉,等.双酚A和四溴双酚A对大型蚤和斑马鱼的毒性[J].环境科学,2007, 28:1784-1787.
[6]JI K,HONG S,KHO Y,et al.E ff ects of bisphenol S exposure on endocrine functions and reproduction of zebra fi sh[J].Environmental Science Technology,2013,47:8793-8800.
[7]张帅帅,刘堰,刘树深,等.不同终点检测5种双酚A类化合物对MCF-7的细胞毒性[J].环境科学, 2012,33(11):3935-3940.
[8]VANdENBERG L N,CHAHOUd I,HEINdEL J J,et al.Urinary,circulating,and tissue biomonitoring studies indicate widespread exposure to bisphenol A[J].Ciˆencia&Sa´ude Coletiva,2010, 17:407-434.
[9]CALAFAT A M,YE X,WONG L Y,et al.Exposure of the U.S.population to bisphenol A and 4-tertiary-octylphenol:2003—2004[J].Environmental Health Perspectives,2008,116:39-44.
[10]BONdESSON M,JONSSON J,PONGRATZ I,et al.A CASCADE of e ff ects of bisphenol A[J]. Reproductive Toxicology,2009,28:563-567.
[11]VOMSAAL F S,AKINGEMI B T,BELCHER S M,et al.Chapel Hill bisphenol A expert panel consensus statement:integration of mechanisms,e ff ects in animals and potential to impact human health at current levels of exposure[J].Reproductive Toxicology,2007,24:131-138.
[12]LANG I A,GALLOWAY T S,SCARLETT A,et al.Association of urinary bisphenol A concentration with medical disorders and laboratory abnormalities in adults[J].Journal of the American Medical Association,2008,300:1303-1310.
[13]FDA.Bisphenol A(BPA):use in food contact application,2012[EB/OL].[2012-12-25]. http://www.fda.gov/NewsEvents/PublicHealthFocus/ucmo64437.htm.
[14]NCSL.NCSL policy update:state restrictions on bisphenol A(BPA)in consumer products, 2012[EB/OL].[2012-12-05].http://www.ncsl.org/issues-research/env-res/policy-update-onstate-restrictions-on-bisphenol-a.aspx.
[15]EC.Amending directive 2002/72/EC as regards the restriction ofuse ofbisphenolA in plastic infant feeding bottles, 2011 [EB/OL].[2012-12-05].http://eurlex. europa.eu/LexUriServ/LexUriServ.do?ur=OJ:L:2011:026:0011:0014:EN:PDF.
[16]SUEIRO R A,SUAREZ S,ARAUjO M,et al.Mutagenic and geno toxic evaluation of bisphenol F diglycidyl ether(BFDGE)in prokaryotic and eukaryotic systems[J].Mutation Research,2003, 536:39-48.
[17]FENG Y,YIN J,JIAO Z,et al.Bisphenol AF may cause testosterone reduction by directly a ff ecting testis function in adult male rats[J].Toxicology Letters,2012,211:201-209.
[18]JIN S W,HUANG Y,LI M,et al.Cytotoxicity of bisphenol A and tetrabromobishphenol A on HepG2 cells[C]//Conference on Environmental Pollution and Public Health.2010:259-262.
[19]SUI Y P,AI N,PARK S H,et al.Bisphenol A and its analogues activate human pregnane X receptor[J].Environmental Health Perspectives,2012,120:399-405.
[20]LIAO C Y,KANNA K.Concentrations and pro fi les of bisphenol A and other bishpenol analogues in foodstu ff s from the United States and their implications for human exposure[J].Agricultural and Food Chemistry,2013,61:4655-4662.
[21]LIAO C Y,LIU F,GUO Y,et al.Occurrence of eight bisphenol analogues in indoor dust from the United States and several Asian countries:implications for human exposure[J].Environmental Science and Technology,2012,46:9138-9145.
[22]LIAO C Y,LIU F,MOON H B,et al.Bisphenol A analogues in sediments from industrialized areas in the United Sates,Japan,and Korea:spatial and temporal distributions[J].Environmental Science and Technology,2012,46:11558-11565.
[23]YANG Y J,YIN J,YANG Y,et al.Determination of bisphenol AF(BPAF)in tissues,serum, urine and feces of orally dosed rats by ultra-high-pressure liquid chromatography-electrospray tandem mass spectrometry[J].Journal of Chromatography B,2012,901:93-97.
[24]IKE M,CHEN M Y,DANZL E,et al.Biodegradation of a variety of bisphenols under aerobic and anaerobic conditions[J].Water Science and Technology,2006,53:153-159.
[25]康佳,雷炳莉,刘倩,等.上海河流沉积物的有机提取物对3种细胞的毒性效应[J].上海大学学报:自然科学版,2013,19:393-399.
[26]SOTO A M,SONNENSCHEIN C,CHUNG K L,et al.The E-Screen assay as a tool to identify estrogens:an update on estrogenic environmental pollut ants[J].Environmental Health Perspectives, 1995,103(S7):113-122.
[27]JUGAN M L,OZIOL L,BIMBOT M,et al.In vitro assessment of thyroid and estrogenic endocrine disruptors in waste water treatment plants,rivers and drinking water supplies in the greater Paris area(France)[J].Science of the Total Environment,2009,407:3579-3587.
[28]JIANG W W,YAN Y,MA M,et al.Assessment of source water contamination by estrogenic disrupting compounds in China[J].Journal of Environmental Sciences,2012,24:320-328.
[29]胡建英,谢国红.酵母双杂交系统测定抗雌激素物质[J].北京大学学报:自然科学版,2003,39: 449-453.
[30]SOMMER S,FUQUA S A W.Estrogen receptor and breast cancer[J].Seminars in Cancer Biology, 2001,11(5):339-352.
[31]PUpO M,PISANO A,LAppANO R,et al.Bisphenol A induces gene expression changes and proliferative e ff ects through GPER in breast cancer cells and cancer-associated fi broblasts[J]. Environmental Health Perspectives,2012,120(8):1177-1182.
[32]李苏华,邓华瑜.雌激素对乳腺癌细胞的作用及其信号转导机制[J].国际检验医学杂志,2008, 39(4):344-346.
[33]YU X Y,FILARdO E J,SHAIKH Z A.The membrane estrogen receptor(GPR30)mediates cadmium-induced proliferation of breast cancer cells[J].Toxicology and Applied Pharmacology, 2010,245:83-90.
[34]BERMUdEZ D,GAY L E,Jr.,WILSON V S.Modeling the interaction of binary and ternary mixtures of estradiol with bisphenol A and bisphenol AF in an in vitro estrogen-mediated transcriptional activation assay(T47D-Lbluc)[J].Toxicological Sciences,2010,116:477-487
[35]LI M,GUO J,GAO W H,et al.Bisphenol AF-induced endogenous transcription is mediated by ERα and ERK1/2 activation in human breast cancer cells[J].POLE ONE,2014,9:1-8.
[36]NATARAjAN N,THAMARAISELVAN R,LINGAIAH H,et al.E ff ect of fl avonone hesperidin on the apoptosis of human mammary carcinoma cell line MCF-7[J].Biomedicine&Preventive Nutrition,2011,1:207-215.
[37]JEONE C E,YEON J J,GUN-HEE K.Genistein inhibits the proliferation and di ff erentiation of MCF-7 and 3T3-L1 cells via the regulation of ER alpha expression and induction of apoptosis[J].Experimental and Therapeutic Medicine,2014,8:454-458.
[38]LI J,MA M,WANG Z J.In vitro pro fi ling of endocrine disrupting e ff ects of phenols[J].Toxicology in Vitro,2010,24:201-207
[39]刘倩,雷炳莉,安静,等.两种实验设计研究DES和EV对MCF-7细胞增殖的联合作用[J].环境科学,2013,34:3303-3308.
[40]DONG S,TERASAKA S,KIYAMA R.Bisphenol A induces a rapid activation of Erk1/2 through GPR30 in human breast cancer cells[J].Environmental Pollution,2011,159:212-218.
本文彩色版可登陆本刊网站查询:http://www.journal.shu.edu.cn
Estrogen activity and toxicity e ff ects of bisphenol A analogues on MCF-7 cells
WEN Yu,LEI Bing-li,KANG Jia, ZHANG Kai-qiong,XU Jie
(Institute of Environmental Pollution and Health,School of Environmental and Chemical Engineering, Shanghai University,Shanghai 200444,China)
Bisphenol A(BPA)and its analogues as main raw materials for synthesis of polycarbonate are important issue of environmental pollution.Most of the current studies focus on PBA analogues’environmental distribution and human exposure.To evaluate the cytotoxic e ff ects of BPA analogues,MTT assay was used to assess the proliferation toxicity of 7 kinds of BPA analogues on MCF-7(ER–),when ER is estrogen receptor.At the same time,releases of lactate dehydrogenase(LDH)escaping into cell culture medium were detected to evaluate the damage of cell membrane.The results showed that in the concentration ranges of 0.01~1.00µmol/L,the toxic e ff ects of tested compounds on MCF-7 cells were small and only a small amount of LDH were released.At concentrations of 10 and 100µmol/L,cell proliferation was signi fi cantly inhibited.Permeability of cell membranewas greatly changed,and lots of LDH were released.In addition,ER gene two-hybrid yeast bioassay was used to evaluate the estrogen e ff ects of BPA analogues.All the dose-response relationships were described by logistic function.The estrogenic activity expressed by EC50 were TDP>BPAF>4Cl-BPA>BPC>BPA>BPE>BPAP.The results shows that the estrogenic e ff ect mechanism is due to the binding of that target compounds and ER.
bisphenol A(BPA)analogues;estrogenic e ff ect;MCF-7 cells;cell toxicity
X 3
A
1007-2861(2015)04-0515-10
10.3969/j.issn.1007-2861.2014.04.021
2013-12-18
高校青年骨干教师国内访问学者计划资助项目(60C11113001);长江学者和创新团队发展计划资助项目(IRT13078)
雷炳莉(1979—),女,副研究员,博士,研究方向为环境毒理学与环境风险评价.
E-mail:leibingli@126.com
