日本血吸虫SjOST48基因的克隆、表达及其重组蛋白免疫保护效果分析
2015-07-19刘艳涛洪炀张旻韩倩曹晓丹李莎陆珂李浩傅志强林矫矫
刘艳涛,洪炀,张旻,2,韩倩,曹晓丹,李莎,陆珂,李浩,傅志强,林矫矫,3
日本血吸虫基因的克隆、表达及其重组蛋白免疫保护效果分析
刘艳涛1,洪炀1,张旻1,2,韩倩1,曹晓丹1,李莎1,陆珂1,李浩1,傅志强1,林矫矫1,3
1 中国农业科学院上海兽医研究所农业部动物寄生虫学重点开放实验室,上海 200241 2 河南科技大学动物科技学院, 河南洛阳 471023 3 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009

刘艳涛, 洪炀, 张旻, 等. 日本血吸虫SjOST48基因的克隆、表达及其重组蛋白免疫保护效果分析. 生物工程学报, 2015, 31(4): 501–511.Liu YT, Hong Y, Zhang M, et al. Cloning, expression of gene SjOST48 from Schistosoma japonicum and evaluation of the immunoprotective efficacy of rSjOST48 in mice. Chin J Biotech, 2015, 31(4): 501–511.
为了鉴定日本血吸虫43基因并评估其重组蛋白作为新的血吸虫病候选疫苗抗原的潜力,利用PCR技术扩增日本血吸虫基因,应用荧光实时定量PCR分析该基因在日本血吸虫不同发育阶段虫体的转录水平,以pET-28a(+) 为载体构建重组表达质粒并诱导其在大肠杆菌中表达。将纯化的重组蛋白免疫BALB/c小鼠制备免疫血清,利用Western blotting检测重组蛋白的免疫原性,应用间接免疫荧光技术对进行蛋白组织定位,利用间接ELISA方法检测小鼠血清中特异性抗体水平。将重组抗原免疫小鼠,评估其免疫保护效果。PCR扩增得到1 248 bp不含信号肽的cDNA序列,同源性分析结果显示,该基因为日本血吸虫寡糖转移酶OST48亚基,命名为。实时定量PCR分析显示在检测的童虫和成虫各个期别虫体中均有转录,其中在28 d虫体中的转录水平最高,在42 d雌虫中的转录量显著高于雄虫。构建的重组表达质粒pET-28a(+)-SjOST48成功在大肠杆菌中表达,重组蛋白rSjOST48分子量约50 kDa。Western blotting分析表明rSjOST48能被小鼠免疫血清识别,具有良好的免疫原性,间接免疫荧光实验表明SjOST48蛋白主要分布于虫体体被,少量分布于实质。ELISA检测结果表明rSjOST48能诱导产生较高的特异性IgG、IgG1和IgG2a抗体。动物免疫保护实验结果表明SjOST48能诱导小鼠产生32.62% (<0.05) 的减虫率及57.61% (<0.01) 的肝脏减卵率。本研究为深入探讨日本血吸虫基因的生物学功能及筛选新的血吸虫疫苗候选分子奠定了基础。
日本血吸虫,基因,表膜蛋白,免疫保护效果
血吸虫病(Schistosomiasis) 是一种分布广泛、危害严重的人畜共患寄生虫病,在全球76个国家和地区流行,受感染人数高达2亿。截至2012年底,我国仍有45个血吸虫病流行县 (市、区),血吸虫病人总数多达240 597例[1]。目前血吸虫病防治仍以吡喹酮化疗为主,但化疗可能诱导抗药性产生,具有潜在产生耐药性的危险,且药物治疗无法控制重复感染,因此血吸虫病新型疫苗及新药相关研究已成为目前血吸虫病防治研究的重大需求。
血吸虫的体被表膜暴露于虫体表面,是血吸虫和宿主物质交换的场所也是宿主免疫效应分子与虫体直接接触的界面,被认为与血吸虫营养摄取、免疫逃避、免疫调节、排泄、渗透压调节和信号转导等密切相关[2],而分布于体被上的表膜蛋白是研发疫苗和药物的理想靶标。目前研究发现Sj23、Sm-TSP-2和Sj29等表膜蛋白可作为抗血吸虫病疫苗候选分子[3-4],但其产生的免疫保护效果仍需提高,筛选诱导更高免疫保护效果的疫苗候选分子是血吸虫病预防取得突破的基础。
2006年Liu等[5]在通过蛋白组学分析日本血吸虫与宿主互作研究和本实验室Zhang等[6]在对日本血吸虫体被蛋白进行蛋白组学分析时都鉴定到了SJCHGC01743蛋白。同源性分析结果显示该蛋白与哺乳动物的寡糖转移酶中的一个亚基DDOST/OST48高度同源,命名为SjOST48。DDOST/OST48是寡糖转移酶 (OST) 复合体中的一个亚基[7],属于寡糖转移酶48 kDa亚家族,它能够跨过内质网膜催化高甘露糖型寡糖 (Dolichol-P-GlcNac2Man9Glc3) 从多萜醇联糖载运脂体转运到新生肽链的糖基化识别位点 (Asn-X-Ser/Thr) 的天冬酰胺受体部位上[8],参与新生蛋白质N-连接糖基化修饰过程。N-连接糖基化普遍发生在细胞外环境的蛋白质中,包括膜蛋白、分泌蛋白和体液中蛋白质,而这些蛋白恰巧都是容易获得并适合用作诊断和治疗的分子,因此,许多临床的生物标志物及治疗的靶标常是糖蛋白[9]。本实验室经鉴定得到SjOST48,推测其参与了蛋白质N-糖基化修饰作用,可能在血吸虫发育、繁殖与蛋白运输中发挥着重要作用[6]。本研究对SjOST48编码基因进行克隆、表达,评估重组蛋白rSjOST48在小鼠中诱导的免疫保护效果,为深入研究该基因的生物学功能奠定了基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂和酶
Trizol、逆转录酶、RNA酶抑制剂购自Invitrogen公司;ExDNA聚合酶、T4 DNA连接酶、pMD19-T载体、限制性内切酶Ⅰ、Ⅰ购自大连宝生物工程有限公司;琼脂糖凝胶DNA回收试剂盒、B型质粒小量快速提取试剂盒购自北京博大泰克生物基因技术有限责任公司;Ni-NTA HisBind Resin (Merck-Novagen) 购自中科新生命生物科技有限公司;硝酸纤维素膜 (Whatman) 购自经科宏达生物技术有限公司;辣根过氧化物酶 (HRP) 标记的山羊抗小鼠IgG (H+L) 购自北京碧云天生物技术研究所;HRP标记的山羊抗小鼠IgG1、IgG2a购自AbD Serotech公司;DAB显色试剂盒、可溶性单组分TMB购自天根生物科技有限公司。
1.1.2 菌种、质粒、实验动物和寄生虫
大肠杆菌DH5α、BL21,表达质粒pET-28a(+),日本血吸虫42 d成虫cDNA均由中国农业科学院上海兽医研究所动物血吸虫病研究室保存;中国大陆株安徽品系的血吸虫阳性钉螺由中国农业科学院上海兽医研究所钉螺室提供;雄性新西兰白兔,体重2.5−3.0 kg,购自上海罗泾飞达实验动物养殖场;6周龄雄性BALA/c小鼠购自上海斯莱克实验动物有限责任公司。
1.2 方法
1.2.1 虫体的收集
新西兰白兔分别以腹部贴片法感染20 000、15 000、10 000、8 000、5 000、2 000条血吸虫尾蚴,在感染后7、14、21、28、35和42 d后剖杀,以肝门静脉灌注法收集虫体,液氮冻存备用。
1.2.2 总RNA的提取
取液氮中冻存的7、14、21、28、35和42 d日本血吸虫各200 mg,按Trizol试剂盒说明书分别进行总RNA的提取。
1.2.3 引物设计和含ORF cDNA片段的扩增
参照NCBI收录的日本血吸虫(gb|AY813753.1|) 核苷酸序列,利用Primer Premier 5.0软件分析并设计引物,分别在上、下游引物的5′端引入Ⅰ和Ⅰ限制性内切酶位点。引物序列见表1,引物由上海华津生物技术有限公司合成。取1 μL 42 d成虫cDNA模板进行PCR扩增,PCR反应条件为:94 ℃预变性5 min;然后94 ℃ 30 s,50 ℃ 30 s,72 ℃ 1.5 min,共30个循环;循环结束后72 ℃延伸10 min,4 ℃保存。
1.2.4 荧光实时定量PCR检测在不同时期虫体内的转录水平
分别提取日本血吸虫7、14、21、35、42 d及雌雄虫体的总RNA,去除基因组DNA后按Prime ScriptTMRT reagent kit试剂盒操作说明反转录获得日本血吸虫各时期的cDNA。以日本血吸虫基因为内参,以不同期别的日本血吸虫cDNA为模板,采用SYBR Premix ExTM进行荧光实时定量PCR。和Sj的实时定量PCR引物序列见表1,预期扩增基因片段长度分别为162 bp和213 bp。引物均由上海英骏生物技术有限公司合成,引物使用浓度为10 pmol/μL。
1.2.5 重组质粒pET-28a(+)-SjOST48的构建
以日本血吸虫42 d成虫cDNA作为模板,利用ExDNA聚合酶进行PCR扩增编码SjOST48的cDNA序列。PCR产物经A型DNA快速纯化试剂盒纯化后,亚克隆到pMD19-T载体中并转化入大肠杆菌DH5α。将转化后的大肠杆菌接种于含有100 μg/mL氨苄青霉素的LB固体培养基上,取阳性单克隆测序。将测序正确的重组质粒pMD19-T-SjOST48和表达载体pET-28a(+)进行双酶切后,用T4 DNA连接酶构建重组表达质粒pET-28a(+)-SjOST48。
1.2.6 重组质粒在大肠杆菌中的表达与表达产物的纯化
将构建的重组表达质粒pET-28a(+)-SjOST48转化入大肠杆菌BL21 (DE3)感受态细胞中,经PCR扩增、序列测定及酶切鉴定正确后,接种到含有100 μg/mL氨苄青霉素的LB液体培养基中,37 ℃振荡培养至大肠杆菌对数生长期,加入 1 mmol/L异丙基-β-D-硫代吡喃半乳糖苷(IPTG) 进行诱导表达。用8 mol/L尿素溶解重组蛋白,利用Ni-NTA HisBind Resin层析柱(Merk公司)在变性条件下分离纯化重组蛋白,经含不同梯度浓度尿素 (5、4、3、2、1、0 mol/L)的PBS逐步透析复性。

表1 PCR和qPCR引物
1.2.7 动物免疫与免疫血清制备
选择6−8周龄 (SPF级) BALB/c小鼠30只,随机分成3组,每组10只,分别为免疫组、佐剂对照组和空白对照组。免疫组每次每只注射100 μL含206佐剂和20 μg纯化的SjOST48重组蛋白的乳化液;佐剂对照组每次每只注射100 μL 206佐剂和PBS的乳化液;空白对照组每次每只注射100 μL的PBS。免疫间隔时间为2周,共免疫3次。第3次免疫后2周,每只小鼠经腹部皮肤贴片攻击感染40±1条日本血吸虫尾蚴。分别在免疫前和每次免疫后第8天对每组小鼠进行眼静脉采血,制备免疫血清。
1.2.8 重组蛋白的免疫原性分析
将10 μg重组蛋白rSjOST48进行SDS-PAGE后低温电转移至硝酸纤维素膜上 (130 mA,1 h),分别以重组蛋白免疫的BALB/c小鼠血清、免疫前健康BALB/c小鼠血清室温孵育2 h,PBST 洗涤3次,羊抗鼠IgG-HRP室温孵育1 h,PBST洗涤3次,用二氨基联苯胺 (DAB) 进行底物显色。
1.2.9 SjOST48蛋白的虫体组织定位分析
将日本血吸虫35 d虫体−20 ℃包埋固定,制成8 μm的冰冻切片备用。用丙酮将虫体组织固定30 min,PBST洗涤3次,以重组蛋白免疫的小鼠血清室温孵育2 h;洗涤3次,以免疫前小鼠血清作为阴性对照。Cy3标记的羊抗鼠IgG (H+L) 室温孵育1 h,洗涤后用DAPI (10 μg/mL) 溶液室温避光复染8 min,置荧光显微镜下观察蛋白的分布情况。
1.2.10 ELISA 检测免疫小鼠血清抗SjOST48特异性IgG、IgG1和IgG2a抗体水平
以纯化的重组蛋白rSjOST48为抗原,以1.2.7中制备的免疫血清为一抗,利用间接ELISA方法检测3组小鼠免疫前后血清中抗SjOST48特异性IgG、IgG1和IgG2a抗体效价变化。以包被缓冲液稀释抗原浓度至10 μg/mL,包被96孔ELISA板,每孔100 μL,4 ℃过夜,用PBST洗涤3次后,每孔加入150 μL PBST-1.5%牛血清白蛋白(BSA) 进行封闭,37 ℃孵育2 h。PBST洗涤3次,被检血清按1∶100稀释后每孔加入100 μL,37 ℃孵育1 h;PBST洗涤3次,羊抗小鼠IgG-HRP (北京碧云天生物技术研究所) 1∶1 000稀释,羊抗小鼠IgG1-HRP和IgG2a-HRP (AbD Serotec,UK) 按1∶4 000稀释后作二抗 (100 μL/孔),37 ℃孵育1 h;PBST洗涤3次,然后加入可溶性TMB底物100 μL,) 避光显色5 min,加入2 mol/L H2SO4(50 μL/孔) 终止反应,用BioTek公司的酶标仪测定450 nm处的吸光值。
1.2.11 小鼠减虫率和减卵率计算
末次免疫2周后,每只小鼠用腹部贴片法感染尾蚴40±1条。攻击尾蚴6周后解剖小鼠,肝门静脉冲洗法收集成虫并记数,同时收集每只小鼠的肝脏。称取肝组织0.5 g,剪碎后加 10 mL 5% NaOH,组织匀浆器匀浆,置56 ℃水浴消化15 min,混匀,吸取50 μL的悬液3份,镜检计数肝组织虫卵。按以下公式计算减虫率、肝脏减卵率 (EPG为平均每克肝组织中所负荷虫卵数)。
减虫率=(1−免疫组平均虫荷数/对照组平均虫荷数)×100%;
肝脏减卵率=(1−免疫组EPG/对照组EPG)×100%。
1.2.12 统计学分析
采用SPASS软件对数据进行统计学分析(Duncan法)。对有3个数值以上的样本数据进行方差分析,求标准差;对两组以上数据进行检验,分析各组数据之间的差异是否显著。
2 结果
2.1基因的克隆及生物信息学分析
参照NCBI收录的日本血吸虫(gb|AY813753.1|) 核苷酸序列设计特异引物,以日本血吸虫42 d成虫cDNA为模板PCR扩增其ORF,得到大小为1 248 bp的特异片段 (图1),与预期目的片段大小相符,与参考序列相比存在5个核苷酸和3个氨基酸的差异。
生物信息学分析结果表明,的ORF含1 299个核苷酸,由433个氨基酸组成,相对分子量为48 696.6,理论等电点为5.14。该氨基酸序列的N端有一个跨膜区和一个信号肽,存在一个糖基化位点Asn51。利用NCBI的Blast 软件对该基因编码的氨基酸序列进行同源性搜索,结果显示该基因编码蛋白与日本血吸虫DDOST/OST48蛋白具有高度同源性,氨基酸序列相似性高达98%。推测该蛋白为日本血吸虫OST48蛋白,命名为SjOST48。

图1 PCR扩增产物
2.2在不同时期虫体内的转录水平分析
Real time PCR分析结果表明,在日本血吸虫的7、14、21、28、35和42 d虫体中均有转录,其中28 d虫体转录量最高,其次是7 d、21 d、35 d,14 d虫体转录量最低。28 d和42 d虫体转录量与14 d虫体转录量相比,差异极显著 (<0.01);42 d雌虫的转录量显著高于42 d雄虫,差异极显著 (<0.01) (图2)。
2.3基因在大肠杆菌中的表达及重组蛋白纯化
SDS-PAGE结果显示,重组质粒pET-28a(+)- SjOST48在大肠杆菌BL21 (DE3)中成功表达,得到一重组蛋白rSjOST48,重组蛋白分子质量约为50 kDa,与预期大小相符 (图3)。在IPTG诱导后1−4 h表达量随时间增长而增加,诱导 4 h后表达量达到最高并趋于稳定。重组蛋白以包涵体形式存在,可溶解于8 mol/L尿素溶液中。经过Ni-NTA His Bind Resin树脂纯化后,获得了较纯的重组蛋白,经尿素梯度PBS逐步透析进行蛋白复性。
2.4 重组蛋白的抗原性分析
将重组蛋白进行SDS-PAGE,经电转移至硝酸纤维素膜上,分别用重组蛋白免疫的BALB/c小鼠血清、健康BALB/c小鼠血清作为一抗进行Western blotting分析,结果显示用重组蛋白免疫的BALB/c小鼠血清作为一抗时,50 kDa处有一明显的识别条带,而阴性对照组在50 kDa处未有条带出现,表明重组蛋白具有良好的抗原性 (图4)。

图2 实时定量PCR分析SjOST48在不同期别(A) 及不同性别(B)虫体中的转录水平差异

图3 重组蛋白rSjOST48的表达分析
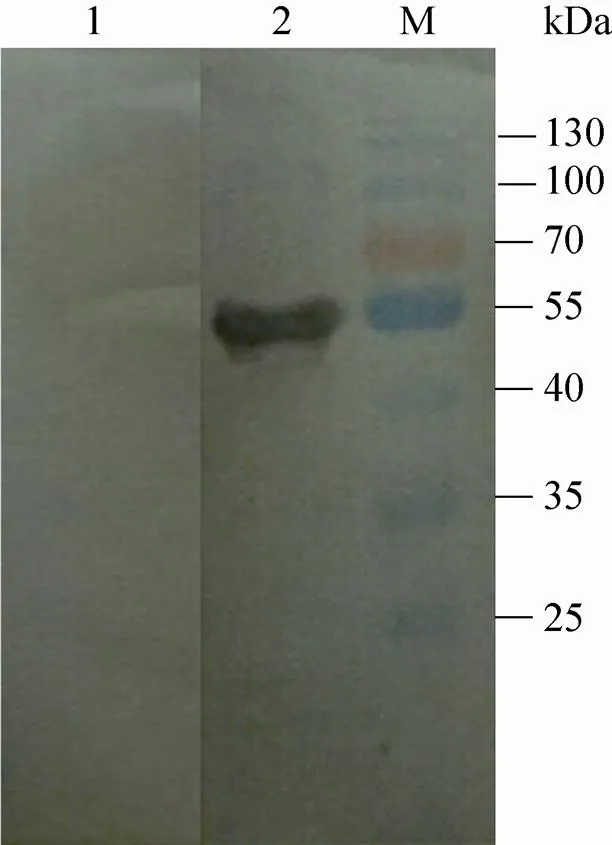
图4 重组蛋白rSjOST48的免疫原性分析
2.5 rSjOST48蛋白在日本血吸虫体内的组织定位
在荧光显微镜下可以观察到Cy3标记的山羊抗小鼠IgG二抗发出的红色荧光以及DAPI复染核酸后发出的蓝色荧光,实验结果表明,以免疫前小鼠血清孵育后,未见红色荧光 (图5A),以重组抗原免疫小鼠血清孵育后,在日本血吸虫体被上出现红色荧光,实质部分也有少量红色荧光分布 (图5B),表明SjOST48蛋白主要分布于体被,少量分布于实质。
2.6 小鼠血清抗rSjOST48蛋白特异性抗体的检测
用间接ELISA法检测3组小鼠免疫前后血清抗rSjOST48特异性抗体IgG、IgG1和IgG2a效价变化,结果显示重组蛋白第一次免疫小鼠后并没有引起小鼠体内特异性IgG抗体水平显著升高,二免、三免后特异性抗体水平较206佐剂组极显著升高 (<0.01),在攻击血吸虫尾蚴6周后其抗体水平达到最大值,与206佐剂组相比差异极显著 (<0.01);而佐剂对照组和空白对照组在整个实验过程中抗rSjOST48的特异性IgG抗体滴度均未出现明显变化 (图6)。同时,对抗rSjOST48蛋白特异性IgG1和IgG2a抗体滴度的测定结果表明,随着3次免疫的进行,206佐剂对照组IgG1和IgG2a抗体滴度没有明显变化,但rSjOST48蛋白免疫组IgG1抗体滴度二免后略有升高,而IgG2a特异性抗体在一免、二免后都没有明显变化,三免后IgG1、IgG2a抗体滴度均显著升高,与206佐剂组相比差异极显著 (<0.01),且随着免疫次数的增加,IgG1/IgG2a比值逐渐增高,二免以后IgG1抗体滴度一直高于IgG2a (表2)。

图5 SjOST48蛋白在35 d日本血吸虫虫体内的定位分析(10×40)

图6 小鼠血清抗rSjOST48特异性IgG抗体水平变化
2.7 动物免疫保护效果
动物免疫实验结果表明,重组蛋白rSjOST48诱导产生了部分的免疫保护效果(表3)。和PBS组比较,重组融合蛋白rSjOST48分别诱导小鼠产生了32.62% (<0.05) 的减虫率以及57.61% (<0.01) 的肝脏减卵率,而佐剂对照组获得的减虫率和减卵率分别为11.63%和1.51%,差异均不显著。
3 讨论
体被具有许多重要的生物功能,被认为是诊断、疫苗和药物的潜在靶点,而其上的表膜蛋白是执行这些功能的分子基础。所以,通过对血吸虫体被表膜蛋白的研究有可能发现新的疫苗和药物靶标,这可为血吸虫病防治提供新思路。实验证明,多种膜蛋白能够诱导宿主产生抗血吸虫感染的保护性免疫反应。例如,属于四跨膜蛋白家族的SmTSP-2能够诱导57%的减虫率和64%的肝脏减卵率[10]。定位于血吸虫体被中的Sm29能够诱导51%的减虫率、60%的肠减卵率和50%的肝脏减卵率[11]。所以,鉴定并比较日本血吸虫不同发育阶段的体被表膜蛋白有助于进一步了解其免疫逃避机理以及发现新的疫苗候选分子和药物靶标[12]。

表2 小鼠血清抗rSjOST48特异性抗体亚型IgG1及IgG2a分析
Data are expressed as. ** (<0.01) indicates statistically significant difference compared to the group of mice immunized with ISA 206.

表3 重组蛋白rSjOST48诱导小鼠产生的免疫保护效果
本研究对日本吸血虫体被表膜蛋白SJCHGC01743进行了克隆、表达、纯化以及生物信息学分析,结果表明SJCHGC01743和日本血吸虫寡糖转移酶OST48亚基的同源性最高,达到98%,命名为SjOST48。实时定量PCR结果显示基因在检测的童虫和成虫各个期别虫体中均有转录,42 d雌虫的转入量显著高于雄虫,约为雄虫的4.7倍,表明是一个雌虫偏向基因,这与之前Fitzpatrick等[13]和Moertel等[14]的推测相吻合,是寡糖转移酶复合体中起辅助催化作用的亚基[15],提示雌雄虫的蛋白质糖基化作用可能存在差异。间接免疫荧光定位实验结果表明,SjOST48蛋白主要分布在日本血吸虫体被上,进一步验证了Zhang等[6]等在日本血吸虫体被蛋白组学研究中有关此蛋白的质谱鉴定结果。Western blotting结果显示重组抗原rSjOST48可被重组蛋白免疫血清识别,表明rSjOST48具有较好的抗原性。以rSjOST48重组抗原进行小鼠免疫保护实验,结果显示免疫小鼠成虫荷虫量减少了32.62%,肝脏虫卵数减少了57.61%,与空白对照组相比差异极显著,表明SjOST48重组抗原在小鼠体内诱导产生了部分免疫保护效果,具有作为日本血吸虫疫苗候选分子的潜能。寡糖转移酶是一个多亚基复合体,OST48作为其中的一个亚基,只用这一亚基的重组蛋白作为疫苗分子获得的免疫保护效果可能有限,如果同时对OST复合体中其他亚基作为疫苗候选分子的潜力进行探讨,研制多价疫苗或多表位重组抗原疫苗,有可能进一步提高候选疫苗的免疫保护效果。免疫应答分析表明,rSjOST48能诱导小鼠产生较高的特异性IgG抗体水平,且随着免疫次数增加,特异性抗体水平显著升高,而空白对照组和佐剂对照组特异性IgG抗体水平一直维持在较低水平,推测重组蛋白在小鼠体内诱导的免疫保护效果可能和其诱导的较高的特异性抗体水平有关。同时,对抗rSjOST48蛋白的特异性IgG1和IgG2a抗体进行测定,结果显示免疫组小鼠特异性IgG1和IgG2a抗体滴度呈上升趋势,二免以后IgG1抗体滴度一直高于IgG2a,且IgG1/IgG2a比值逐渐增高。以往研究表明IgG2a主要激活Th1型辅助细胞,而IgG1主要促进Th0前体细胞向Th2细胞转化[16],在血吸虫感染小鼠模型中,Th1型免疫应答诱导抗感染免疫保护力,而Th2型免疫应答则主要与免疫病理损害有关[17],因此,推测rSjOST48可能诱发小鼠以Th2型为主、抗日本血吸虫感染的Th1/Th2混合型免疫应答。综上所述,基因值得作为潜在的日本血吸虫疫苗候选分子深入研究。本文为深入开展SjOST48的生物学功能研究及抗血吸虫疫苗候选分子筛选提供了基础。
REFERENCES
[1] Li SZ, Zheng H, Gao J, et al. Endemic status of schistosomiasis in People’s Republic of China in 2012. Chin J Schistoso Cont, 2013, 25(6): 557−563 (in Chinese).李石柱, 郑浩, 高婧, 等. 2012年全国血吸虫病疫情通报.中国血吸虫病防治杂志, 2013, 25(6): 557−563.
[2] Jones MK, Gobert GN, Zhang LH, et al. The cytoskeleton and motor proteins of human schistosomes and their roles in surface maintenance and host-parasite interactions. Bioessays, 2004, 26(7): 752−765.
[3] Tran MH, Pearson MS, Bethony JM, et al. Tetraspanins on the surface ofare protective antigens against schistosomiasis. Nature Med, 2006, 12(7): 835−840.
[4] Cardoso FC, Macedo GC, Gava E, et al.tegument protein Sm 29 is able to induce a Th1-type of immune response and protection against parasite infection. PLoS Negl Trop Dis, 2008, 2(10): 1−10.
[5] Liu F, Lu J, Hu W, et al. New perspectives on host-parasite interplay by comparative transcriptomic and proteomic analyses of. PLoS Pathogens, 2006, 2(4): 268–281.
[6] Zhang M, Hong Y, Han Y, et al. Proteomic analysis of tegument-exposed proteins of female and maleworms. J Proteome Res, 2013, 12(11): 5260–5270.
[7] Kelleher DJ, Karaoglu D, Mandon EC,et al. Oligosaccharyltransferase isoforms that contain different catalytic STT3 subunits have distinct enzymatic properties. Molecular Cell, 2003, 12(1): 101–111.
[8] Kelleher DJ, Gilmore R. An evolving view of the eukaryotic oligosaccharyltransferase. Glycobiology, 2006, 16(4): 47R–62R.
[9] Wang JH, Tong Y, Zhu Y, et al. The research progress in protein glycosylation. Pharm Biotechnol, 2011, 18(1): 77−80 (in Chinese).王家红, 童玥, 朱玥, 等. 蛋白质糖基化的研究进展. 药物生物技术, 2011, 18(1): 77−80.
[10] Tran MH, Pearson MS, Bethony JM, et al. Tetraspanins on the surface ofare protective antigens against schistosomiasis. Nature Med, 2006, 12: 835–840.
[11] Cardoso FC, Macedo GC, Gava E, et al.tegument protein Sm29 is able to induce a Th1-type of immune response and protection against parasite infection. PLoS Negl Trop Dis, 2008, 2(10): e308.
[12] Qian MB. The structure and function of schistosome tegument and related proteomic study. Chin J Parasitol Parasit Dis, 2008, 26(6): 466−471 (in Chinese). 钱门宝. 血吸虫体被的结构功能及其蛋白质组研究. 中国寄生虫学与寄生虫病杂志, 2008, 26(6): 466−471.
[13] Fitzpatrick JM, Johnston DA, Williams GW, et al. An oligonucleotide microarray for transcriptome analysis ofand its application/use to investigate gender-associated gene expression. Mol Biochem Parasitol, 2005, 141(1): 1–13.
[14] Moertel L, McManus DP, Piva TJ, et al. Oligonucleotide microarray analysis of strain-and gender-associated gene expression in the human blood fluke,. Mol Cell Probes, 2006, 20(5): 280–289.
[15] Roboti P, High S. The oligosaccharyltransferase subunits OST48, DAD1 and KCP2 function as ubiquitous and selective modulators of mammalian N-glycosylation. J Cell Sci, 2012, 125(14): 3474−3484.
[16] Finkelman FD, Holmes J, Katona IM, et al. Lymphokine control ofimmunoglobulin isotype selection. Annu Rev Immunol, 1990, 8(1): 303−333.
[17] Sher A, Coffman RL, Hieny S, et al. Interleukin 5 is required for the blood and tissue eosinophilia but not granuloma formation induced by infection with. Proc Natl Acad Sci USA, 1990, 87(1): 61−65.
(本文责编郝丽芳)
Cloning, expression of genefromand evaluation of the immunoprotective efficacy of rSjOST48 in mice
Yantao Liu1, Yang Hong1, Min Zhang1,2, Qian Han1, Xiaodan Cao1, Sha Li1, Ke Lu1, Hao Li1, Zhiqiang Fu1, and Jiaojiao Lin1,3
1,,,,200241,2,,471023,,Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and ZoonosesYangzhouJiangsuChina
To identifygene ofand evaluate the potential of the recombinant protein as a new vaccine candidate for schistosomiasis, polymerase chain reaction (PCR) technique was used toamplify the cDNA of the gene and real-time RT-PCR was used to analyze the transcription profiles ofat different development stages. Recombinant plasmid was successfully constructed and transformed into competentBL21 (DE3). Then the recombinant protein was expressed, purified and emulsified with ISA206 adjuvant to immunize BALB/c mice for three times. Theimmunogenicity was confirmed by Western blotting and tissue localization was detected by indirect immunofluorescent assay. The specific antibody level was detected by ELISA. The immunoprotection of rSjOST48 was evaluated by the reduction in worm and egg countsin mice. A cDNA with 1 248 nucleotides was isolated from 28-day-old schistosomes cDNAs by PCR. Sequence analysis revealed thatwas a 48-kDa subunit of the oligosaccharyltransferase complex () and named as. Real-time PCR analysis indicated that this gene was expressed in all investigated stages and had the highest expression level in 28 d worms, the level of gene transcription in female worms was significantly higher than that of male worms. Then recombinant plasmid pET28a(+)-SjOST48 was successfully constructed and expressed inBL21 (DE3). Western blotting analysis showed that rSjOST48 had good immunogenicity. Indirect immunofluorescent analysis revealed that SjOST48 was mainly distributed on the tegument of the worms. The result of ELISA indicated that the rSjOST48 vaccinated group could induce a significant increase in the level of specific IgG, IgG1 and IgG2a. An immunoprotection experiment showed that the vaccination of rSjOST48 in mice induced 32.62% (<0.05) reduction in the numbers of worms and 57.61% (<0.01) in eggs in liver, compared with that of the control group. This study provides the foundation for proceeding further research on the biologicalfunction of SjOST48 and screening new vaccine candidates for schistosomiasis.
,gene, tegument protein, immunoprotective effect
August 20, 2014; Accepted:October 29, 2014
Jiaojiao Lin. Tel: +86-21-34293440; E-mail: jjlin@shvri.ac.cn
Supported by:National Natural Science Foundation of China (Nos. 31172315, 81271871).
国家自然科学基金(Nos. 31172315, 81271871)资助。
网络出版时间:2014-11-17
http://www.cnki.net/kcms/doi/10.13345/j.cjb.140420.html
