姜黄素改善大鼠创伤性脑损伤炎性反应及预后
2015-07-19阳又莲
阳又莲,张 新,罗 扬,刘 宿
(1.第三军医大学学员旅,重庆400038;2.武警重庆市总队医院,重庆400061;3.解放军324医院,重庆400020;4.第三军医大学大坪医院野战外科研究所麻醉科,重庆400042)
姜黄素改善大鼠创伤性脑损伤炎性反应及预后
阳又莲1,张 新2,罗 扬3,刘 宿4
(1.第三军医大学学员旅,重庆400038;2.武警重庆市总队医院,重庆400061;3.解放军324医院,重庆400020;4.第三军医大学大坪医院野战外科研究所麻醉科,重庆400042)
目的探究姜黄素对创伤性脑损伤(TBI)的治疗作用及机制。方法将12只SD大鼠随机分为姜黄素组(6只)和DMSO组(6只),为每只大鼠建立TBI模型,治疗组给予姜黄素治疗3 d,对照组腹腔注射等量DMSO。每天测量体质量和神经功能评分至实验结束。在第5天(高峰期)取大鼠脑组织,用免疫组织化学法染色观察巨噬细胞/小胶质细胞炎症浸润,用实时定量聚合酶链反应(RT-PCR)方法检测炎症因子肿瘤坏死因子-α(TNF-α)、白介素(IL)-1β的相对表达。第25天(恢复期)取大鼠脑组织,用RT-PCR方法检测IL-10、转化生长因子β(TGF-β)的相对表达。结果神经功能评分显示姜黄素治疗后大鼠TBI严重度显著降低,姜黄素能抑制TBI高峰期巨噬细胞在大鼠脑组织中的炎症浸润与小胶质细胞的激活,抑制TBI高峰期脑组织TNF-α、IL-1β表达,促进TBI恢复期IL-10及TGF-β的表达。结论姜黄素对TBI有治疗作用,这种治疗作用可能与姜黄素抑制TBI后炎性反应、促进组织恢复有关。
姜黄素; 脑损伤; 炎症; 巨噬细胞; 小神经胶质细胞; 免疫组织化学
创伤性脑损伤(TBI)发病率逐年增高,据统计,在美国每年约有200万人遭受TBI[1],而中国庞大的人口基数和日益发展的社会建设增加了脑损伤的危险因素;脑损伤不仅对成年人危害极大,婴幼儿脑损伤带来的危害也不容小觑,在我国,脑损伤已被列入新生儿时期危害最严重的疾病之一[2]。因此,研究TBI潜在的发病机制及干预措施是大势所趋。基于目前的研究,脑损伤大致可分为2个部分:(1)创伤部位直接的物理损伤,这种损伤是不可逆的;(2)以大脑缺血缺氧、过度炎性反应等为代表的二次损伤,这种损伤发生率为44.5%[3],主要体现在患者的体温改变、血压及颅内压的波动甚至脑组织坏死等,可加重原发损伤,也可造成脑水肿,严重者可致瘫痪、死亡[4],因此,二次损伤为患者带来的远期危害远甚于原发损伤。
二次损伤有许多细胞成分与炎症介质的共同参与,其中血液来源的巨噬细胞和脑组织的小胶质细胞扮演着主要角色,它们贯穿于TBI的整个病程,能吞噬病原体以阻止伤口感染、分泌大量炎症因子参与炎性反应,还能参与到炎症消退和组织修复中[5]。因此,以巨噬细胞/小胶质细胞作为靶点研究TBI的干预措施是一个理想的途径。
姜黄素作为一种食品添加剂广泛应用于人们的日常生活。目前,越来越多的研究表明,姜黄素不仅具有食品着色功能,还具备抗氧化、抗炎、抗凝、降脂等多种功能[6-7]。本实验拟探究其对TBI的治疗作用及其潜在的治疗靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物 随机选取12只清洁级雄性SD大鼠,周龄7~9周,体质量160~200 g,全部购于第三军医大学大坪医院实验动物中心,正常饲养于清洁动物房。将大鼠随机分为姜黄素组(6只)和DMSO组(6只)。
1.1.2 主要仪器 离心机Centrifuge 5804R(Effendorf,Germany)、Nanodrop紫外分光光度计、PCR仪PTC-100(MJ Research,USA)、实时定量聚合酶链反应(RT-PCR)仪(MJ Research,USA)、颅骨转、自由落体打击器等。
1.1.3 主要试剂 姜黄素、DMSO(Sigma),4%多聚甲醛溶液(武汉博士德),抗CD68单克隆抗体(Serotec,UK),改进型枸橼酸钠抗原修复液、免疫染色封闭液、免疫染色一抗稀释液、免疫染色二抗稀释液(碧云天生物),Trizol裂解液(罗氏公司),Quant cDNA第一链合成试剂盒、RealMaster(SYBGGreen)RT-PCR试剂盒(北京天根生物)等。
1.2 方法
1.2.1 大鼠TBI模型的建立 10%水合氯醛按3.5 mL/kg腹腔注射麻醉大鼠,固定大鼠于操作台上,备皮,用剪刀剪开头皮并充分暴露前囟、冠状缝和矢状缝及顶骨,之后用颅骨转以前囟后3.0 mm、向右旁开矢状缝2.5 mm为中心做一直径约为5.0 mm颅骨钻孔,全过程不损伤硬脑膜。之后,将自由落体装置底座轻置于颅骨钻孔表面,以20 g重物自14 cm高处沿套管下落打击致伤,致伤直径5 mm,最大下陷距离3 mm,最后将大鼠置于37℃恒温室至苏醒。
1.2.2 治疗 造模当天为第1天,1 h后对姜黄素组每只大鼠腹腔注射100 mg/kg姜黄素后每12小时注射1次,共注射6次,DMSO组采用相同方法注射相等量DMSO。每天称体质量并进行运动神经功能评分,评分按Sinson等[8]采用的方法实施,即在造模后第0、5、25天分别对各组大鼠进行计分。
1.2.3 评分标准 提起鼠尾后大鼠左侧和右侧前肢屈曲状况;提起鼠尾后大鼠前肢仍留在平面上,左侧和右侧后肢屈曲状况;对抗左侧和右侧推力状况(以上各项评分各为5档,0为严重损伤,4为正常);在斜板上左、右、垂直方向的站立能力(50.0°为4分,42.5°为3分,40.0°为2分,37.5°为1分),各项相加即为总评分(总分共36分)。
1.2.4 TBI大鼠脑组织炎症因子表达 损伤前5 d为TBI炎症高峰期,第5天用乙醚处死大鼠后迅速解剖脑组织并投入液氮保存。使用Trizol裂鲜液在冰上研磨样本并提取总RNA,用Nanodrop紫外分光光度计测定RNA浓度,之后取1 μg总RNA使用Quant cDNA第一链合成试剂盒按说明书逆转录为 cDNA。按说明书使用RealMaster(SYBG Green)RT-PCR试剂盒对两组cDNA样本进行RT-PCR检测。引物如下:β-actin上游引物5′-CCGTCT TCC CCT CCATCGT-3′,下游引物5′-ATC GTC CCA GTT GGT TAC AAT GC-3′;TNF-α上游引物5′-TGA TCG GTC CCA ACA AGG A-3′,下游引物5′-TGC TTG GTG GTT TGC TAC GA-3′;IL-1β上游引物5′-TGC TGA TGT ACC AGT TGG GG-3′,下游引物5′-CTC CAT GAG CTT TGT ACA AG-3′;IL-10上游引物5′-CCT GCT CTT ACT GGC TGG AG-3′,下游引物5′-TCT CCC AGG GAA TTC AAA TG-3′;TGF-β上游引物5′-TGA ACC AAG GAG ACG GAA TAC AGG-3′,下游引物5′-TAC TGT GTG TCC AGG CTC CAA ATG-3′。
1.2.5 TBI大鼠脑组织免疫组织化学(免疫组化)染色 第5天用水合氯醛深度麻醉大鼠后于左心室内灌注预冷多聚甲醛溶液。迅速解剖大鼠大脑后用多聚甲醛4℃固定过夜,石蜡包埋,4 μm连续切片。脱蜡,脑组织切片在改进型枸橼酸钠抗原修复液中煮沸15 min进行抗原修复。用新配的甲醇/过氧化氢混合液处理15 min以抑制过氧化氢酶,然后于封闭液室温孵育1 h,以阻止非特异性免疫球蛋白的结合。使用抗CD68单克隆抗体标记巨噬细胞。
1.3 统计学处理 应用GraphPad Prism软件进行数据分析,计量资料以±s表示,进行单因素t检验分析;P< 0.05为差异有统计学意义。
2 结 果
2.1 两组TBI大鼠在第0、5、25天运动神经功能评分及体质量比较 在造模第5、25天,姜黄素组大鼠神经功能评分优于DMSO组,差异均有统计学意义(P<0.05),见表1;在造模第5、25天,姜黄素组大鼠体质量显著高于DMSO组,差异均有统计学意义(P<0.05),见表2。
表1 两组TBI大鼠第0、5、25天运动神经功能评分比较(±s,分)
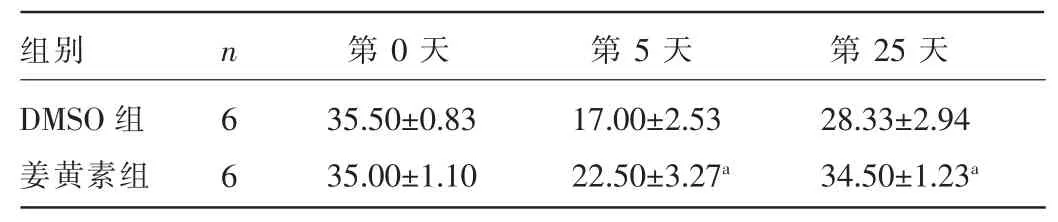
表1 两组TBI大鼠第0、5、25天运动神经功能评分比较(±s,分)
注:与DMSO组同时间点比较,aP<0.05。
组别DMSO组姜黄素组n 第0天 第5天 第25天6 6 35.50±0.83 35.00±1.10 17.00±2.53 22.50±3.27a28.33±2.94 34.50±1.23a
表2 两组TBI大鼠第0、5、25天体质量比较(±s,g)

表2 两组TBI大鼠第0、5、25天体质量比较(±s,g)
注:与DMSO组同时间点比较,aP<0.05。
组别DMSO组姜黄素组n 第0天 第5天 第25天6 6 196.7±13.4 192.7±18.1 157.3±12.3 190.2±14.0a230.2±11.4 316.7±20.6a
2.2 姜黄素抑制TBI高峰期巨噬细胞/小胶质细胞在大鼠脑组织中的炎症浸润 TBI高峰期(第5天)大鼠脑组织CD68+细胞免疫组化染色结果见图1。姜黄素组大鼠脑组织CD68+细胞染色密度显著低于DMSO组,差异有统计学意义(P<0.01)。
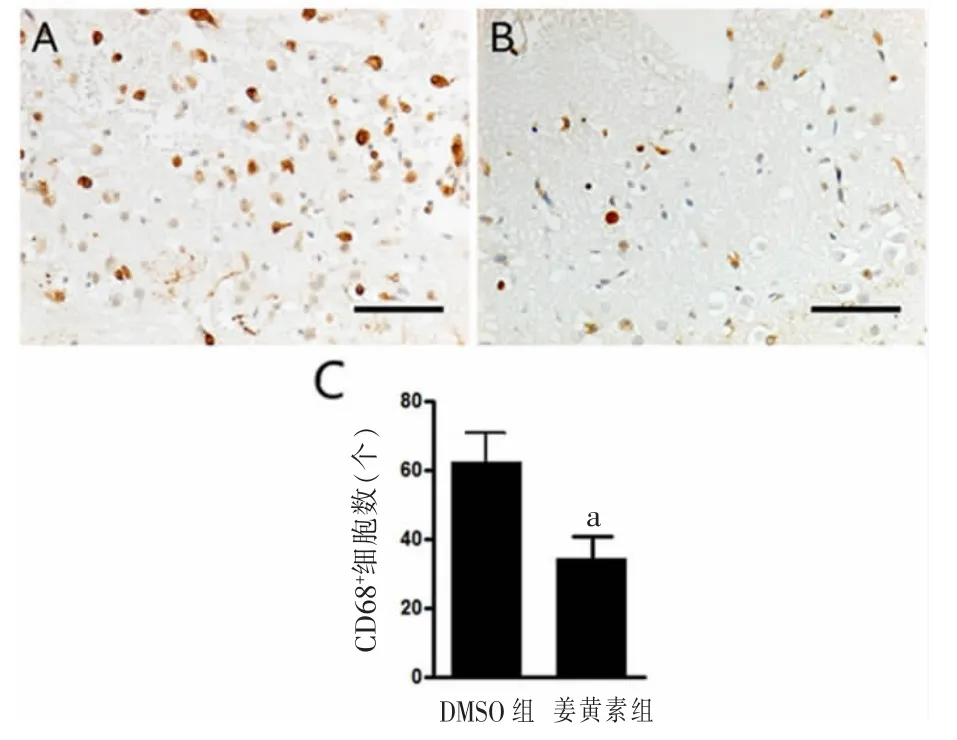
图1 姜黄素抑制TBI高峰期(第5天)CD68+细胞在脑组织中的炎症浸润(SP法,400×)
2.3 姜黄素抑制TBI高峰期脑组织炎症因子表达 对大鼠TBI高峰期(第5天)脑组织中炎症因子mRNA表达进行RT-PCR分析结果见图2。姜黄素组肿瘤坏死因子α(TNF-α)、白介素(IL)-1βmRNA表达较DMSO组显著减低,差异均有统计学意义(P<0.01)。
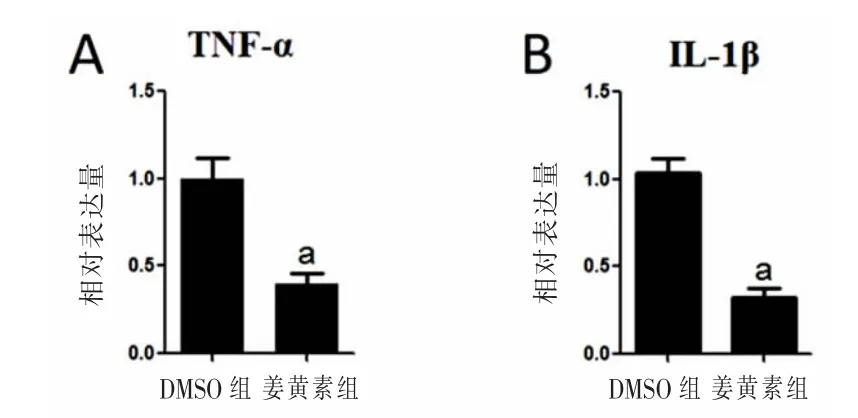
图2 姜黄素抑制TBI高峰期(第5天)TNF-α、IL-1β mRNA的表达
2.4 姜黄素促进TBI恢复期IL-10和转化生长因子β(TGF-β)的表达 对大鼠TBI恢复期(第25天)脑组织中炎症因子mRNA表达进行RT-PCR分析结果见图3。姜黄素组IL-10、TGF-β mRNA表达较DMSO组显著增高,差异均有统计学意义(P<0.01)。
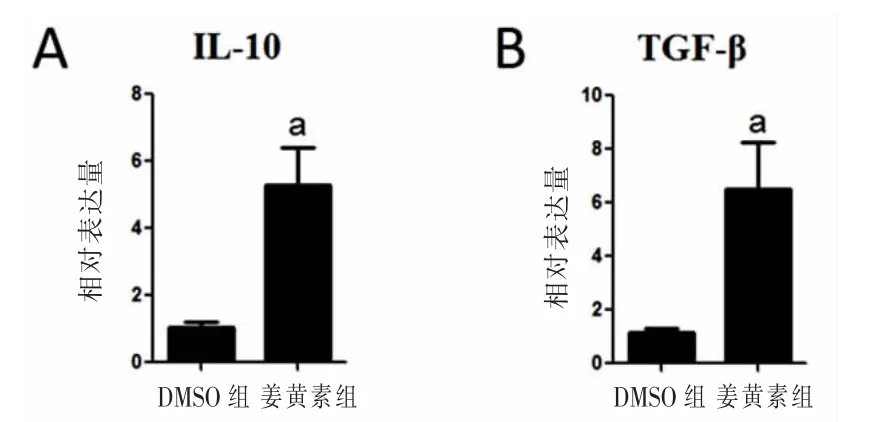
图3 姜黄素促进TBI恢复期(第25天)IL-10、TGF-β mRNA的表达
3 讨 论
炎性反应是TBI继发病理过程的重要部分。已有研究表明,多种炎症成分参与了TBI的进程,其表达谱的差异反映TBI的严重程度[9],其中,巨噬细胞/小胶质细胞是TBI后炎性反应的主要参与者。一方面,它们扮演着中枢神经系统“清道夫”的角色,能快速吞噬凋亡、坏死的组织或细胞[10];另一方面,它们能分泌 TNF-α、IL-1β、IL-10、TGF-β等多种炎症因子参与到炎性反应中去。TNF-α在TBI早期具有神经毒性作用[11];IL-1β能促进TBI后炎性反应,并有实验证实,降低IL-1β的表达能有效缓解出血性脑损伤[12];IL-10与TGF-β能抑制脑组织炎性反应,且TGF-β能促进脑损伤后脑组织的修护[13]。因此,这些指标与脑损伤的程度、病程变化、预后等密切相关,可以作为反映TBI疗效的指标[14]。
姜黄素被证实在神经系统疾病中具有保护作用。Han等[15]发现姜黄素能通过抑制T细胞的炎性激活从而改善大鼠实验性自身免疫性神经炎;在小鼠实验性自身免疫性脑脊髓炎模型中,姜黄素能预防线粒体损伤与缺氧状况[16];除此之外,姜黄素被证实对神经痛[17]、阿尔茨海默病[18]、脊髓损伤[19]具有治疗作用。在TBI中,姜黄素能预防TBI后脑出血[20],能改善TLR4/MyD88/NF-κB信号通路介导的急性炎性反应[21],并对神经元具有保护作用[22];然而,目前尚鲜有文献评估TBI后炎症高峰期(第5天)和恢复期(第25天)姜黄素的疗效,本研究结果提示,在TBI炎症高峰期,姜黄素能显著抑制巨噬细胞的浸润和小胶质细胞的激活,减弱了促炎症因子TNF-α和IL-1β的表达,提示这些作用与姜黄素减轻神经功能障碍相关;在TBI恢复期,姜黄素能增强促组织修复细胞因子IL-10和TGF-β的表达,结合姜黄素显著性改善大鼠TBI后期神经功能,说明姜黄素能促进TBI后期脑组织的修复。
综上所述,本研究结果提示姜黄素是一个贯穿TBI全程的、具有抗炎与组织保护功能的理想TBI治疗药物。由于本研究采用腹腔注射姜黄素的方式评估其对大鼠TBI的治疗作用,临床应用上还有一定局限性,因此,探索出合适的姜黄素口服剂量将具备更好的临床应用前景。
[1]Corps KN,Roth TL,McGavern DB.Inflammation and neuroprotection in traumatic brain injury[J].JAMA Neurol,2015,72(3):355-362.
[2]母得志,李熙鸿.新生儿脑损伤及修复[J].实用儿科临床杂志,2009,24(2):83-86.
[3]费舟,章翔.二次脑损伤[J].中华神经外科疾病研究杂志,2006,5(5):471-473.
[4]沙龙金,夏昌兴,曾文盛,等.二次脑损伤对颅脑损伤预后的影响[J].中原医刊,2006,33(5):20-21.
[5]Zhang ZY,Zhang Z,Fauser U,et al.Global hypomethylation defines a sub-population of reactive microglia/macrophages in experimental traumatic brain injury[J].Neurosci Lett,2007,429(1):1-6.
[6]Jurenka JS.Anti-inflammatory properties of curcumin,a major constituent of Curcuma longa:a review of preclinical and clinicalresearch[J].Altern Med Rev,2009,14(2):141-153.
[7]Shishodia S,Sethi G,Aggarwal BB.Curcumin:getting back to the roots[J]. Ann NY Acad Sci,2005,1056:206-217.
[8]Sinson G,Voddi M,Mcintosh TK.Combined fetal neural transplantation and nerve growth factor infusion:effects on neurological outcome following fluid-percussion brain injury in the rat[J].J Neurosurg,1996,84(4):655-662.
[9]Lagraoui M,Latoche JR,Cartwright NG,et al.Controlled cortical impact and craniotomy induce strikingly similar profiles of inflammatory gene expression,but with distinct kinetics[J].Front Neurol,2012,3:155.
[10]Nayak D,Roth TL,McGavern DB.Microglia development and function[J]. Annu Rev Immunol,2014,32:367-402.
[11]Allan SM,Rothwell NJ.Cytokines and acute neurodegeneration[J].Nat Rev Neurosci,2001,2(10):734-744.
[12]Schielke GP,Yang GY,Shivers BD,et al.Reduced ischemic brain injury in interleukin-1 beta converting enzyme-deficient mice[J].J Cereb Blood Flow Metab,1998,18(2):180-185.
[13]Morganti-Kossmann MC,Rancan M,Otto VI,et al.Role of cerebral inflammation after traumatic brain injury:a revisited concept[J].Shock,2001,16(3):165-177.
[14]贺晓生.重视对创伤性脑损伤炎症反应的研究[J].第四军医大学学报,2004,25(9):769-771.
[15]Han F,Luo B,Shi R,et al.Curcumin ameliorates rat experimental autoimmune neuritis[J].J Neurosci Res,2014,92(6):743-750.
[16]Feng J,Tao T,Yan W,et al.Curcumin inhibits mitochondrial injury and apoptosis from the early stage in EAE mice[J].Oxid Med Cell Longev,2014,2014:728751.
[17]Lee JH,Kim YD,Jung HC,et al.The effect of intrathecal curcumin on mechanical allodynia in rats after L5 spinal nerve ligation[J].Korean J Anesthesiol,2014,67 Suppl:S122-123.
[18]Feng HL,Fan H,Dang HZ,et al.Neuroprotective effect of curcumin to Aβ of double transgenic mice with Alzheimer′s disease[J].Zhongguo Zhong Yao Za Zhi,2014,39(19):3846-3849.
[19]Zhang J,Wei H,Lin M,et al.Curcumin protects against ischemic spinal cord injury:The pathway effect[J].Neural Regen Res,2013,8(36):3391-3400.
[20]Chen TH,Yang YC,Wang JC,et al.Curcumin treatment protects against renal ischemia and reperfusion injury-induced cardiac dysfunction and myocardial injury[J].Transplant Proc,2013,45(10):3546-3549.
[21]Zhu HT,Bian C,Yuan JC,et al.Curcumin attenuates acute inflammatory injury by inhibiting the TLR4/MyD88/NF-κB signaling pathway in experimental traumatic brain injury[J].J Neuroinflammation,2014,11:59.
[22]NoorafshanA,AbdollahifarMA,Karbalay-DoustS.Stresschanges the spatial arrangement of neurons and glial cells of medial prefrontal cortex and sertraline and curcumin prevent it[J].Psychiatry Investig,2015,12(1):73-80.
Curcumin for ameliorating inflammatory reaction and prognosis in traumatic brain injury in rat
Yang Youlian1,Zhang Xin2,Luo Yang3,Liu Su4
(1.Students Brigade,Third Military Medical University,Chongqing 400038,China;2.Chongqing Municipal Corps Hospital of Armed Police Forces,Chongqing 400061,China;3.324 Hospital of PLA,Chongqing 400020,China;4.Department of Anesthesiology,Daping Hospital,Research Institute of Field Surgery,Third Military Medical University,Chongqing 400038,China)
ObjectiveTo investigate the therapeutic effect and the potential mechanism of curcumin for treating traumatic brain injury(TBI).Methods12 SD rats were randomly divided into the curcumin group(6 cases)and the DMSO group(control,6 cases).After TBI model was established,each rat in the curcumin group was treated with curcumin for 3 d,while the DMSO group was given the equal quantity of DMSO by intraperitoneal injection.The body mass and neurological functional score were daily measured from the beginning to the end of experiment.On 5 d(peak period),the brain tissue was taken for observing the macrophage/microglia inflammatory infiltration in the brain by the immunohistochemistry staining.The real time quantitative RT-PCR was performed for detecting the relative expression of TNF-α and IL-1β.On 25 d(recovery period),the brain tissue was taken for detecting the relative expressions of IL-10 and TGF-β in brain by RT-PCR.ResultsThe neurological functional scores showed that the severity degrees of the rat TBI were significantly decreased after curcumin treatment,indicating that curcumin could inhibit the macrophage infiltration and microglia activation in the rat brain tissue,inhibited the expression of TNF-α and IL-1β in the brain tissue during the peak period and promoted the expression of IL-10 and TGF-β during the recovery period of TBI.ConclusionCurcumin has the curative effect on TBI,which may be related with curcumin inhibiting the inflammatory reaction after TBI and promoting the tissue recovery.
Curcumin; Brain injury; Inflammation; Macrophage; Microglia; Immunohistochemistry
10.3969/j.issn.1009-5519.2015.20.004
A
1009-5519(2015)20-3056-03
2015-06-04)
阳又莲(1970-),女,湖南冷水江人,硕士研究生,主要从事创伤护理研究;E-mail:443601147@qq.com。
刘宿(E-mail:liusu3691@qq.com)。
