浅析“恒温”“绝热”条件下化学平衡的差异
2015-07-13林尤宏
林尤宏
我们探讨有关化学平衡问题,一般都是设定“恒温”条件,通过改变浓度或压强来分析平衡移动;或设定“恒容”或“恒压”条件,通过改变温度来判断平衡移动。很少讨论在“绝热”容器中发生可逆反应的有关化学平衡问题。2013年江苏省化学高考试题中出现了这样的试题,很有新意。若不能敏锐地捕捉到“绝热”与 “恒温”的诸多差异,就会陷入习惯思维的陷阱,做出错误的选择。现将这些差异,尽可能多地辨析如下。
2013年江苏省化学高考试卷第15题:一定条件下存在反应:
CO(g)+H2O(g)CO2(g)+H2(g)
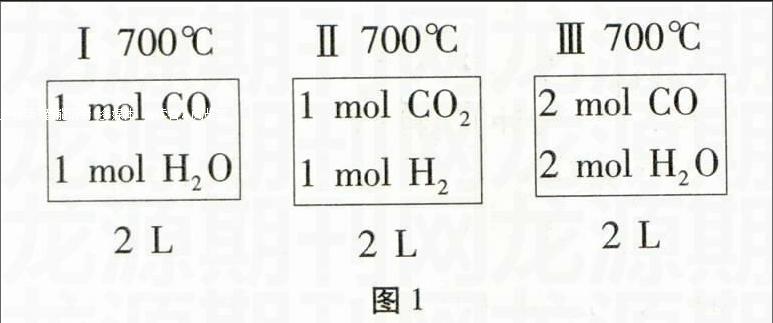
其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是()。
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
为了清楚地说明问题,本题中的反应起始状态用图1表示:
Ⅰ 700℃1 mol CO1 mol H2O2 L
Ⅱ 700℃1 mol CO21 mol H22 L
Ⅲ 700℃2 mol CO2 mol H2O2 L
图1
一、假设为恒温条件
对于
CO(g)+H2O(g)CO2(g)+H2(g)
因为是恒温条件,平衡常数不变。又因为该反应两边化学计量数的和相等,因此达到平衡状态时,Ⅰ、Ⅱ、Ⅲ为等效平衡,各物质的物质的量之比及某物质的物质的量分数相等;Ⅲ中各物质浓度是Ⅰ、Ⅱ中各物质浓度的两倍;Ⅰ、Ⅱ正反应速率相同,Ⅲ正反应速率是Ⅰ、Ⅱ正反应速率的两倍;Ⅰ、Ⅲ中CO的转化率相同,Ⅰ中CO的转化率与Ⅱ中CO2的转化率之和等于1[证明:Ⅰ中n(CO)=1-1α(CO), Ⅱ中n(CO)=1α(CO2),因为Ⅰ、Ⅱ、为等效平衡,n(CO)相等,所以,1-1α(CO)=
1α(CO2),α(CO)+α(CO2)=1]。
达平衡时各相关量见表1。
表1恒温条件下,达到平衡状态时,相关量的比较
ⅠⅡⅢ
V(正)aa2a
压强bb2b
平衡常数ccc
转化率α(CO)=d (CO2)=1-dα(CO)=d
n(CO)ee2e
n(CO)%fff
二、绝热条件
绝热条件,即反应体系与外界无热量交换。从反应开始到平衡状态,若向放热反应方向进行,则温度越来越高;若向吸热反应方向进行,则温度越来越低,直至趋向平衡状态时温度才不变。因受温度改变的影响,达到平衡状态时,平衡常数、反应速率、体系压强、反应物的转化率、某物质的体积分数等,都与恒温条件不同,原恒温条件下的“等效平衡”也不复存在。
对于
CO(g)+H2O(g)CO2(g)+H2(g)
由于正反应是放热反应,所以Ⅰ、Ⅲ容器中,随着反应的进行,温度逐渐上升,因此达到平衡状态时,温度高于恒温条件下达到平衡状态时的温度,反应速率、体系压强比恒温条件下的要大;因温度升高,反应不利于向正方向进行,平衡常数和CO的转化率都比恒温条件下的要小; CO的物质的量及CO的物质的量分数也比恒温条件下的要大。在Ⅱ容器中,反应逆向进行,逆反应为吸热反应,随着反应的进行,温度下降,因此达到平衡状态时,温度低于恒温条件下达到平衡状态时的温度,反应速率、体系压强比恒温条件下的要小;因温度降低,反应不利于向生成CO的方向进行,平衡常数[CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数]增大,CO2的转化率都比恒温条件下的要小; CO的物质的量及CO的物质的量分数也比恒温条件下的要小。由于Ⅲ容器中CO(g)和H2O(g)的起始物质的量浓度是Ⅰ容器的两倍,达到平衡状态时,Ⅲ容器中的温度比Ⅰ容器更高,所以,反应速率、体系压强、CO的物质的量及CO的物质的量分数更大;平衡常数、CO的转化率更小。
表2绝热条件下,达到平衡状态时,相关量的比较
ⅠⅡⅢ
温度T1>700℃T2<700℃T3>T1
v(正)a1>aa2
压强b1>bb2
平衡常数c1 转化率α(CO)1 α(CO2)2=1-dα(CO)3=α(CO)1 n(CO)e1>ee2 n(CO)%f1>ff2 根据以上分析可清楚地看出此高考题的正确选项是CD。 (收稿日期:2014-01-27)
