应用于氧化还原电池正极的VO(CH3 SO3)2 电解液
2015-07-13吴波周德璧
吴波,周德璧
(中南大学 化学化工学院,湖南 长沙 410083)
储能技术是解决可再生能源发电非稳态特性的重要手段,液流电池储能技术由于其价格低、循环寿命长的特点已成为当前研究的热点[1-3]。目前,国内外研究的液流电池体系包括多硫化钠/溴液流电池[4]、锌溴液流电池[5-6]、全钒液流电池[7]、锌铈液流电池[8]等。全钒液流电池的研究较多,正在逐步实现工业化。张华民等研究了全钒液流电池高浓度下V(Ⅳ)/V(Ⅴ)的电极过程,并得到了全钒液流电池用V(Ⅳ)-H2SO4溶液的浓度优化值[9]。Oriji 等采用旋转圆盘电极,研究了2.0 mol/L 的VOSO4在1 ~9 mol/L H2SO4中的电化学特性[10]。但是,V(Ⅳ)离子在硫酸溶液中的溶解度较低,而且其溶解度随酸度的增加明显下降,在钒电池能正常运行的酸度下,V(Ⅳ)离子的浓度低于2 mol/L[11]。同时,V(Ⅴ)离子在溶液中不稳定,容易析出V2O5固体[12],这些特点阻碍了钒电池的发展。提高钒离子的溶解度和钒电解液的稳定性是目前研究的主要方向之一。
Chao Tan 等[13]研究了甲基磺酸体系下的锌钒电池及钒电解液,用甲基磺酸作溶剂,配制出了高浓度的钒电解液且具有良好的稳定性,组装的锌钒电池具有比全钒电池更高的放电电压,甲基磺酸作为溶剂的钒电解液具有良好的运用前景,具有进一步研究的意义。甲基磺酸具有和硫酸类似的强酸性,具有无毒、腐蚀性低等特点。
本文以甲基磺酸为溶剂,配制了自由酸浓度为1 ~5 mol/L,V(Ⅳ)浓度为2 mol/L 的高浓度电解液,并对电解液进行了物理性质、热稳定性与电化学性能测试,得到了甲基磺酸浓度的优化值,并组装了锌钒电池进行测试,为以甲基磺酸为溶剂的氧化还原电池的进一步研究提供参考。
1 实验部分
1.1 材料与仪器
石墨毡;石墨棒(6 mm);均相阳离子交换膜;2 mm厚碳素板;V2O5、CH3SO3H、草酸等均为分析纯。
乌氏玻璃毛细管粘度计;260 型电导电极;ZD-2型自动电位滴定仪;CHI760d 电化学工作站;BTS-3000 系列充放电测试系统。
1.2 电解液的配制与粘度、电导率的测量
称取一定量的V2O5和草酸,加入适量蒸馏水,保持溶液温度在80 ℃左右,逐渐加入甲基磺酸,将V2O5还原为V(Ⅳ),直至V2O5溶解完全,加蒸馏水定容。
在20 ℃的恒温水浴锅中,取一定体积的电解液在固定的液面高度下,使其流经乌氏粘度计,记录流经时间,再用时间与粘度计的校正常数(0.011 33 mm2/S2)相乘,便可得到溶液的粘度。
将电导电极(电导池常数0.6 ±0.2)插入25 ℃的电导率校正溶液(12.85 mS/cm ±0.3%,25 ℃)中测出其溶液电阻,利用公式K =L/RS (L 为电极间距离,R 为溶液电阻,S 为电极面积,K 为电导率)对电导常数校正后,再分别测出其他待测电解液的溶液电阻,利用上述公式可计算溶液电导率。
1.3 热稳定性、循环伏安与电池充放电测试
利用电解槽对相对应浓度的钒电解液进行电解,将V(Ⅳ)氧化成V(Ⅴ)后取出,溶液在50 ℃的水浴锅中敞口放置5 d 后离心分离,利用KMnO4-(NH4)2Fe(进行电位滴定。采用石墨棒为工作电极,饱和甘汞电极为参比电极,大面积铂片为对电极,组成三电极体系,利用CHI760d 电化学工作站进行循环伏安测试。石墨棒的表观面积为1 cm2,测试前分别用1 ~5 号金相砂纸打磨光滑,然后在蒸馏水中超声清洗2 min,在空气中风干备用。循环伏安测试电位范围为0.5 ~1.5 V,扫速分别为2,5,10,20,40,80 mV/s。组装的锌钒电池正极电解液为2 mol/L VO(CH3SO3)2+4 mol/L CH3SO3H,负极电解液为 1 mol/L Zn(CH3SO3)2与硼酸、导电盐;正极材料为石墨毡(3 cm×4 cm),负极材料为碳塑(3 cm ×4 cm);隔膜为质子交换膜。恒流充放电电流为360 mA,充电截止电压2.2 V,放电终止电压0.5 V。
2 结果与讨论
2.1 电解液的热稳定性
制备V(Ⅴ)溶液时,电解槽的阳极反应为VO2++ H2O-e-→+ 2H+,阴极反应为2H++ 2e-→H2↑,阳极产生的氢离子通过隔膜迁移至阴极发生析氢反应,阳极室内电解液的H+浓度基本不变。制备的V(Ⅴ)电解液在50 ℃的敞开环境下经静置滴定的结果见表1。
表1 静置前与静置5 d 后溶液中的与VO2+离子浓度Table 1 and VO2+ concentration in the electrolyte before standing and after 5 d standing

表1 静置前与静置5 d 后溶液中的与VO2+离子浓度Table 1 and VO2+ concentration in the electrolyte before standing and after 5 d standing
注:c(酸)、c(VO2+)、c(VO2+)、c(VO2+)'、c(VO2+)'的单位为mol/L。
c(酸)静置5 d后静置前c(VO2+) c(VO2+)总钒c(VO2+)' c(VO2+)' 总钒'1 MSA 1.766 0.195 1.961 0.828 0.197 1.025 2 MSA 1.662 0.301 1.963 0.746 0.301 1.047 3 MSA 1.555 0.401 1.956 0.902 0.397 1.299 4 MSA 1.462 0.489 1.951 1.452 0.490 1.942 5 MSA 1.444 0.501 1.945 1.443 0.501 1.944 3 H2SO4 1.765 0.195 1.960 0.867 0.190 1.057

表2 25 ℃下2.0 mol/L V(Ⅳ)在1 ~5 mol/L CH3SO3H中溶液的电导率与粘度Table 2 2.0 mol/L V(Ⅳ)electrolyte conductivity and viscosity in 1 ~5 mol/L CH3SO3H at 25 ℃
由表1 可知,在相同的条件下给各溶液充电,CH3SO3H(MSA)的浓度越高得到的VO2+ 浓度越低,相对应的VO2+的浓度越高。这可能是由于随着CH3SO3H 浓度的增加,CH3SO3H 的电离程度会降低,分子间作用力的增强使得溶液的内摩擦力增大,溶液的粘度(见表2)与传质阻力越来越大,溶液在没有流动的情况下,CH3SO3H 浓度越大,电解液反应越不完全。VO2+的浓度在搁置前后基本没有变化,说明VO2+在甲基磺酸溶液中比较稳定。搁置5 d 后,CH3SO3H 为1 ~3 mol/L 与H2SO4为3 mol/L溶液的总钒含量都显著下降,4 ~5 mol/L CH3SO3H溶液中各钒离子的含量几乎没有变化。H2SO4为3 mol/L溶液其稳定性与CH3SO3H 为2 mol/L 的溶液相当。由此可见,当CH3SO3H 的浓度达到4 mol/L后,能比较稳定的存在,稳定性优于使用3 mol/L H2SO4的钒离子电解液。这可能一方面是4 mol/L 的CH3SO3H 溶液中VO2+ 的浓度相对较低,减缓了VO2+→V2O5沉淀速度;另一方面是由于能 与CH3SO3- 离 子 形 成 络 合 物[15],使能在溶液中更稳定。
2.2 电解液的循环伏安分析
由热稳定性分析可知,CH3SO3H 为1 ~2 mol/L的溶液稳定性不理想,缺乏应用价值,故对CH3SO3H 为3 ~5 mol/L 的V(Ⅴ)电解液作了循环伏安测试,结果见图1 ~图3 及表3。
由图1 可知,随着扫描速率的增大,氧化还原峰的峰电流值逐步增大,氧化峰与还原峰的电位差(ΔE)越来越大,并且超过59 mV,说明电极反应表现出不可逆;但扫速低于5 mV/s 时,峰电位差小于59 mV,且两个峰的形状比较对称,说明该体系也不是完全不可逆,所以在CH3SO3H 溶液中V(Ⅳ)/V(Ⅴ)电对在石墨电极上的反应为准可逆过程[16]。准可逆反应的扩散系数介于可逆反应与不可逆反应的扩散系数之间。根据不同扫速下的循环伏安测试结果,可用以下两式进行计算[17-18]。
可逆条件下ip = 2.69 ×105n3/21/2
不可逆条件下ip = 2.99 ×105α1/2v1/2
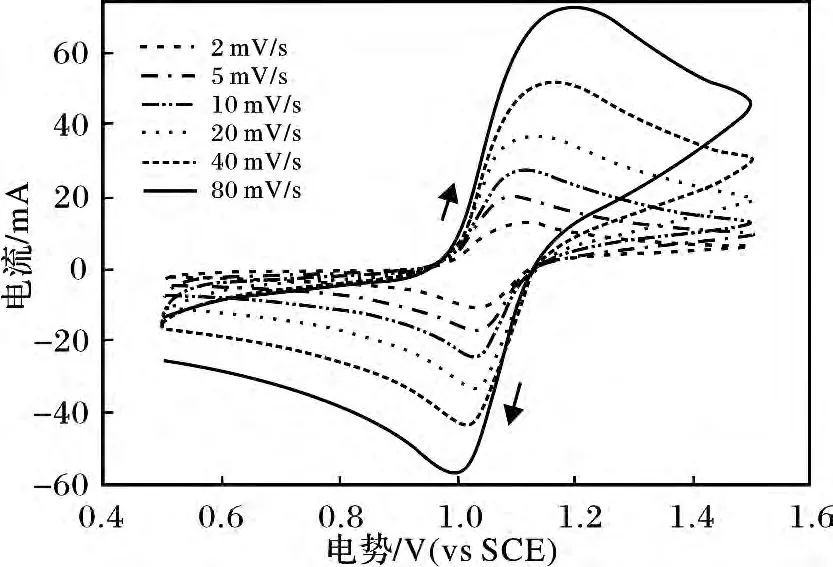
图1 2.0 mol/L V(Ⅳ)在4 mol/L CH3SO3H 中不同扫速下的循环伏安曲线Fig.1 Cyclic voltammograms of the 2.0 mol/L V(Ⅳ)in4 mol/L CH3SO3H electrolyte at different rates

图2 2.0 mol/L V(Ⅳ)在4 mol/L CH3SO3H 中阳极氧化峰电流与扫速平方根之间的关系Fig.2 Relation between anodic peak current and square root of 2.0 mol/L V(Ⅳ)CV scan rates in 4 mol/L CH3SO3H electrolyte
由图2 可求出ip 与v1/2的斜率,然后算出3 ~5 mol/L CH3SO3H 钒电解液的扩散系数,结果见表3。

表3 25 ℃下2.0 mol/L V(Ⅳ)在3 ~5 mol/L CH3SO3H中的扩散系数Table 3 2.0 mol/L V(Ⅳ)electrolyte diffusion coefficient in 3 ~5 mol/L CH3SO3H at 25 ℃
由表3 可知,随着电解液中CH3SO3H 浓度的增加,钒离子的扩散系数下降。这是由于CH3SO3H 浓度的增加,使溶液的粘度与分子间作用力增大,钒离子的迁移阻力增大。CH3SO3H 浓度过高会减弱反应离子的传质与传荷过程,这与热稳定性测试中电解得到的结果一致。
3 ~5 mol/L CH3SO3H 电解液在5 mV/s 扫速下的循环伏安见图3。
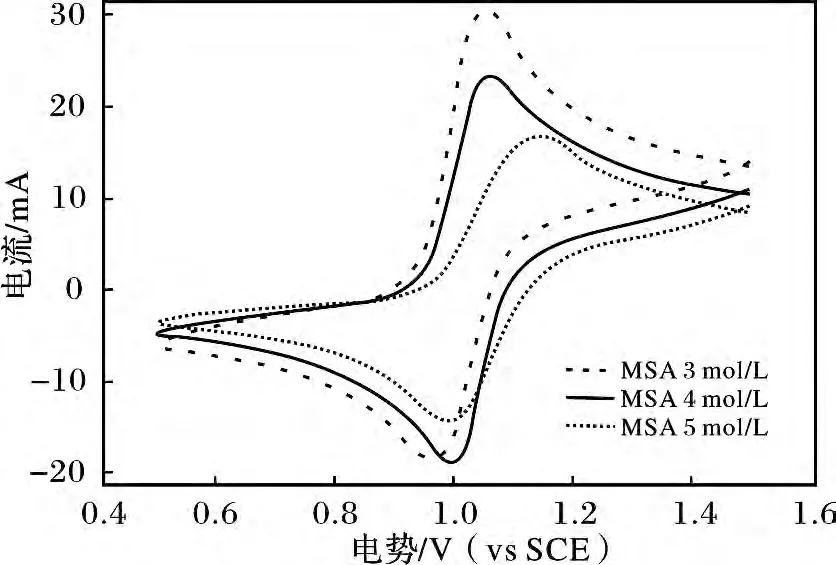
图3 2.0 mol/L V(Ⅳ)在3 ~5 mol/L CH3SO3H 中5 mV/s 扫速下的循环伏安曲线Fig.3 Cyclic voltammograms of the 2.0 mol/L V(Ⅳ)in 3 ~5 mol/L CH3SO3H electrolyte at scan rate of 5 mV/s
由图3 可知,随着CH3SO3H 浓度的增加,氧化峰电流逐步下降,峰电流的比值减小,并逐渐趋近1。CH3SO3H 的浓度4 mol/L 时,峰电位差最小,为61 mV,与59 mV 很接近,此溶液在石墨电极上的可逆性最好;当CH3SO3H 的浓度为5 mol/L 时,峰电流的比值接近1,但其峰电位差为149 mV,远大于59 mV,其可逆性反而下降,这是溶液的传质阻力过大导致的。由此可见,电解液中的CH3SO3H 浓度不宜超过4 mol/L。
2.3 电池性能
由热稳定性和循环伏安测试可知,当CH3SO3H的浓度为4 mol/L 时,电解液的热稳定性与电化学性能最佳,故以2 mol/L VO(CH3SO3)2+ 4 mol/L CH3SO3H 为正极电解液组装了锌钒电池进行测试,结果见图4、图5。
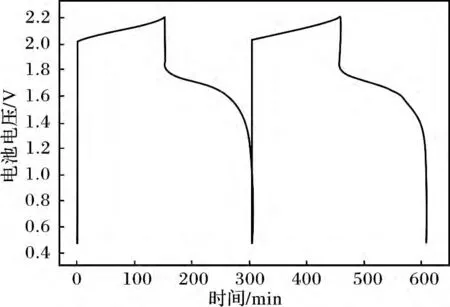
图4 锌-钒电池的充放电曲线Fig.4 Charge-discharge curve of Zn-V battery
由图4 可知,电池在前10 个循环的充电电压基本稳定在2.03 ~2.2 V,放电电压1.83 ~1.04 V;电池充电以后的开路电压达1.96 V,前10 个循环的放电平均中值电压为1.61 V。在保证能量密度的前提下,锌钒电池的开路电压和放电电压都高于全钒液流电池。

图5 锌-钒电池的库伦效率与能量效率Fig.5 Coulombic and energy efficiency of Zn-V battery
由图5 可知,电池在前3 个循环的库伦效率达97%以上,能量效率达74%;随着循环次数的增加,电池的库伦效率逐渐降低。主要有两方面的原因:一方面由于正负极电解液的酸度不一样,随着循环次数的增加,一部分H+渗透到锌负极,尽管负极电解液中有缓冲剂,但还是在一定程度上造成了锌负极的自放电;另一方面,正极少量的高价钒离子迁移到负极电解液中也会造成锌负极的自放电。到第9个循环时,库伦效率下降的趋势减小,基本维持在93%左右,能量效率为72%。这可能是电池的内部基本达到了相对稳定的状态,电解液的相互渗透减小,所以电池的库伦效率和能量效率都变得比较稳定。由此可见,使用更合适的隔膜材料与电极材料,减小电解液的相互渗透,就能提高锌钒电池的库伦效率和能量效率,延长电池的寿命,使锌钒电池更具应用前景。
3 结论
(1)采用CH3SO3H 作为溶剂,得到了应用于氧化还原电池的钒电解液。随着CH3SO3H 浓度的升高,电解液的粘度逐渐增大,钒离子的扩散系数逐渐降低。当自由酸的浓度为4 mol/L 时,电解液具有良好的热稳定性和电化学性能,其热稳定性优于使用3 mol/L 硫酸的电解液。
(2)以2 mol/L VO (CH3SO3)2+ 4 mol/L CH3SO3H 为正极电解液组装的电池,充电后的开路电压达1.96 V,前10 个循环的放电平均中值电压为1.61 V,平均电流效率为96.12%,能量效率为74.03%。在保证能量密度的前提下,锌钒电池的放电平台更高,如能解决好电解液的渗透问题,延长电池的使用寿命,锌钒电池将会有良好的运用前景。
[1] Yang Z G,Zhang J L,Kintner-Meyer M C W,et al.Electrochemical energy storage for green grid[J].Chem Rev,2011,111(5):3577-3613.
[2] Skyllas-Kazacos M,Chakrabarti M H,Hajimolana S A,et al.Progress in flow battery research and development[J].Journal of the Electrochemical Society,2011,158 (8):55-79.
[3] 张华民,张宇,刘宗浩,等. 液流储能电池技术研究进展[J].化学进展,2009,11(21):2333-2340.
[4] 赵平,张华民,高虹,等.多硫化钠/溴液流电池研究进展[J].现代化工,2004,34(5):321-322.
[5] 孟琳.锌溴液流电池储能技术研究和应用进展[J].储能科学与技术,2013,2(1):35-40.
[6] Peter L,Jonshagen B.The zinc/bromine battery system for utility and remote area applications[J]. Power Engineering Journal,1999,13(3):142-148.
[7] 刘大凡,李晓磊,郭西凤,等. 全钒氧化还原液流电池的发展现状[J].无机盐工业,2010,42(8):4-6.
[8] Xie Zhipeng,Zhou Debi,Xiong Fengjiao,et al. Ceriumzinc redox flow battery:Positive half-cell electrolyte studies[J].Journal of Rare Earths,2011,29(6):567-573.
[9] 文越华,张华民,钱鹏,等. 全钒液流电池高浓度下V(Ⅳ)/V(Ⅴ)的电极过程研究[J]. 物理化学学报,2006,22(4):403-408.
[10]Oriji G,Katayama Y,Miura T.Investigation on V(IV)/V(V)species in a vanadium redox flow battery[J]. Electrochimica Acta,2004,49(19):3091-3095.
[11]Rahmana F,Skyllas-Kazacos M.Vanadium redox battery:Positive half-cell electrolyte studies[J].Journal of Power Sources,2009,189(2):1212-1219.
[12] Vijayakumar M,Li L Y,Graff G,et al. Towards understanding the poor thermal stability of V5+electrolyte solution in vanadium redox flow batteries[J].Journal of Power Sources,2011,196(7):3669-3672.
[13]Tang C,Zhou D B.Methanesulfonic acid solution as supporting electrolyte for zinc-vanadium redox battery[J].Electrochimica Acta,2012,65:179-184.
[14]方磊,常芳,李晓斌,等.VRB 电解液的高锰酸钾电位滴定分析[J].电池,2012,42(1):54-57.
[15]Vijayabarathi T,Velayutham D,Noel M.Influence of aromatic reactants and products involved in the two stage electrochemical oxidation on the voltammetric behaviour of Ce(IV)/Ce(III)redox couple[J].Journal of Applied Electrochemistry,2001,31(9):979-986.
[16]Liu Q H,Shinkle A A,Li Y D,et al.Non-aqueous chromium acetylacetonate electrolyte for redox flow batteries[J].Electrochemistry Communications,2010,12(11):1634-1637.
[17] 阿伦·J·巴德,拉里·R·福克纳.电化学方法原理和应用[M].2 版.邵元华等,译.北京:化学工业出版社,2010.
[18]Zhong S,Skyllas-Kazacos M.Electrochemical behaviour of vanadium (V)/vanadium (IV)redox couple at graphite electrodes[J].J Power Sources,1992,39(1):1-9.
