儿童肝脏脉管性病变的影像诊断
2015-07-12施美华钟玉敏殷敏智薛潋滟周莺邵虹王诗渝
施美华,钟玉敏,殷敏智,薛潋滟,周莺,邵虹,王诗渝
·儿科影像学专题·
儿童肝脏脉管性病变的影像诊断
施美华,钟玉敏,殷敏智,薛潋滟,周莺,邵虹,王诗渝
目的:分析儿童肝脏脉管性病变的影像学特征,复习国际脉管性病变研究协会(ISSVA)脉管性病变分类及命名标准,明确影像诊断及正确命名在肝脏脉管性病变诊断中的重要性。方法:搜集本院2006年1月-2014年12月91例儿童肝脏脉管性病变患者的病例资料,其中3例经手术证实,48例经随访证实。91例中男46例,女45例,年龄15天-11岁,中位年龄3岁。将影像诊断(超声、CT、MRI)与术后病理结果以及随访资料进行对照分析。结果:91例中89例未按照ISSVA标准正确命名;CT和MRI显示肝脏脉管性病变表现为孤立性单发肿瘤57例,多发肿瘤21例,弥漫性肿瘤13例;病变的CT和MRI表现相似,均为动脉期明显强化,静脉期持续强化,表现为“快进慢出”的特点;91例中4例合并Kasabach-Merritt综合征。结论:肝脏脉管性病变亦需根据ISSVA标准进行规范命名和分类,影像检查是儿童肝脏脉管性病变的首选诊断方法。
肝脏;脉管性病变;超声;体层摄影术,X线计算机;磁共振成像;儿童;诊断
1996年国际脉管性病变研究协会(ISSVA)将脉管性疾病分为脉管性肿瘤(vascular tumor)和脉管畸形(vascular malformation),使得这类疾病的命名更加规范[1]。目前ISSVA分类及命名方法已为临床上广泛接受,尤其在软组织脉管性病变的诊断中使用广泛[2]。但是对于深部脏器的脉管性病变,如肝脏的脉管性病变的分类及命名尚不规范。笔者通过搜集本院肝脏脉管性病变患者的影像结果、术后病理结果和/或长期随访记录,总结儿童肝脏脉常见脉管性病变的影像学特征,并复习ISSVA对肝脏脉管性病变的分类及命名方法,明确影像诊断及正确命名在肝脏脉管性病变诊断中的重要性。
材料与方法
搜集2006年1月-2014月12月在本院首次影像诊断为肝脏脉管性病变的91例儿童患者的病例资料。其中男46例,女45例,年龄15天-11岁,中位年龄3岁。影像诊断方法包括超声、MRI和CT。超声检查使用Philips Iu22和GE、Logic 9和Logic 500彩色多普勒超声诊断仪。CT检查采用GE Light-Speed 16排CT及GE Discovery 750HD CT机。16排CT扫描参数:120k V,100~120m A,螺距1.375,床速27.5 mm/s,层厚7~10 mm,重建层厚、间隔均为1.25 mm;64排CT扫描参数:100 k V,自动毫安调节,螺距1.375,球管旋转速度0.4 s/r,层厚5 mm,重建层厚及间隔1.25 mm;平扫后按2 m L/kg静脉团注对比剂(碘帕醇)行双期增强扫描(动脉期和静脉期)。MRI检查使用GE Signa Horizon 1.5T MR仪及Philips Achieva Nova Dual 1.5T MR仪。常规平扫序列为FSE T1WI、FSE T2WI,脂肪抑制FSE T2WI,增强扫描采用脂肪抑制FSE T1WI多平面扫描。手术后病变组织使用10%福尔马林液固定,常规脱水、石蜡包埋、HE染色、光镜观察;免疫组化标记采用二步法,免疫组化抗体标记:Glu-T1(葡萄糖转运蛋白-1)、F8、CD31、CD34及血管平滑肌标记物等。将影像诊断与术后病理结果及随访资料进行对照分析。
结 果
1.ISSVA命名
91例中仅2例按照ISSVA标准进行命名,即诊断为肝脏血管瘤(先天性血管瘤或婴儿性血管瘤),87例均命名为肝脏血管内皮瘤、肝脏海绵状血管瘤、肝脏毛细血管瘤,2例诊断不明确。
2.影像学检查方法
本组91例中仅行CT检查25例,仅MRI检查5例,仅US检查12例,CT+MRI检查1例,CT+US检查42例,MRI+US检查3例,MRI+CT+US3例。
3.影像学表现
91例中肝内孤立性单发肿瘤57例,男30例,女27例,其中位于肝左叶27例、肝右叶37例、3例同时累及左右叶。US典型表现为边界清楚、血供丰富的不均匀回声的团块,消退期可见包膜下粗粒钙化影;CT典型表现为为孤立性实质性肿块,边界清晰,平扫时呈等、低密度,增强后呈向心性强化;MRI表现为境界清楚、信号欠均匀的肝内肿块,T1WI上呈低信号,T2WI上以高信号为主,增强后呈向心性强化(图1~3)。
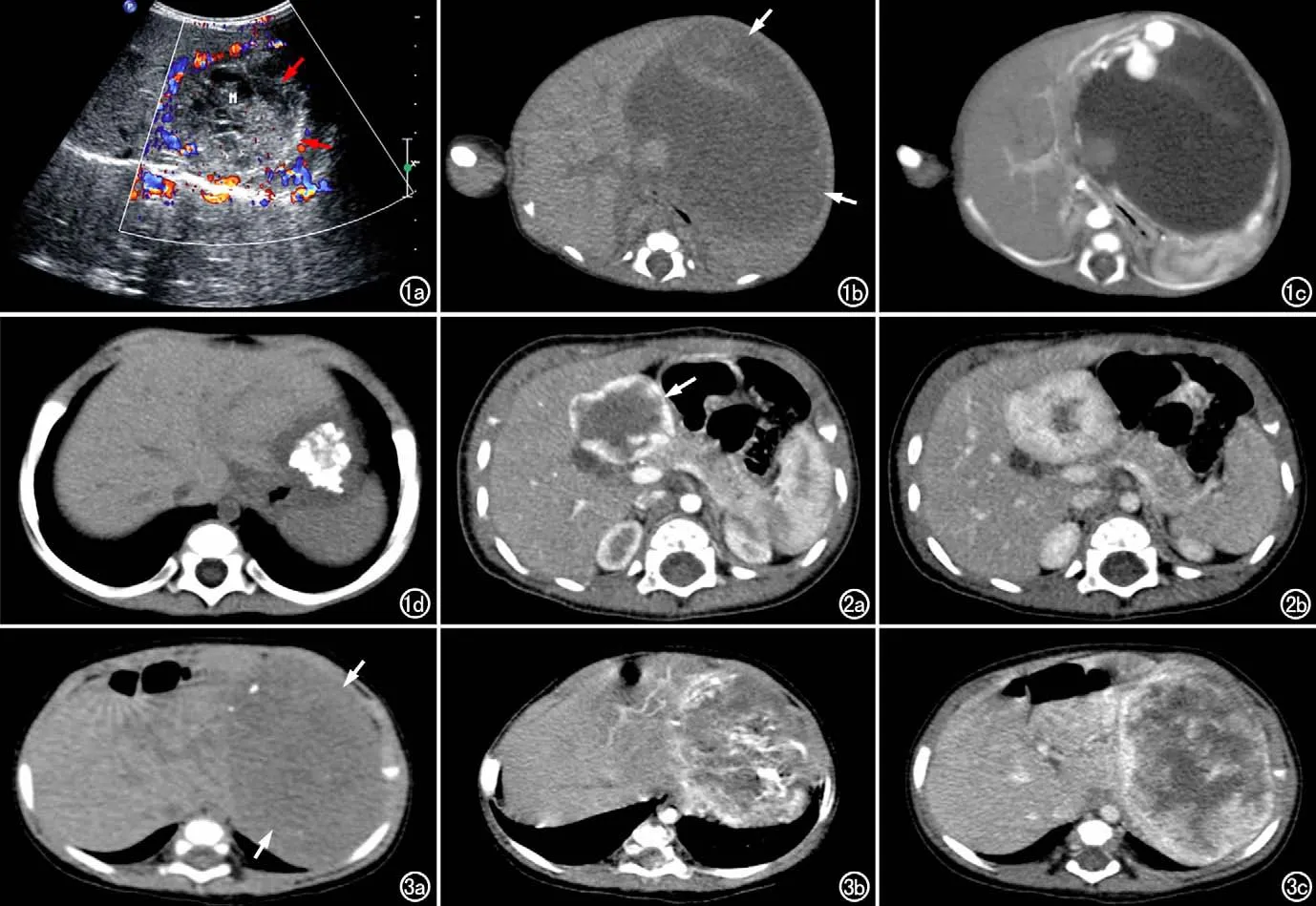
图1 患儿,男,2岁。a)US示肝左叶内可见不均匀回声团(箭),边界尚清,病灶中央未见明显血流信号,周边血流信号较丰富;b)CT平扫示肝左叶内较大不均匀低密度灶(箭),周边局部可见等密度结节突向病灶内;c)CT增强示肿瘤表现为自周边向内部逐渐明显强化,中心强化不明显,周边假包膜及肿瘤内部可见较多粗大扭曲明显强化的血管;d)经强的松治疗一年后复查CT,显示病灶明显缩小,病灶中央可见较多钙化。 图2 男,1岁,肝左叶先天性血管瘤。a)CT增强动脉早期示肝左叶内类圆形病灶边缘强化较明显(箭),边界尚清;b)CT增强延迟期示病灶呈明显向心性强化。 图3 患儿,女,1岁,肝左叶先天性血管瘤。a)CT平扫示肝左叶巨大稍低密度占位(箭),其内多发条片状散在性钙化密度;b)CT增强动脉期示病灶呈不均匀强化,其内可见较多粗大血管影;c)CT增强延迟期示病灶边缘强化较明显,肿瘤内部逐渐强化。
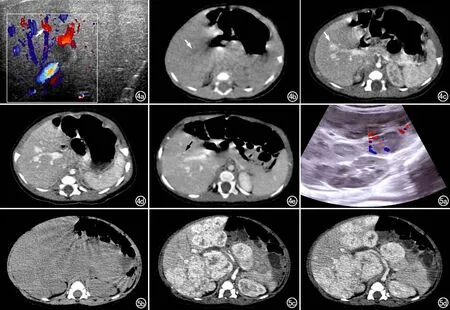
图4 男,1岁。a)彩超示肝内有散在数个圆形不均匀低回声团,似有包膜,边界清晰,内部可见血流信号(箭);b)CT平扫示肝内有数个稍低密度灶(箭),边界不清;c)CT增强动脉期示病灶呈显著强化(箭);d)CT增强延迟期示肿瘤呈持续强化;e)8个月后复查CT增强扫描示病灶消失(箭)。 图5 女,4个月。a)US检查示肝内弥漫性分布大量低回声团,部分病灶内回声欠均匀,形态不规则,周围似可见环形血流信号;b)CT平扫示肝内弥漫性不规则低密度灶;c)增强动脉期示后肝内低密度病灶由周边向内逐渐强化:d)延迟期示部分病灶内可见对比剂完全填充,病灶间可见少量正常肝实质。
肝内多发性肿瘤共21例,肿瘤间尚可见到正常的肝实质。其中男12例,女9例。CT表现为多发等、低密度肿块,增强后呈向心性强化;MRI显示肝内多发肿块,T1WI上呈低信号、T2WI上呈高信号,增强后呈边缘强化;US显示肝内多发大小相似或者大小不一的低回声结节,边界清晰,回声较均匀,大结节内可见肝血管的异常分支迂曲穿行(图4)。
肝内弥漫性肿瘤共13例,肿瘤占据几乎全部肝实质,无明显或只有极少量正常肝脏组织,肝脏明显肿大(图5)。CT、MRI及US表现与肝内多发性肿瘤相似。
91例中4例合并有Kasabach-Merritt综合征,临床表现为血小板下降、凝血指标异常。其中3例表现为肝内单发巨大肿瘤,1例为弥漫性肿瘤。
本组病例中CT独立诊断的符合率为90%,MRI为83%,US为92%。
4.手术结果或随访结果
91例中3例有手术及病理结果,其中2例病理结果均显示为肝脏先天性血管瘤,1例为非脉管性肿瘤;随访病例共48例(表1);失随访40例。孤立性单发肿瘤中随访36例(包含3例胎儿期有MRI检查资料的患儿),其中肿瘤明显缩小16例(随访时间为5个月~5年不等);稍缩小4例(其中1例随访仅1个月,2例随访4个月,1例随访2年),变化不明显7例(最短仅随访1个月,1例为随访2年),增大3例(其中1例在孕37+4周时发现肝右叶占位,新生儿期复查显示肿瘤较前有增大;另2例分别随访6和20个月),完全消失6例。多发肿瘤中8例有随访记录,其中病灶较前缩小7例,完全消失1例。弥漫性肿瘤中4例进行了随访,其中肿瘤较前明显好转3例,较前进展1例。
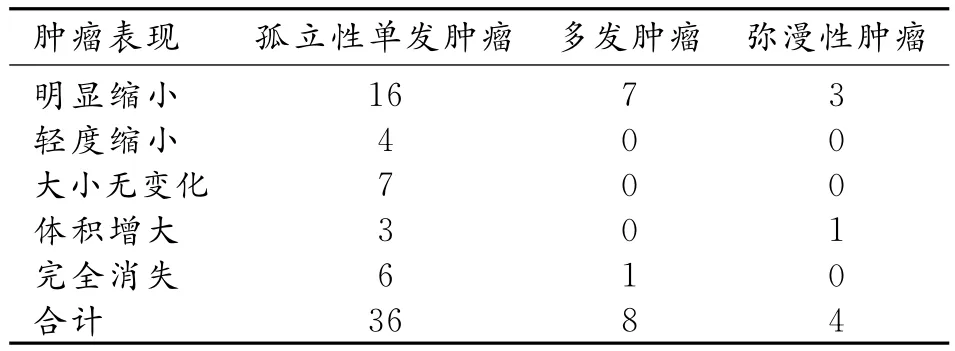
表1 48例肝脏脉管性病变随访结果 (例)
讨 论
1.ISSVA脉管性病变分类标准
1996年国际脉管性病变研究协会(ISSVA)提出了最基本的脉管性病变分类方法[1],共分为两大类:脉管性肿瘤和脉管畸形,其临床表现、影像和病理特征、生物学特性及治疗方法完全不同。脉管性肿瘤中以婴儿型血管瘤最常见,它属于良性血管内皮增生,出生时不存在,大部分在生后4~6个月时出现,婴儿期迅速增大,儿童期逐渐消退;其次为先天性血管瘤,其出在新生儿出生时即存在,它又包括快速消退型(rapidly involuting congenital hemangioma,RICH)和永不消退型(noninvoluting congenital hemangioma,NICH)两个亚型,前者约在生后1~2年消退,后者不消退[3]。脉管畸形基于血流动力学及有无异常血管腔又分为慢血流型和快血流型二个亚型:慢血流型主要有毛细血管畸形、静脉畸形和淋巴管畸形,快血流型主要有动脉畸形、动静脉瘘和动静脉畸形,混合畸形既包括快血流型又包括慢血流型病变。
肝脏脉管性病变应该根据ISSVA命名和分类标准(脉管性肿瘤和脉管性畸形)进行诊断,脉管性肿瘤是最常见的儿童肝脏脉管性病变[4]。有文献报道,大部分儿童肝脏脉管性肿瘤为先天性血管瘤,也可为婴儿性血管瘤,成人的肝脏脉管性病变大多为脉管畸形,以静脉畸形多见;但是目前大部分影像科及临床医生称肝脏先天性或婴儿性血管瘤为肝脏血管内皮瘤[5]。在本组91例患儿的临床诊断中,98%(2/91)都被诊断为肝脏血管内皮瘤、肝脏海绵状血管瘤和肝脏毛细血管瘤。
2.肝脏脉管性病变的影像特征
儿童肝脏脉管性病变以脉管性肿瘤为多见。儿童的肝脏脉管性肿瘤在影像上表现为3种类型:单发肿瘤、多发性肿瘤和弥漫性肿瘤,单发与多发性、弥漫性在生物学及临床上是有区别的,孤立性脉管性肿瘤大部分为快速消退型先天性血管瘤,大多为胎内生长,出生后即发现,所以在胎儿期即可诊断;而多发性和弥漫性脉管肿瘤多为婴儿型血管瘤,在生后几个月后才出现,常伴有皮肤血管瘤[6-7]。
肝脏脉管性病变的CT和MRI表现相似,均表现为动脉期强化,呈“快进慢出”的特点;US显示肝内实质性肿瘤、血供丰富。单发肿瘤的表现较典型;多发肿瘤,在病灶之间可见正常肝组织;弥漫性肿瘤表现为肿瘤弥漫分布,瘤灶间无或仅有极少量正常肝组织。
根据肝脏脉管性病变的影像特征,本组病例中CT独立诊断的符合率为90%,MRI为83%,US为92%。MRI的独立诊断准确性低于CT,笔者分析主要原因为扫描时间相对较长、患者镇静效果不佳等。
3.肝脏脉管性病变的影像诊断价值
大多数肝脏脉管性肿瘤患者无明显的临床症状[8-10],影像学检查是诊断肝脏脉管性病变的主要方法。正确的影像学评估能为肝脏脉管性病变的治疗提供重要帮助。US检查以其费用较低、操作方便及无辐射的优势,常作为首选检查方法;而CT和MRI能更为直观地显示病变范围及是否累及邻近解剖结构,且不易遗漏较小的病灶。本组研究中,CT和US为主要的影像检查方法,尤其是行CT检查的患儿较多。虽然CT检查有电离辐射的缺点,且其软组织对比度不及MRI,但是CT扫描速度快、对患儿的镇静要求低、图像解读方便,因此更为临床医师所接受。但是随着对软组织及肝脏脉管性病变的认识进一步加深,根据ISSVA的推荐,超声和MRI将成为软组织及肝脏脉管性病变的主要影像学诊断方法。
4.肝脉管性病变伴发症状
肝脏脉管性病变可以伴发Kasabach-Merritt综合征、肝脏衰竭、消耗性甲状腺功能减退及心功能衰竭等。本组91例中4例合并有Kasabach-Merritt综合征,临床表现为血小板下降、凝血指标异常。4例中表现为肝内巨大单发肿瘤3例,弥漫性肿瘤1例。
弥漫性脉管性肿瘤由于正常肝脏组织受损,严重时可以引起肝脏衰竭及消耗性甲状腺功能减退[6,13];有学者认为,血管瘤组织中含有3型碘化甲腺氨酸脱碘酶,会消耗甲状腺素,因而可继发显著的甲状腺功能减退,部分患儿需要补充大量甲状腺素以保持正常的甲状腺功能[7]。本组91例患儿均未进行甲状腺素的检测。此外,部分肝脏脉管性肿瘤由于动静脉分流可能继发高输出量的心力衰竭[6,11-13]。
5.肝脏脉管性病变的治疗
大多数儿童肝脏脉管性肿瘤因为无明显的临床症状而未被发现[5],部分患儿系在常规产前检查时、或者在产后因其它原因行影像检查时被偶然发现[6]。
对于孤立性单发肿瘤临床上主张随访观察,而对于多发和弥漫性病变目前主张以药物治疗(激素、干扰素或心得安)为主[11],如药物治疗无效,临床上患儿出现因大分流而导致心力衰竭,则可进行介入治疗;一般不主张手术切除或肝移植。对合并有甲状腺功能减低的患儿可进行替代治疗。多发及弥漫性病变的患儿需要检测血清促甲状腺激素(thyroid stimulating hormone,TSH)的水平。
本研究存在一定的不足之处:首先,本组研究属于回顾性研究,存在一定的选择偏移;其次,失随访40例,其结果无法评判,导致有效病例数减少;其三,对于肝脏多发和弥漫性脉管性病变的患儿,未进行临床细致观察,没有进行甲状腺素的测定,无法判断肝脏脉管性病变是否合并甲状腺功能降低。
[1] Ernemann U,Kramer U,Miller S,et al.Current concepts in the classification,diagnosis and treatment of vascular anomalies[J].Eur J Radiol,2010,75(1):2-11.
[2] 施美华,钟玉敏,殷敏智,等.儿童软组织脉管性病变的影像诊断[J].放射学实践,2013,28(7):724-729.
[3] Gorincour G,Kokta V,Rypens F,et al.Imaging characteristics of two subtypes of congenital hemangiomas:rapidly involuting congenital hemangiomas and non-involuting congenital hemangiomas[J].Pediatr Radiol,2005,35(12):1178-1185.
[4] Meyers RL.Tumors of the liver in children[J].Surg Oncol,2007,16(3):195-203.
[5] Christison-Lagay ER,Burrows PE,Alomari A,et al.Hepatic hemangiomas:subtype classification and development of a clinical practice algorithm and registry[J].J Pediatr Surg,2007,42(1):62-67.
[6] Kulungowski AM,Alomari AI,Chawla A,et al.Lessons from a liver hemangioma registry:subtype classification[J].J Pediatr Surg,2012,47(1):165-170.
[7] Lee KC,Bercovitch L.Update on infantile hemangiomas[J].Semin Perinatol,2013,37(1):49-58.
[8] 单明,孙博,卢再鸣,等.单发婴儿型肝脏血管内皮细胞瘤的CT与MRI表现[J].中国医学影像技术,2013,29(8):1331-1335.
[9] Zhang Z,Chen HJ,Yang WJ,et al.Infatile hepatic hemangioendothelioma:a clinicopathologic study in a Chinese population[J].World J Gastroenterol,2010,16(36):4549-4557.
[10] Buscarini E,Danesino C,Olivieri C,et al.Doppler ultrasonographic grading of hepatic vascular malformations in hereditary hemorrhagic telangiectasia:results of extensive screening[J].Ultraschall Med,2004,25(5):348-355.
[11] Burrows PE,Dubois J,Kassarjian A.Pediatric hepatic vascular anomalies[J].Pediatr Radiol,2001,31(8):533-545.
[12] Kassarjian A,Zurakowski D,Dubois J,et al.Infantile hepatic hemangiomas:clinical and imaging findings and their correlation with therapy[J].AJR,2004,182(3):785-795.
[13] Huang SA,Tu HM,Harney JW,et al.Severe hypothyroidism caused by type 3 iodothyronine deiodinase in infantile hemangiomas[J].New Engl J Med,2000,343(3):185-189.
Imaging diagnosis of hepatic vascular lesions in children
SHI Mei-hua,ZHONG Yu-min,YIN Min-zhi,et al.Department of Radiology,Shanghai Children′s Medical center,Medical College of Shanghai Jiaotong University,Shanghai 200127,P.R.China
Objective:To study the imaging features,pathological findings and follow-up data of hepatic vascular lesions,to review the classification of vascular lesions of the International Society for the Study of Vascular Anomalies(ISSVA),and to further emphasize the significance of nomenclature and imaging diagnosis for hepatic vascular anomalies.Methods:Between January 2006 and December 2014,the clinical data of 91 children with hepatic vascular anomalies proved by surgery(n=3)or follow-up(n=48)in Shanghai Children's Medical Center were collected.Of the 91 cases,the imaging features(ultrasound,CT,MRI),pathological findings and follow-up data of vascular lesions were correlated and compared.Results:Of 91 cases,89 cases had no correct nomenclature by imaging methods;57 cases with solitary single tumor,21 cases with multiple tumors and 13 cases with diffuse tumors were diagnosed by US,CT and MRI.The imaging characteristics including intensive enhancement in arterial phase and persistant enhancement in venous phase which were called as"fast wash-in and slow wash-out"were noted.Four cases were associated with Kasabach-Merritt syndrome.Conclusion:The classification and nomenclature of ISSVA for hepatic vascular anomalies should be used as diagnostic standard in clinical practice;US,CT and MRI are very important imaging modalities for diagnosis of hepatic vascular anomalies in children.
Liver;Vascular lesions;Ultrasound;Tomography,X-ray computed;Magnetic resonance imaging;Children;Diagnosis
R814.42;R445.2;R735.7
A
1000-0313(2015)12-1154-05
10.13609/j.cnki.1000-0313.2015.12.001
2015-11-13
2015-12-04)
200127 上海,上海交通大学医学院附属上海儿童医学中心放射科
施美华(1978-),女,上海人,主治医师,主要从事脉管性病变的影像学研究工作。
钟玉敏,E-mail:zyumin2002@163.com