水稻小G蛋白OsRab5b的亚细胞定位研究
2015-07-12邵军丽龙跃生徐增富
邵军丽 龙跃生 徐增富
(1.广东医学院公共卫生学院,东莞 523808;2.中山大学基因工程教育部重点实验室 有害生物控制与资源利用国家重点实验室,广州 510275;3.广州医科大学附属第二医院神经科学研究所,广州 510260;4.中国科学院西双版纳热带植物园热带植物资源可持续利用重点实验室,昆明 650223)
小GTP结合蛋白(20-25 kD),简称小G蛋白,是一个很大的蛋白超家族,存在于所有的真核生物中,其功能依赖GTP的水解,是信号转导的分子开关[1]。Rab蛋白是小G蛋白超家族中最大的一个家族,是3个(Ras、Rho和Rab)在羧基端存在翻译后脂类修饰的小G蛋白家族之一,参与调节细胞内各个细胞器及内膜系统的运输[1]。Rab蛋白的羧基端包含两个半胱氨酸的高变区,翻译后的脂类修饰发生在高变区末端的半胱氨酸上。这种脂类修饰是蛋白与膜结合必不可少的[2],在酵母及动物中没有发现例外。有意思的是,在植物中除了在羧基端进行脂类修饰的Rab5,即传统的Rab5(植物中称作Rab5a)外,还发现了植物特异的Rab5b类,如冰叶日中花(Mesembryanthemum crystallinum)的McRab5b(m-Rab(mc))[3],拟南芥(Arabidopsis thaliana)的Ara6/AtRabF1[4],轮藻(Chara australis)中的CaARA6(CaRABF1)[5]等。这类植物特异性的Rab5b羧基端缺少24-33个包括两个半胱氨酸的高变区序列。取而代之的是N端比传统的Rab5a多出13-26个保守的氨基酸序列。其中拟南芥的Ara6第二位甘氨酸在体外翻译修饰实验中可以豆蔻酰化,并在一定程度上影响Ara6细胞定位[6]。但其它植物中Rab5b第二位甘氨酸的作用还没有研究。
水稻小G蛋白OsRab5b基因由林慧贤等[7]克隆和鉴定,它与冰叶日中花的McRab5b(GenBank AJ 006225)和百脉根的LiRab5b(GenBank Z73939)cDNA 核苷酸序列相似程度分别为74% 和76 %。在大肠杆菌中表达的GST-OsRab5b具有GTP结合活性[8]。本实验研究OsRab5b在烟草BY-2细胞中的定位及OsRab5b第二位甘氨酸在其亚细胞定位中的作用,旨在为深入研究OsRab5b的功能提供参考。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株和细胞 OsRab5b原核表达质粒、GFP植物表达质粒pYS22由本实验室保存,OsRab5b-GFP与OsRab5b(Gly2Ala)-GFP(将第二位甘氨酸突变为丙氨酸)植物表达质粒为本实验构建。农杆菌EHA105为本实验室保存。烟草BY-2(Bright Yellow-2)细胞由香港中文大学姜里文教授惠赠。
1.1.2 试剂与培养基 乙酰丁香酮:少量DMSO(二甲基亚砜)溶解后,再用蒸馏水定容配成100 mmol/L母液;wortmannin:Sigma 19545-26-7;DMSO配成1 mmol/L贮存液;BFA:Sigma-Aldrich;B-6542;DMSO配成2.5 mg/mL贮存液;FM4-64:Molecular probe(T316),用氯仿配成12 mmol/L贮存液;固定液:50 mmol/L 磷酸钠缓冲液 pH7.0,5 mmol/L EGTA,0.02% Azide,4.5%多聚甲醛;磷酸钠-EGTA缓冲液:50 mmol/L磷酸钠缓冲液pH7.0,5 mmol/L EGTA,0.02% Azide;封闭缓冲液 1(B1):1×PBS,1%BSA;封闭缓冲液2(B2):1×PBS,0.25% BSA,0.25%Gelatin,0.05% NP-40,0.02% Azide。VSRAt-1抗体由香港中文大学姜里文教授惠赠。农杆菌EHA105培养基为YEB。BY-2细胞培养基为植物组织培养常规培养基MS。
1.2 方法
1.2.1 OsRab5b蛋白序列分析 利用软件Clustal X 1.83进行多重蛋白序列比对。进化树分析采用软件MEGA 4.0[9](http://www.megasoftware.net/)。选用N-J(Neighbor-Joining)法,bootstrap 值通过10 000次的重复确定。蛋白序列比对用到的Rab5同源蛋白基因的GenBank序列号依次是:OsRab5b(AF323991),LjRab5b(Z73939),McRab5b(AJ006225),Ara6(NM_115341),NtRab5(X63875),LjRab5a(Z73938),Rha1(X59152),OsRab5a(AY029301),HsRab5a(M28215),YeastYpt51(P36017)。
1.2.2 载体构建及农杆菌转化 以OsRab5b原核表达质粒为模板,扩增野生型的OsRab5b读码框和突变型的OsRab5b(Gly2Ala)读码框,所用引物如下:
OsRab5b:上游引物(XhoI)5'-TAATTCATGGGTTGCT-3',下游引物(KpnI)5'-TAAGACGCCGTTGGCCTG-3'。
OsRab5b(Gly2Ala):上游引物(XhoI):5'-TA-AATTCATGGCTTGCT-3',下游引物(KpnI):5'-TAAGACGCCGTTGGCCTG-3'。
PCR反应程序:94℃5 min;94℃30 s,53℃40 s,72℃50 s,共30个循环;72℃10 min。回收扩增产物。XhoI 和KpnI酶切扩增产物和GFP植物表达载体pYS22(含CaMV35S 启动子),回收酶切后的扩增产物和线性载体。将酶切扩增产物与线性载体连接,得到OsRab5b-GFP与OsRab5b(Gly2Ala)-GFP质粒(图1)。转化大肠杆菌,提取质粒经测序、酶切鉴定。经鉴定成功的质粒用于转化农杆菌,方法为电击转化法。电击仪(Eppendorf公司生产的2510型)电击参数为电压1 800 V,持续5 ms。电击结束后,加入YEB 液体培养基至电击杯中,于28℃、100 r/min 培养4 h。取50 μL 菌液涂布含利福平(50 mg/L)和壮观霉素(100 mg/L)的 YEB 固体平板上培养36 h。挑取菌落用YEB液体培养,提取质粒,酶切鉴定,鉴定成功的转化菌株用于BY-2细胞的转化。
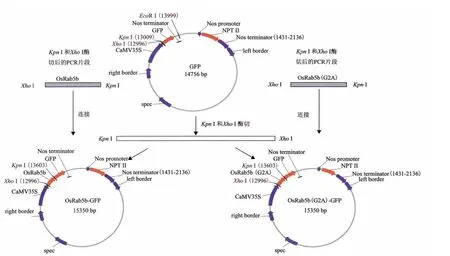
图1 OsRab5b-GFP与OsRab5b(Gly2Ala)-GFP质粒构建示意图
1.2.3 BY-2细胞的转化、wortmannin和BFA处理、免疫荧光标记、FM4-64的摄取实验 均参照相关文献[10,11]进行,简述如下。
BY-2细胞的转化:按1∶10继代BY-2细胞,第3天,向培养皿加入4 mL BY-2悬浮细胞、4 mL MS培养基及乙酰丁香酮(终浓度50-100 μmol/L),反复吸打20次。加入100 μL OD=0.6左右的农杆菌,混匀,包上封口膜,28℃黑暗培养3 d后,将细胞转入50 mL离心管。在50 mL 离心管中用40 mL MS液体培养基洗细胞,上下颠倒,自然沉降,弃上清,重复3-5次。1 mL MS液体培养基重悬BY-2细胞,涂于MS固体培养基(卡那霉素100 μg/mL,羧苄青霉素250 μg/mL),吸出所有液体。包上封口膜,28℃黑暗培养3-5周,即可见阳性克隆长出。
Wortmannin和BFA处理:取0.5 mL BY-2悬浮细胞于1.5 mL 离心管中,自然沉降,弃上清,加入新鲜MS液体培养基0.5 mL,根据实验需要加入相应体积的wortmannin或BFA贮存液。避光放置1 h,取样放于载玻片上,共聚焦扫描显微镜下观察拍照。
BY-2细胞的免疫荧光标记:取1 mL 的细胞沉淀装入15 mL 离心管中,加10 mL 固定液,混匀,常温过夜。用磷酸钠-EGTA洗细胞,室温1 h 或4℃过夜。用磷酸钠缓冲液配制的1%-3%细胞溶解纤维素酶(cellulysin cellulase)孵育细胞,室温20-30 min。磷酸钠-EGTA洗2次。加200-500 μL 0.5%Triton X-100孵育细胞,室温2 min。B1洗细胞2次。B1封闭细胞,室温30 min。离心弃去B1。加B2,按1∶50 或 1∶100 稀释加入多克隆抗血清或4 μg/mL亲和纯化的一抗,4℃过夜。B2洗细胞3次,依次10、10和30 min。离心弃去B2,加新鲜B2,1∶100稀释加入荧光标记的二抗,室温放置 1 h。B2洗细胞3次,依次15、15和20 min。免疫荧光标记完毕,取样放于载玻片上,共聚焦显微镜下观察拍照。
BY-2细胞的FM4-64摄取:取0.5 mL BY-2悬浮细胞于1.5 mL离心管,自然沉降,弃上清,加入新鲜MS液体培养基500 μL,加入1 μL FM4-64(母液:12 mmol/L)混匀,冰上避光放置5 min。MS液体培养基洗2次(冰上)。洗完放于室温,开始计时,15、30和60 min取样放于载玻片上,共聚焦扫描显微镜下观察拍照。
2 结果
2.1 OsRab5b是一种植物特异性小GTP结合蛋白
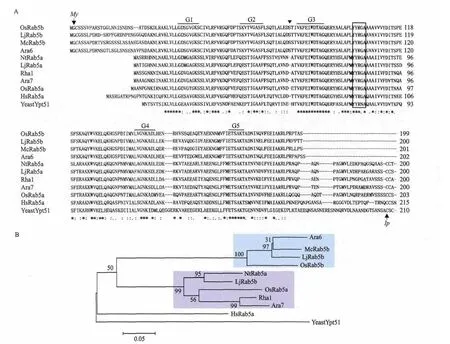
图2 OsRab5b和其它物种同源蛋白序列比对分析(A)及系统进化分析(B)
将OsRab5b与植物、人及酵母中的同源蛋白序列进行比对分析,结果(图2-A)表明,Rab5b与Rab5a家族的成员有较高的相似性,两类Rab5都具有在GTP结合蛋白家族中非常保守的5个结构域,即G1-G5。OsRab5b与其它植物特异性的Rab5b一样,也缺少羧基端的一段不保守的含半胱氨酸的高变区序列,而氨基端多出一段氨基酸序列。采用程序WolfPSORT(http://wolfpsort.seq.cbrc.jp/)预测时,氨基端第二个甘氨酸会被豆蔻酰化。蛋白序列系统进化分析(图2-B)也表明,植物中存在两类Rab5,即Rab5a类和Rab5b类,OsRab5b属于植物特异性的Rab5b。
2.2 Wortmannin和BFA对OsRab5b-GFP及其突变(Gly2Ala)蛋白分布的影响
为了研究OsRab5b在细胞中的定位及第二位甘氨酸在定位中的作用,分别构建了OsRab5b、OsRab5b(Gly2Ala)与报告基因GFP融合的植物表达质粒(图1),并转化到农杆菌EHA105。利用农杆菌介导法将2个GFP融合载体转化到烟草BY-2细胞,通过共聚焦显微镜筛选得到GFP阳性克隆。OsRab5b-GFP转基因细胞的GFP大部分呈点状分布,少部分在细胞质弥散分布。OsRab5b(Gly2Ala)-GFP转基因细胞的GFP全部弥散分布于细胞核和细胞质内(图3)。Wortmannin 处理使OsRab5b-GFP 标记的细胞器膨胀成小的环状结构;BFA 在100 μg/mL时使OsRab5b-GFP标记的细胞器聚集,但在 10 μg/mL时没有引起OsRb5b-GFP标记的细胞器形态发生变化(图3-A)。据此可以初步判断OsRab5b-GFP 标记的细胞器是前液泡区(prevacuolar compartment)。Wortmannin和 BFA处理没有引起OsRab5b(Gly2Ala)-GFP信号的任何变化(图3-B)。
2.3 OsRab5b与前液泡区标记物VSRAt-1的共定位
为了进一步确证OsRab5b-GFP 定位于前液泡区,本研究选用拟南芥液泡分选受体VSRAt-1作为前液泡区标记物对OsRab5b-GFP转基因细胞进行了免疫荧光标记。如图4所示,在没有药物(图4-A)及有药物处理(图4-B,4-C,4-D)时,OsRab5b-GFP标记的细胞结构都有一部分被VSRAt-1抗体染色。
2.4 OsRab5b与内吞示踪染料FM4-64的共定位
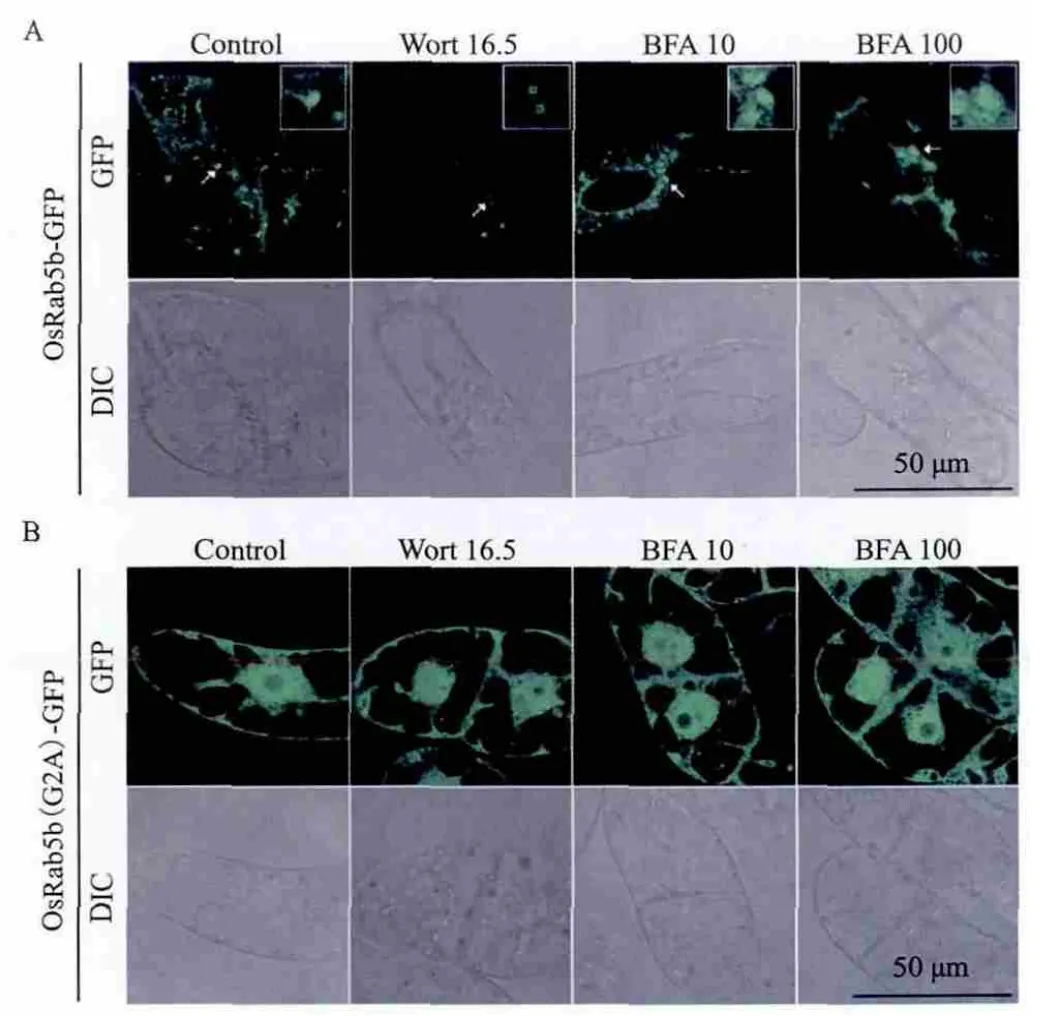
图3 OsRab5b-GFP(A)和OsRab5b(Gly2Ala)-GFP(B)转基因细胞对药物wortmannin和BFA的反应
OsRab5b定位于内吞途径的前液泡区(晚期内吞体),所以OsRab5b应该和内吞示踪染料FM4-64有共定位。为了验证这个假设,本研究进行了转基因BY-2细胞的FM4-64摄取实验。如图5所示,在转基因细胞摄取FM4-64的60 min,而不是较早的15 min和30 min时,OsRab5b-GFP标记的结构大部分被FM4-64标记。
3 讨论
Wortmannin 可以使前液泡区(晚期内吞体)膨胀形成小的空泡(small vacuoles),荧光图上表现为小的环状结构,但不会影响高尔基体[11,12]。BFA低浓度时(5-10 μg/mL)使高尔基体形成聚集,不影响前液泡区形态。但是,BFA 高浓度时(50-100 μg/mL)既可以使高尔基体也可以使前液泡区形成聚集[10]。根据本研究药物处理的结果,可以推断OsRab5b-GFP 定位于前液泡区。拟南芥液泡分选受体VSRAt-1主要定位于烟草BY-2细胞的前液泡区[11],本研究将VSRAt-1作为前液泡区的标记物,对OsRab5b-GFP转基因细胞进行了VSRAt-1抗体免疫荧光标记,结果表明OsRab5b有一部分和VSRAt-1共定位于前液泡区。FM4-64是一种苯乙烯基荧光染料,可通过内吞进入细胞,常被用作内吞示踪染料[13,14]。OsRab5b-GFP转基因细胞的FM4-64摄取实验表明OsRab5b主要定位于晚期内吞体,即前液泡区[11,15]。综合上述3个亚细胞定位实验,可以判定OsRab5b定位于前液泡区。
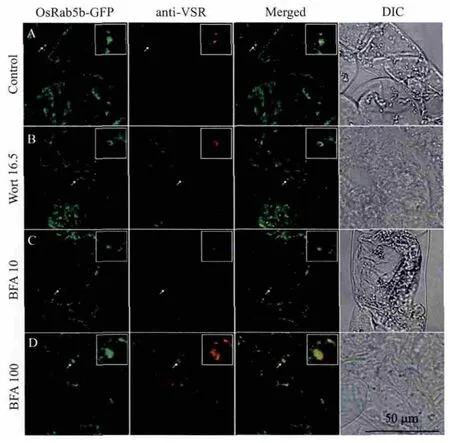
图4 OsRab5b-GFP和前液泡区标记物VSRAt-1的共定位
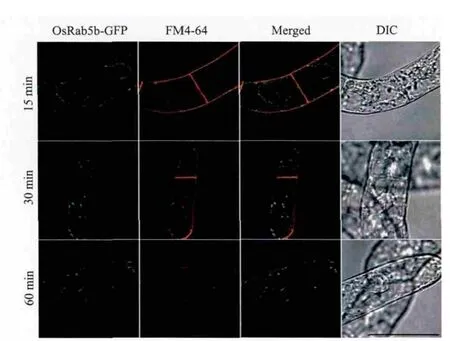
图5 OsRab5b-GFP定位于FM4-64标记的内吞途径上的晚期内吞体(即前液泡区)
在冰叶日中花中,McRab5b除了大部分定位于BP-80和AtPEP12p标记的前液泡区,还与JIM84和ST标记的高尔基体结构有一定程度的联系[3]。同样,轮藻CaARA6既有内吞体定位,也有高尔基体定位[5]。那么被OsRab5b-GFP标记而没有被VSRAt-1标记的结构也有可能是高尔基体结构。前液泡区,也叫晚期内吞体,是内吞途径的细胞器,而高尔基体是分泌途径的细胞器。一种蛋白可以既定位于分泌途径又定位于内吞途径,并不矛盾。因为已经有很多证据表明内吞途径和分泌途径可以在高尔基体[16]、早期内吞体[15]和前液泡区(晚期内吞体)汇合[17]。这就提示,OsRab5b可能在内吞途径和分泌途径都发挥功能,这可作为下一步研究的方向。还有一部分OsRab5b-GFP信号弥散于细胞质中,这与Rab5在膜与细胞质两个区域循环[18]一致。
OsRab5b(Gly2Ala)-GFP弥散分布于细胞核和细胞质内,而且wortmannin和BFA处理没有引起OsRab5b(Gly2Ala)-GFP信号的任何变化,所以可以推测第二位甘氨酸具有引导OsRab5b正确定位的功能。
从转基因细胞的激光共聚焦显微镜图片上看,一个非常有趣的现象是OsRab5b(Gly2Ala)-GFP表达量远高于OsRab5b-GFP,这在植物中还未见报道。这可能是因为OsRab5b(Gly2Ala)-GFP定位错误,功能丧失,导致降解调节机制失灵,最后造成了OsRab5b(Gly2Ala)蛋白的大量积累。在动物细胞中也存在类似的现象。Rab5、Rab7羧基端的异戊烯化被药物洛伐他汀(lovastatin)抑制后,其蛋白量增加4倍之多[19]。因此,对这一现象的分子机制进行深入研究具有重要意义。
4 结论
水稻小G蛋白OsRab5b属于植物特异性的Rab5b类。3个定位实验都表明OsRab5b定位在BY-2细胞的前液泡区,即晚期内吞体,可能在内吞及分泌过程中发挥功能。突变体OsRab5b(Gly2Ala)弥散分布于细胞核和细胞质内,所以OsRab5b的第二位甘氨酸在该蛋白的正确定位中具有重要作用。
致谢:本研究得到了香港中文大学姜里文教授和缪严松博士的大力帮助,在此表示衷心的感谢。
[1] Aloisi AL, Bucci C. Rab GTPases-cargo direct interactions:fine modulators of intracellular trafficking[J] . Histol Histopathol,2013, 28(7):839-849.
[2] Khan AR, Menetrey J. Structural biology of Arf and Rab GTPases’effector recruitment and specificity[J] . Structure, 2013, 21(8):1284-1297.
[3] Bolte S, Brown S, Satiat-Jeunemaitre B. The N-myristoylated Rab-GTPase m-Rabmc is involved in post-Golgi trafficking events to the lytic vacuole in plant cells[J] . J Cell Sci, 2004, 117(6):943-954.
[4] Ebine K, Miyakawa N, Fujimoto M, et al. Endosomal trafficking pathway regulated by ARA6, a RAB5 GTPase unique to plants[J] .Small GTPases, 2012, 3(1):23-27.
[5] Hoepflinger MC, Geretschlaeger A, Sommer A, et al. Molecular and biochemical analysis of the first ARA6 homologue, a RAB5 GTPase,from green algae[J] . J Exp Bot, 2013, 64(18):5553-5568.
[6] Ueda T, Yamaguchi M, Uchimiya H, et al. Ara6, a plant-unique novel type Rab GTPase, functions in the endocytic pathway ofArabidopsis thaliana[J] . Embo J, 2001, 20(17):4730-4741.
[7] 林慧贤, 刘筱斌, 李发强, 等. 水稻小GTP蛋白基因Osrab5B基因的克隆和鉴定[J] . 高技术通讯, 2001(3):9-14.
[8] 林慧贤, 刘筱斌, 梁承邺, 等. 水稻rab5B基因在大肠杆菌中的表达、纯化和GTP结合分析[J] . 生物化学与生物物理进展,2002(3):434-438.
[9] Tamura K, Dudley J, Nei M, et al. MEGA4:Molecular Evolutionary Genetics Analysis(MEGA)software version 4. 0[J] . Mol Biol Evol, 2007, 24(8):1596-1599.
[10] Tse YC, Lo SW, Hillmer S, et al. Dynamic response of prevacuolar compartments to brefeldin a in plant cells[J] . Plant Physiol,2006, 142(4):1442-1459.
[11] Tse YC, Mo B, Hillmer S, et al. Identification of multivesicular bodies as prevacuolar compartments inNicotiana tabacumBY-2 cells[J] . Plant Cell, 2004, 16(3):672-693.
[12] Wang J, Cai Y, Miao Y, et al. Wortmannin induces homotypic fusion of plant prevacuolar compartments[J] . J Exp Bot, 2009,60(11):3075-3083.
[13] Paudyal R, Jamaluddin A, Warren JP, et al. Trafficking modulator TENin1 inhibits endocytosis, causes endomembrane protein accumulation at the pre-vacuolar compartment and impairs gravitropic response inArabidopsis thaliana[J] . Biochem J,2014, 460(2):177-185.
[14] Firdessa R, Oelschlaeger TA, Moll H. Identification of multiple cellular uptake pathways of polystyrene nanoparticles and factors affecting the uptake:Relevance for drug delivery systems[J] .Eur J Cell Biol, 2014, 93(8-9):323-337.
[15] Lam SK, Siu CL, Hillmer S, et al. Rice SCAMP1 defines clathrincoated, trans-golgi-located tubular-vesicular structures as an early endosome in tobacco BY-2 cells[J] . Plant Cell, 2007, 19(1):296-319.
[16] Dettmer J, Hong-Hermesdorf A, Stierhof YD, et al. Vacuolar H+-ATPase activity is required for endocytic and secretory trafficking inArabidopsis[J] . Plant Cell, 2006, 18(3):715-730.
[17] Lam SK, Tse YC, Jiang L, et al. Plant prevacuolar compartments and endocytosis[J] . Plant Cell Monoge, 2005, 1:37-61.
[18] Charest PG, Firtel RA. Big roles for small GTPases in the control of directed cell movement[J] . Biochem J, 2007, 401(2):377-390.
[19] Laezza C, Bucci C, Santillo M, et al. Control of Rab5 and Rab7 expression by the isoprenoid pathway[J] . Biochem Biophys Res Commun, 1998, 248(3):469-472.
