新疆加工番茄上南方番茄病毒外壳蛋白基因的克隆与原核表达
2015-07-12崔百明郑银英向本春
张 强,崔百明,郑银英,向本春
(石河子大学 生命科学学院 农业生物技术重点实验室,新疆 石河子 832003)
新疆加工番茄上南方番茄病毒外壳蛋白基因的克隆与原核表达
张 强,崔百明,郑银英,向本春
(石河子大学 生命科学学院 农业生物技术重点实验室,新疆 石河子 832003)
【目的】 克隆南方番茄病毒(STV)的外壳蛋白(CP)基因,构建其原核表达载体并进行诱导表达,为制备检测该病毒的高效价血清提供参考。【方法】 利用一步法RT-PCR从新疆加工番茄上克隆STVCP基因,将其连接到原核表达载体pET-28a(+)上,获得重组质粒pET-28a-STV CP。将重组质粒转化大肠杆菌BL21后用IPTG进行诱导表达。【结果】 成功克隆了STVCP基因,其长度为1 134 bp。构建了原核重组表达质粒pET-28a-STV CP,其在1 mmol/L IPTG诱导下,成功表达出分子质量约47 ku的蛋白。【结论】 成功克隆了STVCP基因,并诱导了pET-28a-STV CP重组蛋白的原核表达。
南方番茄病毒;外壳蛋白基因;原核表达
加工番茄属于普通番茄的一种类型,在新疆有“红色产业”之称。近些年,随着种植面积的逐年加大,加工番茄已成为新疆经济的支柱性产业之一,也是新疆经济增长速度最快的产业之一[1-2]。
加工番茄由于枝繁叶茂、种植密度大、品种抗病能力不一、栽培时间长、连作和重茬地增多等因素,导致其病毒病日趋严重。对加工番茄的病毒病进行调查发现,加工番茄病毒病类型主要有花叶型、蕨叶型、条斑型、巨芽型、卷叶型和黄顶型等。侵染加工番茄的主要病毒有黄瓜花叶病毒(Cucumbermosaicvirus,CMV)、番茄花叶病毒(Tomatomosaicvirus,ToMV)、马铃薯Y病毒(PotatovirusY,PVY)等。在2006-2010年,CMV在新疆北疆加工番茄上的检出率为21.5%~83.2%;2009-2010年,ToMV、PVY在新疆北疆加工番茄上的检出率分别为96.7%和24.8%,这些病毒对加工番茄品质和产量产生了严重的影响,同时也造成了较大的经济损失[3-6]。
南方番茄病毒(Southerntomatovirus,STV)是最近报道的一种植物dsRNA病毒,其基因组全长为3 437 nt,在正义链上存在部分重叠的2个开放阅读框(ORF)。虽然STV基因组结构与整体病毒科(Totiviridae)病毒相同,但是两者在氨基酸序列和二级结构上存在很大差异。利用RNA依赖RNA聚合酶(RdRp)蛋白全序列及保守区进行聚类分析发现,STV与分体病毒科(Partitiviridae)病毒的亲缘关系较整体病毒科病毒更近。因此,STV是一种与整体病毒科病毒和分体病毒科病毒均有亲缘关系的植物病毒[7]。
2011年,新疆加工番茄出现STV感染植株。STV是严格种传病毒,不能通过摩擦接种和嫁接等方式传播,但可通过品种引进、品种培养和良种繁育等过程传播[8]。因此,建立快速、准确的病毒检测方法是STV病害监控和防治的关键。病毒特异性抗血清的制备和应用是目前病毒检测最有效的手段之一[9-11]。因此,本研究克隆了STV 外壳蛋白(Coat protein,CP)基因,构建其原核表达载体,并进行诱导表达,以期为制备该病毒检测所需高效价抗血清提供参考。
1 材料与方法
1.1 材 料
1.1.1 加工番茄样品 于2012-08,自新疆石河子蔬菜花卉研究所随机采集加工番茄,样品编号为S3-13。
1.1.2 菌株与质粒 大肠杆菌(Escherichiacoli)DH5α、BL21及表达载体pET-28a(+),由石河子大学农业生物技术重点实验室319室保存。克隆载体pGEM-T Easy Vector,购于Promega公司。
1.1.3 酶与试剂 限制性内切酶NcoⅠ、BamHⅠ,购自Fermentas公司;TaqDNA Polymer-ase,购自Roche公司;T4 DNA连接酶、PCR产物凝胶回收试剂盒,购自Promega公司;质粒提取试剂盒,购自GENOMED公司;胰蛋白胨、酵母提取物等,购自上海生工生物工程技术服务有限公司;Agarose-Molecular Biology Grade,购自Invitrogen公司。
1.2 方 法
1.2.1 引物的设计与合成 根据GenBank上的STV全序列(GenBank登录号:EF442780)设计引物,上游引物5′-CATGCCATGGCTGGTGTCGGAGGTT-3′(下划线部分为NcoⅠ酶切位点);下游引物5′-CGCGGATCCACCTCTATCCTTGCGTTGGG-3′(下划线部分为BamHⅠ酶切位点)。引物预期扩增片段长度为1 134 bp,由北京六合华大基因科技股份有限公司合成。
1.2.2 总RNA的提取 使用Invitrogen公司TRIZOL Reagent提取加工番茄叶片的总RNA。取适量新鲜叶片于1.5 mL离心管中,加入400 μL TRIZOL,用研磨棒充分研磨,室温放置5 min,加入80 μL氯仿,振荡20 s,静置2~3 min,4 ℃、12 000 r/min离心15 min。取100 μL上清,加入等体积异丙醇,混匀,静置10 min,4 ℃、12 000 r/min离心10 min。弃上清,加入500 μL 体积分数75%的无水乙醇,混匀,4 ℃、12 000 r/min离心5 min,弃上清并收集沉淀,加入20 μL DEPC水,1%琼脂糖凝胶电泳检测后,-70 ℃保存备用。
1.2.3CP基因的克隆 使用Invitrogen公司SuperScript®Ⅲ One-Step RT-PCR System with Platinum®TaqDNA Polymerase进行一步法RT-PCR扩增。反应体系如下:总RNA 1 μL,上下游引物(10 μmol/L)各0.5 μL,5 mmol/L MgSO40.8 μL,2×Reaction Mix 5 μL,SuperScript®Ⅲ RT/PlatinumTaqMix 0.2 μL,用ddH2O补充至10 μL。试验同时设立阴性对照,以ddH2O代替模板进行扩增。反应条件为:55 ℃ 15 min,94 ℃ 3 min;94 ℃ 30 s, 59 ℃ 30 s,68 ℃ 90 s,40个循环;68 ℃ 5 min。PCR产物经1%琼脂糖凝胶电泳和EB染色后在凝胶成像仪上观察结果。使用PCR产物凝胶回收试剂盒回收纯化PCR产物,与pGEM-T Easy Vector载体相连接,构建重组质粒pGEM-T Easy-STV CP并转化DH5α感受态细胞,利用蓝白斑试验筛选阳性克隆,提取质粒,经NcoⅠ和BamHⅠ双酶切鉴定后,送北京六合华大基因科技股份有限公司测序。质粒测序后,将本研究的CP与NCBI上已公布的STV相关序列进行BLAST比对分析。
1.2.4 原核表达载体的构建 用限制性内切酶NcoⅠ和BamHⅠ双酶切阳性重组质粒pGEM-T Easy-STV CP,与经同样双酶切的原核表达载体pET-28a(+)连接,获得重组质粒pET-28a-STV CP,转化DH5α感受态细胞,利用蓝白斑试验筛选阳性克隆,提取质粒,进行NcoⅠ和BamH Ⅰ双酶切鉴定。
1.2.5CP基因的诱导表达 将重组质粒pET-28a-STV CP转化大肠杆菌BL21(DE3),挑取阳性克隆接种于含50 μg/mL卡那霉素的LB液体培养基中,37 ℃过夜活化,1∶100(体积比)稀释到5 mL含卡那霉素的LB液体培养基中,37 ℃、250 r/min培养3 h,加IPTG至终浓度为1 mmol/L,继续培养6 h,分别于2,4,6 h取样并离心收集菌体,加适量的PBS裂解液振荡悬浮,再加等体积5×SDS上样缓冲液,100 ℃煮沸8 min,SDS-PAGE电泳检测CP的表达情况。试验同时设未经IPTG诱导的pET-28a(+)载体、经IPTG诱导的pET-28a(+)载体、未经IPTG诱导的pET-28a-STV CP重组质粒为对照。
2 结果与分析
2.1 STV CP基因的克隆与序列分析
提取的总RNA经电泳检测,出现3条带,其中28S和18S条带较亮,5S条带较弱,但可以用来进行后续试验。一步法RT-PCR产物经1%琼脂糖凝胶电泳,结果显示,样品在1 134 bp处扩增出明显条带(图1),长度与预期扩增结果相符,而去离子水阴性对照没有扩增出相应的片段。
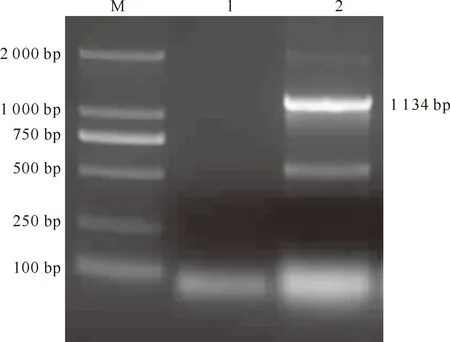
图1 STVCP基因的一步法RT-PCR扩增
M.DNA Marker DL2000;1.阴性对照;2.CP基因一步法RT-PCR扩增产物
Fig.1 One-Step RT-PCR amplification of STVCP
M.DNA Marker DL2000;1.Negative control;2.Product of STVCPgene
将回收后的STVCP与pGEM-T Easy Vector连接,转化筛选获得阳性克隆pGEM-T Easy-STV CP。本研究的CP与NCBI上已公布的STV相关序列分析结果显示,序列同源性均在99%以上。
2.2 STV CP基因表达载体的鉴定
重组质粒pGEM-T Easy-STV CP用NcoⅠ/BamHⅠ双酶切,回收目的片段,定向插入到NcoⅠ/BamHⅠ双酶切的pET-28a(+)中,转化筛选获得重组质粒pET-28a-STV CP。对重组质粒pET-28a-STV CP进行NcoⅠ/BamHⅠ双酶切鉴定,结果酶切出现约1 134 bp的目的片段(图2),表明STVCP基因已连接至pET-28a(+)原核表达载体上。
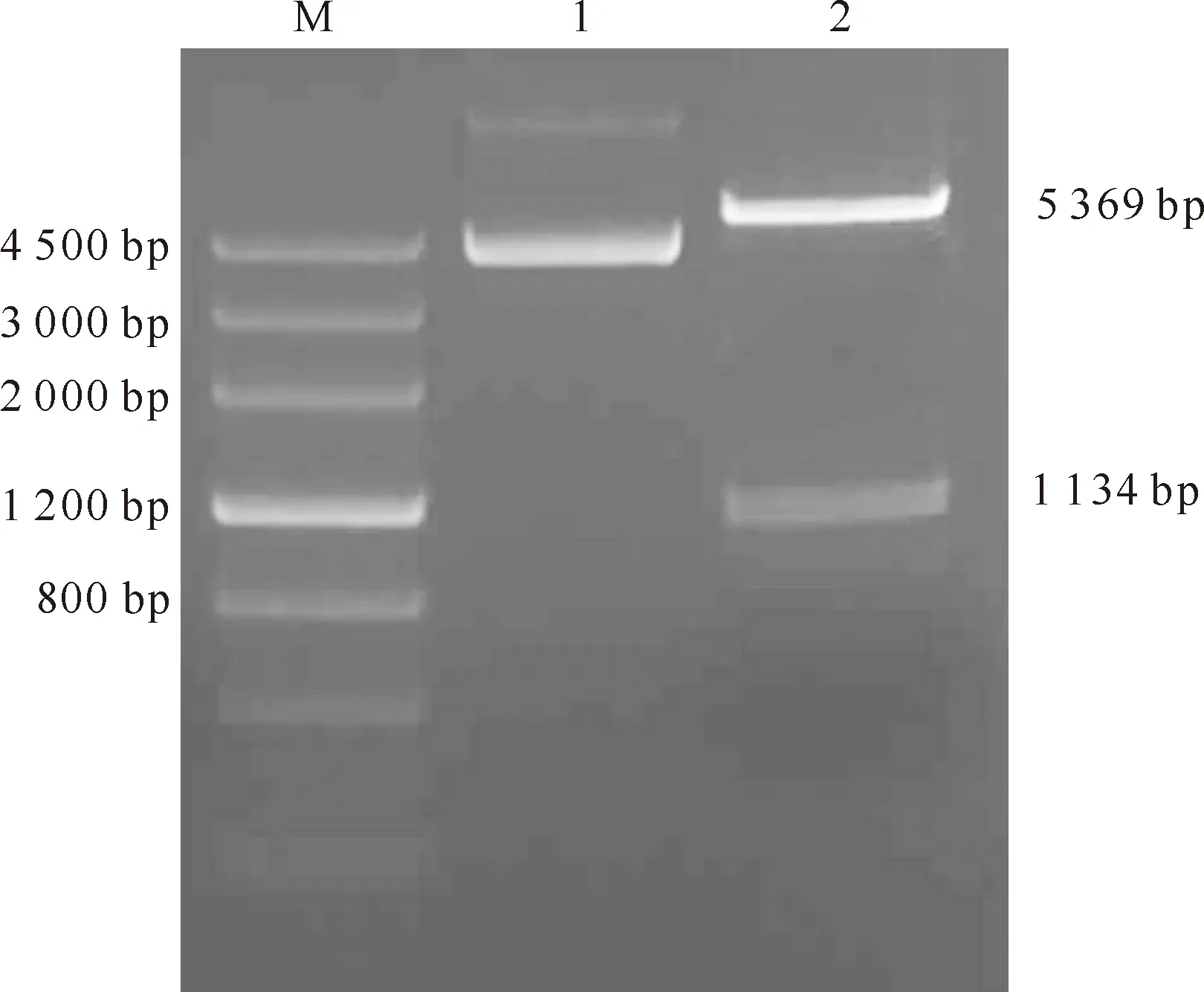
图2 重组质粒pET-28a-STV CP的酶切鉴定
M.DNA MarkerⅢ;1.pET-28a-STV CP重组质粒;2.pET-28a-STV CP重组质粒的NcoⅠ和BamHⅠ双酶切产物
Fig.2 Enzyme digestion of pET-28a-STV CP withNcoⅠ/BamHⅠ
M.DNA MarkerⅢ;1.pET-28a-STV CP;2.Digestion of pET-28a-STV CP withNcoⅠ/BamHⅠ
2.3 pET-28a-STV CP在大肠杆菌中的诱导表达
取表达产物进行SDS-PAGE电泳分析,发现IPTG诱导后泳道中出现1条非常明显的蛋白带,其分子质量约为47 ku,与预期融合蛋白大小相符,且随着诱导时间的延长,蛋白表达量逐渐增加(图3)。
3 讨 论
在我国,加工番茄的栽培主要集中在新疆,并逐渐发展到内蒙古、甘肃、宁夏等地区,推动了这些地区的经济发展。由于病毒病的普遍发生,加工番茄的品质和产量受到了严重影响。因此,病毒病的检测对于预防和控制病毒病具有非常重要的意义。目前,植物病毒的检测主要有生物学、血清学和分子生物学等方法。其中,血清学方法因具有快速简便、灵敏度高、检测样品多等优点,而成为应用最为广泛的植物病毒检测技术之一[12-14]。

图3 pET-28a-STV CP表达产物的SDS-PAGE电泳
M.低分子质量蛋白Marker;1.未经IPTG诱导的pET-28a(+)载体;2.经IPTG诱导的pET-28a(+)载体;3.未经IPTG诱导的pET-28a-STV CP重组质粒;4~6.分别为1 mmol/L IPTG诱导2,4,6 h的 pET-28a-STV CP 重组质粒
Fig.3 SDS-PAGE analysis of expression products
M.Low molecular protein Marker;1.pET-28a(+), uninduced;2.Induced pET-28a(+);3.pET-28a-STV CP, uninduced;4-6.Proteins of pET-28a-STV CP induced by IPTG at 2,4 and 6 h,respectively
STV作为一种新近发现的植物病毒,其在番茄上的致病症状尚不明确。尽管有STV与番茄的退绿、黄化、衰退、果实小等症状相关的报道[15],但是还未证实其直接相关性。因此,目前对STV的检测主要依赖于分子生物学方法。另外,由于现在尚未分离观察到STV病毒粒子,所以不能采用以纯化病毒粒子或病毒粗提液作为抗原免疫动物的传统方法来制备其血清学检测所需的抗体[16]。
相比之下,克隆病毒的一段基因并进行表达,以表达产物作为抗原制备抗体,克服了传统方法的各种困难,其表现出的特有优势也极大地促进了以免疫学为基础的病毒检测技术在病毒监控和防治中的应用。大肠杆菌表达体系是植物病毒界表达蛋白最常用的表达系统,它具有成本低、周期短、产量高、表达稳定等特点。因此,本研究采用在大肠杆菌中克隆表达重组蛋白功能最强大的pET系统来进行STVCP基因的原核表达,这可使外源蛋白C端与载体上的6个组氨酸相融合,以方便、快捷地通过His Bind柱提取获得融合蛋白。与切胶回收获得目的蛋白的方法相比,该方法所获目的蛋白可缩短后续试验抗血清制备过程,且减少了反复SDS-PAGE电泳对蛋白空间结构的破坏[17-18]。
本研究克隆了南方番茄病毒的CP基因,构建了其原核表达载体,并成功地进行了诱导表达,这为进一步制备STV特异性抗血清和建立间接ELISA检测方法提供了材料,为快速、准确调查STV在新疆等地区的分布、危害情况及加工番茄产业的健康发展具有积极的促进作用。
[1] 都业娟,许文博,向本春,等.侵染新疆加工番茄的中国番茄黄化曲叶病毒DNA-A的基因组特征 [J].植物病理学报,2011,41(4):393-398.
Du Y J,Xu W B,Xiang B C,et al.Genomic characterization ofTomatoyellowleaf curlChinavirusinfecting processing tomato in Xinjiang [J].Acta Phytopathologica Sinica,2011,41(4):393-398.(in Chinese)
[2] 姜玉霞,向本春,安仙丽,等.新疆加工番茄上番茄花叶病毒的分子鉴定 [J].新疆农业科学,2008,45(3):484-489.
Jiang Y X,Xiang B C,An X L,et al.Identification on molecular ofTomatomosaicvirusof processing tomato in Xinjiang [J].Xinjiang Agricultural Sciences,2008,45(3):484-489.(in Chinese)
[3] 都业娟,石宝萍,李成亮,等.加工番茄病毒病田间发生情况及毒原的分子检测 [J].植物保护,2013,39(4):110-115.
Du Y J,Shi B P,Li C L,et al.Incidence and molecular detection of virus on processing tomato in the field [J].Plant Protection, 2013,39(4):110-115.(in Chinese)
[4] 常 波,向本春,刘升学,等.新疆加工番茄条斑坏死病原黄瓜花叶病毒外壳蛋白基因的克隆与序列分析 [J].石河子大学学报:自然科学版,2006,24(4):410-414.
Chang B,Xiang B C,Liu S X,et al.Cloning and sequence analysis of coat protein gene of cucumber mosaic virus isolate from stripe and necrosis virus of processing tomatos in Xinjiang [J].Journal of Shihezi University:Natural Science,2006,24(4):410-414.(in Chinese)
[5] 程朝玲,向本春,崔百明,等.新疆石河子、伊宁地区黄瓜花叶病毒株系分化 [J].植物保护学报,2013,40(2):115-120.
Cheng C L,Xiang B C,Cui B M,et al.The CMV strains differentiation of processing tomato,pumpkin and peppers in Shihezi and Yining [J].Acta Phytophylacica Sinica,2013,40(2):115-120.(in Chinese)
[6] 程朝玲,向本春,崔百明,等.新疆石河子南瓜和加工番茄CMV卫星RNA与RNA3序列分析 [J].西北农业学报,2013,22(5):83-90.
Cheng C L,Xiang B C,Cui B M,et al.Analysis of cucumber mosaic virus satellite RNA and RNA3 sequence of processing tomato and pumpkin in Shihezi of Xinjiang [J].Acta Agriculturae Boreali-occidentalis Sinica,2013,22(5):83-90.(in Chinese)
[7] Sabanadzovic S,Valverde R A,Brown J K,et al.Southern tomato virus:The link between the families Totiviridae and Partitiviridae [J].Virus Research,2009,140:130-137.
[8] 苏海娣,梁学超,崔百明,等.新疆加工番茄上一种类似南方番茄病毒的分子检测 [J].石河子大学学报:自然科学版,2013,31(3):271-275.
Su H D,Liang X C,Cui B M,et al.Molecular detection of a virus similar to Southern Tomato Virus of processing tomato in Xinjiang [J].Journal of Shihezi University:Natural Science,2013,31(3):271-275.(in Chinese)
[9] 王健华,王运勤,吉训聪,等.植物病毒检测技术研究进展 [J].热带农业科学,2005,3(25):71-75.
Wang J H,Wang Y Q,Ji X C,et al.Advances on techniques for detection of plant virus [J].Chinese Journal of Tropical Agriculture,2005,3(25):71-75. (in Chinese)
[10] 朱常香,宋云枝,王玟玟,等.烟草环斑病毒外壳蛋白基因的原核表达及抗血清的制备 [J].植物病毒学,2005,20(4):434-437.
Zhu C X,Song Y Z,Wang W W,et al.Cloning and expression of the coat protein gene of tobacco ringspot virus and preparation of virus-specific antiserum [J].Virologica Sinica,2005,20(4):434-437.(in Chinese)
[11] 王亚娇,任堂雨,刘 艳,等.小麦矮缩病毒外壳蛋白基因的原核表达、抗体制备及应用 [J].植物病理学报,2013,43(4):362-367.
Wang Y J,Ren T Y,Liu Y,et al.Antiserum preparation of wheat dwarf virus using coat protein expressed inEscherichiacoliand its application [J].Acta Phytopathologica Sinica,2013,43(4):362-367.(in Chinese)
[12] 杜智欣,李桂芬,马 洁,等.两种抗原制备黄瓜花叶病毒多克隆抗体的比较研究 [J].植物检疫,2013(3):40-44.
Du Z X,Li G F,Ma J,et al.Comparative identification for two polyclonal antibodies to M strain of cucumber mosaic virus by using two kinds of antigens [J].Plant Quarantine,2013(3):40-44.(in Chinese)
[13] Martin R,James D,Lévesque C.Impacts of molecular diagnostic technologies on plant disease management [J].Annual Review of Phytopathology,2000,38:207-239.
[14] 朱常香,王玉军,郭兴启,等.烟草蚀纹病毒外壳蛋白基因的克隆、原核表达及抗血清的制备 [J].植物保护学报,2005,32(4):362-366.
Zhu C X,Wang Y J,Guo X Q,et al.Cloning and prokaryotic expression of coat protein gene of Tobacco etch virus and preparation of viral-specific antiserum [J].Acta Phytophylacica Sinica,2005,32(4):362-366.(in Chinese)
[15] Sabanadzovic S,Ghanem-Sabanadzovic N A,Valverde R A.A novel monopartite dsRNA virus from rhododendron [J].Arch Virol,2010,155:1859-1863.
[16] 李晓鹏,王连春,彭杰军,等.香石竹斑驳病毒外壳蛋白基因的原核表达及抗血清制备 [J].云南农业大学学报,2013,28(1):32-35.
Li X P,Wang L C,Peng J J,et al.Prokaryotic expression and antiserum preparation of the coat protein gene ofCarnationmottlevirus[J].Journal of Yunnan Agricultural University,2013,28(1):32-35.(in Chinese)
[17] 秦云霞,曾华金,刘志昕,等.黄瓜花叶病毒CP基因原核表达及抗血清的制备 [J].中国生物工程杂志,2004,24(8):73-76.
Qin Y X,Zeng H J,Liu Z X,et al.Efficient expression of coat protein gene of cucumber mosaic virus and preparation of viral-specific antiserum [J].China Biotechnology,2004,24(8):73-76.(in Chinese)
[18] 郭 颂,张福兴,怀 晓,等.樱桃病毒A北京分离物外壳蛋白的原核表达及抗血清制备 [J].植物病理学报,2010,40(6):568-573.
Guo S,Zhang F X,Huai X,et al.Prokaryotic expression of coat protein of cherry virus A isolate Beijing and preparation of the polyclonal antiserum [J].Acta Phytopathologica Sinica,2010,40(6):568-573.(in Chinese)
Cloning and prokaryotic expression of coat protein gene of Southern tomato virus from processing tomato in Xinjiang
ZHANG Qiang,CUI Bai-ming,ZHENG Yin-ying,XIANG Ben-chun
(CollegeofLifeScience,KeyLaboratoryofAgricultureBiotechnology,ShiheziUniversity,Shihezi,Xinjiang832003,China)
【Objective】 This paper aimed to clone the coat protein (CP) gene ofSoutherntomatovirus(STV),and construct and express its prokaryotic expression vector,providing reference for preparation and detection of high titer serum of the virus.【Method】 The STVCPgene was cloned by One-Step RT-PCR and connected with pET-28a(+) to obtain pET-28a-STV CP.Then the recombinant plasmid was transformed intoE.coliBL21 and induced by IPTG.【Result】 The STVCPgene was cloned successfully with the size of 1 134 bp and prokaryotic expression vector pET-28a-STV CP was also constructed.TheCPprotein with molecular weight of 47 ku was highly expressed after being induced by 1 mmol/L IPTG.【Conclusion】 STVCPgene was successfully cloned,and the expression of recombinant protein was induced successfully.
Southern tomato virus;coat protein gene;prokaryotic expression
2013-11-28
国家自然科学基金项目(31260420);国际科技合作与交流专项(20072072)
张 强(1985-),男,陕西蒲城人,在读硕士,主要从事植物病毒学研究。E-mail:zhangqiang1047@126.com
郑银英(1975-),女,吉林延边人,副教授,主要从事植物病毒学研究。E-mail:zyycbm@sina.cn
时间:2015-03-12 14:17
10.13207/j.cnki.jnwafu.2015.04.001
S432.41
A
1671-9387(2015)04-0118-05
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20150312.1417.001.html
