猕猴桃抗溃疡病基因连锁SSR分子标记初步研究
2015-07-12易盼盼樊红科雷玉山
易盼盼,樊红科,雷玉山,王 飞
(1 西北农林科技大学 园艺学院,陕西 杨凌 712100;2 陕西省农村科技开发中心,陕西 西安 710054)
猕猴桃抗溃疡病基因连锁SSR分子标记初步研究
易盼盼1,樊红科2,雷玉山2,王 飞1
(1 西北农林科技大学 园艺学院,陕西 杨凌 712100;2 陕西省农村科技开发中心,陕西 西安 710054)
【目的】 研究与猕猴桃抗溃疡病基因连锁的SSR分子标记,为猕猴桃抗病育种提供早期分子筛选标记。【方法】 以易感病的雌株西选二号和抗病的雄株SX45872杂交F1代的198株群体以及40份猕猴桃材料为试材,利用离体接种法进行抗性鉴定。利用SSR(Simple sequence repeat)技术,结合集群分类分析法 (Bulked segregation analysis,BSA)进行猕猴桃抗溃疡病基因(PR)分子标记筛选。【结果】 抗性鉴定结果表明,猕猴桃溃疡病抗/感病分离比符合由1对主效基因控制的1∶1分离比例。通过对51对SSR引物的筛选,获得了与抗溃疡病基因连锁的SSR分子标记UDK97-428116;将获得的SSR标记在40份猕猴桃材料中进行验证,分子标记结果与离体枝条接种结果一致率达95.5%,从而验证了该标记的可靠性。【结论】 SSR标记UDK97-428116可用于猕猴桃材料溃疡病抗性鉴定和分子标记辅助育种。
猕猴桃;溃疡病;抗性基因;SSR标记;离体接种
猕猴桃溃疡病是一种由丁香假单胞杆菌(Pseudomonassyringaepv.actinidae)引起的全球性细菌性病害,该病害易造成猕猴桃大面积死亡[1-7]。目前控制猕猴桃溃疡病的主要措施是化学防治,然而由于病原菌的抗药性以及环境污染等问题,化学防治的局限性日益突出。因此选育和利用抗病品种是控制溃疡病最根本、有效的手段[8]。鉴定猕猴桃种质资源对细菌性溃疡病的抗性是抗病育种的关键。
目前,对于猕猴桃溃疡病的研究多集中在病原分类、病害防治、抗病生理机制等方面。王忠肃等[9]、朱晓湘等[10]、承河元等[11]、Scortichini等[12]、Gallelli等[13]、Kerry等[14]对猕猴桃溃疡病病原菌的分类鉴定进行了研究。赵利娜等[15]对来源于不同地区的猕猴桃溃疡病菌菌种进行了分子鉴定和致病力分析,结果表明不同菌种致病力有差异,中国猕猴桃溃疡病致病菌为丁香假单胞杆菌猕猴桃致病变种。申哲等[16]对陕西关中地区猕猴桃溃疡病进行了初步调查。李淼等[17-18]通过田间定点抗病性调查与生理研究,报道了不同猕猴桃品种对细菌性溃疡病的抗病性及生理机制。综观现有的相关研究,尚未见关于猕猴桃抗溃疡病基因SSR分子标记的研究报道。为此,本研究利用西选二号与SX45872雄株杂交的F1代群体,对猕猴桃抗溃疡病基因(PR)进行了SSR标记,以期为进一步开展猕猴桃抗溃疡病分子标记辅助选择育种提供参考。
1 材料与方法
1.1 猕猴桃杂交F1代溃疡病抗性鉴定
杂交F1代溃疡病抗性鉴定材料为16年生的抗病雄株SX45872和感病雌株西选二号于2002年杂交授粉的198株F1代实生苗,材料取自陕西省西安市猕猴桃试验站。供试菌株为2012-04从试验站感病红阳猕猴桃病枝上分离出的致病菌,该病原为丁香假单胞杆菌猕猴桃致病变种(菌种的16S rDNA序列已上传GenBank,登录号JX282390.1)。致病性溃疡病菌的培养参照方中达[19]的方法进行。
采集F1代猕猴桃材料1年生健康枝条,取中部20~30 cm枝段,两端用封剪油处理防止失水,带回实验室进行离体接种鉴定。参照任欣正[20]的方法进行接种,每份材料接种15根枝条,3次重复,接种前先用体积分数70%酒精表面消毒,而后用消毒打孔器(打孔器直径8 mm,面积为50.2 mm2)造成等体积伤口,用一次性注射器于伤口处接种3×108CFU/mL孢子菌液100 μL,接种后的枝条置于20 ℃下恒温保湿,24 h后逐日观察发病情况,连续观察至20 d,统计感病率(接种20 d 时感病枝条数占总枝条数的百分比)。猕猴桃离体枝条溃疡病分级标准:0 级,枝条感病率≤3.3%;1级,3.3%<枝条感病率≤10%;2级,10%<枝条感病率≤40%;3级,40%<枝条感病率≤70%;4级,枝条感病率>70%。计算病情指数:病情指数=∑(各级病枝数×该级代表值)/(接种总枝数×发病最高一级的代表数值)×100[21]。猕猴桃病情指数≤1.67,判为高抗材料;1.67<病情指数≤6.7,判为抗病材料;6.7<病情指数≤20,判为中间型材料;20<病情指数≤73.3,判为感病材料;病情指数>73.3,判为高感材料。将病情指数≤20的猕猴桃材料(包括高抗、抗病及中间型材料)记为抗病材料,病情指数>20的(包括感病和高感猕猴桃材料)记为感病材料。
1.2 40份猕猴桃材料溃疡病抗性鉴定
从2002年感病雌株西选二号和抗病雄株SX45872杂交开始到2012年,期间在198株猕猴桃杂交后代雄株上进行开花多、花期长、花粉量大的株系选择,在雌株上进行果实内在品质与外观性状优良的株系选择,同时淘汰感染溃疡病严重的材料,最终选择出有利用价值的YZ31012、1号雄株、3号雄株、QM91136、LF31023、1号雌株、2号雌株、4号雌株共8种材料用于试验。同时选用野生猕猴桃材料软枣猕猴桃、毛花猕猴桃、蓝天实生、野生雄株、商县中华、太白美味、1号雄株、3号雄株及生产上常用的秦美、金农、金锁、海沃德、华优、徐香、秋明、晨光、金早、金桃、豫黄一号、金霞、金阳、豫黄二号、黄金果雄株、脐红、晚红、西选二号、红阳雄株、翠香、楚红、红阳、金艳、黄金果用于鉴定。
对上述40份猕猴桃材料进行离体枝条溃疡病抗性鉴定,鉴定方法同1.1.1节。
1.3 猕猴桃抗溃疡病基因SSR标记的筛选及验证
1.3.1 抗溃疡病基因SSR引物的筛选 利用集群分类分析法(BSA法)筛选特异标记。
(1)基因组DNA提取和基因池构建。2011年春季取1年生枝条上的健康嫩叶,采用简易CTAB法[22]提取基因组DNA,经RNase A消化处理,进行琼脂糖凝胶电泳和紫外分光光度计检测,将检测合格样品的质量浓度调至50 ng/μL,-20 ℃保存备用。参照Michelmore等[23]的方法,从杂交F1代中取抗病(感病率小于10%)和感病(感病率大于40%)材料的DNA各8份,将其分别等量混合,组成高抗基因池和高感基因池。
(2)SSR引物的筛选。选用Huang等[24]的40对猕猴桃微卫星引物(UDK96-001、UDK96-009、UDK96-013、UDK96-015~UDK96-020、UDK96-022、UDK96-023、UDK96-026、UDK96-028、UDK96-030、UDK96-033~UDK96-035、UDK96-037、UDK96-39、UDK96-40、UDK97-401~UDK97-409、UDK97-411~UDK97-416、UDK97-419~UDK97-422、UDK97-424)及作者根据CNBI数据库中已报道的猕猴桃序列,利用Primer 5.0软件设计的11对引物(UDK97-426~UDK97-436)作为供筛选引物。引物由上海Sangon公司合成。
提取亲本西选二号和SX45872DNA为模板,进行PCR扩增,初步筛选出能从两者中扩增出多态性DNA片段的引物。PCR反应体系为20 μL,包括10×PCR Buffer 2.0 μL,25 mmol/L MgCl21.2 μL,2 mmol/L dNTPs 2.0 μL,10 μmol/L引物1 μL,5 U/μLTaq聚合酶 0.2 μL,20 ng模板DNA,用双蒸水补足体系到20 μL。PCR反应程序:94 ℃预变性4 min;94 ℃变性1 min,48.5~52 ℃退火1 min,72 ℃延伸1 min,35个循环;最后72 ℃延伸10 min。扩增产物用8%非变性聚丙烯酰胺凝胶电泳,经硝酸银染色后观察、照相[25]。
用西选二号和SX45872DNA、F1代高抗和高感基因池及其组成材料的DNA为模板,用所选引物进行PCR扩增,试验方法同上,以筛选与猕猴桃抗溃疡病基因连锁的SSR标记,试验重复2~3次。
1.3.2 抗溃疡病基因SSR标记的验证 提取40份猕猴桃材料的DNA作为模板,用所选SSR引物进行PCR扩增,试验方法同1.3.1节。将试验结果与40份猕猴桃材料的离体枝条溃疡病抗性鉴定结果进行对比,以验证SSR标记是否与猕猴桃抗溃疡病基因相关,试验重复2~3次。
1.4 数据分析
采用SPSS 18.0 软件进行方差分析及数据处理。
2 结果与分析
2.1 猕猴桃杂交F1溃疡病抗性鉴定

2.2 40份猕猴桃的溃疡病抗性鉴定
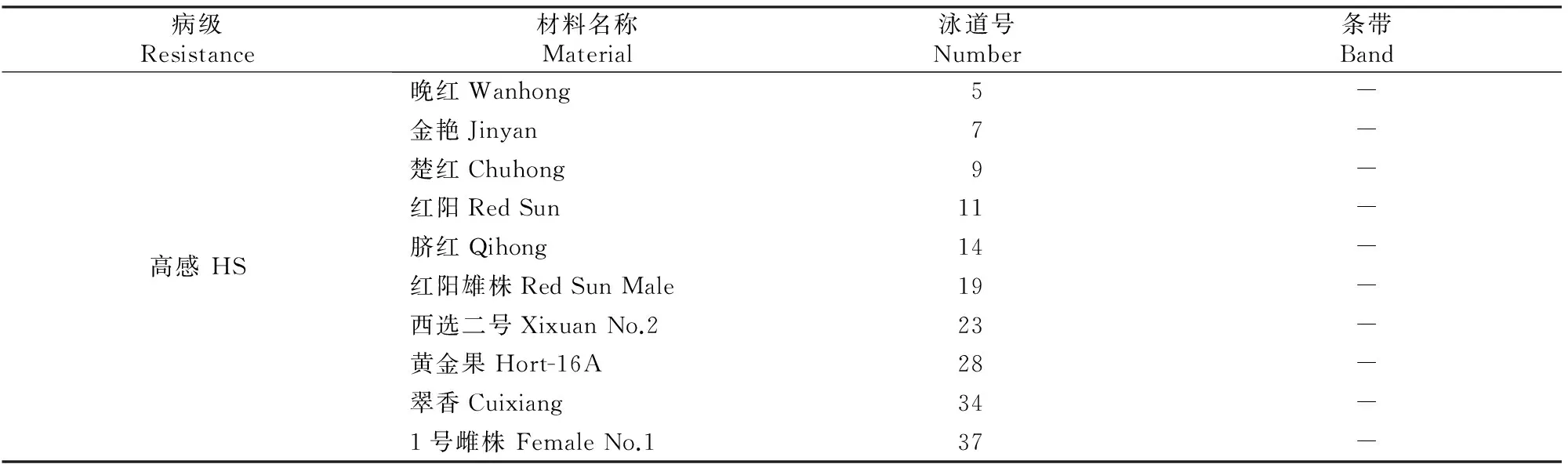
对40份猕猴桃材料进行溃疡病抗性鉴定,结果见表1。由表1可以看出,软枣、毛花,完全不感病,属于高抗资源;QM91136、哑特、金魁、LF31023、YZ31012、蓝田实生、野生雄株、太白美味、1号雄株和3号雄株抗病,为抗病资源;秦美、华优、徐香、金农、金锁、海沃德、晨光、金早、秋明和2号雌株,不同气候环境、海拔、树势等会对其造成影响,有感病情况发生但不严重,属于中间型;金桃、豫黄一号、商县中华、金霞、金阳、4号雌株、豫黄二号、黄金果雄株感病;而脐红、晚红、西选二号、红阳雄株、翠香、1号雌株、楚红、红阳、金艳、黄金果感病严重,有菌脓溢出,属于高感类型。

表1 40份猕猴桃材料溃疡病抗性鉴定结果Table 1 Identification of resistance against canker resistance of 40 kiwifruit materials

续表1 Continued table 1
注:HR.高抗;R.抗病;M.中间型;S.感病;HS.高感。
Note:HR.High-resistance;R.Resistance;M.Middle-susceptibility;S.Susceptibility;HS.High-susceptibility.
2.3 猕猴桃抗溃疡病基因SSR标记的筛选
以感病亲本西选二号和抗病亲本SX45872DNA为模板,通过PCR扩增,对引物进行初步筛选,结果表明,在51对引物中能够扩增出具有多态性条带的引物有7对(占13.7%),其中引物UDK97-428 SSR (正向序列:5′-ACAGTCGAGTTGGCAATATG-3′,反向序列:5′-AGGAATCACCTGTGTTAGTG-3′)能够在亲本间扩增出差异条带,抗病雄株SX45872DNA可扩增出116 bp位点条带,而感病雌株西选二号DNA未扩增出该条带(图1)。
采用BSA法,用UDK97-428引物筛选差异条带,结果在116 bp处高抗池和高感池有1个明显的差异条带(图2)。初步判断这个位点与PR基因连锁。
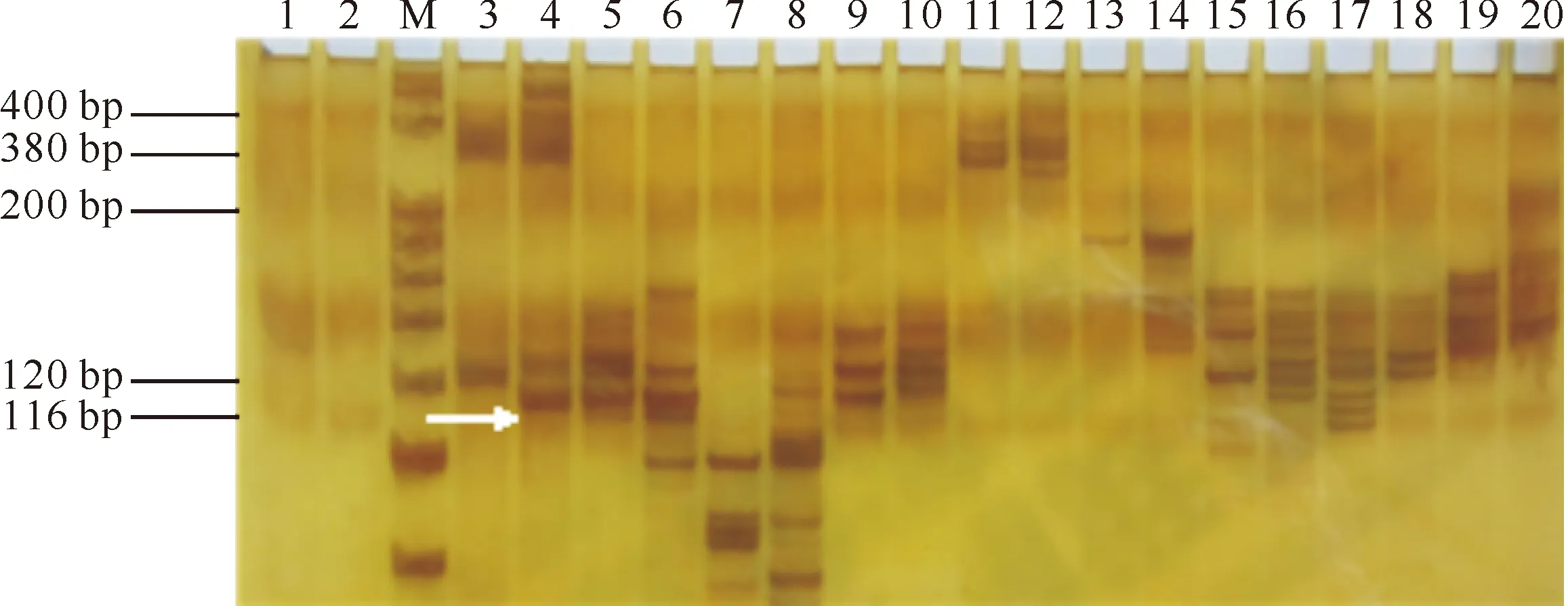
图1 部分引物对猕猴桃感病雌株西选二号和抗病雄株SX45872的扩增结果M.20 bp DNA Marker;1,3,5,7,9,11,13,15,17,19.依次为引物UDK97-427~UDK97-433、UDK96-013、UDK97-434和UDK97-435对感病雌株西选二号扩增结果;2,4,6,8,10,12,14,16,18,20.依次为引物UDK97-427~UDK97-433、UDK96-013、UDK97-434和UDK97-435对抗病雄株SX45872扩增结果;箭头所指为抗病基因标记片段位点Fig.1 Amplification of Xixuan No.2 and SX45872 by some pair primersM.20 bp DNA marker;1,3,5,7,9,11,13,15,17,19 are amplification of resistance male Xixuan No.2 by those pair primers, in the order are UDK97-427-UDK97-433,UDK96-013,UDK97-434 and UDK97-435;2,4,6,8,10,12,14,16,18,20 are amplification of disease female SX45872 by those pair primers,in the order are UDK97-427-UDK97-433,UDK96-013,UDK97-434 and UDK97-435.Arrow indicates the site of resistance marker fragment
2.4 猕猴桃抗溃疡病基因SSR标记的验证
利用引物UDK97-428对40份猕猴桃材料的DNA进行PCR扩增,结果(图3及表1)表明,毛花、软枣、QM91136、哑特、金魁、LF31023、YZ31012、蓝天实生、野生雄株、1号雄株、太白美味、3号雄株、华优、徐香、秦美、金农、金锁、海沃德、晨光、金早、秋明等21份猕猴桃材料中存在UDK97-428116(暂命名)标记片段,而晚红、金艳、楚红、红阳、金阳、脐红、金桃、红阳雄株、金霞、西选二号、黄金果雄株、黄金果、豫黄一号、商县中华、翠香、1号雌株、4号雌株、2号雌株、豫黄二号等19份猕猴桃材料不存在该标记。将引物UDK97-428对40个猕猴桃材料扩增结果(表2)与离体枝条接种结果(表1)进行对比,结果发现,在高抗、抗病和中间型猕猴桃材料中,除2号雌株外都存在UDK97-428116标记位点,而感病及高感猕猴桃材料都不存在该标记位点(图3),2种方法鉴定结果的一致率达95.5%。表明分子标记结果与人工离体枝条鉴定结果基本一致,证明UDK97-428116可以作为猕猴桃抗溃疡病基因的SSR标记。

图2 引物UDK97-428对猕猴桃F1分离群体(部分个体)及其父母本的扩增结果M.20 bp DNA Marker;♂.抗病雄株SX45872;♀.感病雌株西选二号;R.高抗基因池;S.高感基因池;1~8.抗病个体;9~16.感病个体;箭头所指为抗病基因标记片段位点Fig.2 Amplification of individuals from the F1 population of Xixuan No.2 and SX45872 with UDK97-428M.20 bp DNA Marker;♂.Resistant male (SX45872);♀.Diseased female (Xixuan No.2); R.DNA pool of resistance;S.DNA pool of susceptible;1-8.Individuals with resistance; 9-16.Individuals with susceptibility.Arrow indicates the site of resistance marker fragment

表2 40份猕猴桃材料SSR标记结果统计Table 2 Statistical results of SSR markers of 40 kiwifruit germplasm resources
续表2 Continued table 2
注:+.有条带;-.无条带。
Note:+.Has band;-.No band.

图3 UDK97-428对40份猕猴桃材料的扩增结果M.20 bp DNA Marker;1~40.品种编号,同表1;箭头所指为抗病的标记片段Fig.3 Amplification of 40 kiwifruit germplasm resources with UDK97-428M.20 bp DNA Marker;1-40.Numbers of germplasm resources are same to Table 1;Arrow indicates the site of disease-resistance marker fragment
3 讨 论
陕西秦岭北麓是我国猕猴桃主产区,近年来,溃疡病成为猕猴桃栽培中的毁灭性病害,已严重影响到猕猴桃产业的发展[16]。王振荣等[8]认为,栽培抗病品种是防治溃疡病的最有效手段,抗病种质资源的筛选、研究与利用是猕猴桃抗溃疡病育种的基础。因此,猕猴桃溃疡病的鉴定和抗性资源的系统筛选对猕猴桃产业的发展非常重要。本研究通过对猕猴桃杂交后代进行溃疡病抗性表型遗传分析,初步统计发现猕猴桃溃疡病抗/感病分离比符合由1 对主效基因控制的1∶1的分离比例。
分子标记用于辅助选择育种可提高选择的准确性和效率,缩短育种年限。前人研究表明,分子标记技术结合BSA 法是筛选与目的基因紧密连锁的分子标记的一个有效方法[25]。王刚刚等[26]利用SSR 技术,结合BSA 法,获得了与果实酸/低酸性状紧密连锁的SSR Hi01e10标记。在猕猴桃抗溃疡病基因的研究上,李淼等[27]对6种猕猴桃种质资源进行RAPD分析发现,在引物S1053扩增的图谱中,抗病资源可扩增出1 458 bp DNA片段,而感病资源未扩增出该片段,由此推断该片段与猕猴桃抗溃疡病相关。本研究利用SSR技术结合BSA法,从51对随机引物中筛选出了1对可以扩增出特异性DNA片段的引物,获得了与猕猴桃抗溃疡病基因相关的SSR标记UDK97-428116。
为了进一步证实SSR标记UDK97-428116与猕猴桃抗溃疡病基因有关,本研究利用UDK97-428引物对40份猕猴桃材料的DNA进行SSR扩增,并将扩增结果与人工接种鉴定结果进行对比,结果发现,在高抗和抗病猕猴桃材料中均含有UDK97-428116标记片段;而感病和高感猕猴桃材料不存在该标记片段;中间型猕猴桃材料中除了2号雌株,其他9份中间型材料均含有UDK97-428116标记片段。说明该片段与猕猴桃溃疡病抗性有关。应用SSR技术和离体枝条接种法进行猕猴桃溃疡病抗性目标基因研究存在主观上的误差,不可能准确分析出特征片段与抗病基因的相关程度,因此猕猴桃抗溃疡病基因的研究仍需进一步深入。下一步应对SSR特异片段进行克隆、测序,然后用转基因方法转入溃疡病感病植株内,再用离体枝条接种法对转基因猕猴桃进行抗性验证。
本研究发现,我国秦巴山区野生猕猴桃资源溃疡病抗性较好, 如野生雄株、太白美味;杂交后代中有溃疡病抗性较强但果实品质一般的材料,如YZ31012;也有溃疡病抗性强且果实品质优良的材料,如QM91136和LF31023;而一些栽培品种溃疡病抗性较低,如红阳、黄金果、西选二号、金艳等。因此,要实现抗病育种,对野生猕猴桃资源和杂交后代综合性状优良株系的筛选与利用不容忽视,如对本试验抗性良好的QM91136、LF31023、YZ31012,可进一步研究其抗溃疡病遗传机制以及品质特性,并在溃疡病抗性育种以及优良品种选育中加以利用。
[1] Balestra G M,Renzi M,Mazzaglia A.First report of bacterial canker ofActinidiadeliciosacaused byPseudomonassyringaepv.actinidiaein Portugal [J].New Disease Reports,2010,22:10.
[2] Bastas K K,Karakaya A.First report of bacterial canker of kiwifruit caused byPseudomonassyringaepv.actinidiaein Turkey [J].Plant Disease,2012,96(3):452.
[3] EPPO.First report ofPseudomonassyringaepv.actinidiaein Australia [J].EPPO Reporting Service,2011,6:130.
[4] Everett K R,Taylor R K,Romberg M K,et al.First report ofPseudomonassyringaepv.actinidiaecausing kiwifruit bacterial canker in New Zealand [J].Australasian Plant Disease Notes,2011,6(1):67-71.
[5] Koh J K,Cha B J,Chung H J,et al.Out break and spread of bacterial canker in kiwifruit [J].Korean Journal of Plant Pathology,1994,10:68-72.
[6] Serizawa S,Ichikawa T,Takikawa Y,et al.Occurrence of bacterial canker of kiwifruit in Japan:description of symptoms,isolation of the pathogen and screening of bactericides [J].Annals of the Phytopathological Society of Japan,1989,55:427- 436.
[7] Vanneste J L,Poliakoff F,Audusseau C,et al.First report ofPseudomonassyringaepv.actinidiaethe causal agent of bacterial canker of kiwifruit in France [J].Plant Disease,2011,95(10):1311.
[8] 王振荣,高同春,顾江涛,等.猕猴桃溃疡病防治研究 [J].安徽农业科学,1998, 26(4):349-351.
Wang Z R,Gao T C,Gu J T,et al.The prevention research of kiwifruit canker [J].Journal of Anhui Agricultural Sciences,1998,26(4):349 -351.(in Chinese)
[9] 王忠肃,唐显富,刘绍基.猕猴桃细菌溃疡病(Actinidiabacterialcanker) 病原细菌鉴定 [J].西南农业大学学报, 1992,14 (6):500-503.
Wang Z S,Tang X F,Liu S J.Identification of the pathogenic bacterium for bacterrical canker onActinidiain Sichun [J].Journal of Southwest Agricultural Univerisity,1992,14(6):500-503.(in Chinese)
[10] 朱晓湘,方炎祖,廖新光.猕猴桃细菌性溃疡病病原研究 [J].湖南农业科学,1993(6):31-33.
Zhu X X,Fang Y Z,Liao X G.Study on the pathogenic of bacterial canker of kiwifruit [J].Journal of Hunan Journal of Hunan Agriculture Science,1993(6):31-33.(in Chinese)
[11] 承河元,李 瑶,万嗣堃,等.安徽省猴猴桃溃疡病菌的鉴定 [J].安徽农业大学学报,1995,22(3):219-223.
Cheng H Y,Li Y,Wan S K,et al.Pathogenic identification of kiwifruit bacterial canker in Anhui [J].Journal of Anhui Agricultural University,1995,22(3):219-223.(in Chinese)
[12] Scortichini M,Marchesi U,Di Prospero P.Genetic relatedness amongPseudomonasavellanae,P.syringaepv.theae andP.s.pv.actinidiae,and their identification [J].European Journal of Plant Pathology,2002,108(3):269-278.
[13] Gallelli A,Talocci S,L’aurora A,et al.Detection ofPseudomonassyringaepv.actinidiae,causal agent of bacterial canker of kiwifruit,from symptomless fruits and twigs,and from pollen [J].Phytopathologia Mediterranea,2011,50:462-472.
[14] Kerry E R,Robert K T,Megan K R,et al.First report ofPseudomonassyringaepv.actinidiaecausing kiwifruit bacterial canker in New Zealand [J].Journal of Plant Pathology,2011,6(1):67-71.
[15] 赵利娜,胡家勇,叶振风,等.猕猴桃溃疡病病原菌分子鉴定和致病力鉴定 [J].华中农业大学学报,2012,31(5):604-608.
Zhao L N,Hu J Y,Ye Z F,et al.Moleculer identification and pathogenicity detection ofPseudomonassyringaepv.actinidiae[J].Journal of Huazhong Agricultural University,2012,31(5):604-608.(in Chinese)
[16] 申 哲,黄丽丽,康振生.陕西关中地区猕猴桃溃疡病调查初报 [J].西北农业学报,2009,18(1):191-193,197.
Shen Z,Huang L L,Kang Z S.The investigation of kiwifruit bacterial canker in guanzhong zone of Shaanxi province [J].Acta Agriculturae Boreal-Occidentalis Sinica,2009,18(1):191-193,197.(in Chinese)
[17] 李 淼,檀根甲,李 瑶,等.不同猕猴桃品种对细菌性溃疡病的抗病性及其聚类分析 [J].植物保护,2004,30(5):51-54.
Li M,Tan G J,Li Y,et al.Resistance of different kiwifruit cultivars to kiwifruit bacterial canker caused byPseudomonassyringaepv.actinidiaeand cluster analysis [J].Plant Protection, 2004,30(5):51-54.(in Chinese)
[18] 李 淼,檀根甲,李 瑶,等.猕猴桃品种对细菌性溃疡病的抗性机制 [J].植物保护学报,2005,32(1):37-42.
Li M,Tan G J,Li Y,et al.Resistance mechanism of kiwifruit cultivars toPseudomonassyringaepv.actinidiae[J].Acta Phytophlacia Sinica,2005,32(1):37-42.(in Chinese)
[19] 方中达.植病研究方法 [M].3版.北京:中国农业出版社,1998.
Fang Z D.Research technique of plant pathology [M].3rd ed.Beijing:China Agricultural Press,1998.(in Chinese)
[20] 任欣正.植物病原细菌分类和鉴定 [M].北京:农业出版社,1999.
Ren X Z.Plant pathogenic bacteria classification and identification [M].Beijing:China Agricultural Press,1999.(in Chinese)
[21] 王 磊,臧 睿,黄丽丽,等.陕西省关中地区苹果树腐烂病调查初报 [J].西北农林科技大学学报:自然科学版,2005,33(8):98-100.
Wang L,Zang R,Huang L L,et al.The investigation of apple tree valsa canker in Guangzhong region of Shaanxi province [J].Jour of Northwest Sci-Tech Univ of Agri and For:Nat Sci Ed,2005,33(8):98-100.(in Chinese)
[22] 陈 华,徐小彪,易干军,等.猕猴桃基因组DNA不同提取方法的研究 [J].江西农业大学学报,2005,27(1):12-16.
Chen H,Xu X B,Yi G J,et al.A study on different methods for extraction of kiwifruit genomic DNA [J].Acta Agriculturae Universitatis Jiangxiensis,2005,27(1):12-16.(in Chinese)
[23] Michelmore R W,Paran I,Kesseli R V.Identification of markers linked to disease resistance genes by bulked segregant analysis:A rapid method to detect markers in specific genomic regions by using segregating populations [J].Proceedings of National Academy of Sciences of the United States of America,1991,88:9828-9832.
[24] Huang W G,Cipriani G,Morgante M,et al.Microsatellite DNA in Actinidia chinensis:Isolation,characterization,and homology in related species [J].Theoretical and Applied Gentics,1998,97:1269-1278.
[25] Varshney R K,Grnaer A,Sorrells M E.Genetic microsatellite markers in plants:Features and applications [J].Trends in Biotechnology,2005,23:48-55.
[26] 王刚刚,王 飞,赵政阳,等.苹果果实酸/低酸性状的SSR标记 [J].西北农林科技大学学报:自然科学版,2010,38(6):133-137.
Wang G G,Wang F,Zhao Z Y,et al.SSR markers of apple fruit acid/low-acid trait [J].Jour of Northwest Sci-Tech Univ of Agri and For:Nat Sci Ed,2010,38(6):133-137.(in Chinese)
[27] 李 淼,檀根甲,李 瑶,等.不同猕猴桃品种RAPD分析及其与抗溃疡病的关系 [J].植物保护,2009,35(3):41-46.
Li M,Tan G J,Li Y,et al.Analysis of the relationship between different kiwifruit cultivars and their resisitance toPseudomonassyringaepv.actinidiaeby RAPD [J].Plant Protection,2009,35(3):41-46.(in Chinese)
Priliminary study on SSR marker of gene linkage againstPseudomonassyringaepv.actinidae
YI Pan-pan1,FAN Hong-ke2,LEI Yu-shan2,WANG Fei1
(1CollegeofHorticulture,NorthwestA&FUniversity,Yangling,Shaanxi712100,China;2ShaanxiRuralScienceandTechnologyDevelopmentCenter,Xi’an,Shaanxi710054,China)
【Objective】 The study investigated SSR marker of gene linkage against kiwifuit canker disease to provide molecular marker for breeding of kiwifruit with resistance. 【Method】 198 progenies in F1generation of the susceptible female Xixuan No.2 and the disease resistance male plant SX45872and 40 kiwifruit materials were selected for identification of resistance usinginvitroinoculation method.Then simple sequence repeat (SSR) technique combined with bulk segregation analysis (BSA) was used to conduct marker screening of canker disease resistance gene (PR) in kiwifruit.【Result】 The identification of resistance showed that the separation of kiwifruit canker disease resistance was in accordance with the 1∶1 segregation ratio controlled by a pair of main effect genes.A total of 51 primer pairs were screened,and an SSR marker (UDK97-428116) closely linked toPRgene was identified.The validity of this SSR marker was verified in 40 kiwifruit materials with the consistent rate of 95.5% compared to SSRinvitroinoculation branches.【Conclusion】 The SSR marker UDK97-428116can be used as molecular marker to assist selection of resistance to kiwifruit canker.
kiwifruit;canker;resistance gene;SSR marker;invitroinoculation
2013-12-06
陕西省科技统筹创新工程项目(2011KTCL02-06);陕西省农业科技创新项目(2012NKC01-05);陕西省猕猴桃产业提升关键技术研究与产业基地建设项目(2012GB2G000438)
易盼盼(1987-),女,河南正阳人,在读硕士,主要从事果树生理生化研究。
王 飞(1954-),女,河南孟津人,教授,博士生导师,主要从事园艺植物种质资源评价与利用研究。
时间:2015-03-12 14:17
10.13207/j.cnki.jnwafu.2015.04.025
S663.4
A
1671-9387(2015)04-0091-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20150312.1417.025.html
