脑梗死后抑郁与甲状腺激素水平相关性的研究
2015-07-12胡永军李兰红张学梅胡伟凯
胡永军,李兰红,张学梅,胡伟凯
·神经科疾病临床观察/研究·
脑梗死后抑郁与甲状腺激素水平相关性的研究
胡永军,李兰红,张学梅,胡伟凯
目的探讨急性脑梗死后抑郁患者甲状腺激素水平的变化。方法对120例急性脑梗死患者进行分组,脑梗死后无抑郁组(60例)和脑梗死后抑郁组(60例),各组中轻、中、重度抑郁各20例。60例正常健康体检者为对照组。收集脑梗死组发病第2天及第14天的血清及对照组血清待测。测定所有血清游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)及促甲状腺素(TSH)水平,比较脑梗死后抑郁与脑梗死后无抑郁及脑梗死后不同程度抑郁甲状腺激素水平的变化情况。结果脑梗死后无抑郁组及脑梗死后抑郁组发病第2天时血清FT3水平低于对照组,FT4水平高于对照组,差异有统计学意义(P<0.05),且脑梗死后抑郁组较脑梗死后无抑郁组变化更显著,(P<0.05);脑梗死后无抑郁组血清促甲状腺素(TSH)较对照组增高(P<0.05),而脑梗死后抑郁组TSH水平与对照组相比差异无统计学意义。发病第14天脑梗死后无抑郁组FT3、FT4基本恢复,与对照组比较差异无统计学意义;而脑梗死后抑郁组FT3、FT4水平恢复不明显,与对照组相比差异有统计学意义(P<0.05)。3组的TSH水平差异不明显;脑梗死后抑郁患者TSH的改变量与HAMD评分密切相关(P<0.05),而血FT3、FT4与HAMD评分无相关关系(P>0.05)。结论急性脑梗死患者抑郁症状可能与甲状腺激素水平变化有关,血清FT3、FT4和TSH可作为评价急性脑梗死患者抑郁症状及程度的客观指标。
脑梗死;抑郁症;甲状腺激素
脑卒中后抑郁(post-stroke depression,PSD)是卒中后出现的以冷漠、丧失兴趣、情绪低落、自杀想法、焦虑、睡眠障碍、快感缺乏、病理性激情等为主导症状的常见并发症[1]。发病率报道不一,国内报道临床研究有更高的患病率[2]。早期罹患抑郁的中风幸存者将有持续抑郁、不好的预后以及功能依赖性增加甚至死亡的危险[3]。早期识别及治疗可防止更严重的影响。脑梗死后会导致炎症反应及内分泌变化[4]。脑梗死后神经内分泌的变化似乎是与脑梗死严重性有关,并与认知和/或情绪损伤有关[4,5]。脑梗死后抑郁患者会影响到下丘脑-垂体-甲状腺轴(hypothalamic pituitary thyroid axis,HPT)[6]。本研究就急性脑梗死后抑郁患者甲状腺激素水平的变化进行探讨。
1 资料与方法
1.1 入选及排除标准 脑梗死组:收集2012年11月—2013年12月在我科序贯住院的符合入选标准的急性脑卒中患者120例,据HAMD评分分为脑梗死后抑郁组(60例)及脑梗死后无抑郁组(60例)。脑梗死后抑郁组男性36例,女性24例;年龄(26~75)岁;年龄(55.71±13.13)岁;吸烟36例;饮酒26例;高血压病40例,糖尿病16例;独居30例;在职36例。脑梗死后无抑郁组男性34例,女性26例;年龄(22~70) (59.49±13.00)岁;吸烟38例;饮酒30例;高血压34例;糖尿病20例;独居34例,在职38例。对照组:选取我院体检中心无脑梗死成年人60例,男性28例,女性32例,年龄(24~78)岁(52.60岁±14.40岁);吸烟42例,饮酒28例,高血压病38例,糖尿病26例;独居32例;在职42例。排除脑卒中病史、甲状腺疾病、精神疾病及其他全身严重疾病及家族史。
入选标准:年龄18岁以上,性别不限。所有脑梗死患者均符合2010年中国急性缺血性脑卒中诊治指南卒中诊断标准,本次脑梗死病程在1周以内,首次发病,并经头颅CT和(或)头颅磁共振检查证实。排除标准:病情严重或伴意识障碍,导致不能配合检查者。有明显失语及智能障碍不能顺利完成相关抑郁量表的测评。合并以下严重躯体疾病,如:癌症、癫痫、严重的心肾功能衰竭、肝功能衰竭、甲状腺疾病、自身免疫病等。既往有精神疾病史,包括脑器质性精神病、精神分裂症、双相情感障碍等或既往曾持续两周以上足量服用过抗精神病药、抗抑郁药物、心境稳定剂者。3组年龄、性别、吸烟、饮酒、高血压病、糖尿病等资料比较差异无统计学意义(P>0.05),有可比性。
1.2 卒中后抑郁诊断及分组 发病第14天采用Zung抑郁自评量表(SDS)进行初筛,再由两名专训人员用HAMD-17量表进行测评(Kappa一致性检验示一致性好);HAMD总分≥8分为存在脑梗死后抑郁。卒中的严重程度评分使用SSS量表。抑郁患者需同时符合DSM-Ⅳ“其他的心境障碍-由于脑卒中所致的心境障碍”(编码293.83)诊断标准。将120例急性脑梗死患者分为脑梗死后无抑郁组(60例)及脑梗死后抑郁组(60例),其中轻、中、重度各20例。
1.3 标本留取 梗死组收集发病第2天及第14天清晨06:30~07:00空腹肘静脉血标本(3~5)mL,对照组相同条件采血1次,自然凝固30 min后常温3 000 r/min离心15 min,分离血清,-70℃低温冰箱保存,等待成批检测血清。采用放射性免疫分析法(Radioimmunoassay,RIA)成批测定脑梗死组(发病第2天、第14天)及对照组血清游离三碘甲状腺原氨酶(FT3)、游离甲状腺素(FT4)和促甲状腺素(TSH)水平。试剂盒由北京原子高科股份有限公司提供,灵敏度为0.2 pmol/L。应用Beckman DXC 800全自动生化分析仪测定。
1.4 统计学处理 计量资料以均数±标准差(x± s)表示,计数资料以频数表示。计量资料3组间比较使用one-way ANOVA,组间两两比较采用完全随机设计的两样本t检验。定性资料比较方法为多个样本构成的卡方检验。相关性采用Pearson相关分析。所有数据采用SPSS16.0统计软件包进行统计,检验水准为α=0.05。
2 结 果
2.1 各组临床资料比较(见表1) 3组年龄、性别、吸烟、饮酒、高血压病、糖尿病、是否独居、职业及文化程度等方面比较无统计学意义(P>0.05)。

表1 各组临床资料比较
2.2 各组间FT3、FT4、TSH水平比较(见表2) 脑梗死后无抑郁组及脑梗死后抑郁组发病第2天时血清FT3水平低于对照组,FT4高于对照组(P<0.05),且脑梗死后抑郁组较脑梗死后无抑郁组变化更显著(P<0.05);脑梗死组TSH变化不一致,脑梗死后无抑郁组TSH较对照组增高(P<0.05),而脑梗死后抑郁组TSH水平与对照组相比差异无统计学意义。发病第14天脑梗死后无抑郁组FT3、FT4基本恢复,与对照组比较差异无统计学意义;而脑梗死后抑郁组FT3、FT4水平恢复不明显,与对照组相比差异有统计学意义(P<0.05);3组的TSH,水平差异不明显。
表2 3组FT3、FT4、TSH水平比较(±s)
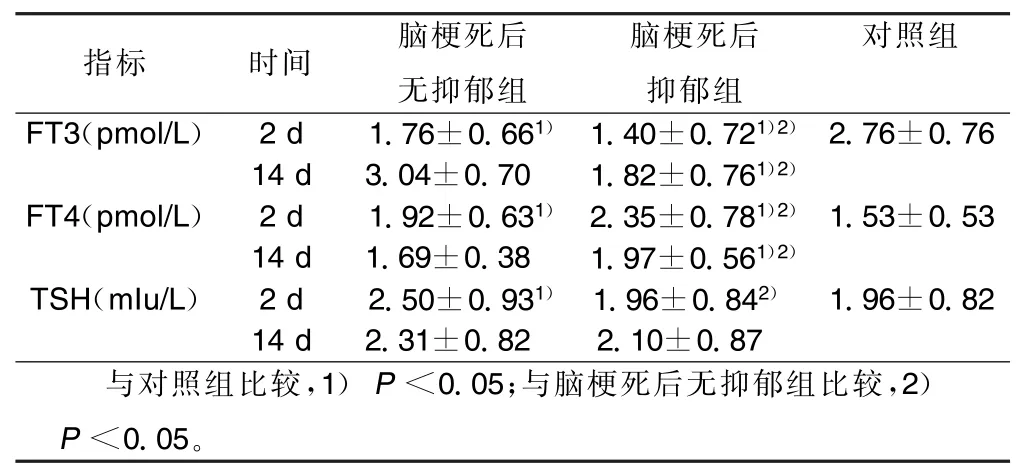
表2 3组FT3、FT4、TSH水平比较(±s)
指标时间脑梗死后无抑郁组脑梗死后抑郁组对照组FT3(pmol/L)2 d1.76±0.661)1.40±0.721)2)2.76±0.76 14 d3.04±0.70 1.82±0.761)2)FT4(pmol/L)2 d1.92±0.631)2.35±0.781)2)1.53±0.53 14 d1.69±0.38 1.97±0.561)2)TSH(mIu/L)2 d2.50±0.931)1.96±0.842)1.96±0.82 14 d2.31±0.82 2.10±0.87与对照组比较,1)P<0.05;与脑梗死后无抑郁组比较,2) P<0.05。
2.3 脑梗死后抑郁患者血FT3、FT4、TSH水平与HAMD评分的相关分析 将脑梗死后抑郁患者2个时间段血FT3、FT4、TSH与HAMD评分进行相关分析显示,脑梗死后抑郁患者血TSH的改变量与HAMD评分密切相关(r=-0.33,P<0.05),而FT3,FT4与HAMD评分无相关系(r=-0.25,-0.13,-0.15,-0.09,P均>0.05)。
3 讨 论
脑梗死作为急性应激事件,可对患者的神经内分泌产生影响,表现为甲状腺功能异常,脑梗死后抑郁者变化更明显。各种急、慢性应激状况均可导致HPA轴的兴奋性增高。脑梗死自身也是一个应激,可导致HPA轴的激活,血浆糖皮质激素水平持续增高。李东芳等[7]对109例急性脑卒中患者研究发现,脑卒中急性期情感障碍患者甲状腺功能发生明显变化,表现为血清低FT3、高FT4和相对低水平的TSH。
在血液中T4及T3均有结合型和游离型两种形式存在,且在周围组织中起作用的主要是游离型。本研究结果显示,急性脑梗死患者无论是否发生脑梗死后抑郁,其甲状腺功能都会发生变化,表现为FT3降低,FT4升高,而在脑梗死后抑郁患者,这一变化更加明显,即脑梗死后抑郁组较脑梗死后无抑郁组,其FT3降低及FT4升高更明显,差异均有统计学意义。国外研究显示[8],抑郁障碍者存在的甲状腺异常主要包括: T 4水平升高,低T3、高rT3,TSH对TRH的反应迟钝等。
脑梗死作为应激事件,可对患者的神经内分泌功能如下丘脑-垂体-甲状腺轴功能产生影响,结合相关研究成果推测其原因如下:①急性脑梗死后脑细胞水肿、血管痉挛、颅内压升高等病理变化直接或间接作用于下丘脑-垂体-甲状腺轴,导致垂体门脉循环受阻及产生各种炎性因子,使其功能受损出现甲状腺激素分泌异常[9]。②各种应激状态下出现的甲状腺功能改变称为低T3综合征,以FT3降低为主。急性脑梗死时机体处于应激状态,T4的内环脱碘酶被激活,T4向r T3的转化加速,而5-’脱碘酶(5-MDI)活性下降,T4向T3转化减慢,T3生成率下降,使血清FT3下降,以降低脑细胞代谢及氧耗,有利于脑损伤的恢复[9],脑梗死中的严重性和功能受损与急性期后的抑郁症状有重要关系[10]。关于抑郁者甲状腺功能变化更明显这一现象进一步的解释是:①抑郁时皮质醇水平增加导致负责T4向T3转化的D2酶受抑制,这有利于通过D3酶产生rT3[11]。②抑郁时下丘脑TRH的激活和随后的甲状腺功能增加——继发于与抑郁症有关的高皮质醇血症可导致T4的增加[12]。脑梗死后无抑郁组患者TSH水平较正常对照组升高,考虑与脑梗死后下丘脑功能受损导致促激素释放激素应激性增加及血清FT3降低的负反馈作用有关,两者均可刺激TSH分泌增加。但在脑梗死后抑郁患者,该变化并不明显,分析其原因考虑与以下因素有关:①抑郁者的TSH昼夜节律异常,表现为TSH夜间脉冲分泌的缺失[13]。而且和正常人相比,25%~30%的抑郁受试者存在TSH对TRH反应迟钝[14],迟钝的TSH反应可能是被抑郁相关的皮质醇增多症或经由肾上腺素机制调节的甲状腺激素水平的升高所诱导的[15]。②抑郁者机体对5-HT活动减少,因此通过代偿性增加TRH的长期释放来尝试使5-HT功能正常和维持甲状腺激素的正常水平[16],并且这种慢性TRH分泌过多可导致垂体TRH受体下调[17]。因此在脑梗死后抑郁患者,TSH的变化涉及HPT轴及HPA轴对应激的复杂反应,其结果并不是单一的。
本研究结果显示,脑梗死后无抑郁患者甲状腺功能于发病2周~3周时已恢复正常,而脑梗死后抑郁组恢复不明显。蔡永良等[18]认为在卒中后抑郁患者,甲状腺功能抑制的时间较长,为21 d,在90 d时才恢复正常。是否与卒中病情严重程度或抑郁的内在因素所致,目前还不清楚,尚需更长时间的随访来进一步明确其机制及甲状腺功能恢复正常的时间。另外本研究还显示,脑梗死后抑郁患者血TSH的改变量与HAMD评分密切相关,这提示脑梗死后甲状腺激素水平的改变,尤其是TSH水平改变,可能参与了脑梗死后抑郁的发病过程。
脑卒中后抑郁发病率高,对患者康复及预后影响大,增加了患者的疾病负担,需引起临床工作者的重视,应对其相关影响因素、机制及诊断等进行进一步研究。研究脑梗死后抑郁患者甲状腺激素水平的变化情况,认为脑梗死患者应常规筛查血清FT3、FT4及TSH。因此及早发现其异常不仅可以用于指导二级预防,且可以预测脑梗死后抑郁发生,指导治疗,对意识障碍及言语障碍等不利于早期发现的抑郁患者尤为重要。
[1] Caeiro L,Ferro JM,Santos CO,et al.Depression in acute stroke[J].J Psychiatr Neurosci,2006,31(6):377-383.
[2] 陈翠荣,赵晓晖,周媛,等.脑卒中后不同时段抑郁的发生及与预后的关系[J].卒中与神经疾,2011,18(4):205-207;221.
[3] Siren E,Kouwenhoven,Marit Kirkevold,et al.Depression in acute stroke:Prevalence,dominant symptoms and associated factors.A systematic literature review[J].J Disability Rehabilitation,2011,33(7):539-556.
[4] Boysen G,Christensen H.Early stroke:A dynamic process[J]. Stroke,2001,32:2423-2425.
[5] Culebras A,Miller M.Absence of sleep-related elevation of growth hormone level in patients with stroke[J].Arch Neurol,
[6] Tichomirowa MA,Keck ME,Schneider HJ,et al.Endocrine disturbances in depression[J].Endocrinol Invest,2005,28(1):89-99.
[7] 李东芳,李光来,薛村水,等.脑卒中急性期抑郁患者甲状腺功能变化的临床研究[J].中华老年心脑血管病杂志,2005,7(1):33-35.
[8] Vandoolaeghe E,Maes M,Vandevyvere J,et al.Hypothalamicpituitary-thyroid-axis function in treatment resistant depression[J].J Affect Disord,1997,43(2):143-150.
[9] 傅宝生,卜辉,王铭维,等.急性脑血管病患者急性期与恢复期血清甲状腺素和皮质醇的变化及临床意义[J].脑与神经疾病杂志,2000,8(4):223-225.
[10] Berg A,Palomäki H,Lehtihalmes M,et al.Poststroke depression:An 18-month follow up[J].Stroke,2003,34(1):138-143.
[11] Nemeroff CB.Clinical significance of psychoneuroendocrinology in psychiatry:Focus on the thyroid and adrenal[J].J Clin Psychiatry,1989,50:13-22.
[12] Bahls SC,de Carvalho GA.The relation between thyroid function and depression:A review[J].Rev Bras Psiquiatr,2004,26(1): 41-49.
[13] Souetre E,Salvati E,Wehr TA,et al.Twenty-four-hour profiles of body temperature and plasma TSH in bipolar patients during depression and during remission and in normal control subjects[J].Am J Psychiatry,1988,145(9):1133-1137.
[14] Prange AJ,Lara PP,Wilson IC,et al.Effects of thyrotropin-releasing hormone in depression[J].Lancet,1972,2(7785):999 1002.
[15] Duval F,Mokrani MC,Crocq MA,et al.Influence of thyroid hormones on morning and evening TSH response to TRH in major depression[J].Biol Psychiatry,1994,35(12):926-934.
[16] Duval F,Mokrani MC,Bailey P,et al.Thyroid axis activity and serotonin function in major depressive episode[J].Psychoneuroendocrinology,1999,24(7):695-712.
[17] Loosen PT,Prange AJ.Serum thyrotropin response to thyrotropin-releasing hormone in psychiatric patients:A review[J].Am J Psychiatry,1982,139(4):405-416.
[18] 蔡永良,张雅丽,刘振宇.脑卒中后抑郁患者甲状腺轴功能改变的研究[J].临床和实验医学杂志,2011,10(19):1491-1493.
R743 R255
:Bdoi:10.3969/j.issn.1672-1349.2015.03.035
:1672-1349(2015)03-0363-04
2014-07-11)
(本文编辑王雅洁)
太原市第二人民医院(太原030002),E-mail:13994229384 @163.com
