夹脊电针对脊髓损伤后大鼠c-fosmRNA 及BNIP3 mRNA 表达影响的实验研究*
2015-07-11李晓宁杨庆红刘双岭单筱淳栾仲秋
李晓宁,张 良,杨庆红,刘双岭,单筱淳,栾仲秋,孔 菲
(1.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨150001;2.安达市红十字会医院,黑龙江 安达151400;3.黑龙江中医药大学,黑龙江 哈尔滨150040;4.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨150040)
脊髓损伤是临床上常见且严重的神经系统疾患。其发生原因多为意外事故如车祸伤、坠落伤等造成患者严重的肢体伤残,对患者本人及其家庭造成极大的身心伤害和经济负担,同时也为社会增添负担。继发性病理机制十分复杂,随着电针疗法的深入研究,电针治疗脊髓损伤的临床疗效已被证实。本研究通过研究夹脊电针对c-fos mRNA 及BNIP3 mRNA 表达的影响,探讨夹脊电针治疗脊髓损伤的作用机制以及c-fos mRNA及BNIP3 mRNA 在脊髓损伤中所起的作用。
1 材料与方法
1.1 动物及分组
将由黑龙江中医药大学实验动物中心提供的45只Wistar 健康雄性大鼠,重量为(200 ±20)g,随机分为3 组:夹脊电针组、模型对照组、假手术对照组。每组再分为1 天、3 天、7 天3 个时间亚组,每个亚组为5 只。
1.2 方法
1.2.1 动物模型制作 用改良的Allen’s 氏法[1]制作脊髓损伤模型。手术操作方法:首先用10%的水合氯醛(300 mg/kg)进行腹腔注射麻醉,再将麻醉后的大鼠于仰卧位固定于拱形鼠台,腹部垫一约3 cm 的软垫,在手术部位皮肤常规消毒。确定手术位置后,选取后背正中切口,在第8 胸椎上2.5 cm、下0.5 cm 切长约3 cm 的纵行切口。通特制手术钳咬除T7~T9全部棘突及椎板,脊髓背侧硬膜表面放置一块弯曲度与脊髓表面相符合的金属垫片作为打击板,面积0.25 cm×0.4cm,用5 g 圆柱状金属棒在玻璃导管的引导下从20 cm 高处落下,行重力打击,致伤力为5 g ×10 cm,以T8为中心造成该段脊髓损伤。脊髓损伤造模术后分层缝合切口。造模成功的标准:①身体痉挛性颤动;②尾巴痉挛性摇动;③硬脊膜内充血或血肿。3 个征象出现2 个即为造模成功。术后处理:保持室温在20℃~25℃,正常喂养。
1.2.2 治疗方法 ①夹脊电针组:造模成功后进行电针治疗,每次30 min,1 天1 次。技术指标:采用KWD-808II 型脉冲电针仪;取穴部位:在距损伤上下端两个椎体的棘突间隙旁开距中线旁开约3 ~4 mm 处取穴。操作:用30 号一寸毫针垂直刺入4 ~5 mm,两组导线分为正负极,分别上下连接针柄,正极在上,负极在下,然后打开电流输出旋钮,使用连续脉冲电流,电流输出强度1 Hz,电压0.5 V。②模型对照组:手术造模后不给予任何治疗,仅常规饲养。③假手术对照组:手术后常规饲养,不给予任何治疗。
1.2.3 检测指标 ①CBS 联合评分法:CBS 评分包括5 项指标,分别为:斜面试验、步态、缩腿反射翻、正反射和趾伸反射,按照时间点对各组大鼠进行动态观察并综合评分,客观准确的评价肢体恢复的情况。②c-fos mRNA 表达的检测:各组动物在进行麻醉后,开胸腔暴露出心脏,依次灌注150 ml 生理盐水,使其经左心室流入主动脉,直至流出清亮液体,灌注多聚甲醛40 g/L 固定,常规脱水、包埋,连续切片呈冠状。取标本切片,进行杂交,继加生物素化鼠抗地高辛抗体标记物,最后DAB 显色。③BNIP3 mRNA 表达的检测:对各组大鼠分别取材后常规石蜡包埋、切片,采用RT-PCR 方法检测,经过匀浆化作用,分离阶段,RNA 的沉淀、洗脱、再溶解,用于逆转录,观察各组脊髓损伤后不同时间段内BNIP3 mRNA 表达结果。
1.3 统计学处理
处理运用SPSS19.0 进行统计学分析,CBS 评分、c-fos mRNA 基因表达比较采用单因素方差分析,以P <0.05 示检验的差别有统计意义。BNIP3 mRNA 检测,符合正态分布采用t 检验;不符合正态分布采用Wilcoxon 检验,P <0.05 示检验的差别有统计意义。
2 实验结果
2.1 CBS 联合评分
实验中对大鼠的CBS 五项指标进行观察并评分,分别在术后第1 天、3 天、7 天对大鼠进行联合行为评分,干预后不同时间CBS 评分的差异有统计学意义。3 组大鼠CBS 评分的组间差异总体上有统计学意义。干预1 天、3 天后,3 组大鼠的动作完成无显著差异;干预7 天后,夹脊电针组大鼠的动作完成明显优于假手术组和模型组,具有显著性差异。见表1。
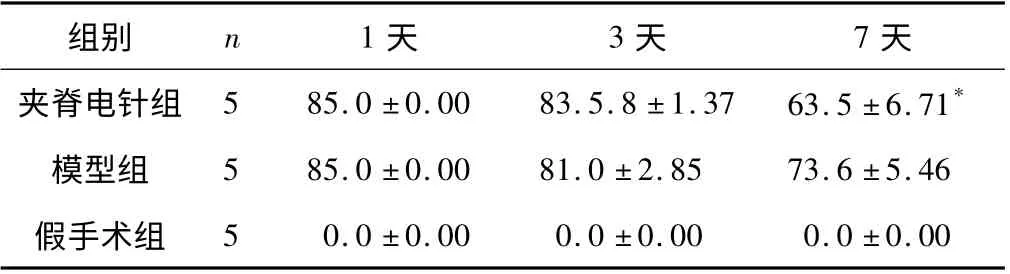
表1 各组CBS 联合评分比较
2.2 c-fos mRNA 的表达结果
c-fos mRNA 阳性表达,在前角神经元处表达最强,也可见于后角的中小神经元等处。假手术组脊髓内存在少量c-fos mRNA 弱阳性的神经细胞,且3 个时间点表达的变化不显著;模型组和夹脊电针组的cfos mRNA 表达,在术后均迅速升高,在术后第1 天时明显升高,第3 天时,表达逐渐下降,第7 天时有所回升;夹脊电针组和模型组在各时间点的c-fos mRNA表达阳性细胞数量,与假手术组相比,差异具有显著意义(P <0.05);术后第1 天时,夹脊电针组与模型组相比,c-fos mRNA 表达阳性细胞数低于模型组;术后第3 天时,夹脊电针组与模型组相比,不具有显著差异;术后第7 天时,夹脊电针组与模型组相比,c-fos mRNA 表达阳性细胞数高于模型组。见表2。

表2 各组c-fos mRNA 表达结果比较
2.3 各组BNIP3 mRNA 表达水平比较
由表3 可知,夹脊电针组内比较,治疗7 天组与治疗1 天和3 天组相比,BNIP3 mRNA 表达水平明显降低(P <0.05),差异具有统计学意义;夹脊电针组与模型夹脊电针组相比,夹脊电针组7 天时,BNIP3 mRNA表达水平有明显降低(P <0.05),具有统计学意义。
表3 各组治疗不同时间BNIP3 mRNA 表达水平比较(±s)
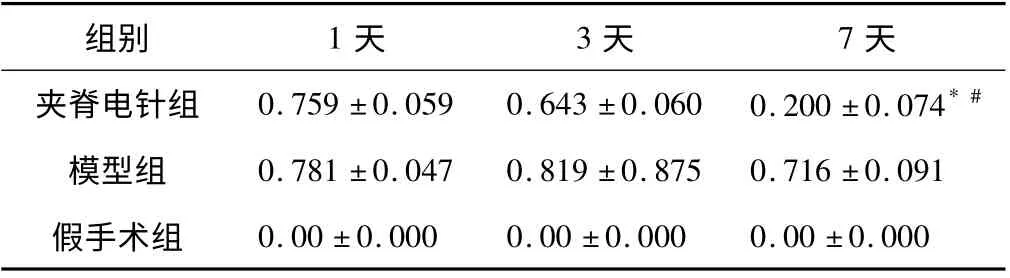
表3 各组治疗不同时间BNIP3 mRNA 表达水平比较(±s)
注:与3 天比较,* P <0.05;与模型组7 天比较,#P <0.05。
组别 1 天 3 天 7天夹脊电针组 0.759 ±0.059 0.643 ±0.060 0.200 ±0.074*#模型组 0.781 ±0.047 0.819 ±0.875 0.716 ±0.091假手术组0.00 ±0.000 0.00 ±0.000 0.00 ±0.000
3 讨论
夹脊电针治疗脊髓损伤的机理复杂,从中医角度讲,督脉损伤是脊髓损伤的病理基础,夹脊电针通过疏通督脉,起到振奋阳气使阴阳调和的作用。夹脊电针[2]对脊髓损伤大鼠运动及感觉功能恢复取得了一定临床疗效。从现代医学角度讲,夹脊穴位于脊神经后支,电刺激可直接作用于脊髓及其包膜,调节血液供应及神经功能。对夹脊穴电刺激,可影响到与交感神经有联系的脊神经,使机体产生反应,而交感神经通过神经体液的调节,释放有关的化学介质,从而治疗疾病。有学者很早提出[3]:夹脊电针形成电场,可以促进脊髓纤维的再生;夹脊电针可以通过提高抗氧化酶的活性,使组织免受自由基的继发损伤;使细胞凋亡因子得到抑制,伤区脊髓组织的微循环得以改善,促进脊髓损伤的恢复。
本实验运用CBS[4]联合评分法进行评分,考虑到造模后,对大鼠损伤较大,游泳实验易引起伤口感染,影响实验结果,故采用85 分评分标准,使观察指标更精准和客观。通过CBS 评分法得出:干预1 天、3 天后,3 组大鼠的CBS 评分比较,差异均无统计学意义;干预7 天后,夹脊电针组大鼠的CBS 评分与假手术组和模型组比较,差异具有显著意义。说明夹脊电针的治疗短期内疗效一般,但长期治疗效果显著。
c-fos 基因属于即刻早期基因的一种,在正常生理情况下,c-fos 基因的阳性细胞数表达在神经元及细胞中呈低水平,中枢神经元受到各种外界刺激后,受体和第二信使被激活,诱导c-fos 转录合成m RNA,并译成蛋白在胞浆中与目的基因结合,使目的基因的表达被激活,促使其产生迅速、一过性表达。c-fos 基因被诱导的数量与所受刺激强度一致,可作为研究脊髓损伤后神经系统功能及结构的指标[5]。有学者研究发现:刺激因素的不同对c-fos 基因表达出现的快慢及持续时间长短有所不同。本实验通过观察得出:3组间相比较,假手术组分别与夹脊电针组、模型组相比,c-fos mRNA 表达的阳性细胞数显著升高;3 个时间点相比较,夹脊电针组和模型组的c-fos mRNA 表达的阳性细胞数1 天达到最高,3 天时明显下降,这提示了大鼠脊髓损伤后c-fos mRNA 的表达增强与脊髓继发性损伤有密切关系,这可能与一种机体对机械刺激以及疼痛的应激性反应有关;7 天时c-fos mRNA表达的阳性细胞数表达回升,在第7 天时,夹脊电针组与模型组比较,明显高于模型组。根据Hayashi 等[6]研究,发现即刻早期基因可能促进神经营养因子的表达,进而促进损伤神经细胞的再生;此外,柯青[7]在研究针刺促进脊髓可塑性的关系中发现:第7 天时,针刺脊髓及背根节c-fos mRNA 的表达有促进作用,表达显著增加,提示c-fos mRNA 可能是促进脊髓可塑性的分子机制之一。故第7 天时,模型对照组与夹脊电针组c-fos mRNA 表达水平回升。
BNIP3 属于Bcl2 家族成员,BNIP3 蛋白C 末端含有一个跨膜区域可与线粒体膜结合,引起线粒膜通透性孔开放,膜电位降低,活性氧增加,导致细胞死亡[8]。而BNIP3 mRNA 的促细胞凋亡机制[9]主要有与缺氧以及缺氧诱导因子有关的途径、促细胞凋亡线粒体途径、非依赖Caspase 的细胞凋亡途径。于大堂等[10]发现脊髓损伤大鼠线粒体自噬相关蛋白BNIP3表达增高。可见BNIP3 表达与脊髓损伤密切相关。
综上所述,夹脊电针治疗脊髓损伤不仅可以改善运动、感觉功能,通过抑制脊髓损伤后促凋亡细胞
BNIP3 mRNA 的表达以及对脊髓损伤有益的即刻凋亡基因c-fos 基因的表达,起到促进脊髓可塑性、抑制细胞凋亡的作用,而且长期疗效较好,是安全、经济、环保的优选治疗方法,为脊髓损伤的长期、分阶段治疗提供了理论依据。脊髓损伤的各阶段c- fos 基因、BNIP3 mRNA 对细胞凋亡的影响已得到证实,但其对脊髓损伤后恢复的作用机制仍不十分明确,还需进一步探讨。
[1] Allen AR.Surgery of experimental lesions of spinal cord eduivalent to crush injury of fracture dislocation. Preliminary report[J]. JAMA,1991,57:878-880
[2] Michael GF,Charles HT,F R C S,et al.The effect of direct-current field on recovery from experimental spinal cord injury[J]. J Neurosurg,1988,68:781-792
[3] 刘晓华,沈梅红,李忠仁.针刺对缺血性脑血管病的分子生物学调节机制的研究进展[J].针灸临床杂志,2010,26(6):62-64
[4] Richard Baffour,Kranthi Achanta.Synergistic effect of basic fibroblast grouch factor and methyprednis-one on neurological function after experimental spinal cord injury[J].Neurosurg,1995,83:105-109
[5] Pitsikas N,Zisopoulou S,Pappas I,et al.The selective 5-HT(6)receptor antagonist Ro04-6790 attenuates psychotomimetic effects of the NMDA receptor antagonist MK-801[J].Behav Brain Res,2008,188(2):304-309
[6] Hayashi M,Ueyama T,Nemoto K,et al. Sequential mRNA expression for immediate early genes,cytokines,and neurotropins in spinal cord injury[J].J Neurotrauma,2000,17(3):203-218
[7] 柯青.c-fos、c-jun 与脊髓可塑性及针刺促进脊髓可塑性关系的探讨[D].昆明:昆明医学院,2003
[8] Chen G,Cizeau J,Vande VC,et al.Nix and Nip3 form a subfamily of pro- apoptotic mitochondrial proteins[J]. J Biol Chem,1999,274(1):7-10
[9] 邓茜,李志平. BNIP3 基因促细胞凋亡研究新进展[J]. 肿瘤,2009,29(8):807-811
[10] 于大堂,李茗芳,倪兵.大鼠脊髓损伤后神经元线粒体自噬相关蛋白LC3 和BNIP3 的表达[J]. 第三军医大学学报,2013,35(9):841-845
