首乌方对左旋多巴诱导异动症大鼠的干预作用及其机制
2015-07-07刘洋孙丹丹王丹巧梁嵘
焦 ,刘洋,孙丹丹,王丹巧Δ,梁嵘
(1.中国中医科学院 医学实验中心 北京市中医药防治重大疾病基础研究重点实验室,北京 100700; 2.北京中医药大学 基础医学院,北京 100029)
首乌方对左旋多巴诱导异动症大鼠的干预作用及其机制
(1.中国中医科学院 医学实验中心 北京市中医药防治重大疾病基础研究重点实验室,北京 100700; 2.北京中医药大学 基础医学院,北京 100029)
目的 探讨首乌方对左旋多巴诱导的异动症(levodopa induced dyskinesia,LID)大鼠的干预作用及其机制。方法 32只雄性SPF级SD大鼠,随机分为4组:假手术组(sham operation,SO组)、异动症模型组(levodopa induced dyskinesia,LID组)、首乌方高剂量组(shouwufang-high dose,SWF-H组)、首乌方低剂量组(shouwufang-low dose,SWF-L组),每组8只。单侧双位点注射6-羟基多巴胺造成PD模型后,灌胃给予多巴丝肼(30 mg/kg)22 d诱发LID,首乌方剂量组同时灌胃(SWF-H含生药27 g/kg,SWF-L含生药18 g/kg)。观察各组LID发病率并进行动物AIM评分;清醒自由活动状态下脑内纹状体微透析、水杨酸捕获羟自由基方法采样,高效液相-电化学检测动态观察病变靶器官细胞外液中羟自由基指标(2,3-DHBA、2,5-DHBA)的浓度变化;检测大鼠体内超氧化物歧化酶(SOD)及丙二醛(MDA)水平的变化。结果 首乌方可明显降低大鼠LID的发病率及AIM评分,降低纹状体细胞外液2,3-DHBA及2,5-DHBA的浓度、并显著降低血清内MDA的水平。结论 首乌方可以改善大鼠LID的行为学指标,有预防及干预LID的作用,其机制可能与减轻整体特别是病变靶器官的氧化应激损伤有关。
左旋多巴诱导异动症;氧化应激;首乌方;微透析
左旋多巴(levodopa,L-DOPA)是临床上治疗帕金森病(parkinson’s disease,PD)的“金标准”用药,对大多数患者可取得显著疗效,然而长期用药后则会出现副作用或并发症。L-DOPA诱导的异动症(levodopa-induced dyskinesia, LID)是其长期治疗过程中普遍出现的严重问题。累计资料分析显示L-DOPA治疗4~6年后,约40%的患者会出现LID,治疗9~15年后,发生率可上升到90%[1],而且随着疾病的加重和治疗时间的延长,LID的程度加重,发生频率进一步增加,因而限制了L-DOPA的长期临床应用。
国内外许多学者对于LID进行了大量研究,其病理生理机制至今仍不十分明确[2-4]。研究表明PD是LID的发病基础,PD的严重程度及治疗时L-DOPA的脉冲样刺激对LID发生发展有直接影响[5]。而不论在PD的进展或LID的发病机制中,氧化应激损伤均参与其中并发挥重要的作用[6-7]。
由于LID目前的治疗方法有限,应用长效多巴胺(dopamine,DA)制剂、神经保护剂、谷氨酸拮抗剂、抗精神病药、立体定向苍白球损毁术以及丘脑底核或苍白球内侧部的脑深部电刺激术等,效果并不满意且存在一定的副作用,因此,如何找到干预和治疗LID的有效措施,是PD治疗中急需解决的临床问题。
首乌方(Shouwufang,SWF)由首乌、鹿茸、天麻、钩藤等中药组成,补益肝肾、强筋壮骨、息风止颤。临床研究表明,本方在配合多巴丝肼治疗PD患者时,可以提高多巴丝肼的临床疗效,减少多巴丝肼的用量[8]。本课题组既往的实验研究显示,SWF可提高PD大鼠纹状体细胞外液DA递质的水平,减少外源性L-DOPA引起的血液、脑细胞外液药物浓度的波动[9],提示了干预LID的可能性。因此,本研究拟在PD基础上在LID大鼠模型,并采用水杨酸捕获羟自由基的脑内微透析技术手段,通过观察SWF对其行为学指标、活体靶器官细胞外液及整体氧化/抗氧化物质水平的影响,探讨SWF对LID的干预作用及其可能的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:雄性SD 大鼠,32只,体质量200~250 g,SPF级,由北京维通利华实验动物技术有限公司提供,合格证号:11400700022793。
1.1.2 药品与试剂:多巴丝肼片(madopar,每片0.25 g,含L-DOPA 200mg与苄丝肼50 mg)购自上海罗氏公司;阿朴吗啡购自中国食品药品检定研究所,批号100839;首乌方(何首乌20 g,鹿茸3 g,天麻10 g,钩藤15 g,厚朴15 g等中药组成)煎剂为本实验室自制,3次水煎液合并浓缩为生药量3.6 g/mL。水杨酸钠、6-羟基多巴胺(6-OHDA)、辛烷磺酸钠、2,3-二羟基苯甲酸(2,3-DHBA)、2,5-二羟基苯甲酸(2,5-DHBA)均购自Sigma公司,乙腈,乙酸,磷酸和甲醇购自Fisher公司。6-OHDA和阿朴吗啡分别溶解于生理盐水中,避光保存。超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)测试盒购自南京建成科技有限公司。
1.1.3 仪器:微透析系统CMA/12脑部探针(透析膜长4 mm)及探针套管、CMA/402微量泵、CMA/470低温样品自动收集器,清醒动物活动装置(瑞典CMA公司)。手术使用设备:大鼠脑立体定位仪STRONG8003、动物体温维持仪269001、颅钻/90-102(深圳瑞沃德公司)。高效液相色谱检测系统(德国Sykam S-2100)。
1.2 方法
1.2.1 动物造模、给药及微透析过程:6-OHDA制备PD大鼠模型[10-11]:大鼠腹腔注射10%水合氯醛(3.5 mL/kg)麻醉后,头颅水平位固定在脑立体定位仪上,参照大鼠脑立体定位图谱确定黑质致密部(substantia nigra pars compacta,SNc),中脑腹侧被盖部(ventral tegmental area,VTA)三维坐标位置。SNc:A:-4.8 mm,R:+2.0 mm,V:-8.0 mm;VTA:A:-4.8 mm,R:+1.2 mm,V:-8.0 mm。每个位点注射6-OHDA 生理盐水(含维C)8 μL(2 μg/μL),SO组注射等量生理盐水。
分组及给药:PD大鼠随机分为LID组(给予多巴丝肼30 mg/kg),SWF-H组(多巴丝肼30 mg/kg+SWF 27 g/kg),SWF-L组(多巴丝肼30 mg/kg + SWF 18 g/kg),灌胃给药每天1次,连续22d,SO组灌胃相应体积的纯净水。每组8只大鼠。最后1次异常不自主运动(abnormal involuntary movement, AIM)评价后麻醉大鼠,于纹状体内(striatum:A:+0.2 mm,L:+3 mm,V:-7.5 mm)埋入探针套管,次日在大鼠清醒自由活动状态下插入脑探针,进行微透析取样。微透析过程:先以生理盐水平衡1 h后换为5 mmol/L水杨酸钠林格液以捕获纹状体细胞外液的羟自由基;以2 μL/min的速度灌流,每30 min收集1 管,取前3 管测定的数值均值作为基础水平(0 min),然后灌胃最后1次药物或纯净水,并认每30 min 收集1 管透析液直至240 min。微透析样品采用高效液相-电化学检测方法分析。探针在使用前测定体外回收率,按此折算透析液中各种检测物质的浓度。微透析结束后麻醉大鼠,取腹主动脉血,4 ℃低温过夜后离心取上清液。
1.2.2 行为学评价:6-OHDA造模术后21 d,腹腔注射0.5 mg/kg阿朴吗啡,记录1 h内大鼠向健侧旋转圈数,大于100圈每小时为PD模型制作成功。
LID的行为学评价采用AIM评分:分别就前肢及口面部不自主运动、轴性及旋转运动进行评定[12],根据其严重程度划分为5个等级(0~4分),其中0分:无;1分:偶尔出现;2分:经常出现;3分:持续存在,刺激使之停止;4分:持续存在,刺激也不能使之停止。每7 d评价1次,总计评价4次21 d。每次评价过程如下:口服多巴丝肼后每30 min记录一次分数,至给药后120 min。AIM分数为4个时间点评价分数的总和,最高值为64分。
1.2.3 高效液相色谱-电化学(HPLC-ED)法测定2,3-DHBA,2,5-DHBA浓度。检测方法参照本实验室以前的研究[13]。Sykam C18分析柱(2.1 mm×100 mm,3 μm)。Antec Decade ⅡSDC电化学检测器。流动相:乙二胺四乙酸二钠(0.027 mmol/L)、辛烷磺酸钠(0.74 mmol/L)、氯化钾(2 mmol/L)、磷酸二氢钠(100 mmol/L)、甲醇(15%)、乙睛(1%)、乙酸(0.05%)。流速0.2 mL/min,柱温:30 ℃,工作电压0.52 V,进样量20 μL。
1.2.4 SOD及MDA检测:MDA测定利用硫代巴比妥酸比色法,SOD采用黄嘌呤氧化酶法测定。实验步骤按照南京建成试剂盒说明书进行操作。
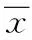
2 结果
2.1 首乌方对LID大鼠行为学的影响 给SO组大鼠灌胃生理盐水,无异常动作发生;多巴丝肼反复用药,诱发了PD大鼠出现异常不自主运动——LID:主要表现为轴性肌张力障碍,颈部和躯干上部向毁损对侧扭动,甚至不能保持平衡;毁损对侧上肢或下肢异常不自主、无目的运动;对侧旋转等。与SO组相比,LID组AIM评分在7、14、21 d显著升高(P<0.05,P<0.01); SWF-H组则在21 d显著降低了这一指标,仅为LID组的30%左右(P<0.01),见表1。动态观察AIM评分>20的严重LID的发生率, LID组在21 d达到75.0%;而SWF-L组和SWF-H组分别为50.0%,12.5%,见表2。
表1 SWF对LID大鼠AIM评分的影响,分)Tab.
*P<0.05,**P<0.01,与SO组相比,compared with SO group;#P<0.05,与LID组相比,compared with LID group
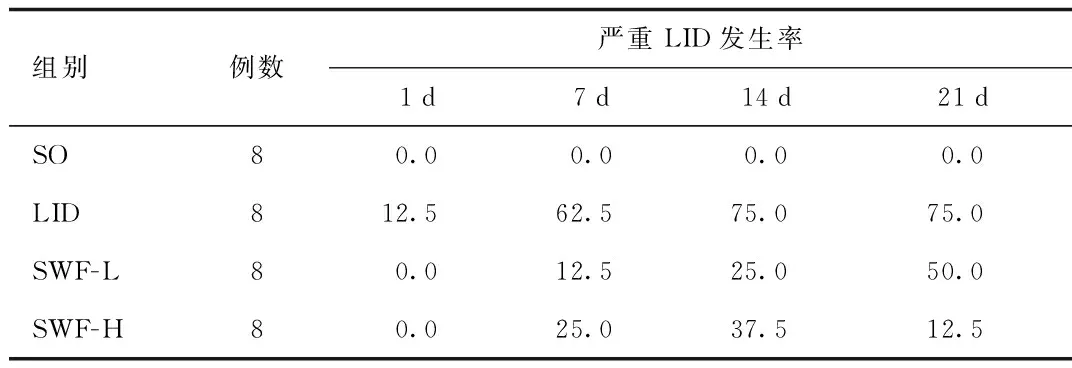
表2 各组严重LID发生率(AIM评分>20,%)Tab.2 The incidence of severe LID(AIM score>20,%)
2.2 SWF对LID大鼠纹状体细胞外液2,3-DHBA和2,5-DHBA浓度的影响 采用水杨酸捕获法,使脑内极不稳定的羟自由基形成稳定的2,3-DHBA和2,5-DHBA,通过HPLC-EDC方法检测。结果可以看到0~240 min内,LID组2,3-DHBA浓度一直处于较高水平,与SO组相比,有6个时间点其升高有统计学意义(P<0.05,P<0.01);SWF-L组和SWF-H组在观察时间内一直低于LID组,其中SWF-H组有1个时间点降低有统计学意义(P<0.01)。见图1。
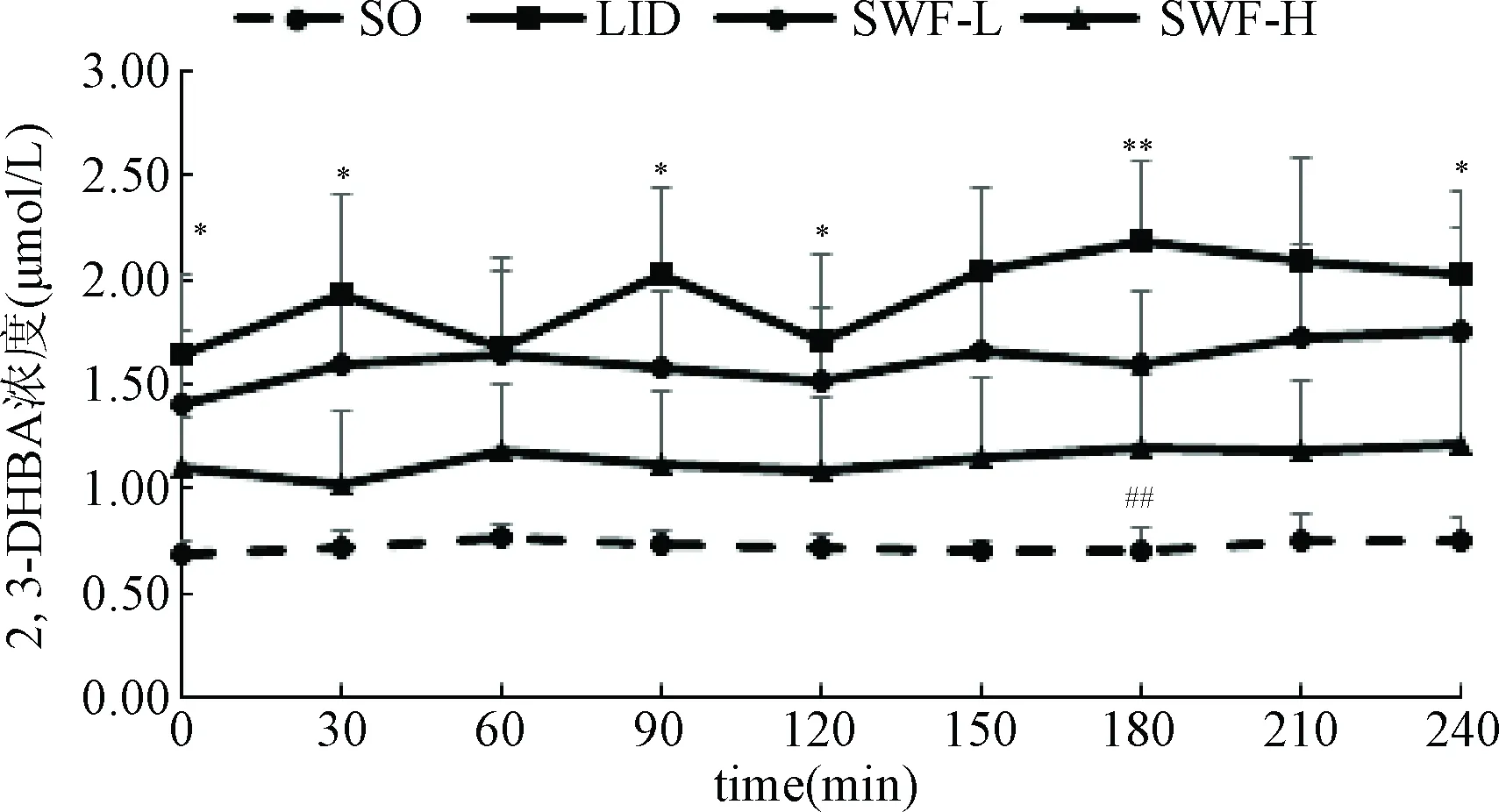
图1 首乌方对LID大鼠纹状体细胞外液2,3-DHBA的影响*P<0.05,**P<0.01,与SO组相比;##P<0.01,与LID组相比Fig.1 Effect of SWF on extracellular concentration of*P<0.05,**P<0.01,compared with SO group;##P<0.01,compared with LID group
LID与SWF 2组的2,5-DHBA浓度均升高。与SO组相比,LID组,在除240 min外其余各点均显著升高(P<0.05,P<0.01);SWF-L组在0~240 min内各时间点均高于SO组(P<0.05,P<0.01);SWF-H组有4个时间点显著高于SO组(P<0.05,P<0.01),但与LID组间差异无统计学意义。见图2。

图2 首乌方对LID大鼠纹状体细胞外液2,5-DHBA浓度的影响 *P<0.05,**P<0.01,与 SO group相比较Fig.2 Effect of SWF on extracellular concentration of *P<0.05,**P<0.01,compared with SO group
2.3 SWF对LID模型大鼠血中SOD活力和MDA浓度的影响 LID组大鼠血中MDA浓度为(4.7±0.9)nmol/mL,明显高于SO组(P<0.01),与LID组比较SWF高、低组MDA水平显著降低(P<0.01)。LID组、SWF-L组和SWF-H组的SOD活力分别为(280.8±13.0) U/mL,(291.1±64.1) U/mL及(251.2±9.1) U/mL;高于SO组的(239.1±14.1)U/mL,但各组之间差异无统计学意义。见图3。

图3 首乌方对LID大鼠血中MDA浓度(A)和SOD活力(B)的影响**P<0.01,与SO组相比较;##P<0.01,与LID组相比较Fig.3 Effect of SWF on MDA concentration (A) and activity of**P<0.01,compared with SO group;##P<0.01,compared with LID group
3 讨论
LID是L-DOPA治疗PD过程中出现的严重并发症,皮质-基底神经节-丘脑皮层环路是其发生的结构基础,由于该环路受多种神经元、神经递质、受体的调控,机制异常复杂[14]。近年来,对于LID的突触前机制、突触后可塑性、GABA 能和谷氨酸能神经元及非多巴胺能调节因子等机制研究报道较多,取得了新进展[15-16]。而本研究从氧化应激途径探讨在PD治疗中与L-DOPA有协同作用的中药SWF对LID的干预作用,为LID的防治提供新的思路。
多数研究表明,氧化应激损伤参与PD的进展并进而参与LID的发生机制,基础研究最常使用的6-OHDA造成的动物模型即模拟了PD的氧化应激损伤机制[17]。本研究应用6-OHDA所致PD基础上的LID大鼠模型,是在6-OHDA神经毒性、氧化应激损伤基础上,附加L-DOPA反复波动性刺激诱发的。模型在PD阶段,黑质、纹状体的氧化/抗氧化功能已失平衡,过度产生的高活性及毒性的活性氧、羟自由基等,与细胞膜上的不饱和脂肪酸形成脂质过氧化物,破坏了生物膜的结构,改变了对离子的通透性、受体的功能等,生物酶活性丧失,线粒体、溶酶体等细胞器裂解,造成DA能神经元损伤或死亡[18]。在此基础上,外源性L-DOPA异常波动性刺激,进一步改变了基因表达、信号转导及神经元可塑性,使本已失衡的DA能环路功能更加异常。最近有研究甚至提出,L-DOPA长时间给药后加重PD患者DA神经损伤的可能原因是其在代谢过程中产生内源性6-OHDA[19],因此L-DOPA自身代谢产生的活性氧和自由基等更加重了氧化应激损伤,促进PD的进展及LID的发生[20]。因此,靶器官氧化应激指标的观察,对于LID病理生理学和药理学研究具有极其重要的意义。
羟自由基是氧自由基的一种,在研究中经常被用于代表性观测指标。由于羟自由基在活体脑内寿命极短,性质活泼,产生后即在该部位造成神经元损害并随之迅速代谢,故难于直接测定,以往测定脑匀浆中羟自由基的方法也具有较大的局限性。本实验采用水杨酸捕获羟自由基的微透析采样法,使半衰期极短、直接检测困难的羟自由基在活体内被水杨酸捕获而形成稳定的2,3-DHBA和 2,5-DHBA,经HPLC电化学方法检测。该方法能够反映LID疾病模型动物在清醒、自由活动状态下病变靶组织细胞外液中羟自由基水平的动态变化,使氧化应激损伤的化学研究更真实客观。
本实验中,LID组大鼠出现运动、肌张力障碍等行为学症状,病变靶器官纹状体细胞外液的羟自由基指标2,3-DHBA和2,5-DHBA水平明显升高,反映了局部氧化应激损伤的严重程度。整体受自由基攻击程度的氧化物指标MDA水平在LID组异常增高,并反应性地引起抗氧化物SOD水平升高。SOD在胞浆和线粒体中分别以Cu/ZnSOD及MnSOD的形式存在,使超氧自由基歧化为水,以对抗氧化损伤[21]。有报道:使用酶学与原位杂交技术发现PD患者黑质部SOD水平增高[22],认为这种改变可能为代偿性反应,与本实验结果一致,也提示在PD和LID的机制中,氧化与抗氧化水平动态变化具有重要意义。
中药SWF在本实验中显示了可明显减轻大鼠LID的发病率及AIM评分、降低纹状体细胞外液2,3-DHBA及2,5-DHBA的浓度,并显著降低血浆内MDA水平的效果。提示SWF可能直接或通过减缓L-DOPA代谢而间接抑制靶器官细胞外液羟自由基指标、调节整体氧化/抗氧化功能动态平衡发挥抗氧化作用,减轻病变局部脑组织的氧化应激损伤,改善失衡的DA能环路功能,从而干预了PD的进展和LID的形成和维持机制,表现为模型动物LID发病率降低和运动障碍程度减轻。
中医学将PD、LID产生的震颤、舞蹈症、手足徐动症等归属于颤证、震掉、痉病范畴,辨证多为肝肾阴虚、风痰阻络、肝郁血瘀、气血两虚等。SWF以入肝肾两经的首乌、鹿茸为主药,补益肝肾、强筋壮骨;辅以天麻、钩藤平肝熄风;佐以厚朴下气消痰,使以川芎引药上行入脑。诸药合用,共奏补肝肾、益精血、祛风止颤之效。因此,可以说首乌方是在中医理论指导下,切中PD、LID中医病机的合理中药组方。现代药理学研究显示:首乌、鹿茸、天麻、钩藤具有抑制血清、脑内过氧化脂质生成,或抑制脑内单胺氧化酶-B、增强抗氧化能力的作用[23-26]。本课题组前期的研究也证实:SWF在6-OHDA所致的PD大鼠模型中,抑制L-DOPA引起的脑组织内羟自由基升高[9]。进而采用清醒自由活动的PD模型大鼠脑内和血液双位点同步微透析-HPLC检测技术,观察到SWF不仅抑制PD模型大鼠纹状体细胞外液羟自由基产生,尚可增加DA递质的浓度、平缓外源性L-DOPA投与产生的波动,并升高L-DOPA的血药浓度[9, 27]。这也为本方干预PD及LID的作用机制提供了更多的药理学依据。
综上所述,本研究采用了PD基础上的LID大鼠模型及水杨酸捕获羟自由基的脑内微透析技术手段,通过观察SWF对其行为学指标、活体靶器官细胞外液及整体氧化/抗氧化物质水平的影响,证明了氧化应激损伤参与了LID的发生机制,SWF通过减轻整体特别是病变靶器官的氧化应激损伤,改善LID大鼠行为学症状、减少了LID发病率。SWF抗氧化作用的分子机制和形态学研究尚待进一步进行。
[1] Ahlskog JE,Muenter MD.Frequency of levodopa-related dyskinesias and motor fluctuations as estimated from the cumulative literature[J].Mov Disord,2001,16(3): 448-458.
[2] Hung AY,Schwarzschild MA.Treatment of Parkinson’s disease: what’s in the non-dopaminergic pipeline?[J].Neurotherapeutics,2014,11(1): 34-46.
[3] Finlay CJ,Duty S,Vernon AC.Brain morphometry and the neurobiology of levodopa-induced dyskinesias: current knowledge and future potential for translational pre-clinical neuroimaging studies[J].Front Neurol,2014(5):95.
[4] Huot P,Johnston TH,Koprich JB,et al.The pharmacology of L-DOPA-induced dyskinesia in Parkinson’s disease[J].Pharmacol Rev,2013,65(1): 171-222.
[5] Putterman DB,Munhall AC,Kozell LB,et al.Evaluation of levodopa dose and magnitude of dopamine depletion as risk factors for levodopa-induced dyskinesia in a rat model of Parkinson’s disease[J].J Pharmacol Exp Ther,2007,323(1): 277-284.
[6] Gaki GS,Papavassiliou AG.Oxidative stress-induced signaling pathways implicated in the pathogenesis of Parkinson’s disease[J].Neuromolecular Med,2014,16(2): 217-230.
[7] Muller T.Detoxification and antioxidative therapy for levodopa-induced neurodegeneration in Parkinson’s disease[J].Expert Rev Neurother,2013,13(6): 707-718.
[8] 崔玲,于向东,崔军.自拟补肾平颤方配合美多巴片治疗帕金森病的临床疗效观察[J].中国中西医结合杂志,2003,23(7):504-507.
[9] 牛晓红,王丹巧,孙晓芳,等.首乌方与美多芭同用对PD模型大鼠纹状体细胞外液神经化学物质的影响[J].中国实验方剂学杂志,2013,19(3):155-159.
[10] Thomas J,Wang J,Takubo H,et al.A 6-hydroxydopamine-induced selective parkinsonian rat model: further biochemical and behavioral characterization[J].Exp Neurol,1994,126(2): 159-167.
[11] 徐岩,孙圣刚,曹学兵.左旋多巴诱发异动症大鼠模型的制作及其行为学评估[J].中华物理医学与康复杂志,2005,27(11):649-652.
[12] Lee CS,Cenci MA,Schulzer M,et al.Embryonic ventral mesencephalic grafts improve levodopa-induced dyskinesia in a rat model of Parkinson’s disease[J].Brain,2000,123 ( Pt 7): 1365-1379.
[13] 吴兆恩,牛晓红,张美玉,等.大鼠脑微透析样品中左旋多巴、多巴胺及其代谢产物、羟自由基的测定[J].药物分析杂志,2012,32(2):217-220.
[14] Santini E,Valjent E,Fisone G.Parkinson’s disease: Levodopa-induced dyskinesia and signal transduction[J].FEBS J,2008,275(7): 1392-1399.
[15] Calabresi P,Di Filippo M,Ghiglieri V,et al.Molecular mechanisms underlying levodopa-induced dyskinesia[J].Movement Disorders,2008,23(suppl 3): S570-S579.
[16] Brotchie JM.Nondopaminergic mechanisms in levodopa-induced dyskinesia[J].Movement Disorders,2005,20(8): 919-931.
[17] Elkon H,Melamed E,Offen D.Oxidative stress,induced by 6-hydroxydopamine,reduces proteasome activities in PC12 cells: implications for the pathogenesis of Parkinson’s disease[J].J Mol Neurosci,2004,24(3): 387-400.
[18] Yuan H,Zheng JC,Liu P,et al.Pathogenesis of Parkinson’s disease: oxidative stress,environmental impact factors and inflammatory processes[J].Neurosci Bull,2007,23(2): 125-130.
[19] Borah A,Mohanakumar KP.L-DOPA induced-endogenous 6-hydroxy-dopamine is the cause of aggravated dopaminergic neurodegeneration in Parkinson’s disease patients[J].Med Hypotheses,2012,79(2): 271-273.
[20] Basma AN,Morris EJ,Nicklas WJ,et al.L-dopa cytotoxicity to PC12 cells in culture is via its autoxidation[J].J Neurochem,1995,64(2): 825-832.
[21] 朱秀敏.超氧化物歧化酶的生理活性[J].当代医学,2011,17(15):26-27.
[22] 胡俊,史树贵,李露斯.神经系统疾病与超氧化物歧化酶[J].中国临床康复,2005,9(33):142-144.
[23] 王巍,王丹巧.何首乌脑保护作用机理研究的进展[J].中国中西医结合杂志, 2005, 25(10):955-959.
[24] 田丽丽,罗颉,杨鸣琦,等.鹿茸对小鼠脑组织抗氧化指标和凋亡相关蛋白表达的影响[J].西北农林科技大学学报(自然科学版),2013,41(2):35-40.
[25] 李海龙,粟艳,厚荣荣,等.天麻素对百草枯和代森锰诱导的小鼠脑黑质多巴胺能神经元损伤的保护作用[J].成都中医药大学学报,2010,33(1):57-59.
[26] 黄华,丁伯平.钩藤生物碱对中枢神经系统的药理作用研究进展[J].现代药物与临床, 2013, 28(5): 806-810.
[27] 孙晓芳,王丹巧,吴兆恩,等.首乌方对帕金森病模型大鼠血液和纹状体细胞外液左旋多巴药代动力学影响的研究[J].中国实验方剂学杂志,2011,17(11):111-115.
(编校:王冬梅)
Effect and mechanism of ShouwuFang on rats with levodopa-induced dyskinesia
JIAO Yue1,LIU Yang1,SUN Dan-dan1,WANGDan-qiao1Δ,LIANG Rong2Δ
(1.Experimental Research Center, China Academy of Chinese Medicine Science, Key Laboratory of Basic Research on TCM Prevention and Treatment of Major Diseases, Beijing 100700, China; 2.School of Basic Medical Sciences, Beijing University of Chinese Medicine, Beijing 100029, China)
ObjectiveTo investigate the effect of ShouwuFang (SWF) on levodopa-induced dyskinesia (LID) and its mechanism.Methods32 SD rats were randomized into 4 group: sham operation(SO) group, LID group, SWF low dose (SWF-L) group, and SWF high dose (SWF-H) group.Established the PD model by unilateral perfusion of 6-OHDA in two positions.The PD rats were administrated madopa (30 mg/kg), madopa (30 mg/kg) + SWF (27 g/kg), or madopa (30 mg/kg) + SWF (18 g/kg) for 22 days.Observed the incidence of LID and assessed the abnormal involuntary movement(AIM)scores in every group.Detected the dynamic change of hydroxyl free radicals indexes (concentration of 2,3-DHBA and 2,5-DHBA), captured by salicylic acid in the extracellular fluid of target tissue in free moving LID rats by brain microdialysis and HPLC-ED techniques; evaluated the changes of superoxide dismutase (SOD) and malondialdehyde (MDA) level in blood after microdialysis.ResultsSWF reduced the incidence of LID and AIM scores significantly, decreased the concentration of 2,3-DHBA and 2,5-DHBA in extracellular fluids of striatum; meanwhile significantly decreased the MDA level in the serum. ConclusionSWF can improve the behavior and had the effect of prevention and protection on LID rats.Its mechanism is connected with reduction of oxidative stress damages in organism and especially in the target organs.
levodopa-induced dyskinesia(LID);oxidative stress;ShouwuFang (SWF); microdialysis
国家自然科学基金(81274121);中国中医科学院自主选题研究项目(ZZ2012010)
焦玥,女,博士在读,研究方向:中药药理学,E-mail:jiaoyue_medicine@163.com;王丹巧,通讯作者,女,博士,研究员,博士生导师,研究方向:中药药理、中西医结合老年医学基础研究,E-mail:dq_wang96@sohu.com; 梁嵘,共同通讯作者,女,博士,教授,博士生导师,研究方向:中医诊法的客观化与规范化研究,E-mail:liangr@hotmail.com。
R332
A
1005-1678(2015)02-0001-05
