卡培他滨对晚期胃癌患者血清TNF-α、IL-6、VEGF及肿瘤标志物水平的影响及其疗效
2015-07-07罗忠民路太英路彦娟桑璐倩
罗忠民,路太英,路彦娟,桑璐倩
(郑州大学第一附属医院 肿瘤内科三病区,河南 郑州 450052)
卡培他滨对晚期胃癌患者血清TNF-α、IL-6、VEGF及肿瘤标志物水平的影响及其疗效
罗忠民,路太英Δ,路彦娟,桑璐倩
(郑州大学第一附属医院 肿瘤内科三病区,河南 郑州 450052)
目的 观察卡培他滨治疗晚期胃癌(advanced gastric cancer,AGC)患者的疗效、不良反应及其对患者血清肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白介素-6(interleukin-6,IL-6)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和肿瘤标志物CEA、CA19-9、CA125的影响。方法 选取郑州大学第一附属医院肿瘤科2012年10月~2014年10月收治的161例晚期胃癌患者,随机将其分为对照组78例与观察组83例。对照组给予常规多西紫杉醇加顺铂方案治疗,观察组在常规治疗基础上给予卡培他滨口服治疗,观察并比较2组患者疗效、不良反应及其对患者血清TNF-α、IL-6、VEGF和肿瘤标志物CEA、CA19-9、CA125水平的影响。结果 观察组患者治疗有效率与对照组比较差异无统计学意义(50.6%vs.43.6%,χ2=0.793,P=0.373),观察组患者疾病控制率与对照组比较差异无统计学意义(78.3%vs. 69.2%,χ2=1.720,P=0.190)。观察组患者半年、1年及2年生存率均显著高于对照组(90.4%vs.71.8%,78.3% vs. 57.7%,60.2% vs.41.0%,P<0.05)。观察组患者Ⅰ-Ⅱ度胃肠道不良反应发生率明显高于对照组患者(P<0.05)。观察组治疗后血清VEGF水平显著低于对照组,而TNF-α、IL-6水平明显高于对照组(P<0.05)。观察组治疗后CEA、CA19-9、CA125均显著低于对照组(P<0.05)。结论 卡培他滨能够改善机体免疫功能,抑制肿瘤血管形成,治疗晚期胃癌疗效确切,可有效提高患者生存率,且不良反应轻微。这可能与卡培他滨能够调节患者VEGF、TNF-α、IL-6和肿瘤标志物CEA、CA19-9、CA125水平有关。
卡培他滨;晚期胃癌;肿瘤坏死因子-α;白介素-6;血管内皮生长因子;肿瘤标志物
胃癌的发病率居恶性肿瘤的第4位,病死率位居各种恶性肿瘤的第3位,其发病率与死亡率均较高,严重威胁人类健康[1]。大部分胃癌患者在确诊时已失去了最佳手术机会,化学治疗可提高晚期胃癌患者的生活质量,延长生存期,因此进展期胃癌的化疗在整个胃癌的治疗过程中占有极为重要的地位[2]。但胃癌化疗方案众多,目前尚无“金标准”可循[3]。新药和新治疗策略的不断出现为胃癌患者的治疗带来新的希望。近年来,抗癌药物卡培他滨疗效显著、不良反应较小,在临床上广泛用于晚期原发性或转移性乳腺癌、直肠癌、结肠癌和胃癌的治疗[4]。临床虽有将卡培他滨用于治疗晚期胃癌的报道,却并无血清肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白介素-6(interleukin-6,IL-6)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和肿瘤标志物CEA、CA19-9、CA125研究分析的报道。本研究通过观察卡培他滨对晚期胃癌患者血清TNF-α、IL-6、VEGF和肿瘤标志物水平的影响,分析卡培他滨治疗晚期胃癌患者的临床疗效,为胃癌患者的治疗提供新的方法和思路。
1 资料与方法
1.1 一般资料 收集郑州大学第一附属医院2012年10月~2014年10月已确诊为Ⅲ期、Ⅳ期胃癌的患者161例,年龄20~80岁。采用分层随机法将患者分为对照组78例和观察组83例。对照组患者男40例,女38例,平均年龄(57.9±16.9)岁,病理类型:低分化腺癌42例,高分化腺癌15例,印戎细胞癌12例,黏液腺癌9例。观察组患者男性42例,女性41例,平均年龄(58.9±13.5)岁,病理类型:低分化腺癌42例,高分化腺癌19例,印戎细胞癌13例,黏液腺癌9例。2组患者在年龄、性别及病理类型的差异均无统计学意义。本研究已获本院医学伦理委员会批准。
纳入标准:①KPS评分要求大于60分,预期生存时间大于3个月,有完全民事行为能力;②无处于活动期心、肺、脑等基础疾病,治疗前血常规、血液生化、肿瘤标志物、心电图、影像学检查等检查基本正常;③初诊患者,既往均未接受肿瘤方面的治疗;④病理学或细胞学经我院病理科诊断为中晚期胃癌;⑤有可测量病灶;⑥影像学分期为不能手术的Ⅲ-Ⅳ期患者;⑦化疗前均签署化疗同意书。
排除标准:①一般情况、年龄不符合者;②未完成至少2个周期化疗者;③接受其他肿瘤相关治疗者;④无完全民事行为能力者。
1.2 治疗方法 对照组给予多西紫杉醇(江苏恒瑞医药股份有限公司,国药准字H20020543)联合顺铂(齐鲁制药有限公司,国药准字H37021358)常规化疗,具体给药方法是:于第1天给予静脉滴注多西紫杉醇,滴注量为65~75 mg/m2;第1~5天给予顺铂避光静脉滴注,滴注量为15~20 mg/m2;治疗21 d为1个周期。观察组在对照组给药基础上口服卡培他滨片(江苏恒瑞医药股份有限公司,国药准字H20133365)联合化疗,具体给药方法是:第1~14天口服卡培他滨1000 mg/m2,2次/天,治疗1个周期为21 d。化疗2周期后对可测量病灶进行疗效评定,如无疾病进展时则继续4~6个周期的化疗。化疗前给予5-HT3受体拮抗剂[盐酸托烷司琼注射液(四川太极制药有限公司,国药准字H20090020)]止吐预处理;化疗期间给予复方甘草酸苷注射液(北京凯因科技股份有限公司,国药准字H20058999)持续静脉滴注保肝、保胃、足量水化等处理;用多西紫杉醇前1天晚上服用地塞米松(厦门星鲨制药有限公司,国药准字H35021298)抗过敏,并预防水钠潴留。
1.3 疗效评价及观察指标 根据美国癌症研究中心实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)疗效评估方法(2000年)评价临床近期疗效,包括完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、稳定(stable disease,SD)、进展(progressive disease,PD)。完全缓解:所有目标病灶消失且病理性淋巴结短径<10 mm;部分缓解:与基线病灶长径总和比较缩小30%;疾病进展:原靶病灶长径总和增加大于20%且原靶病灶长径总和增加的绝对值大于5 mm;疾病稳定:基线病灶长径总和有缩小但未达部分缓解或有增加但未达疾病进展[5]。有效=CR+PR,疾病控制=CR+PR+SD。
随访记录患者半年、1年、2年的生存率。
依据世界卫生组织(World Health Organization,WHO)制定的不良反应评价标准[6],对胃癌患者的不良反应进行评估。治疗期间观察记录并比较2组患者的不良反应发生情况。
2组患者在治疗前、治疗后均空腹采集静脉血,将静脉血装入采血管中,3000 r/min离心10 min,离心结束后将上层血清装入离心管,并在离心管上标注姓名、组别及日期等,放入-80 ℃冰箱中备用。采用ELISA法检测治疗前后2组患者血清TNF-α、IL-6、VEGF和肿瘤标志物CEA、CA19-9、CA125水平。
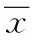
2 结果
2.1 治疗后2组患者瘤体大小治疗效果比较 观察组患者治疗有效率与对照组比较差异无统计学意义(50.6%vs.43.6%,χ2=0.793,P=0.373),观察组患者疾病控制率与对照组比较差异无统计学意义(78.3%vs. 69.2%,χ2=1.720,P=0.190)。见表1。
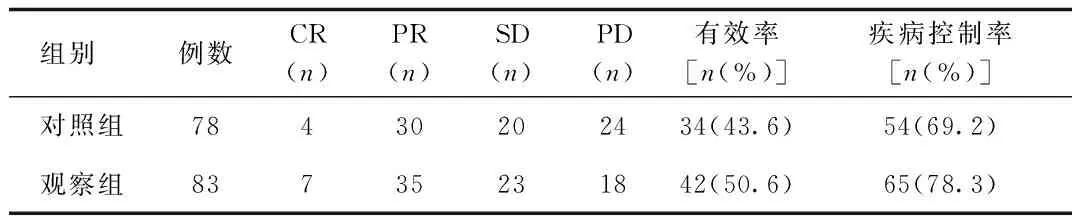
表1 治疗后2组患者瘤体大小治疗效果比较Tab.1 Comparison of efficacy on tumorous size between two groups
2.2 2组患者生存率比较 观察组患者半年、1年及2年生存率均显著高于对照组(90.4%vs.71.8%,78.3% vs. 57.7%,60.2% vs.41.0%,P<0.05)。见表2。
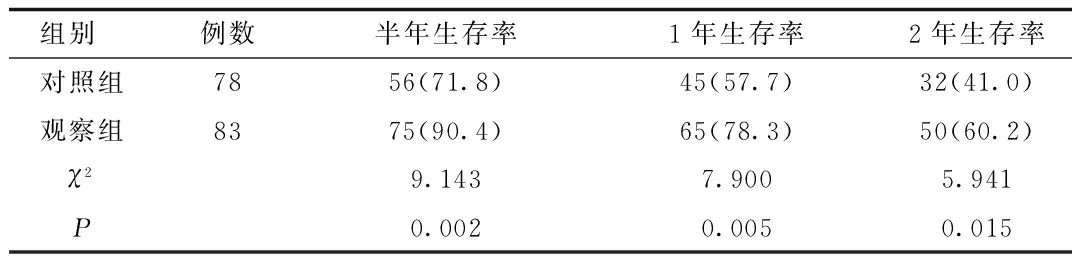
表2 2组患者生存率比较[n(%)]Tab.2 Comparison of survival rate between two groups[n(%)]
2.3 2组患者不良反应情况比较 2组患者在中性粒细胞减少、血小板减少、血红蛋白减少、肝功能损害以及手足综合征等不良反应方面差异无统计学意义,观察组患者Ⅰ-Ⅱ度胃肠道反应发生率明显高于对照组患者(χ2=15.636,P<0.05)。见表3。

表3 2组患者不良反应情况比较(n)Tab.3 Comparison of adverse reactions between two groups(n)
2.4 2组患者血清TNF-α、IL-6、VEGF水平比较 治疗前,2组VEGF、TNF-α、IL-6水平比较差异无统计学意义。治疗后,2组上述指标水平均不同程度下降(P<0.05)。观察组治疗后血清VEGF水平显著低于对照组,而TNF-α、IL-6水平明显高于对照组(P<0.05)。见表4。
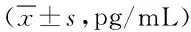
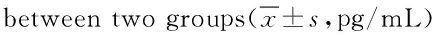
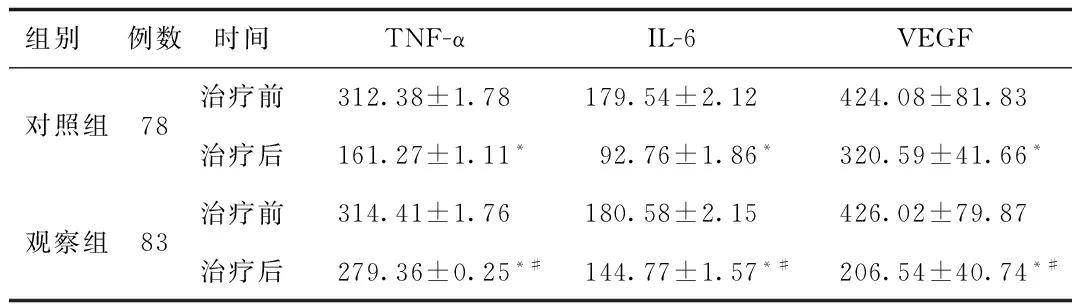
组别 例数时间TNF-αIL-6VEGF对照组78治疗前312.38±1.78179.54±2.12424.08±81.83治疗后161.27±1.11*92.76±1.86*320.59±41.66*观察组83治疗前314.41±1.76180.58±2.15426.02±79.87治疗后279.36±0.25*#144.77±1.57*#206.54±40.74*#
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与对照组治疗后比较,compared with control group post-treatment
2.5 2组患者血清CEA、CA19-9、CA125水平比较 2组患者治疗前血清CEA、CA19-9、CA125水平相比较差异无统计学意义。治疗后,2组患者血清上述指标水平均较治疗前显著降低(P<0.05)。观察组治疗后CEA、CA19-9、CA125均显著低于对照组(P<0.05)。见表5。


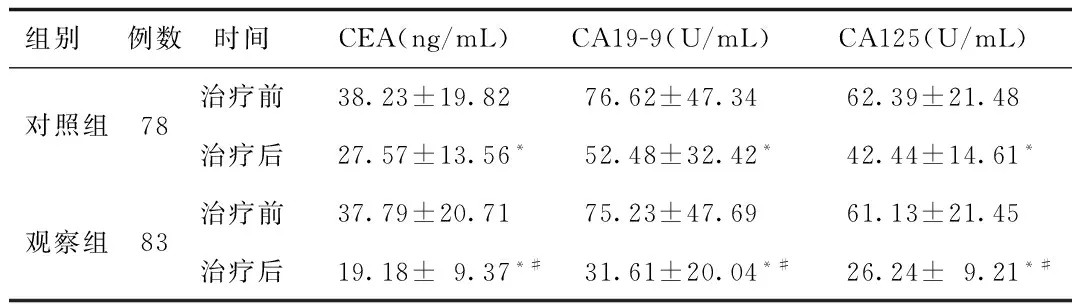
组别 例数时间CEA(ng/mL)CA19-9(U/mL)CA125(U/mL)对照组78治疗前38.23±19.8276.62±47.3462.39±21.48治疗后27.57±13.56*52.48±32.42*42.44±14.61*观察组83治疗前37.79±20.7175.23±47.6961.13±21.45治疗后19.18±9.37*#31.61±20.04*#26.24±9.21*#
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与对照组治疗后比较,compared with control group post-treatment
3 讨论
晚期胃癌患者采用适量化疗,能减缓肿瘤的发展速度,改善症状,有一定的近期效果。进展期胃癌根治术后、姑息手术后或根治术后复发者需要化疗。对于晚期胃癌,联合化疗在抑制病情进展及延长总生存期等方面均优于最佳支持治疗及单药化疗[7]。胃癌常用的口服化疗药有替加氟、尿嘧啶替加氟片、替吉奥等,常用的静脉化疗药有氟尿嘧啶、顺铂、紫杉醇、依托泊苷等。近年来卡培他滨等新的化疗药物用于胃癌。但在化疗过程中,患者普遍有明显的恶心呕吐和骨髓抑制等副作用,给患者带来不适感。所以需要注意的是,化疗并非适用于所有的胃癌患者,对于那些体质差、免疫功能低下或者恶液质的老年患者应该慎用。那么如何选择有效并且不良反应较小的化疗药物以及合理的化疗方案就成为了当前胃癌治疗所重点关注的问题。
多西紫杉醇联合顺铂治疗胃癌取得较好的疗效,并且应用于多种癌症的常规治疗,但其疗效仍有待于进一步提高[8]。卡培他滨是氟化尿嘧啶类药物,它是通过TP酶在机体内最终转化为5-氟尿嘧啶来达到抑制肿瘤细胞的目的。TP酶在正常组织的表达较低而在癌细胞中的表达水平却很高,因此在卡培他滨治疗胃癌时,对癌细胞具有选择性的杀伤作用,药物不良反应明显降低[9]。本研究中,观察组和对照组有效率和疾病控制率差异均无统计学意义,表明卡培他滨并不能明显提高现有胃癌化疗方案的有效率。然而,联合卡培他滨治疗后可以显著提高胃癌患者远期生存率,2组差异具有显著统计学意义(P<0.05)。此外,联合卡培他滨治疗并未显著增加患者在中性粒细胞减少、血小板减少、血红蛋白减少、肝功能损害及手足综合征等方面的不良反应,但是其Ⅰ-Ⅱ度胃肠道反应方面的不良反应却有所增加(P<0.05)。这些结果表明,卡培他滨治疗晚期胃癌,不但可以延长患者生存期,安全性也较好。
肿瘤患者体内存在着以细胞免疫为主的抗肿瘤机制,这种机制主要由IL-6、TNF-α等细胞因子调节[10]。在应用化疗药物之后IL-6、TNF-α水平都会下降,免疫功能受到损害,影响化疗效果。VEGF是公认的促血管生成因子,胃癌患者中该因子水平显著高于健康人[11]。因此,降低VEGF表达,提高IL-6、TNF-α细胞因子水平,可以减少肿瘤血管形成,改善患者的机体免疫,提高胃癌治疗效果。肿瘤标志物水平直接显示胃癌病情轻重。在胃癌患者的血清中检测 CEA、CA19-9、CA125对判断胃癌的转移和预后有着非常重要的意义[12]。然而,到目前为止尚还未见卡培他滨联合顺铂与多西紫杉醇治疗晚期胃癌时对患者血清TNF-α、IL-6、VEGF和肿瘤标志物CEA、CA19-9、CA125影响的报道。本研究中发现,2组胃癌患者治疗后血清TNF-α、IL-6、VEGF和肿瘤标志物CEA、CA19-9、CA125水平与治疗前相比均有所降低(P<0.05)。且与对照组治疗后比较,观察组治疗后血清肿瘤标志物CEA、CA19-9、CA125水平更低(P<0.05)。观察组治疗后血清VEGF下降程度比对照组更明显,而观察组治疗后TNF-α、IL-6水平却明显高于对照组治疗后TNF-α、IL-6水平,比较差异都有统计学意义(P<0.05)。这些结果表明,卡培他滨在抑制肿瘤细胞的同时,还可以有效减少胃癌的肿瘤血管新生,改善免疫功能,从而提高治疗效果,本研究认为这可能也是患者生存率提高和生活质量改善的重要原因。
综上所述,卡培他滨可以改善机体免疫功能,抑制肿瘤血管形成,降低肿瘤标志物水平,并可有效提高患者生存率,且不良反应轻微。
[1] 郑朝旭,郑荣寿,张思维,等.中国2010年胃癌发病与死亡分析[J].中国肿瘤,2013,22(5):327-332.
[2] 张国伟,宋丽杰.进展期胃癌化疗现状与进展[J].临床药物治疗杂志,2009,7(5):14-18.
[3] 蒋劲松,曹卫国,马韬,等.不同化疗方案(PCFvsOLF)治疗晚期胃癌的疗效及安全性评价[J].中国癌症杂志,2006,16(12):1023-1027.
[4] Tham CK,Choo SP,Poon DY,et al.Capecitabine with radiation is an effective adjuvant therapy in gastric cancers[J].World J Gastroenterol,2010,16(29):3709-3715.
[5] Therasse P,Arbuck SG,Eisenhauer EA,et al.New guidelines to evaluate the response to treatment in solid tumors[J].Breast Cancer,2005,12(1):16-27.
[6] Kautio AL, Haanpää M, Kautiainen H,et al.Oxaliplatin Scale and National Cancer Institute-Common Toxicity Criteria in the Assessment of Chemotherapy-induced Peripheral Neuropathy[J].Anticancer Res,2011,31(10):3493-3496.
[7] 白璐,李青山.晚期胃癌的化学治疗[J].山东医药,2012,52(7):96-98.
[8] 王庆才,毛一香,陈凯,等.多西紫杉醇/顺铂/5-氟脲嘧啶联合治疗进展期胃癌的近期疗效观察[J].苏州大学学报(医学版),2008,28(3):477-479.
[9] Han JY,Hong EK,Lee SY,et al.Thymidine phosphorylase expression in tumour cells and tumour response to capecitabine plus docetaxel chemotherapy in non-small cell lung cancer[J].J Clin Pathol,2005,58(6):650-654.
[10] 孙昕,段力,单丽丽.乳癌患者血清TNF-α和IL-6水平观察及临床意义[J].安徽医药,2001,5(2):118-119.
[11] Liu XE,Sun XD,Wu JM.Expression and significance of VEGF-C and FLT-4 in gastric cancer[J].World J Gastroenterol,2004,10(3):352-355.
[12] Yamao T,Kai S,Kazami A,et al.Tumor markers CEA,CA19-9 and CA125 in monitoring of response to systemic chemotherapy in patients with advanced gastric cancer[J].Jpn J Clin Oncol,1999,29(11):550-555.
(编校:王俨俨)
Effect of capecitabine on serum TNF-α, IL-6, VEGF and tumor biomarkers levels in patients with advanced gastric cancer and its efficacy
LUO Zhong-min, LU Tai-yingΔ, LU Yan-juan, SANG Lu-qian
(Department of Oncology, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China)
ObjectiveTo investigate the effect of capecitabine on serum tumor necrosis factor α(TNF-α), interleukin-6(IL-6), vascular endothelial growth factor (VEGF) and tumor biomarker (CEA,CA19-9 and CA125)levels in patients with advanced gastric cancer (AGC) and its efficacy and adverse reactions. MethodsOne hundred and sixty-one AGC patients from October 2012 to October 2014 in the hospital were randomly divided into control group (n=78) and observation group (n=83). The control group were treated with cisplatin in combination with docetaxel, while the observation group were treated with capecitabine on the basis of control group. The efficacy, adverse reactions and serum levels of TNF-α, IL-6, VEGF and tumor biomarkers were compared between two groups. ResultsThere was no significant difference in effective rate between observation group and control group (50.6%vs.43.6%,χ2=0.793,P=0.373) and disease control rate (78.3%vs. 69.2%,χ2=1.720,P=0.190). The half a year,1-year and 2-year survival rates in observation group were significantly higher than those in control group (90.4%vs.71.8%,78.3% vs. 57.7%,60.2% vs.41.0%,allP<0.05). The gradeⅠ-Ⅱ adverse reactions of gastrointestinal tract in observation group was significantly higher than control group(P<0.05). After treatment, serum VEGF level in observation group was lower and serum TNF-α,IL-6 levels were higher than those in control group (P<0.05). The serum levels of CEA, CA19-9 and CA125 in observation group were lower than those in control group (P<0.05). ConclusionCapecitabine could improve immunologic function and inhibit tumor angiogenesis, which has an exact effect and increase survival rate of advanced gastric cancer patients with minor adverse reactions. Its mechanism may be regulating serum VEGF, TNF-α, IL-6 and tumor biomarkers of CEA, CA19-9 and CA125.
capecitabine; advanced gastric cancer; tumor necrosis factor α; interleukin-6; vascular endothelial growth factor; tumor biomarkers
罗忠民,男,硕士,住院医师,研究方向:恶性肿瘤的综合治疗,E-mail:henanluozhongmin@163.com;路太英,通讯作者,女,博士,主任医师,研究方向:恶性肿瘤的综合治疗,E-mail:wanlucying@163.com。
R735.2
A
1005-1678(2015)09-0149-04
