单次大剂量和多次小剂量STZ诱导昆明小鼠1型糖尿病模型的探究
2015-07-07郑国亚连波刘顺梅齐佳刘晓影綦慧敏
郑国亚,连波,刘顺梅Δ,齐佳,刘晓影,綦慧敏
( 1. 潍坊医学院 生物科学与技术学院,山东 潍坊 261053;2. 潍坊医学院 药学院,山东 潍坊 261053)
单次大剂量和多次小剂量STZ诱导昆明小鼠1型糖尿病模型的探究
郑国亚1,连波1,刘顺梅1Δ,齐佳1,刘晓影1,綦慧敏2
( 1. 潍坊医学院 生物科学与技术学院,山东 潍坊 261053;2. 潍坊医学院 药学院,山东 潍坊 261053)
目的 通过研究单次大剂量和多次小剂量链脲佐菌素(streptozotocin,STZ) 诱导昆明小鼠1型糖尿病的成模率和稳定性,探究理想的1型糖尿病小鼠建模方法。方法 60只昆明小鼠随机分为4组(15只/组):空白对照组、阴性对照组(注射磷酸盐缓冲液)、单次大剂量组(150 mg/kg,单次腹腔注射)、多次小剂量组(50 mg/kg,连续注射5 d)。末次注射后,每天测定小鼠摄食量和饮水量,每周测定小鼠空腹血糖及体质量1次,连续观察4周。结果 2个模型组小鼠均表现出糖尿病的“三多一少”症状,模型组小鼠的平均空腹血糖均明显高于2个对照组(P<0.05)。单次大剂量组和多次小剂量组的小鼠第1周时成模率分别为60%和53.33%,4周后分别为60%和80%,4周后的死亡率分别为33.33%和20%。且多次小剂量组中高血糖小鼠的血糖值从第2周始一直稳定上升并维持在较高水平。结论 多次小剂量注射STZ (50 mg/kg连续注射5d)是较理想的建立昆明小鼠1型糖尿病模型的方法。
链脲佐菌素;1型糖尿病模型;昆明小鼠;单次大剂量;多次小剂量
糖尿病(diabetes mellitus,DM)的全球患病率逐年上升,目前已成为继肿瘤与心脑血管病之后的第三大严重威胁人类健康的慢性代谢类疾病,主要分为1型(type 1 diabetes mellitus,T1DM)及2型(T2DM)。T1DM被认为是由T细胞介导的胰岛β细胞选择性破坏而引起的自身免疫性疾病[1-2]。迄今为止,该病的病因及发病机理还不完全清楚,预防和治疗措施仍不完善。因此,构建T1DM动物模型成为现代医学研究T1DM的重要举措[1]。
链脲佐菌素(streptozotocin,STZ) 是目前世界范围内最常用的诱发动物糖尿病的化学诱导剂[3],具有毒性低、用药量小、高特异性的破坏胰岛β细胞等优点。STZ诱导DM动物模型的方法有两种,即单次大剂量或多次小剂量腹腔注射[3-6]。尽管目前已有多篇STZ用于糖尿病鼠建模的文献报道,但大多数研究是使用大鼠[4,7-9]和C57BL/6J小鼠[1-2,5-6,10-11],利用昆明小鼠建模的报道较少[12-14]。而昆明小鼠相对于大鼠来说,不但价格便宜,而且可节省实验用药量,特别适合用于降血糖药物比较珍贵和难以获取的实验。昆明小鼠相对于C57BL/6J小鼠价格便宜很多,对于那些需要较多模型鼠的实验来说可节省不少研究费用。所以,利用STZ建立昆明小鼠糖尿病模型的研究是非常必要的。
由于不同的动物品系会对同样的药物及剂量产生不同的反应,C57BL/6J以及其它品系小鼠的适宜建模方法不一定适用于昆明小鼠。因此,本文探讨了单次大剂量和多次小剂量STZ注射诱导T1DM小鼠模型的成模率及死亡率,以期为构建理想的T1DM昆明小鼠模型提供实验指导。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:昆明小鼠,雄性,60只,SPF级,6周龄,体质量(25±2)g,购自山东大学实验动物中心,合格证号:SCXK(鲁) 2013-0009。小鼠饲养于通风、清洁的动物房中,室温(23±2) ℃,相对湿度(50±5)%,12 h光照和12 h黑暗循环进行,所有小鼠均自由摄食、饮水。实验动物严格遵守《实验动物保护条例》,动物处理程序经过潍坊医学院伦理委员会认证。
1.1.2 药品与仪器:药品:STZ购自Sigma公司。仪器:德国卓越型罗氏血糖仪和血糖试纸。
1.2 实验方法
1.2.1 试剂配制:1% STZ溶液的配制:将STZ粉末溶于预冷的pH 4.2~4.5的0.1 mol/L柠檬酸缓冲液中配成新鲜的1% STZ溶液,并用0.22 μm一次性滤器过滤除菌。
1.2.2 动物分组与处理:购买的昆明小鼠在实验室适应性饲养2周后选取空腹血糖介于3.0~6.0 mmol/L的健康小鼠为实验对象,随机分为4组(15只/组):正常对照组、阴性对照组、单次大剂量组(150 mg/kg)和多次小剂量组(50 mg/kg)。小鼠的建模方法参考文献[1-2,5]中的方案,并加以优化,各组小鼠分笼饲养,造模前禁食12 h,自由饮水。禁食结束后,正常对照组无任何处理;阴性对照组连续5 d腹腔注射与实验组同体积(约0.35 mL)的柠檬酸缓冲液;单次大剂量组一次性腹腔注射150 mg/kg 1% STZ溶液;多次小剂量组连续5 d腹腔注射50 mg/kg 1% STZ溶液。
1.2.3 模型评鉴指标:注射STZ后每天观察并记录小鼠的一般状况和死亡情况,一般状况主要包括精神状态、毛发颜色、运动情况和排尿情况等;每天测量各组小鼠的摄食量和饮水量;每周测量一次空腹血糖和体质量,连续4周。空腹血糖值≥11.1 mmol/L为建模成功[10]。比较各组的成模率和死亡率、成模小鼠的血糖值变化和体质量变化等。
2 结果
2.1 小鼠外观形态观察 注射STZ后,各组给予充足的粮和水,垫料每天更换一次,保持干燥。在整个实验期间,对各组小鼠外观形态观察发现,正常对照组和阴性对照组(下称对照组)的小鼠皮毛洁白干净,有光泽,精神状况良好,比较活泼,反应灵敏,排尿量少;而单次大剂量组和多次小剂量组(下称模型组)的小鼠出现毛色灰暗、变黄,精神萎靡,活动少,反应迟缓等表象。单次大剂量组从注射后第3 d起出现多尿现象,多次小剂量组从第一次注射后的第6 d起出现多尿现象,2个模型组的垫料明显比2个对照组垫料的湿度大,多尿症状明显。
2.2 不同建模方法对小鼠饮水量和摄食量的影响 注射STZ后,两个实验组与两个同龄对照组相比饮水量均有显著增加(P<0.01)。第1周(首次注射后的第7天),单次大剂量组的饮水量明显大于多次小剂量组(P<0.01),随后多次小剂量组的饮水量逐渐增加,第3周时2个模型组的饮水量差异无统计学意义,第4周时多次小剂量组的饮水量明显高于单次大剂量组(P<0.05)。以上结果表明两种方法诱导的糖尿病模型小鼠均出现了明显的多饮症状。见表1。
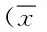
表1 各组小鼠建模前后的饮水量±s,mL)Tab. 1 Water intake of each group of mice before and after modeling ±s,mL)
*P<0.05,**P<0.01,与正常对照组相比,compared with normal control group;#P<0.05,##P<0.01,与单次大剂量组相比,compared with single high dose group .
给药后单次大剂量组和多次小剂量组的摄食量均比两个对照组有显著增加(P<0.01)。在第1周时,单次大剂量组的摄食量大于多次小剂量组(P<0.01);随着建模时间延长,多次小剂量组的摄食量逐渐增加,第2周和第3周时2个模型组的摄食量间已差异无统计学意义,到第4周时,多次小剂量组的摄食量明显高于单次大剂量组(P<0.01)。上述结果表明,两种方法诱导的糖尿病小鼠均出现了多食的症状。见表2。
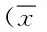
表2 各组小鼠建模前后摄食量 ±s,g)Tab. 2 Food intake of each group of mice before and after ±s,g)
*P<0.05,**P<0.01,与正常对照组相比,compared with normal control group;#P<0.05,##P<0.01,与单次大剂量组相比,compared with single high dose group .
2.3 不同建模方法对小鼠体质量的影响 建模前各组小鼠体质量差异无统计学意义,但在实验期间对照组小鼠的体质量逐渐增加,而模型组小鼠的体质量却逐渐下降,2个模型组的体质量明显低于两个对照组(P<0.01),而单次大剂量和多次小剂量组的体质量差异无统计学意义。实验还发现,糖尿病小鼠中血糖水平恢复正常者比同组糖尿病小鼠的体质量略有增加。见表3。
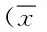
表3 各组小鼠建模前后体质量±s,g)Tab. 3 Body weight of each group of mice before and after modeling ±s,g)
*P<0.05,**P<0.01,与正常对照组相比,compared with normal control group
2.4 不同建模方法对小鼠空腹血糖的影响 小鼠血糖高低直接体现建模成功与否。建模前各组小鼠空腹血糖差异无统计学意义,但在注射STZ后,单次大剂量组和多次小剂量组小鼠的平均空腹血糖与两个对照组相比都显著升高(P<0.01)。第1周时,单次大剂量组小鼠空腹血糖高于多次小剂量组,但两者之间的差异无统计学意义。随着实验的进行,单次大剂量组中个别小鼠的空腹血糖值有所下降,最终恢复到正常值;而多次小剂量组的小鼠空腹血糖值稳定升高,最终达到一个较高的水平,其平均空腹血糖值明显高于单次大剂量组(P<0.05)。见表4。

表4 各组小鼠建模前后空腹血糖值Tab. 4 Fasting blood glucose level of each group of mice before and after modeling ±s,mmol/L)
*P<0.05,**P<0.01,与正常对照组相比,compared with normal control group;#P<0.05,与单次大剂量组相比,compared with single high dose group.
2.5 不同建模方法对模型成功率的影响 STZ注射1周后,单次大剂量组死亡2只,成模9只;其死亡率为13.33%,成模率为60%。多次小剂量组在1周后的死亡数为0,成模率为53.33%。随着实验的进行,单次大剂量组死亡鼠增多,个别小鼠的血糖值逐渐降低至正常血糖水平,因而平均血糖值呈下降趋势(见表4),至实验结束时其成模率为60%,死亡率为33.33%。与之相反,多次小剂量组小鼠的血糖逐渐增高,其成模率随实验进行呈上升趋势,第4周时的成模率为80%,死亡率为20%。见表5。

表5 各组成模鼠和死亡鼠的数量(只)Tab.5 Number of successful modeled mice and number of died mice in each group(number)
3 讨论
糖尿病是一种全球性疾病,近年来,由于诸多因素的影响,糖尿病的全球发病率迅速上升,严重威胁着人类健康。据国际糖尿病联合会估算,到2030年,全世界糖尿病患者将由2010年的2.85亿上升至4.38亿[15]。因此,对糖尿病的发病机制、预防与治疗等研究已不容忽视。为了克服人体研究的局限性,构建理想且可靠的糖尿病动物模型已成为研究糖尿病发病机制、并发症以及研制新型治疗药物的重要手段。
尽管目前已有不少用小鼠建立糖尿病模型的报道,但这些研究绝大多数都是采用C57BL/6J小鼠建模,也有以ICR[5,16-17]、BALB/C[16,18]和CD-1[3]小鼠为实验对象的研究,利用昆明小鼠建模的报道较少,对于适合昆明小鼠的STZ剂量、给药方式、成模率等关系研究也不够深入。昆明小鼠是我国最常用的实验动物之一,价格便宜,适用性广。因此,利用STZ诱导昆明小鼠糖尿病模型非常值得研究。
本实验以昆明小鼠为实验对象,采用单次大剂量(150 mg/kg)和多次小剂量(50 mg/kg,连续5 d)腹腔注射STZ诱导T1DM,结果发现上述2种不同的STZ处理方式均能使模型组小鼠的摄食量和饮水量显著增加,排尿量增加,体质量显著减少,即糖尿病的“三多一少” 症状非常明显;模型组小鼠的空腹血糖水平也显著高于正常组和阴性对照组。这些结果表明单次大剂量和多次小剂量腹腔注射STZ均能成功诱导昆明小鼠发生糖尿病。这与周烨文[12]、韦立顺[13]、屈彦纯[14]的实验结果相符。周烨文[12]的研究发现45 mg/kg STZ连续注射5 d能较好地诱导昆明小鼠发生糖尿病;韦立顺[13]发现一次性腹腔注射150 mg/kg STZ可诱导83.3%的昆明小鼠发病;屈彦纯[14]的研究结果显示180 mg/kg STZ一次性腹腔注射和50 mg/kg STZ连续5天注射都可成功诱发糖尿病,180 mg/kg组和50 mg/kg组在注射STZ 2周后的成模率分别为90%和80%。
本研究还发现,虽然单次大剂量和多次小剂量STZ注射都能诱发糖尿病,但多次小剂量注射比单次大剂量注射的成模率要高,死亡率较低,且高血糖在造模后4周内稳定性好。150 mg/kg 和50 mg/kg组在建模1周后血糖分别为16.62和14.66 mmol/L,4周时的血糖分别为13.85和19.98 mmol/L。这些结果说明单次大剂量STZ注射可使小鼠的血糖水平快速升高但稳定性较差,随着实验的进行血糖会有所下降;而多次小剂量STZ注射虽然使小鼠的血糖水平升高缓慢,但血糖可持续上升,直至维持在较高水平。
综上所述,实验结果表明单次大剂量和多次小剂量注射STZ的方法均能诱发小鼠T1DM。单次大剂量注射与多次小剂量注射方法相比,操作简单,用药量小,但对小鼠的毒性较大,死亡率较高,成模率较低,血糖水平波动幅度大,有些小鼠可逐渐恢复至正常血糖水平。而多次小剂量注射建模方法虽然用药量大,操作麻烦,但却具有成模率较高、死亡率较低的优点,且血糖值一直维持在较高水平,很少见到复转。
一般认为,单次大剂量STZ注射会造成胰岛β细胞大量破坏,胰岛素的分泌明显下降,进而使血糖迅速升高,形成急性糖尿病,但此模型无胰岛炎症,与人类T1DM患者的实际病理特征差距较大[19]。而多次小剂量注射STZ可部分破坏胰岛β细胞,可诱发针对胰岛β细胞的自身免疫性损伤,使血糖水平渐进性升高,诱导形成迟发型T1DM,这种渐进性胰岛损害能更好的模拟人类T1DM的发病机制和胰岛损害[20],建立这种动物模型可能对人类研究和治疗糖尿病具有更好的帮助与指导作用。
综合考虑本次实验结果与前人的有关理论,多次小剂量注射STZ 50 mg/kg是较单次大剂量注射150 mg/kg更为科学而有效的建立T1DM小鼠模型的方法。
[1] 李如江,邱曙东,田宏,等. 多次小剂量STZ诱导的成年鼠糖尿病指标的自发恢复[J].动物学研究,2013,34(3): 238-243.
[2] 李甜,张亚楼,陈龙,等. 链脲佐菌素诱导C57 小鼠1 型糖尿病模型的研究[J].现代生物医学进展,2014,14(26): 5031-5033.
[3] Furman B L. Streptozotocin-induced diabetic models in mice and rats[J].Curr Protoc Pharmacol, 2015,70:5.
[4] 熊煜欣,杨莹,陶文玉,等. STZ 小剂量多次与大剂量单次腹腔注射诱导糖尿病大鼠模型的研究[J].昆明医科大学学报,2014,35(9): 9-12.
[5] 张金保,庄朋伟,林映雪,等. 小鼠品系、给药剂量及次数对链脲霉素诱导1 型糖尿病的影响[J].中国现代医学杂志,2013,23(36): 31-35.
[6] 闵筱辉,陈其奎,于涛,等. 链脲佐菌素诱导建立长期稳定糖尿病小鼠模型的给药方案研究[J].中国医药导报,2013,10(4 ): 7-10.
[7] Dang JK, Wu Y, Cao H, et al. Establishment of a Rat Model of Type II Diabetic Neuropathic Pain[J].Pain Medicine, 2014, 15(4): 637-646.
[8] 左风云,董岭,杨英. 大鼠1 型与2 型糖尿病模型的对比研究[J].疾病监测与控制杂志,2015,9 (6): 383-385.
[9] 俞韩,何泽民. 链脲佐菌素联合高脂高糖饲料诱导糖尿病大鼠模型的建立[J].江苏医药,2015,41(4): 469-470.
[10] 虞冬辉,程红科,李勇,等. 禁食时间对链脲佐菌素诱导1型糖尿病小鼠模型的影响[J].中国临床医学,2013,20(4): 472-473.
[11] 唐文庄,钟良宝. 糖尿病C57BL/6 小鼠STZ剂量的选择及CD2AP在糖尿病肾病蛋白尿进展中的表达变化[J].海南医学,2012,23(16): 24-28.
[12] 周烨文,张福梅. 链脲佐菌素诱导糖尿病小鼠模型的构建[J].生物技术世界,2014,(6):78-80.
[13] 韦立顺,许忠新,田河林,等. 链脲佐菌素致小鼠糖尿病模型的建立与评价 [J].中国实验诊断学,2013,17(5):806-808.
[14] 屈彦纯,杜娥,张玥,等. 糖尿病小鼠模型制备方法的初步探讨[J].医学研究杂志,2011,40(3): 78-80.
[15] Hwang PA, Hung YL, Tsai YK, et al. The brown seaweed Sargassum hemiphyllum exhibits a-amylase and a-glucosidase inhibitory activity and enhances insulin release in vitro[J]. Cytotechnology, 2015, 67(4): 653-660.
[16] 刘长青,宋立江,蒋东升,等. 不同种属和禁食时间对链脲佐菌素诱导糖尿病模型的影响研究[J].实用预防医学,2010,17(2): 377-378.
[17] 李荣春,黄梁浒,陈宗峰,等. 链脲佐菌素致ICR和C57/BL6小鼠I型糖尿病模型的比较[C].中国器官移植大会论文汇编,2012年.
[18] 谭潇,肖建华.Ⅰ型糖尿病小鼠模型的构建[J].国际检验医学杂志,2011,32(14): 1589-1591.
[19] Elsner M, Guldbakke B, Tiedge M, et al. Relative importance of transport and alkylation for pancreatic beta-cell toxicity of streptozotocin[J].Diabetologia, 2000, 43(12): 1528-1533.
[20] 杨巍,罗春元,于春雷,等. 不同剂量 STZ 诱导小鼠糖尿病模型的发病机制[J].吉林大学学报(医学版),2006,32(3): 432-435.
(编校:谭玲)
Construction of type 1 diabetic KM mice model induced by single high dose and multiple low dose of streptozotocin
ZHENG Guo-ya1, LIAN Bo1, LIU Shun-mei1Δ, QI Jia1, LIU Xiao-ying1, QI Hui-min2
(1. Weifang Medical College, School of Bioscience and Technology, Weifang 261053, China; 2. Weifang Medical College, School of Pharmacy, Weifang 261053, China)
ObjectiveTo explore an optimal method of producing STZ-induced type 1 diabetic KM mice model by investigating the molded rate of single high dose and multiple low dose of STZ injection.MethodsSixty KM mice were randomly divided into 4 groups(n=15), two control groups and two model groups. In the two control groups, one was blank control and the other was negative control. Mice in the blank control group treated with no injection, but mice in the negative control group were treated with injection of citric acid salt buffer. For the two model groups, one was single high-dose group, 150 mg/kg STZ was injected only once. The other was multiple low-dose group, 50 mg/kg STZ was injected for 5 consecutive days. After the last injection, daily food and water intake were tested, blood glucose level and body weight were examined once a week for 4 consecutive weeks.ResultsMice in the two model groups showed typical features of diabetes. The blood glucose levels in the two model groups were significantly higher than in the two control groups(P<0.05). For the two model groups, the molded rate of 150 mg/kg and 50 mg/kg group were 60% and 53.33% respectively at 1st week, but at the 4th week, they were 60% and 80% respectively. The mortality of these two groups at the 4th week was 33.33% and 20% respectively. Moreover, the blood glucose level in multiple low-dose group increased stably from the 2nd week to the 4th week. ConclusionThe multiple low-dose STZ injection (50 mg/kg for 5 consecutive days) is an optimal method for producing KM mice model of type 1 diabetes mellitus.
streptozotocin; type 1 diabetic model; KM mice; single high-dose; multiple low-dose
国家自然科学基金(41206129);山东省自然科学基金(ZR2012DL13);山东省高等学校科技计划项目(J12LM51);潍坊医学院科技创新基金(K1301009);大学生创新基金(KX2015019)
郑国亚,女,硕士在读,研究方向:海洋生物活性物质研究,E-mail:1070933320@qq.com;刘顺梅,通信作者,女,博士,副教授,研究方向:海洋生物活性物质研究,E-mail:liushm@wfmc.edu.cn。
R587.1
A
1005-1678(2015)12-0013-05
