塞来昔布对类风湿性关节炎患者血清生化指标影响及其疗效与安全性评价
2015-07-07周丽琴张菊
周丽琴,张菊
(1.辽阳市中心医院 病房药局,辽宁 辽阳 111000;2.辽阳市中心医院 风湿免疫科,辽宁 辽阳 111000)
塞来昔布对类风湿性关节炎患者血清生化指标影响及其疗效与安全性评价
周丽琴1,张菊2
(1.辽阳市中心医院 病房药局,辽宁 辽阳 111000;2.辽阳市中心医院 风湿免疫科,辽宁 辽阳 111000)
目的 探讨塞来昔布对类风湿性关节炎患者生化指标影响及其疗效与安全性评价。方法 选取辽阳市中心医院风湿科收治的类风湿性关节炎患者92例,随机数字表达法分为2组,每组46例,对照组予甲氨蝶呤片、硫酸羟氯喹片;实验组在对照组治疗的基础上加用塞来昔布胶囊。比较2组患者血清骨保护因子(osteoprotegerin,OPG)及免疫相关生化指标水平,医生疗效与患者自我疗效评价及不良反应发生情况。结果 治疗后2组患者血清中IL-1、IL-6、CRP、C3、C4、RF、IgA、IgG及IgM水平较治疗前降低(P<0.05),实验组OPG较治疗前降低(P<0.05),对照组OPG与治疗前比较差异无统计学意义。实验组治疗后上述指标与对照组比较显著降低(P<0.05)。治疗后实验组患者治疗后医生评定临床有效率(86.96%)明显高于对照组(69.57%)(χ2=4.09,P<0.05),实验组患者自评疗效总有效率(84.78%)明显高于对照组(65.22%)(χ2=4.70,P<0.05)。实验组总不良反应发生率为13.04%,显著低于对照组的45.56%(χ2=11.79,P<0.01)。结论 塞来昔布能够明显改善类风湿性关节炎患者临床症状、体征,改善血清中细胞免疫因子及补体水平,降低不良反应,此治疗方法安全有效。
塞来昔布;类风湿性关节炎;免疫因子;临床疗效;安全性
类风湿关节炎(rheumatoid arthritis,RA)是因关节滑膜慢性炎症反应导致一系列关节症状的自身免疫性疾病,多发于35~50岁女性,是造成人类丧失劳动力和致残的主要原因之一[1]。非甾体抗炎药是目前临床上治疗类风湿性关节炎的主要药物之一,通过抑制环氧化酶1、环氧化酶2以达到镇痛解热消炎[2]。但是非甾体抗炎药不良反应较大,常引起不同程度的消化道反应,导致消化性溃疡的出现,甚至引起出血[3]。本研究通过观察类风湿性关节炎患者临床表现的缓解、用药后不良反应的发生率和血清中生化指标的变化,来探究特异性环氧化酶抑制剂对类风湿性关节炎的治疗效果和安全性,现报道如下。
1 资料与方法
1.1 一般资料 收集就诊于辽阳市中心医院风湿科2012年1月~2013年8月确诊为类风湿性关节炎的老年患者92例。通过随机数字表法将研究对象均分为实验组和对照组,每组46例。实验组男27例,女19例,年龄35~75岁,平均年龄(55.6±8.4)岁,病程0.5~3年;对照组男25例,女21例,年龄35~75岁,平均年龄(55.2±8.7)岁,病程0.5~3年。患者的年龄、性别、平均病程等一般资料比较差异无统计学意义,具有可比性。本研究已获得本医院的伦理学相关机构批准授权。
1.2 诊断标准 根据美国风湿病协会类风湿性关节炎分类确定诊断标准[4]:①关节内或周围晨僵持续1 h以上且病程至少6周以上;②同时伴有至少3个关节区软组织肿或积液;③至少有1个腕、掌指、近端指间关节区出现肿胀;④对称性关节炎,且病程至少6周以上;⑤有类风湿结节;⑥血清中类风湿因子(RF)阳性;⑦X线至少有骨质疏松和关节间隙狭窄的改变;以上7项有4项符合者即可诊断类风湿性关节炎。
1.3 纳入标准与排除标准 纳入标准:符合类风湿性关节炎的诊断标准;患者年龄在35~75岁,并能为自己做主者;患者以及家属对本研究具体情况了解知情并自愿参与和签署知情同意书。排除标准:精神、神志异常不能配合者;患有银屑病性关节炎、红斑狼疮、骨性关节炎、强直性脊柱炎者;严重心、肝、肾、肺、脑和消化性溃疡疾病者;患有肺癌、肝癌、肾癌、脑癌、白血病等恶性肿瘤者;患有艾滋病、梅毒、病毒性肝炎、结核等传染病者;磺胺类过敏患者;近3个月服用抗类风湿性关节炎药物患者。
1.4 治疗方法 根据骨关节炎临床治疗指南[5],对照组入院后予以休息、物理疗法、急性期的关节制动和恢复期的关节功能锻炼等一般疗法,并同时予以甲氨蝶呤片(湖南正清制药集团股份有限公司,国药准字H19983205)20 mg/次,每周1次口服;硫酸羟氯喹片(上海中西制药有限公司,国药准字H19990263)200 mg/次,每天1次口服,以及相应的对症治疗;6个月为1个疗程,治疗1个疗程;实验组在对照组治疗的基础上加用塞来昔布胶囊(Pfizer Manufacturing Deutschland GmbH,注册证号:H20120355)200 mg/次,每天2次口服,6个月为1个疗程,治疗1个疗程。
1.5 观察指标
1.5.1 血清骨保护因子(osteoprotegerin,OPG)及免疫相关生化指标检测:患者于治疗前和治疗后晨起空腹抽取肘静脉血5 mL,静置离心取上清,采用酶联免疫吸附法(ELISA)检测2组患者血清中白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、C反应蛋白(CRP)、骨保护因子(OPG)、补体(C3、C4)及免疫球蛋白(IgA、IgG、IgM)水平,采用乳胶增强散射比浊法测定类风湿因子(RF)水平。IL-1、IL-6、RF和CRP试剂盒由武汉优尔生科技股份有限公司提供,OPG、补体、免疫球蛋白试剂盒由赛驰生物公司提供,并且严格按照说明书操作。
1.5.2 疗效观察:比较2组患者治疗后关节疼痛指数、肿胀指数、晨僵、握力、血沉以及类风湿因子的变化。
1.5.3 不良反应:记录并比较2组患者治疗过程中和治疗后出现的腹痛、腹胀、腹泻、消化不良、恶心呕吐、消化性溃疡例数,以及中断治疗的例数。
1.6 疗效判定
1.6.1 医生评定标准:根据2010年类风湿关节炎分类标准[6]改良后的疗效评定标准:显效:治疗后患临床症状、体征、生化指标较治疗前好转≥70%;有效:治疗后患临床症状、体征、生化指标较治疗前好转≥50%,<70%;改善:治疗后患临床症状、体征、生化指标较治疗前好转≥30%,<50%;无效:治疗后患临床症状、体征、生化指标较治疗前好转<30%[7]。总有效率=(显效例数+有效例数+改善例数)/总例数×100%。
1.6.2 患者自我评定标准:参考改良版类风湿性关节炎病人的生存质量量表[7],参考原量表中晨僵、关节症状,加入压痛、握力等其他项目。优:治疗后患者关节晨僵、肿痛、压痛、握力较治疗前改善≥70%;良:治疗后患者关节晨僵、肿痛、压痛、握力较治疗前改善≥50%,<70%;中:治疗后患者关节晨僵、肿痛、压痛、握力较治疗前改善≥30%,<50%;差:治疗后患者关节晨僵、肿痛、压痛、握力较治疗前改善<30%。总有效率=(优例数+良例数+中例数)/总例数×100%。

2 结果
2.1 2组患者各生化指标水平比较 治疗后2组患者血清中IL-1、IL-6、CRP、C3、C4、RF、IgA、IgG及IgM水平较治疗前降低(P<0.05),实验组OPG较治疗前降低(P<0.05),对照组OPG与治疗前比较差异无统计学意义。实验组治疗后上述指标与对照组比较显著降低(P<0.05)。见表1。

表1 治疗前后2组患者各生化指标水平比较情况±s)Tab.1 Comparison of biochemical indicators between two groups before and after ±s)
*P<0.05,与同组治疗前比较,compared with the same group before treatment;#P<0.05,与对照组治疗后比较,compared with control group after treatment
2.2 2组患者治疗后疗效比较
2.2.1 医生评定疗效比较:治疗后实验组患者治疗后医生评定临床有效率(86.96%)明显高于对照组(69.57%)(χ2=4.09,P<0.05)。见表2。

表2 2组患者治疗后医生评定疗效比较Tab.2 Comparison of efficacy evaluation by doctors between two groups after treatment
2.2.2 患者自评疗效比较:治疗后2组实验组患者自评疗效总有效率(84.78%)明显高于对照组(65.22%)(χ2=4.70,P<0.05)。见表3。
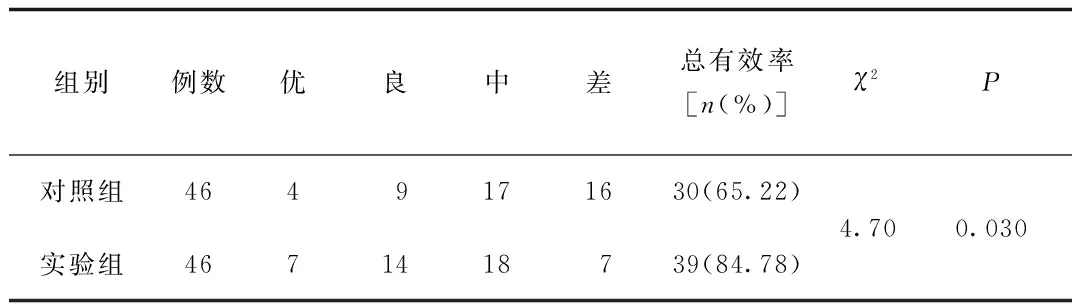
表3 2组患者治疗后患者自评疗效比较情况Tab.3 Comparison of self evaluation of patients between two groups after treatment
2.4 2组患者治疗过程中及治疗后不良反应出现情况 治疗过程中和治疗后,对照组患者出现腹痛3例、腹胀5例、腹泻4例、消化不良3例、恶心呕吐4例和消化性溃疡2例,不良反应发生总数为21例(45.56%),有4例中断治疗;实验组患者出现腹痛1例、腹胀1例、腹泻1例、消化不良1例、恶心呕吐2例,不良反应发生总数为6例(13.04%)。2组相比总不良反应发生率差异有统计学意义(χ2=11.79,P<0.01)。
3 讨论
类风湿性关节炎(RA)是风湿科常见的导致人类丧失劳动力和致残的自身免疫性疾病。类风湿性关节炎的病因迄今尚无定论,公认机体免疫紊乱是类风湿性关节炎的主要发病机制[8],活化的CD4+T细胞和MHC-Ⅱ型阳性的抗原递呈细胞浸润滑膜关节,启动特异的免疫应答,导致相应的关节炎症状。目前临床上常采用非甾体抗炎药、抗风湿药、糖皮质激素及手术等方法治疗,其中非甾体抗炎为类风湿性关节炎的主要治疗药物,能够通过抑制前列腺素合成、环氧化酶1和环氧化酶2起到镇痛、消炎的作用[9]。非甾体抗炎药能够明显刺激胃黏膜,引起消化不良、胃溃疡等一系列胃肠道反应,有报道表明还能够导致上呼吸道感染、皮疹的出现,致使患者用药依从性差,疗效不显著[10]。
塞来昔布是一种特异性抑制环氧化酶的非甾体抗炎药物,具有较好消炎、镇痛作用,且没有相关胃肠反应出现[11]。继承了非甾体抗炎药的作用机制,且避免了相关的不良反应出现,为类风湿性关节炎的一线用药。本研究结果显示,使用了塞来昔布的实验组患者用药后腹痛、腹胀、腹泻、恶心呕吐、消化不良及消化性溃疡等不良反应的发生率明显低于常规治疗的对照组,且实验组治疗后临床疗效亦明显高于对照组,说明塞来昔布能够提高类风湿性关节的临床疗效,并且能降低用药后的不良反应的发生。塞来昔布抑制环氧化酶的活性以镇痛消炎,并几乎对胃黏膜无刺激,从而降低了胃肠道不良反应的发生,提高了患者用药的依从性,从而提高临床治疗效果。
白细胞介素-1(IL-1)和白细胞介素-6(IL-6)类风湿性关节炎进展期关节破坏过程中起着重要的作用,IL-1和IL-6作用于多种细胞以产生不同的功能,作用于内皮细胞能够激活黏附因子的活性,作用于上皮细胞可诱导血管翳的形成,还能够刺激B细胞产生类风湿因子(RF)、免疫球蛋白和抑制调节性T细胞免疫应答,并能刺激破骨细胞分化和活化,诱导骨质的破关,加重类风湿性关节炎症状[12];补体为非特异性免疫反应的主要成分之一,若补体含量不足则容易导致自身免疫性疾病的发生,C3为补体系统的经典途径和替代途径的主要因子,C4是补体系统经典途径的第2个被激活的主要成分,2者在维持自身免疫稳定中起着重要作用[13];C反应蛋白(CRP)是在肝脏合成由炎性细胞因子释放的糖蛋白,在机体发生炎症、组织损伤时,能够激活补体,并能够促进细胞的吞噬作用[14];类风湿关节炎患者在致病因子侵袭机体后,引起机体TH细胞活跃,相对性的降低TS细胞功能,TH细胞活跃产生一系列的免疫球蛋白介导炎症反应,并与活跃的B细胞分泌的抗体共同引起一系列的免疫反应,引起组织损伤[15];类风湿性关节炎骨质破坏与破骨细胞通过细胞间相互作用介导骨破坏有关,其中OPG/RANK/RANKL起着重要的作用,RANKL能够抑制OPG的表达,并与RANK结合活化破骨细胞,促进骨质破坏;RF为检测类风湿性关节炎的敏感因子,但其特异性较差[16]。本研究结果显示,通过塞来昔布治疗的实验组血清中的IL-1、IL-6、CRP、OPG、补体、免疫球蛋白以及RF均明显低于对照组,提示塞来昔布能够降低类风湿性关节炎患者血清中促进骨质破坏、组织损伤和引起免疫紊乱的生化物质,改善临床症状,提高临床疗效,这可能与塞来昔布能够抑制环氧化酶的作用有关。
通过对92例类风湿性关节炎患者治疗后临床疗效观察、安全性分析和血清中生化指标的改善,证实塞来昔布能够降低患者血清中促进骨质破坏、组织损伤和引起免疫紊乱的生化物质,提高临床治疗效果,副作用小,安全性较高,是未来治疗类风湿性关节炎的潜能性药物。
[1] 谢伟林,管剑龙.上海市活动性类风湿关节炎患者医院感染的流行病学调查[J].中国感染与化疗杂志,2014,14(2):135-141.
[2] 池里群,周彬,高文远,等.治疗类风湿性关节炎常用药物的研究进展[J].中国中药杂志,2014,39(15):2851-2858.
[3] 刘亚州,宋铁兵,刘瑞鹏,等.非甾体抗炎药胃肠道不良反应的预防[J].中国药师,2009,12(8):1149-1150.
[4] 肖卫国.美国风湿病协会2012年类风湿关节炎治疗推荐意见解读[J].中国实用内科杂志,2013,33(1):38-41.
[5] 国际ACR小组委员会.类风湿性关节炎的治疗指南[J].继续医学教育,2005,19(3):67-73.
[6] Aletaha D,Neogi T,Silman AJ,et al.2010 Rheumatoid arthritis classification criteria: An American College of Rheumatology/European League Against Rheumatism collaborative initiative[J].Arthritis Rheum,2010,62(9):2569-2581.
[7] 李曼.类风湿性关节炎患者生存质量评价标准和方法[J].中国临床康复,2002,6(3):316-317.
[8] 郭明,安高,封桂英,等.CD4+T细胞亚群在类风湿性关节炎中的研究进展[J].细胞与分子免疫学杂志,2014,30(9):1004-1007.
[9] 董宇,李云霞,陈世益.非甾体抗炎药物在骨性关节炎中的应用[J].上海医药,2012,33(15):5-8.
[10] 杨欣.非甾体抗炎药的临床应用及不良反应[J].临床合理用药杂志,2012,5(34):88-89.
[11] 谭利民.塞来昔布治疗类风湿性关节炎疗效观察[J].中国医学创新,2012,9(1):37-38.
[12] 汤荣华,黄建军.类风湿性关节炎患者血清GM-CSF,IL-6,IL-17和TNF-α的水平测定及临床意义[J].检验医学,2013,28(3):173-177.
[13] 刘健,郭雯,程华威,等.类风湿性关节炎血清补体水平相关因素分析[J].中国临床保健杂志,2006,9(1):11-13.
[14] 喻少波,王晋平,居军.超敏C反应蛋白与类风湿关节炎,骨关节炎关系的探讨[J].临床荟萃,2007,22(3):180-182.
[15] 李妍,康辉.Th1,Th2和Th17型细胞在类风湿性关节炎和系统性红斑狼疮中的活化特点[J].微生物学杂志,2008,28(5):98-101.
[16] 范慧洁,戴如春,廖二元.OPG/RANK/RANKL系统与骨折和类风湿性关节炎[J].国际内分泌代谢杂志,2006,26(4):241-244.
(编校:王俨俨)
Effect of celecoxib on serum biochemical parameters in rheumatoid arthritis patients and its clinical effect and safety assessment
ZHOU Li-qin1, ZHAGN Ju2
(1.Ward Area Pharmacy, Liaoyang City Center Hospital, Liaoyang 111000, China; 2.Department of Rheumatism, Liaoyang City Center Hospital, Liaoyang 111000, China)
ObjectiveTo investigate the effect of celecoxib on serum biochemical parameters in rheumatoid arthritis patients and its clinical effect and safety assessment.Methods92 cases of rheumatic arthritis were selected and divided into two groups.46 cases in control group were treated with methotrexate and hydroxychloroquine sulfate, and 46 cases in experitment group were treated on the basis of control group with celecoxib.The serum osteoprotegerin (OPG) levels and related biochemical parameters, efficacy evaluation by doctors and self evaluation of patients and adverse reactions were compared between two groups.ResultsAfter treatment, the serum levels of IL-1, IL-6, CRP, C3, C4, RF, IgA, IgG and IgM levels after treatment were significantly lower than those before treatment in two groups (P<0.05), OPG serum level after treatment group was lower than that before treatment in experiment group(P<0.05), but there was no significant difference in control group.The above indexes in experiment group in experiment group were lower than those in control group after treatment.The efficacy evaluation by doctors in experiment group was 86.96%, which was higher than 69.57% in control group(χ2=4.09,P<0.05), and efficacy self evaluation by patients was 84.78%, which was higher than 65.22% in control group (χ2=4.70,P<0.05).The adverse reactions in experiment group was 13.04%, which was significantly lower than 45.56% in control group (χ2=11.79,P<0.01).ConclusionCelecoxib could significantly improve clinical symptoms and physical sign and serum biochemical markers, and reduce adverse reactions in rheumatoid arthritis patients, which is an effective and safety treatment.
celecoxib; rheumatoid arthritis; immune factors; clinical efficacy; safety
周丽琴,女,本科,副主任药师,研究方向:临床药学,E-mail:zjzhouliqin123@163.com。
R684.3
A
1005-1678(2015)06-0111-04
