响应面法优化小球藻叶绿素提取工艺及其稳定性研究
2015-07-05邓祥元成婕刘孟姣高坤崔思宇
邓祥元,成婕,刘孟姣,高坤,崔思宇
响应面法优化小球藻叶绿素提取工艺及其稳定性研究
邓祥元1,2,成婕1,刘孟姣1,高坤1,崔思宇1
(1.江苏科技大学生物技术学院,江苏镇江212018;2.南京农业大学资源与环境科学学院,南京210095)
采用响应面法优化蛋白核小球藻(Chlorella pyrenoidesa)叶绿素提取工艺,研究影响其稳定性的相关因素。结果表明,小球藻叶绿素最优提取条件为:固液比5 g·L-1,超声温度62℃,超声时间2 h;在此条件下,模型预测提取量为11.24 mg·g-1,验证试验提取量为10.99 mg·g-1。室内自然光、人工光、UV辐射、高温、酸、碱、柠檬酸、高浓度麦芽糖、金属离子Al3+、Fe2+和Fe3+等对小球藻叶绿素稳定性有不同程度破坏作用;而氧化还原剂、葡萄糖、蔗糖、低浓度麦芽糖、VC、食盐、金属离子Mg2+、Ca2+、K+、Zn2+和Na+等对叶绿素稳定性影响不显著;Cu2+可增强小球藻叶绿素稳定性。
蛋白核小球藻;叶绿素;提取工艺;响应面分析法;稳定性
小球藻(Chlorella sp.)是球形普生性单细胞藻类,富含色素、多糖、蛋白质等多种营养成分,是可人工大规模培养的微藻种类之一[1-2],其叶绿素含量为4%~6%,高于已商业化脱水苜蓿的叶绿素含量[3]。叶绿素属于卟啉类化合物,无毒,可食用,有造血、提供维生素、解毒、抗病、促进创伤愈合、脱臭等多种用途[4],被广泛应用于食品、药品、化妆品等行业[5-7]。但叶绿素易受光照、温度、酸、碱等因素影响而发生脱镁、脱植醇反应,使其色泽发生变化而影响品质。
目前,常见叶绿素提取方法主要有超临界CO2法,吸附树脂法和有机溶剂浸提法[8-10]。超临界CO2法能缩短提取时间,减少提取剂使用量,受到关注[11],但是该方法受操作复杂、设备昂贵、成本较高等因素困扰,应用领域受到限制。因此,采用有机溶剂浸提法提取叶绿素,选用合适有机溶剂即可进行提取,并辅助微波、超声波或离子交换分离等手段提高提取效率和纯度[12]。其中超声波辅助法是利用超声波在溶剂中传播产生“空化效应”,使物料进一步破裂并将目标产物释放到提取溶剂中,可缩短提取时间,减少溶剂使用量,降低生产成本[13-14]。在前期工作中,利用超声波辅助法对提取小球藻叶绿素工艺中的固液比、超声温度和超声时间进行单因素试验,本研究在前期试验基础上进一步采用响应面法[15-17]优化上述3个工艺参数对小球藻叶绿素提取影响,探索最优提取工艺条件,同时根据不同条件下叶绿素含量变化情况,对其稳定性进行研究,为利用藻类资源生产叶绿素提供技术支持。
1 材料与方法
1.1 材料与仪器
蛋白核小球藻(Chlorella pyrenoidesa)藻粉购自江苏省东台市赐百年生物工程有限公司;无水乙醇、甲醇等试剂均为分析纯(上海国药集团化学试剂有限公司产品)。
UV-1800PC型紫外可见分光光度计(上海美谱达仪器有限公司);TEA-1004型台姆超声波(200 W,上海台姆超声波设备有限公司);FA114型电子天平(上海海康电子仪器厂);Spectrafuge 6C型离心机(美国莱伯特(Labnet)仪器有限公司);光照度计(浙江托普仪器有限公司);紫外辐照计(北京师范大学光电仪器厂)。
1.2 方法
1.2.1 小球藻叶绿素的测定
称取小球藻藻粉于离心管中,加入10 mL甲醇乙醇混合液(甲醇∶乙醇体积比为1∶3),摇匀并置于超声波内,超声波作用一定时间后;将提取液在5 000 r min-1下离心5 min,取上清液于比色皿中,以所用提取溶剂为参比,在波长645和663 nm下测其吸光值。利用以下公式计算叶绿素a(Ca)、叶绿素b(Cb)及总叶绿素(CT)的提取量[18-19]:
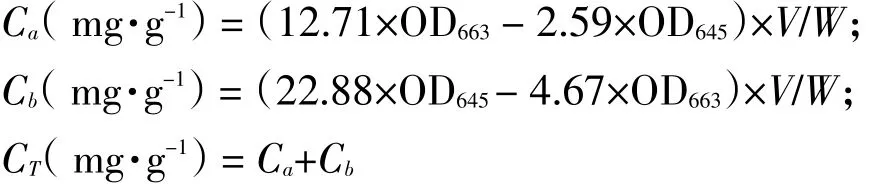
式中,V-提取液体积(L);W-藻粉质量(g)。
1.2.2 单因素试验
按照1.2.1方法,研究固液比(2、3、4、5、6、7、8、10、20、25 g·L-1)、超声温度(40、50、60、70℃)和超声时间(0.5、1、1.5、2、2.5、3 h)对小球藻叶绿素提取量的影响。
1.2.3 响应面分析试验
结合单因素试验结果,利用Box-Behnken中心组合试验设计优化影响小球藻叶绿素提取量的3个因素,即固液比(X1),超声温度(X2)和超声时间(X3),并以-1、0、+1代表其水平(见表1)。
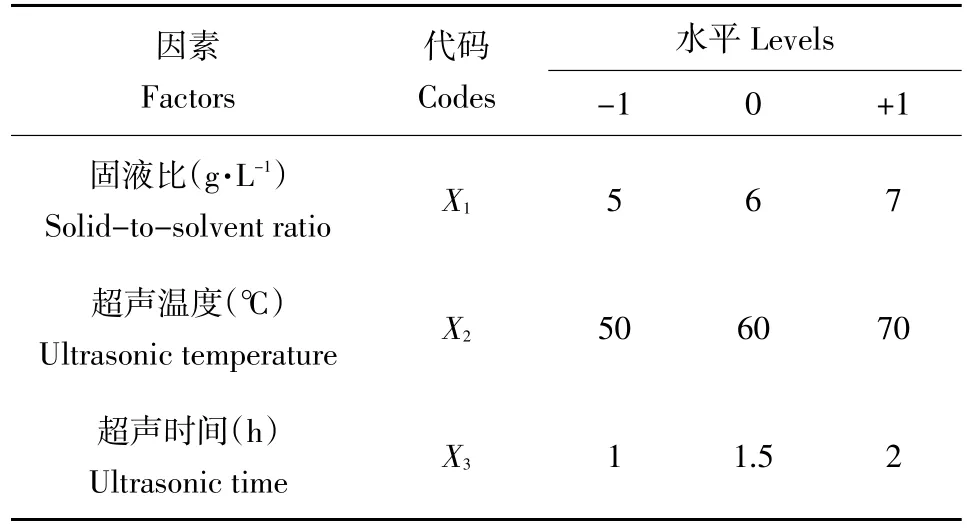
表1 小球藻叶绿素提取工艺Box-Behnken试验因素水平设计Table 1Factor levels design of Box-Behnken experiments for optimizing extraction process of chlorophyll from C.pyrenoidesa
采用Design Expert 7.1.6软件对数据进行回归分析,获得各因素一次效应、二次效应及其交互效应的关联方程,并对小球藻叶绿素提取工艺进行优化。
1.2.4 光对小球藻叶绿素稳定性的影响
取小球藻叶绿素提取液置于不同光环境条件下,设置避光处理组(DL)、室内自然光照组(NL)、人工光照组(AL)和紫外线辐射组(UV);其中人工光照组设3种光强度,分别为1 000 lx(AL1)、3 000 lx(AL2)和5 000 lx(AL3);紫外线辐射组设3种辐射强度,分别为2 μw·cm-2(UV1)、7 μw·cm-2(UV2)和20 μw·cm-2(UV3)。
1.2.5 温度及pH对小球藻叶绿素稳定性的影响
设置不同温度梯度[4℃、室温(约30℃)、40、50和60℃]和pH(2、4、6、8、10、12),研究不同温度及pH对小球藻叶绿素稳定性的影响。
1.2.6 金属离子对小球藻叶绿素稳定性的影响
向叶绿素提取液中加入常见金属离子Mg2+(Mg⁃SO4)、Ca2+(CaCl2)、K+(KCl)、Cu2+(CuSO4)、Zn2+(ZnCl2)、Na+(NaCl)、Al3+(Al2(SO4)3)、Fe2+(Fe⁃SO4)、Fe3+(FeCl3),浓度为10 mmol·L-1;于室温黑暗条件下处理10 d后测量各组叶绿素含量,并计算叶绿素残存率。
1.2.7 常见食品添加剂对小球藻叶绿素稳定性的影响
在叶绿素提取液中加入常见食品添加剂,蔗糖、食盐、葡萄糖、维生素C(VC)、柠檬酸,其浓度分别为10%、3%、2%、0.5%和1.6%,在室温黑暗条件下,每24 h测定叶绿素含量。
1.2.8 小球藻叶绿素耐氧化还原性试验
向叶绿素提取液中分别加入不同浓度Na2SO3(25、50、100、200 mmol·L-1)和H2O2(12.5、25、50、100 mmol·L-1),置于室温黑暗条件下分别处理1和2 h后依次测定各组中叶绿素含量,并计算残存率。
1.2.9 小球藻叶绿素耐糖性试验
向叶绿素提取液中加入蔗糖、葡萄糖、麦芽糖,并设定不同浓度梯度(5%、10%、20%、40%),在室温黑暗条件下分别处理2.5和5 h后测定各组叶绿素含量,并计算残存率。
1.2.10 叶绿素含量及其残存率的计算
以提取溶剂为空白对照,用分光光度计测定叶绿素提取液在645和663 nm波长下吸光值,利用以下公式计算叶绿素含量和残存率[18-19]:
C(mg·g-1)=8.04×OD663+20.29×OD645×V/W;
残存率(%)=(C/C0)×100%;
式中,C0和C分别为处理前后叶绿素含量(mg·g-1);OD663和OD645为叶绿素提取液在663和645 nm下吸光值。所有试验均重复3次以上。
2 结果与分析
2.1 单因素试验结果与分析
固液比、超声温度及超声时间对小球藻叶绿素提取量的影响如图1所示。
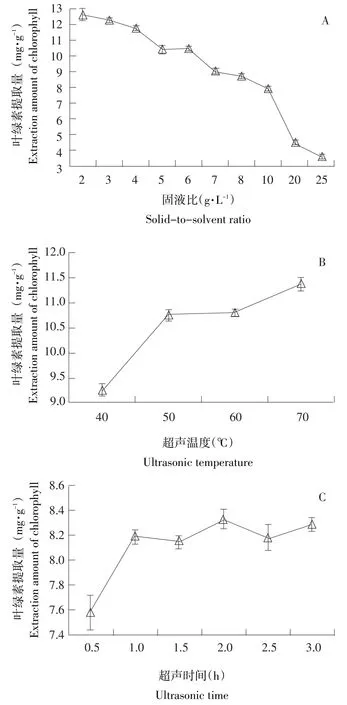
图1 固液比、超声温度、超声时间对小球藻叶绿素提取量的影响Fig.1Effects of solid-to-solvent ratio,ultrasonic temperature and time on extraction amount of chlorophyll from C.pyrenoidesa
由图1A可知,小球藻叶绿素提取量随固液比增加而下降,这主要是随固液比增大,两相间浓度差变小,导致传质推动力小;相反,降低固液比会较大程度提高传质推动力,但也增加生产成本及后续处理难度,因而固液比的选择应兼顾过程的经济性与简便性[20]。从降低成本、方便操作、易于放大等方面考虑,选择5、6、7 g·L-1为响应面分析时固液比的3个水平。
由图1B可知,随超声温度升高,小球藻叶绿素提取量先增加后基本不变;这是由于随温度升高,溶剂分子运动加快,使叶绿素与提取溶剂间相互作用随温度升高而增强;但温度越高,提取剂挥发越快,对叶绿素破坏作用也越大[21]。因此,综合考虑各因素,响应面分析时超声温度选择50、60和70℃3个水平。
图1C表示超声时间对小球藻叶绿素提取量的影响,提取量随超声时间延长先增加后基本不变。这是由于在提取初始,原料与提取剂两相间的浓度差较大,促进叶绿素快速溶解并扩散至提取剂,但随着时间推移,叶绿素在溶剂中的浓度不断增大,浓度差逐渐变小,扩散速度变慢,提取一定时间后,两相间浓度达到平衡,提取过程基本完成,这时继续延长超声时间不能提高提取效率,反而会由于超声时间过长造成叶绿素损失、杂质溶出和溶剂挥发等[9]。因此,在进行响应面分析时超声时间选取的3水平为1、1.5和2 h。
2.2 响应面试验结果与分析
2.2.1 小球藻叶绿素提取工艺的响应面分析
在单因素试验基础上,采用3因素3水平的响应面法优化小球藻叶绿素提取工艺,结果见表2。
此次Box-Behnken试验设计方案共有17个试验点,其中12个为析因试验,其余5个为中心试验。析因点为自变量取值在X1、X2、X3构成的三维顶点,零点区域为中心点,零点区域重复5次,用于估计试验误差。
2.2.2 回归方程的建立与检验
利用Design Expert 7.1.6分析软件对表2中的试验数据进行回归分析,得到小球藻叶绿素提取量对固液比(X1)、超声温度(X2)和超声时间(X3)3个因素的二次多项回归方程:
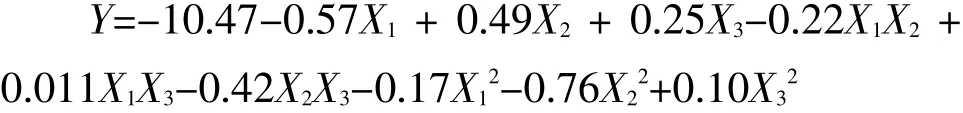
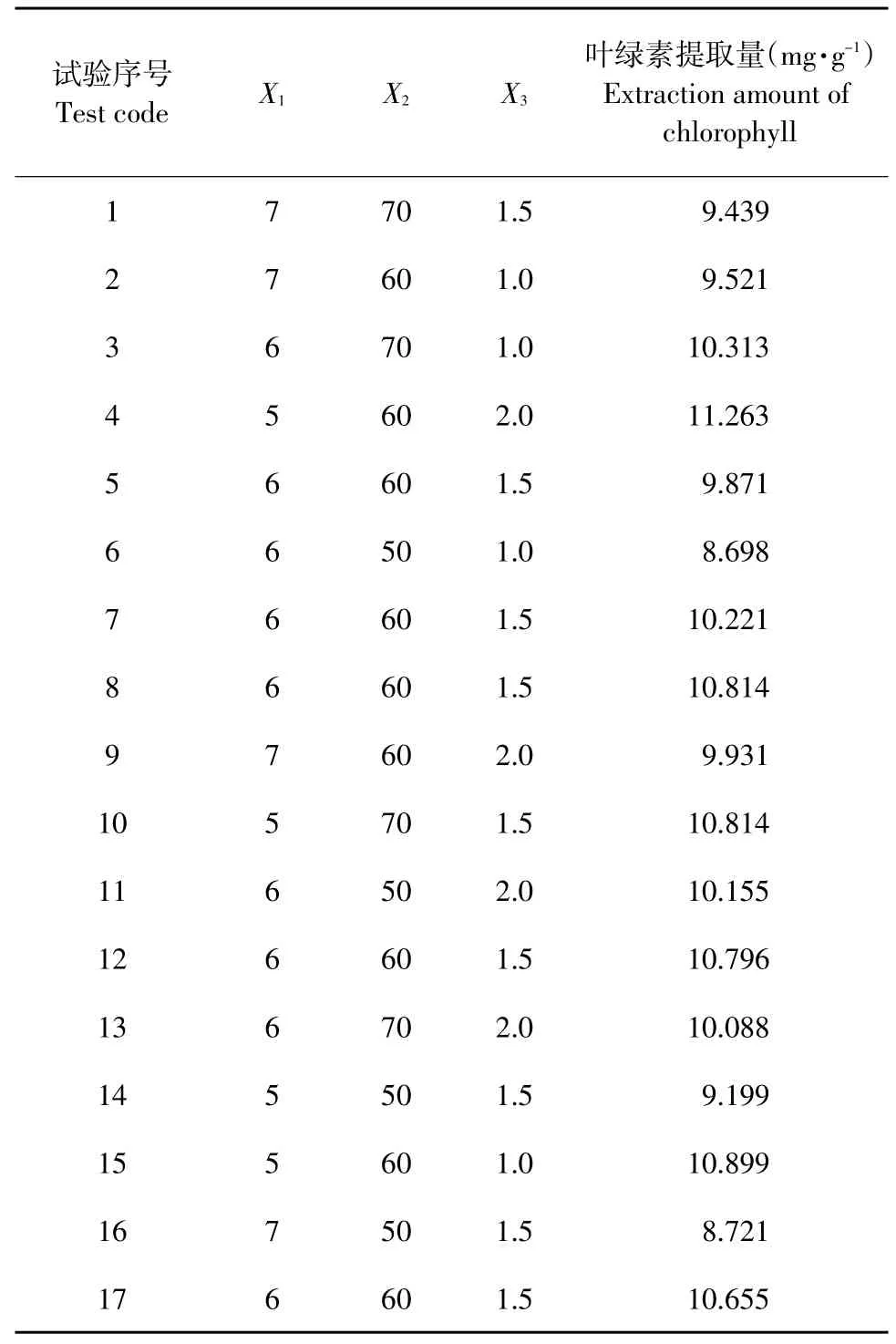
表2 小球藻叶绿素提取工艺响应面试验设计方案及结果Table 2Experimental design and corresponding results of response surface experiments for optimizing extraction process of chlorophyll from C.pyrenoidesa
以上二次多项回归方程的方差分析和显著性检验结果见表3。由表3可知,回归模型高度显著(P=0.0071<0.01),失拟项不显著(P=0.7715>0.05),以及Adjusted R2=0.7871和Adep precision= 9.428远大于4,可知回归方程拟合度和可信度均较高。由回归方程系数显著性检验结果可知,方程一次项X1和X2对小球藻叶绿素提取量的线性效应极显著,而X3对小球藻叶绿素提取量无显著影响(P=0.0848>0.05),各因素对小球藻叶绿素提取量的影响大小分别为X1>X2>X3;二次项中X22对小球藻叶绿素提取量的影响显著;交互作用项中X2X3对小球藻叶绿素提取量有显著影响。
2.2.3 因素间的交互作用分析
用Design Expert 7.1.6软件根据回归方程进行绘图分析,得到响应面图2。
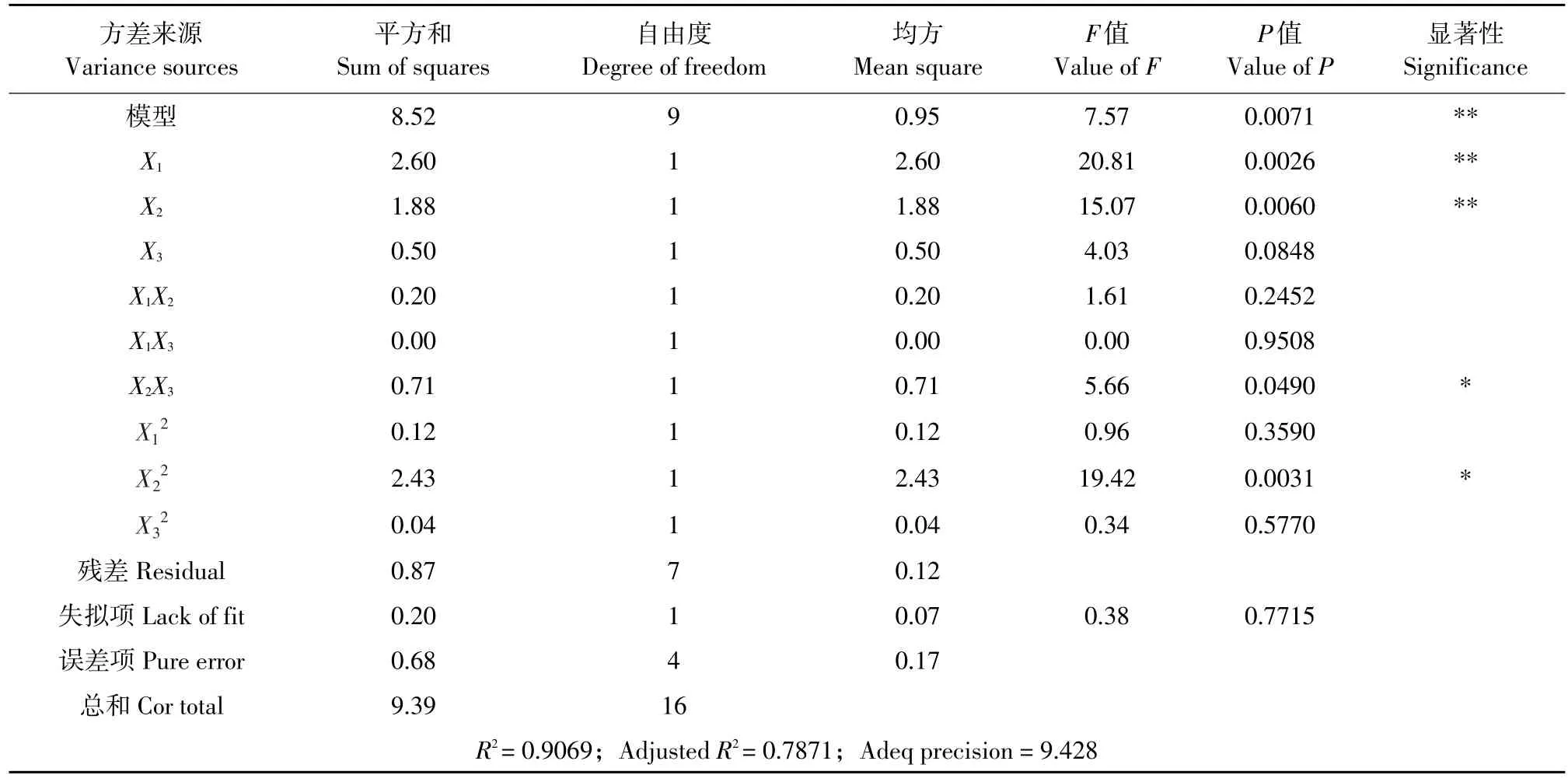
表3 小球藻叶绿素提取工艺优化的回归方程的方差分析及其系数显著性检验Table 3Variance analysis and significance test of the regression equation of response surface experiments for optimizing extraction process of chlorophyll from C.pyrenoidesa
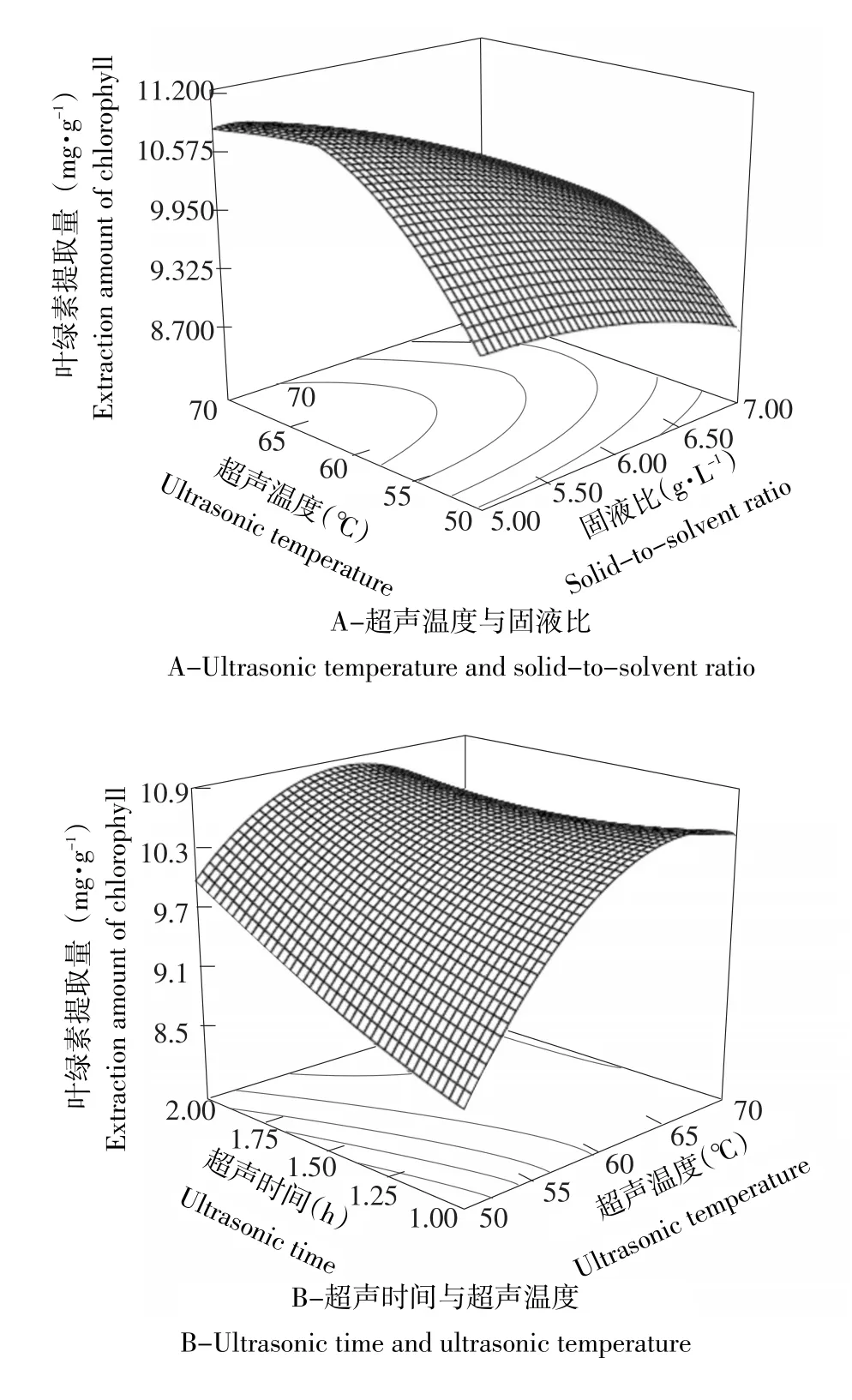

图2各因素交互作用对小球藻叶绿素提取量的影响Fig.2Interaction effects of every two factors on extraction amount of chlorophyll from C.pyrenoidesa
图2 A显示当超声时间为1.5 h时,超声温度与固液比间的交互作用对小球藻叶绿素提取量的影响,这两个因素的交互作用不显著;随超声温度和固液比增加,叶绿素提取量先缓慢提高,然后缓慢降低,表明叶绿素提取量可以承受超声温度和固液比的微小变化;同时适当的超声温度和固液比可在一定程度上提高叶绿素提取量。由图2B可知,当固液比为6 g·L-1时,超声时间与超声温度对小球藻叶绿素提取量的交互作用表现为显著水平,当超声温度在低水平时,超声时间的响应面抛物曲线最高点在高水平;当超声温度在高水平时,超声时间的响应面抛物曲线最高点在低水平,选取最优组合的超声时间和超声温度可使小球藻叶绿素提取量最高。图2C显示当超声温度为60℃时,超声时间与固液比的交互作用对小球藻叶绿素提取量的影响,这两个因素的交互作用不显著;超声时间一定时,叶绿素提取量随固液比增加而降低;固液比一定时,随超声时间增加叶绿素提取量先增加后减少;高水平超声时间和低水平固液比可使小球藻叶绿素提取量处于高水平。
2.2.4 最佳工艺条件确定
根据Box-Behnken分析模型得知,小球藻叶绿素最优提取工艺条件为:固液比5 g·L-1,提取温度61.91℃,提取时间2 h。在此工艺条件下,所得小球藻叶绿素提取量理论值为11.24 mg·g-1。为检验响应面法所得最优工艺的可靠性,同时考虑实际操作情况,将小球藻叶绿素提取工艺条件修正为固液比5 g·L-1,超声温度62℃,超声时间2 h,实际测得小球藻叶绿素提取量为10.99 mg·g-1,与理论预测值间误差为2.19%(<5%)。
2.3 小球藻叶绿素稳定性分析
2.3.1 光照对小球藻叶绿素稳定性的影响
不同光照条件对小球藻叶绿素稳定性的影响如图3所示。由图3A可知,室内自然光与人工光对小球藻叶绿素稳定性影响很大,其中人工光源光照强度越大对叶绿素破坏作用越显著,室内自然光对叶绿素也有较强破坏作用,放置在黑暗处的叶绿素浓度变化很小。这可能是因为叶绿素中多不饱和双键很不稳定,在光照下,活性氧往往可激活碳环的多不饱和双键而引起叶绿素环降解;而且人工光和自然光中可见光及红外线可以产生热量,提高温度,从而加速自由基等氧化性强的物质对叶绿素的破坏作用;同时长时间光照也会导致叶绿素光敏氧化,降解为无色产物,从而使叶绿素含量大幅度降低[22-24]。图3B表明紫外光对小球藻叶绿素稳定性有一定影响,而且紫外光强度越大对叶绿素的破坏作用越强,但<7 μw·cm-2的低强度紫外光比室内自然光照对叶绿素破坏作用小,而高强度紫外光比室内自然光照对叶绿素破坏作用大。这可能是由于紫外光照射具有产生自由基的作用[22],不同紫外照射强度可能不同程度破坏叶绿素结构,使叶绿素含量呈下降趋势[25-26]。
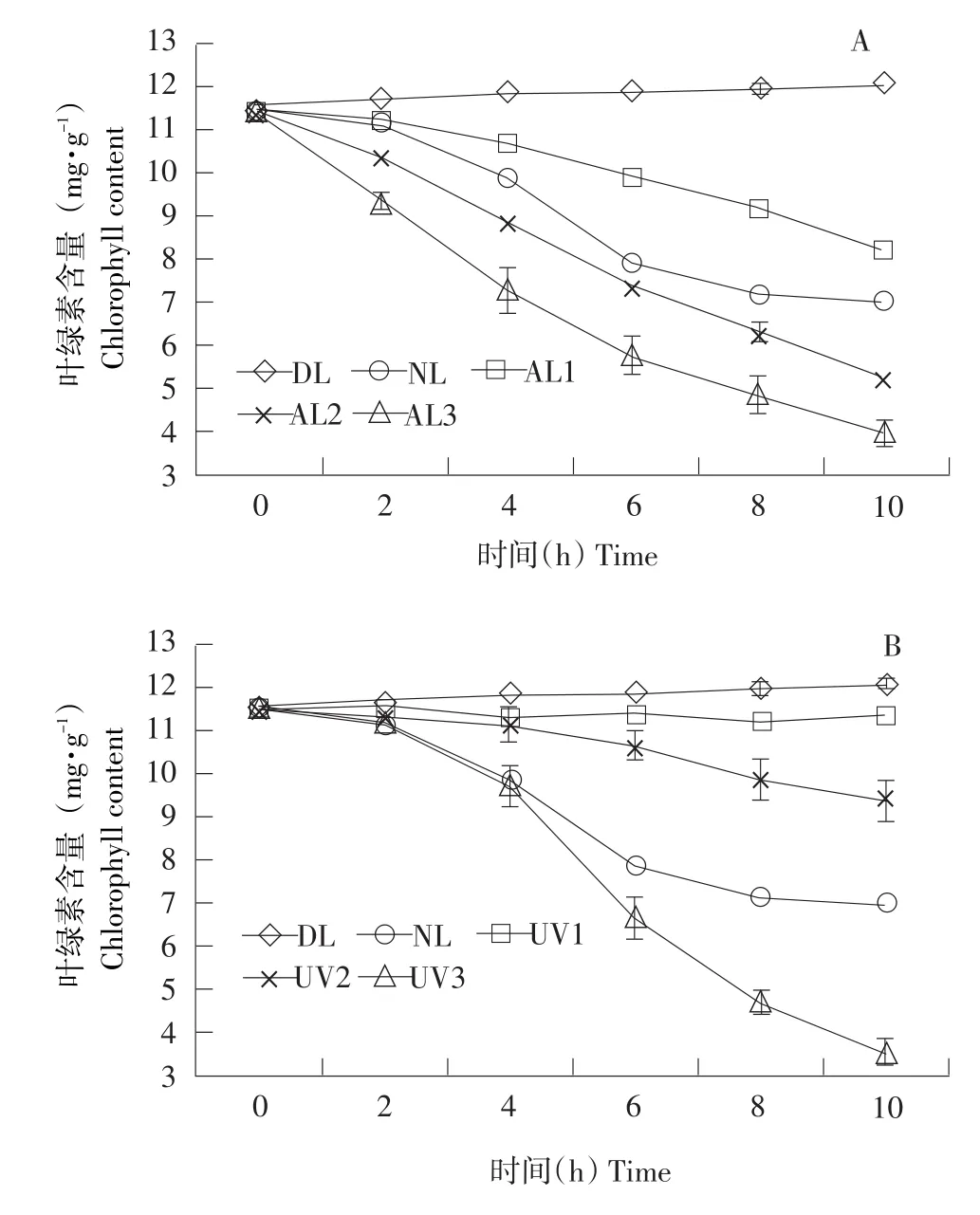
图3 光照对小球藻叶绿素稳定性的影响Fig.3Effects of light on stability of chlorophyll from C.pyrenoidesa
2.3.2 温度对小球藻叶绿素稳定性的影响
由图4可以看出,小球藻叶绿素在低温条件下较稳定,如在4℃、室温、40℃水浴下叶绿素含量变化不明显;50℃水浴下叶绿素含量有所增加;而当温度过高时叶绿素稳定性降低,如在60℃水浴下叶绿素含量明显下降,这与曾家豫等对紫堇叶绿素稳定性研究结果[27]一致。这可能是由于低温可抑制细菌及叶绿素内部酶对叶绿素的破坏作用,使叶绿素稳定性相对增加;但高温条件下,叶绿素分解产生自由基,在高温及氧作用下,叶绿素被迅速降解,同时在高温条件下,叶绿素卟啉环结构中心Mg2+脱落而引起脱色[27],使叶绿素含量降低。由此可见,低温是保证叶绿素质量重要条件,应避免高温长时间加热,叶绿素产品最好在室温下避光保存。
2.3.3 pH对小球藻叶绿素稳定性的影响
pH对小球藻叶绿素稳定性的影响见图5。
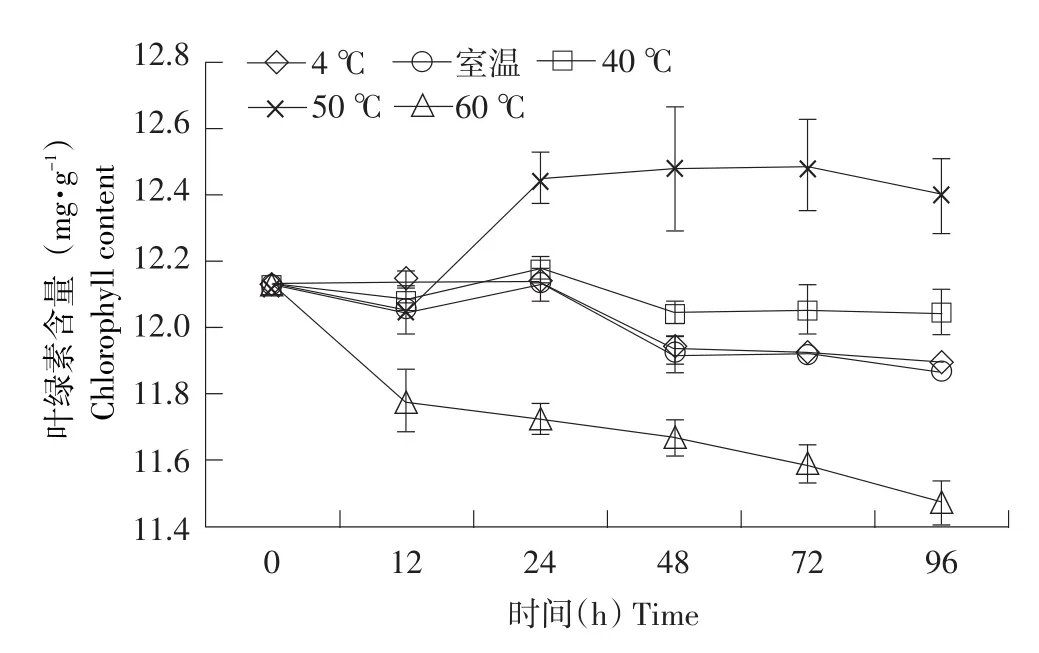
图4 温度对小球藻叶绿素稳定性的影响Fig.4Effects of temperature on stability of chlorophyll from C.pyrenoidesa
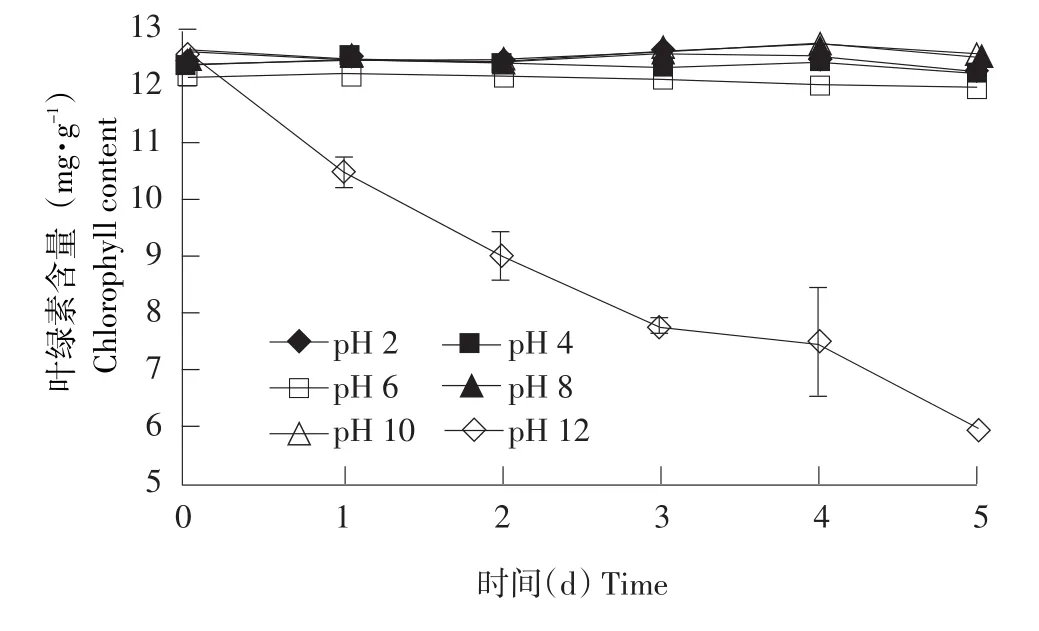
图5 pH对小球藻叶绿素稳定性的影响Fig.5Effects of pH on stability of chlorophyll from C.pyrenoidesa
由图5可知,小球藻叶绿素在酸性或碱性条件下均不稳定,pH为2、4、6的试验管叶绿素变为灰色;弱碱性条件下,叶绿素相对稳定,pH为8时叶绿素最稳定;强碱条件下叶绿素变为黄绿色且pH越大绿色越浅,叶绿素含量越少。这可能是由于叶绿素是双羧酸酯,一定浓度酸碱介质均会对其产生影响,叶绿素中心Mg2+极不稳定,在酸性条件下易被H+取代,导致叶绿素脱镁降解生成叶绿酸;碱性过强则会加速脱酯反应使叶绿素分解,在碱性条件下,叶绿素不发生脱镁和碳环裂解反应,色泽相对稳定[28]。由此可知,叶绿素在偏碱性条件下稳定性最好,与孙鹤等对绿色蔬菜汁中叶绿素稳定性研究结果[29]一致。因此,将此类叶绿素储存在微碱性或者中性环境下可增强稳定性。
2.3.4 金属离子对小球藻叶绿素稳定性的影响
由表4可以看出,Al3+和Fe3+与叶绿素反应产生沉淀,颜色变为黄绿色;Fe2+与叶绿素反应产生少量沉淀,颜色变为草绿色;Cu2+与叶绿素反应,颜色基本没变,叶绿素含量提高;其他金属离子Mg2+、Ca2+、K+、Zn2+和Na+与叶绿素反应颜色基本不变,对叶绿素稳定性无影响。叶绿素多不饱和双键很不稳定,易被氧化降解,Al3+和Fe3+均具有氧化性,均对叶绿素有氧化破坏作用,使叶绿素含量降低;Fe2+使叶绿素变色降解,可能是因为部分Fe2+被氧化生成Fe3+而使叶绿素降解变色;Cu2+使叶绿素含量增加的原因可能是叶绿素中Mg2+易被H+取代形成去镁叶绿素,并与Cu2+结合生成绿色铜代叶绿素使其稳定性增加[30],这与冯爱青等关于金属离子对大叶黄杨叶绿素的研究结果[4]一致。因此,小球藻叶绿素在生产储存过程中应避免与Al3+、Fe3+、Fe2+等金属离子接触。
2.3.5 食品添加剂对小球藻稳定性的影响
由图6可以看出,食品添加剂蔗糖、食盐、葡萄糖和VC对小球藻叶绿素稳定性基本无影响,柠檬酸使叶绿素含量降低。这可能是因为柠檬酸呈弱酸性易使叶绿素失去卟啉环中的镁成为去镁叶绿素,使叶绿素降解变为灰绿色,稳定性降低。

表4 金属离子对小球藻叶绿素稳定性的影响Table 4Effects of metallic ions on stability of chlorophyll from C.pyrenoidesa
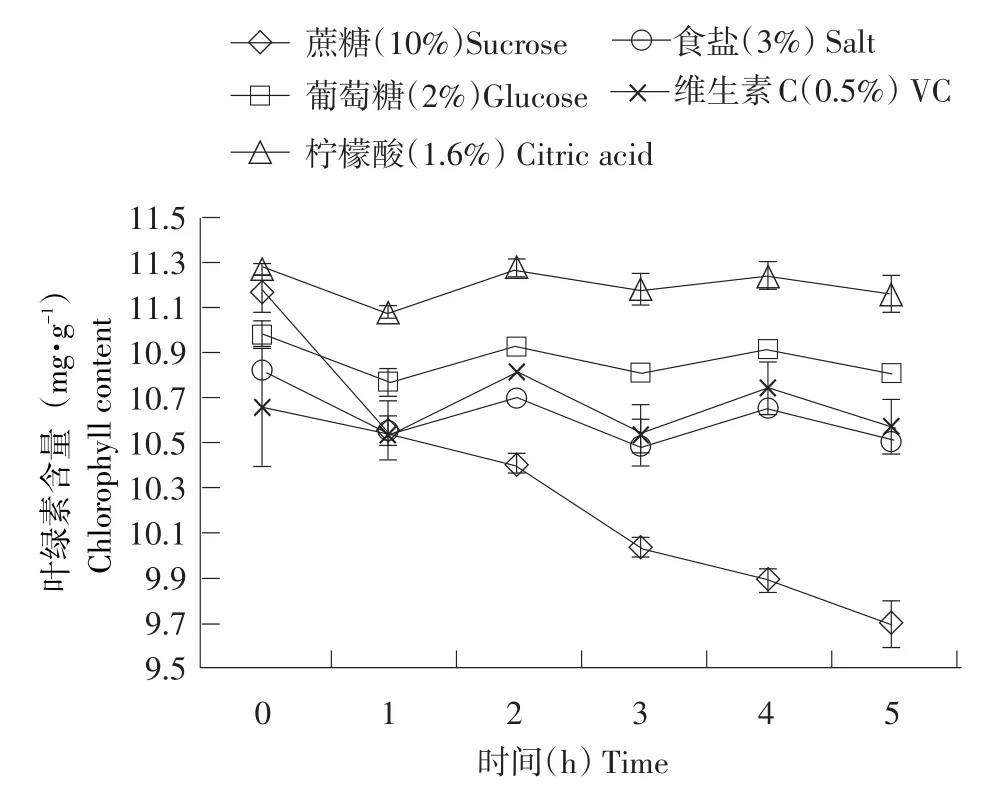
图6 食品添加剂对小球藻叶绿素稳定性的影响Fig.6Effects of food additives on stability of chlorophyll from C.pyrenoidesa
2.3.6 耐氧化还原性
由表5可以看出,小球藻叶绿素在试验条件下耐氧化还原性较强,色调不变,残存率在99%以上,与吴荣金等对凤眼莲叶叶绿素稳定性研究结果基本一致[28],但与张亮等研究大叶黄杨叶绿素稳定性结果有所不同[30]。基于本研究结果,小球藻叶绿素稳定性较强,可耐受较高浓度氧化剂、还原剂的长时间作用,应用领域将进一步扩大。
2.3.7 耐糖性试验
结果见表6。小球藻叶绿素对蔗糖和葡萄糖具有较好的耐性,因此该叶绿素可用于含蔗糖及葡萄糖较高的食品和饮料中,具有较大开发利用价值。但小球藻叶绿素对高浓度麦芽糖耐性较差,在含麦芽糖较高的食品中应限制使用,但其色调基本为绿色,表明小球藻叶绿素具有耐糖性。
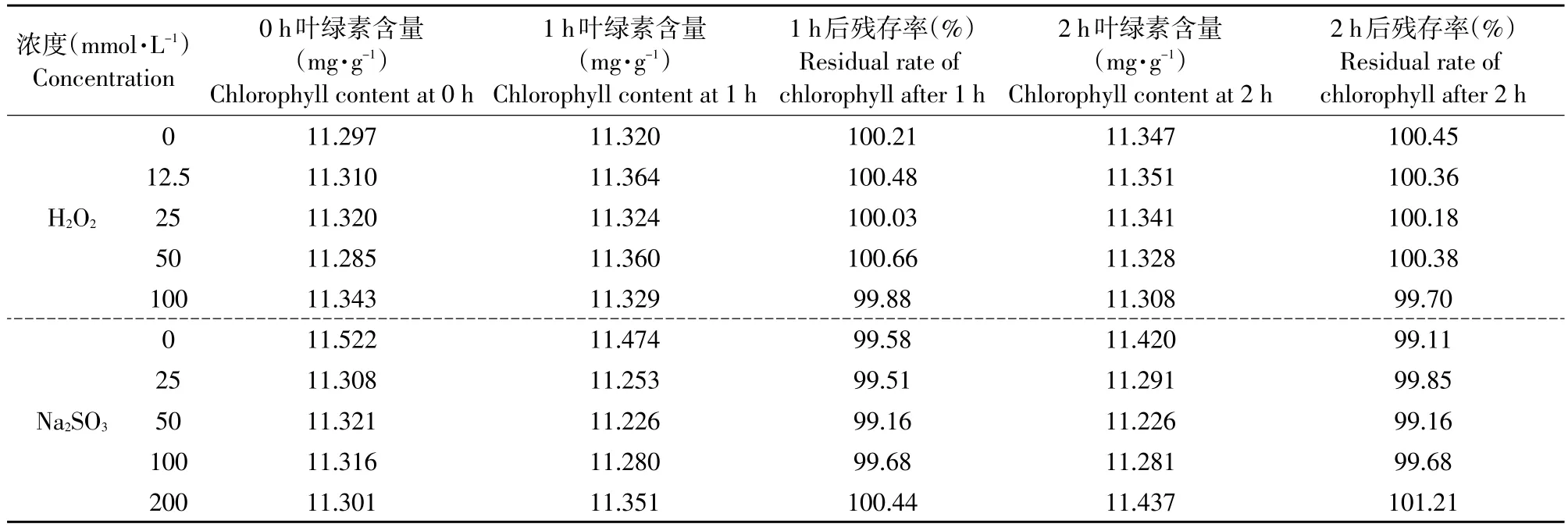
表5 H2O2和Na2SO3对小球藻叶绿素稳定性的影响Table 5Effects of H2O2and Na2SO3on stability of chlorophyll from C.pyrenoidesa
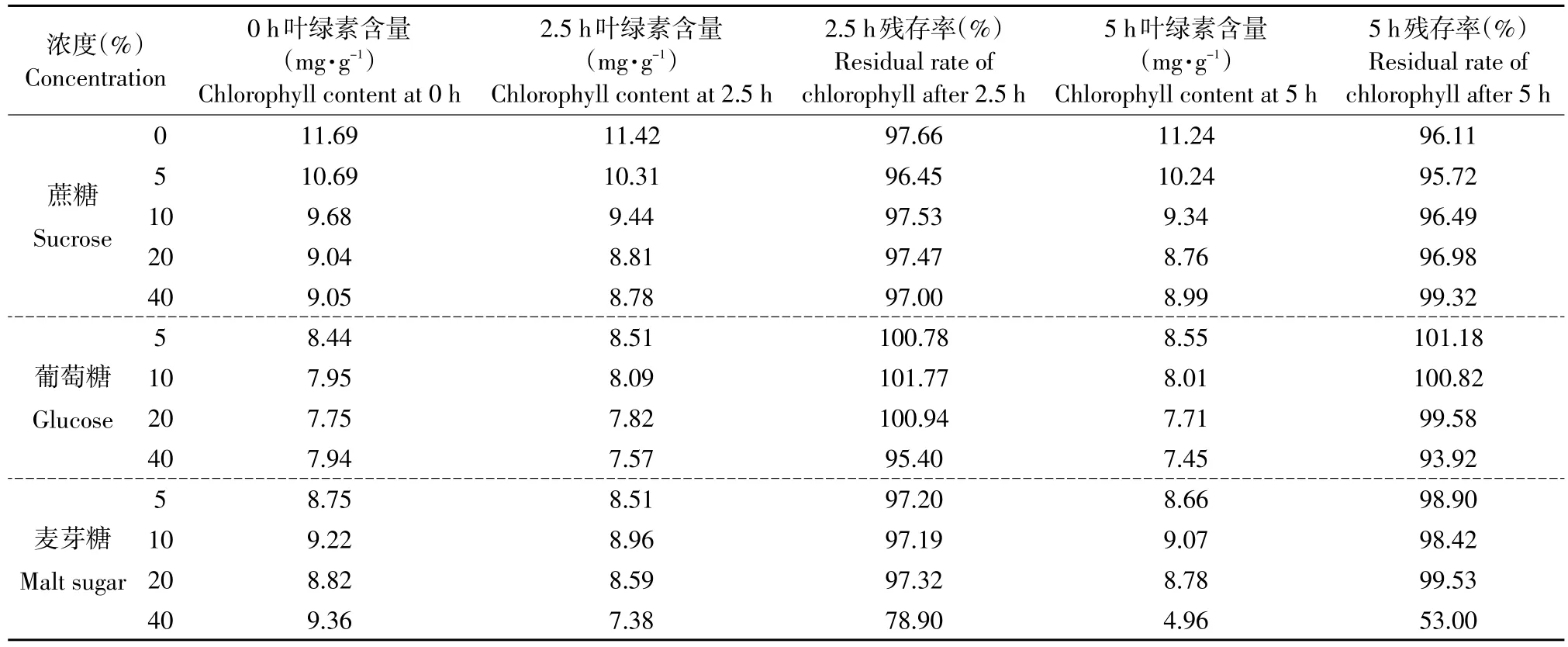
表6 不同糖类对小球藻叶绿素稳定性的影响Table 6Effects of different sugar concentrations on stability of chlorophyll from C.pyrenoidesa
3 讨论与结论
采用响应面法优化蛋白核小球藻叶绿素提取工艺,得到最优提取工艺条件为:固液比5 g·L-1,提取温度62℃,提取时间2 h。在此工艺条件下,小球藻叶绿素提取量为10.99 mg·g-1。影响小球藻叶绿素提取量的因素主次顺序为:固液比>超声温度>超声时间,且超声温度和超声时间交互作用显著。
本研究结果表明,自然光照、人工光照、UV辐射、高温、酸、碱、柠檬酸、高浓度麦芽糖、Al3+、Fe2+和Fe3+等对小球藻叶绿素稳定性均有影响;其中光照对叶绿素稳定性影响极显著,随着光照强度增加小球藻叶绿素降解加快;但叶绿素能耐受一定温度,当温度超过60℃后小球藻叶绿素才会降解;酸性条件下叶绿素溶液变为灰色;碱性条件下叶绿素降解溶液变为黄绿色,碱性越强叶绿素降解越快,颜色越浅;柠檬酸可使叶绿素降解,溶液变为灰绿色;小球藻叶绿素能耐受蔗糖、葡萄糖和低浓度麦芽糖,但麦芽糖浓度过高时小球藻叶绿素含量降低;金属离子Al3+、Fe3+和Fe2+与叶绿素接触产生沉淀且使叶绿素降解溶液分别变为黄绿色、灰绿色和黄绿色;此外,小球藻叶绿素具有较强的耐氧化还原性。因此,小球藻叶绿素及其产品在生产加工储存过程中应尽量采取避光处理,pH控制在微碱性或中性范围内,避免加入柠檬酸等酸性食品添加剂,避免接触含铁、铝制品。
[1]刘海琴,韩士群.小球藻提取物的生物活性研究[J].海洋科学, 2005,29(9):23-26.
[2]魏文志,夏文水,李湘鸣,等.小球藻糖蛋白的分离纯化与性质测定[J].食品科学,2006,27(11):101-104.
[3]陈晓清,苏育才.小球藻的应用研究进展[J].生物学教学, 2012,37(1):8-9.
[4]冯爱青,胡秋娈,王蕊蕊.大叶黄杨叶绿素的提取及其稳定性研究[J].洛阳师范学院学报,2009,28(2):75-77.
[5]黄寿吾.叶绿素的药理和临床应用[J].食品与药品,2006,8(4): 5-8.
[6]徐春生.天然松针提取物在牙膏中的应用[J].牙膏工业,2006 (2):23-25.
[7]黄之杰,费逸伟,黄之宁.叶绿素在绿色伪装涂料中的应用研究[J].现代涂料与涂装,2006,9(4):13-17.
[8]孟庆廷.叶绿素提取方法及稳定性研究进展[J].河北化工, 2009,32(3):2-3.
[9]陈绍瑗,吕贞儿,董峰丽,等.响应面分析法优化桑叶叶绿素提取工艺[J].浙江大学学报:农业与生命科学版,2012,38(6):725-731.
[10]邓祥元,沙鹏,高坤,等.应用响应面法优化蚕沙叶绿素超声波辅助提取工艺[J].蚕业科学,2012,38(2):329-333.
[11]关锦毅,郝再彬,张达,等.叶绿素提取与检测及生物学功效的研究进展[J].东北农业大学学报,2009,40(12):130-134.
[12]苏正淑,张宪政.几种测定植物叶绿素含量的方法比较[J].植物生理学通讯,1989(5):77-78.
[13]杨祖荣.超声技术在天然药物有效成分提取中的应用[J].云南中医学院学报,2003,26(3):29-31.
[14]Hromádková Z,Ebringerová A.Ultrasonic extraction of plant ma⁃terials-investigation of hemicellulose release from buckwheat hulls[J].Ultrasonics Sonochemistry,2003,10(3):127-133.
[15]Khuri A I,Mukhopadhyay S.Response surface methodology[J]. Wiley Interdisciplinary Reviews:Computational Statistics,2010,2 (2):128-149.
[16]李亚娜.响应面分析法优化羊栖菜多糖的提取工艺[J].华南理工大学学报,2004,32(11):29-31.
[17]乔孟,屈晓青,丁之恩,等.响应面法优化超声波辅助提取湖北海棠叶中总黄酮工艺[J].食品科学,2013,34(2):143-147.
[18]Arnon D I.Copper enzymes in isolated chloroplasts:Polypheno⁃loxidase in Beta vulgaris[J].Plant Physiology,1949,24(1):1-15.
[19]李得孝,员海燕,郭月霞,等.混合液浸提法测定玉米叶绿素含量的研究[J].玉米科学,2006,14(1):117-119.
[20]邓祥元,高坤,张丽娟.不同溶剂萃取桑叶叶绿素效率的初步研究[J].中国农学通报,2011,27(2):389-394.
[21]邓祥元,沙鹏,高坤.超声波辅助提取蚕沙叶绿素的工艺研究[J].中国农学通报,2011,27(33):248-253.
[22]潘柯伊,芮汉明,张立彦.复绿海带中叶绿素稳定性研究[J].食品工业科技,2012,33(1):141-143.
[23]Ren T T,Su Y C.Effects of electrolyzed oxidizing water treatment on reducing Vibrio parahaeamolyticus and Vibrio vulnificus in raw oyster[J].Journal of Food Protection,2006,69(8):1829-1834.
[24]Huang Y R,Hsien H S,Lin S Y,et al.Application of electrolyxed oxidizing water on the reduction of bacterial contamination for sea⁃food[J].Food Control,2006,17:987-993.
[25]王海英,蔡妙颜,郭祀远.微藻与环境监测[J].环境科学与技术,2004,27(3):98-102.
[26]蔡恒江,唐学玺,张培玉.UV-B辐射对青岛大扁藻生长及其某些生理特性影响[J].海洋科学进展,2005,23(4):460-465.
[27]曾家豫,杨国兵,张继,等.紫堇叶绿素稳定性的研究[J].食品工业科技,2008,29(1):241-244.
[28]吴荣金,林泽浩,陈键,等.凤眼莲叶叶绿素的提取及其性质的稳定性[J].仪器仪表及分析监测,2007(1):32-33.
[29]孙鹤,丛培军,王榕树,等.绿色蔬菜汁中叶绿素稳定性研究[J].食品科学,1997,18(2):9-13.
[30]张亮,曹从华,任荣珠,等.大叶黄杨叶绿素的提取及稳定性研究[J].安徽农业科学,2010,38(17):8923-8925,8943.
Study on optimization of chlorophyll extraction fromChlorella pyrenoi⁃desaand its stability evaluation by response surface methodology/
DENG Xiangyuan1,2,CHENG Jie1,LIU Mengjiao1,GAO Kun1,CUI Siyu1(1.School of Biotechnology, Jiangsu University of Science and Technology,Zhenjiang Jiangsu 212018,China;2.School of Resources and Environmental Sciences,NanjingAgricultural University,Nanjing 210095,China)
Response surface methodology(RSM)was employed to optimize the extraction conditions of chlorophyll fromChlorella pyrenoidesa.And effects of factors on stability of chlorophyll were also studied. Results showed that the optimum extraction conditions were solid-to-solvent ratio 5 g·L-1,ultrasonic temperature 62℃,and ultrasonic time 2 h.Under these conditions,the maximum predicted extraction amount of chlorophyll fromC.pyrenoidesawas 11.24 mg·g-1,which was close to the actual value of 10.99 mg·g-1.In addition,it was showed that these factors,including natural light in room(NL),artificial light(AL),ultraviolet radiation(UV),high temperature,strong acid/base,citric acid,high concentration of maltose,Al3+,Fe2+and Fe3+, had remarkable effects on the stability of chlorophyll.However,other factors,such as oxidant and reductant, glucose,sucrose and low concentration of maltose,vitamin C,salt,and Mg2+,Ca2+,K+,Zn2+and Na+had no effects on the stability of chlorophyll.Cu2+could enhance the stability of chlorophyll in solution.
Chlorella pyrenoidesa;chlorophyll;extraction process;response surface methodology; stability evaluation
TS202.3
A
1005-9369(2015)07-0040-10
时间2015-7-9 14:42:42[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150709.1442.009.html
邓祥元,成婕,刘孟姣,等.响应面法优化小球藻叶绿素提取工艺及其稳定性研究[J].东北农业大学学报,2015,46(7)∶40-49.
Deng Xiangyuan,Cheng Jie,Liu Mengjiao,et al.Study on optimization of chlorophyll extraction fromChlorella pyrenoidesa and its stability evaluation by response surface methodology[J].Journal of Northeast Agricultural University,2015,46(7)∶40-49.(in Chinese with English abstract)
2015-02-09
国家自然科学基金项目(31200381);中国博士后科学基金项目(2013M531370,2014T70532);国家海洋局近岸海域生态环境重点实验室资助项目(201209)
邓祥元(1982-),男,副教授,博士,硕士生导师,研究方向为微藻生物制品。E-mail:dengxy2009@126.com
