黑糯玉米基因组DNA的提取方法
2015-07-04周丽娟李桂萍蔡士兵巴青松
周丽娟,李桂萍,蔡士兵,巴青松
(1.淮北师范大学 生命科学学院,安徽 淮北 235000;2.安徽濉溪农业科研试验站,安徽 濉溪 235100 )
黑糯玉米含有丰富的天然黑色素,其黑色素具有很好的抗氧化、清除自由基、抗突变、抗肿瘤等生理功能,有很高的医疗保健价值.近年来,随着人们生活水平和对健康要求的不断提高,黑糯玉米备受消费者青睐[1-2].
随着分子生物学的发展,与其相关的实验技术在黑糯玉米优良种质筛选、遗传多样性的研究以及性状改良等方面发挥越来越重要的作用,尤其对于黑糯玉米基因资源的挖掘与利用提供新的方法与手段[3-5].在利用PCR方法对黑糯玉米资源遗传多样性进行分析和其他分子生物学研究时,黑糯玉米基因组DNA的提取方法是决定后续实验能否成功的关键.目前,从玉米植物组织材料中提取DNA的方法通常有SDS法、CTAB法、改良CTAB法等多种不同的方法[6-8].对于黑糯玉米不同部位的组织材料,由于其中所含的次生代谢产物不同,DNA的提取方法也不尽相同.本研究分别以黑糯玉米幼苗、种子和盾片为材料,采用CTAB法、SDS法和碱煮法分别对3种实验材料进行基因组DNA的提取及DNA质量的检测,以期通过比较分析获得黑糯玉米理想的DNA提取方案,为进一步开展黑糯玉米的分子生物学研究提供理论依据.
1 材料与方法
1.1 材料
黑糯玉米自交系种子由淮北市濉溪农科所提供.在光照培养箱发苗,取4叶期玉米幼苗的倒二叶用于叶片DNA提取;同时选取大小均匀的种子用于种子DNA提取;另外将种子的盾片用刀片分离下来用于DNA提取.
1.2 实验方法
本研究用于黑糯玉米不同组织材料基因组DNA提取的方法有CTAB法[9]、SDS法[10]和碱煮法[11],每种方法对每一种材料重复提取2次以上.
1.2.1 不同组织材料的处理
取黑糯玉米幼叶0.1 g放入用液氮预冷的研钵中,倒入足量的液氮迅速研磨至粉末状,转入预冷的离心管中,-20 ℃保存备用;取两粒用蒸馏水浸泡12 h左右的黑糯玉米种子,剥去种皮放入研钵中研磨至很细的粉末状,后转入离心管中保存备用[9];取干种子的盾片20粒放入研钵中研磨至粉末状后转入离心管中保存备用[12].叶片、种子和盾片分别研磨8管,每种实验方法所用组织材料的处理均相同.
1.2.2 DNA质量检测
(1)琼脂糖凝胶电泳检测
取5 μL DNA样品和3 μL 6×loading buffer 混匀,上样于0.8%琼脂糖凝胶,100 V电泳约40 min,在凝胶成像仪上观察和拍照.
(2)紫外分光光度计检测
取24 μL DNA 样品用TE 稀释至2.4 mL 用TE 做空白对照.在紫外分光光度计上测定OD260和OD280的值,重复4次.
1.3 数据处理
本研究所得数据均用spss20.0处理分析.
2 结果与分析
2.1 不同方法提取不同组织材料DNA形态比较
2.1.1 CTAB法
取4管装有磨碎叶片离心管加入与样品等体积65 ℃预热的CTAB 提取液充分混匀后,放入65 ℃恒温水浴锅水浴50 min;取出离心管冷却至室温后加入等体积的氯仿:异戊醇(24:1),混合摇匀放在摇床上振荡40 min;抽提完成后于高速冷冻离心机按照8 000 r/min,4 ℃离心15 min;转移上清液至新的离心管,加入约2倍体积-20 ℃预冷的无水乙醇,轻摇后即析出白色絮状DNA沉淀.
从样品种子和盾片的离心管取出的上清夜在加入二倍体积预冷的无水乙醇后析出的不是白色絮状沉淀,而是整管都呈浑浊状态,在-20 ℃沉淀30 min后全部沉到管底,但最终没有抱团现象.
2.1.2 SDS法
用SDS法对3种不同材料提取DNA过程中DNA析出现象与CTAB法比较相似.从叶片提取的DNA呈白色絮状沉淀,而从种子和盾片提取的DNA不容易抱团,呈松散状.
2.1.3 碱煮法
取装有种子和盾片的离心管,分别加入0.2 mol/L NaOH 后沸水浴15 min;待冷却至室温,加入0.5 mol/L Tris-HCL和TE8.0;后于高速冷冻离心机按照10 000 r/min,4 ℃离心15 min,转移上清液至新的离心管,4 ℃保存用以后续检测.
2.2 DNA样品凝胶电泳检测结果
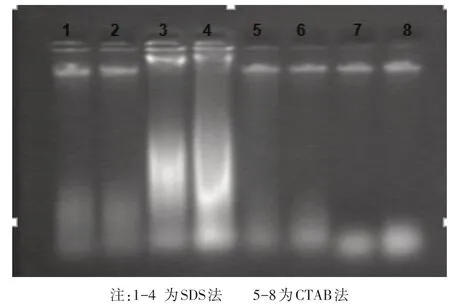
图1 不同方法提取的叶片基因组DNA电泳图
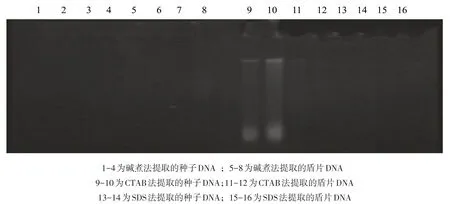
图2 不同方法提取的种子和盾片DNA电泳图
对于用黑糯玉米不同组织材料提取的DNA 进行琼脂糖凝胶电泳检测.结果表明,用种子和盾片提取的DNA质量都比较差,电泳后只有微弱的主带,有些甚至无主带产生.而用叶片提取的基因组DNA质量较好,带型清晰,亮度均一,DAN片段大小一致,无明显拖尾现象(见图1、2).
对于用不同方法提取的DNA进行琼脂糖凝胶电泳检测.结果表明,用种子和盾片提取基因组DNA的方法中,碱煮法的效果最差,几乎看不出条带,CTAB法和SDS法效果也很不好,电泳检测结果只有很微弱的主带(图2),说明要提取黑糯玉米基因组DNA,种子和盾片不是理想的提取材料.在用黑糯玉米苗期叶片提取基因组DNA 的两种方法中,CTAB 法明显好于SDS 法(图1).用CTAB 法提取的DNA 电泳检测结果无明显拖尾现象,亮度均一,DNA片段大小一致,RNA的污染低,且加样孔内的亮度很低,说明蛋白质和酚类的污染很低;而用SDS法提取的DNA电泳检测结果有个别主带有轻微的拖尾现象,且RNA的污染也比CTAB 法明显,且加样孔内有明显的亮度,说明DNA 样品中有明显的蛋白质和酚类物质的污染.
2.3 DNA样品分光光度检测结果
分别用CTAB 法、SDS 法和碱煮法提取的黑糯玉米种子和盾片的DNA 样品经琼脂糖凝胶电泳检测后,没有提到或者仅仅提到微量的DNA,故不对以上两种组织材料提取的DNA样品进行紫外分光光度法检测.只对用黑糯玉米幼嫩叶片提取的DNA进行紫外分光光度法检测,结果见表1,将表1结果进一步处理得表2.
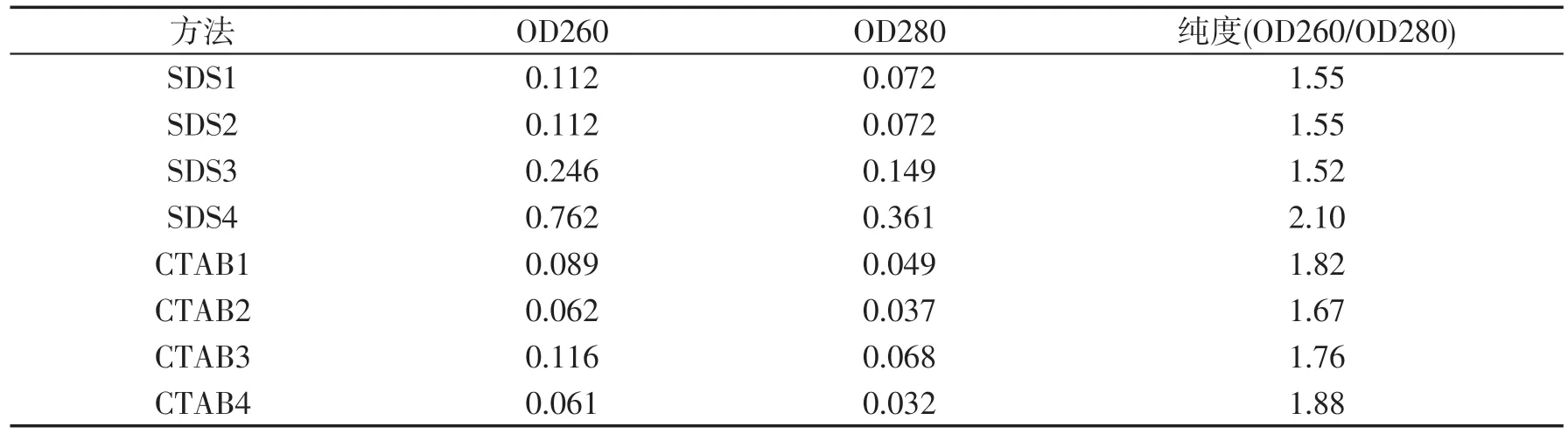
表1 CTAB法和SDS法提取黑糯玉米叶片基因组DNA的纯度

表2 CTAB法和SDS法提取黑糯玉米基因组DNA的纯度比较
从表1、表2可以看出,CTAB法提取的叶片DNA样品的纯度OD260/OD280在1.61~1.88之间,DNA样品纯度都较高,其均值为1.782 5,大于SDS法提取DNA的纯度均值,且标准误明显比SDS的均值标准误小,稳定性较高.而 SDS 法提取的 DNA 样品的纯度 OD260/OD280 在 1.52~1.55 之间,有一管为 2.10,DNA样品纯度都较低,说明可能含有较多的酚类物质或者蛋白质,有一管含有较多的RNA.由此可以看出CTAB法提取的黑糯玉米叶片基因组DNA样品纯度较高、稳定性好,此方法优于SDS法.
3 讨论
从本研究结果可以看到分别用3种不同方法进行黑糯玉米基因组DNA提取时,CTAB法提取的DNA质量最好.曾桂萍[13]等对快速提取普通玉米DNA方法的研究中发现采用普通玉米的盾片提取的DNA的浓度和质量明显高于叶片DNA,本研究分别用黑糯玉米幼苗、种子和盾片3种不同材料提取黑糯玉米基因组DNA时,种子和盾片的提取效果均不如幼苗.推测原因是:与普通玉米相比,黑糯玉米种子(尤其是果种皮)中含有较多的花青素和多酚类物质,这些组分可能会影响DNA的提取效果;另外种子和盾片是成熟的组织材料,研磨不够彻底导致后续提取过程中提取液较难溶解细胞膜,而健康的幼苗代谢产物少,细胞数量多,是比较理想的提取基因组DNA的组织材料.
[1]马越,赵晓燕,徐亚民.黑玉米的营养价值与保健作用[J].营养健康,2006,27(9):115-117.
[2]王金亭.天然黑玉米色素研究与应用进展[J].粮食与油脂,2013,26(2):44-49.
[3]陈婧,杨引福,郭强.利用SSR标记分析40个糯玉米自交系遗传多样性[J].玉米科学,2009,17(4):32-35.
[4]高文伟,李晓辉,李新海.玉米单粒和单叶片DNA快速提取及SSR标记分析[J].玉米科学,2004,12(2):111-113.
[5]王芳,王化俊,王汉宁.玉米基因组DNA的提取及SSR分析[J].玉米科学,2006,14(2):30-32.
[6]易红梅,张芳,王凤格,等.不同取样方式对DNA快速提取效果的影响[J].华北农学报,2007,22(5):114-116.
[7]雷开容,石春焱,李明顺,等.一种玉米叶片基因组DNA快速提取新方法的初步研究[J].华北农学报,2006,21(2):10-12.
[8]穆春华,张发军,李文才,等.玉米叶片基因组快速提取方法研究[J].玉米科学,2010,18(3):170-172.
[9]李艺,铁双贵,朱卫红.快速CTAB法提取玉米种子胚基因组DNA[J].河南农业科学,2008,2:17-20.
[10]李葱葱,刘 娜,李飞武.一种快速提取玉米基因组 DNA 的方法[J].玉米科学,2011,19(1):52-55.
[11]王伟威,孟庆虹,张瑞英,等.5种主要农作物DNA快速提取方法研究[J].黑龙江农业科学,2008,5:1-2.
[12]魏琦超,畅丽萍,周岩,等.一种简便实用的玉米干种子基因组DNA提取方法[J].广东农业科学,2009,6:165-167.
[13]曾桂萍,戴保威,余显权.快速提取玉米DNA方法的研究[J].安徽农业科学,2007,35(23):7110-7111.
