樟子松幼苗生长及光合特性对强风沙流吹袭的响应
2015-07-04赵哈林周瑞莲云建英潘成臣
赵哈林,李 瑾,周瑞莲,云建英,曲 浩,潘成臣
(1 中国科学院寒区旱区环境与工程研究所,兰州730000;2 鲁东大学 生命科学学院,山东烟台264025)
风沙流是指含有沙粒的运动气流,当起沙风经过干燥疏松裸露沙质地表时,就会形成风沙流[1]。在中国北方沙漠地区,由于气候干旱、风大沙多,风沙流频繁发生[2]。由于风沙流所携带沙粒能够对植物造成磨蚀作用,导致其幼嫩表皮组织受损和细胞液外流而致植株死亡,因而在风沙流活动强烈地区除沙生植物以外大多数植物不能生存和繁衍,使植物分布范围及其物种多样性受到严重抑制[3]。近年来,随着国际社会对沙区生态保护和植被恢复重建日益重视,有关风沙流对植物影响及其响应研究开始受到关注。
有关风和风沙流对植物影响及其响应研究已有一些报道。如沙漠环境中的植物群落结构和功能[4]、物种多样性[5]、种群适应性等[6]。通过这些研究,初步阐述了风沙环境对植物种群和群落结构、功能的影响及其机制[4-6]。但这些研究主要是从群落和种群层面分析植物与风沙环境的关系,没有把风和风沙流作为单一因子分离出来,因而无法确定风和风沙流对植物的具体作用。迄今虽也有一些风吹对植物影响的研究报道,如风吹对植物生长节律[7]、光合蒸腾特性[8]影响及其逆境生理响应[9]等研究,初步阐述了风对沙漠植物生长、繁衍、形态、生物量分配、表性可塑性等方面的影响[7-9]。但由于受到仪器设备的限制,过去大多数风吹试验都是采用人工晃动的模拟方法,每次模拟时间多在30s 至20 min,而且只能模拟净风吹袭[10]。近年来,随着野外便携式风洞的应用,真正的风吹试验才得以开展,但绝大多数风吹试验仍然只局限于净风试验[9]。有关风沙流对植物生长影响及其光合影响的研究,迄今还鲜有报道[3],有关不同时间强风沙流吹袭对乔木生长影响及其光合响应机制还知之甚少。
樟子松(Pinussylvestrisvar.mongolica)又名海拉尔松、蒙古赤松,天然分布于呼伦贝尔沙地及大兴安岭山地西侧。由于具有较强的耐寒、耐旱和耐瘠薄能力,又是常绿树种,自20世纪50年代以来已在中国北方沙区广泛推广种植[11]。但樟子松也有一个弱点,即其苗期不耐沙打沙埋,在裸露沙地直接造林存活率只有10%左右[12]。关于樟子松生物学特性及其对干旱、盐碱等环境胁迫响应或适应的研究已有一些报道[11-12],但有关风沙流胁迫对其幼苗生长及其生理响应的研究还很少见。因此,本试验开展不同时间强风沙流吹袭对樟子松幼苗生长及其光合蒸腾特性影响研究,探讨其光合蒸腾特性对风沙环境的适应机制,可为提高其大范围推广成效提供理论支撑。
1 研究方法
1.1 研究区自然概况
研究区位于内蒙古通辽市奈曼旗境内,地处科尔沁沙地腹地(42°55′~42°57′N,120°41′~120°45′E,海拔340~370m)。该区属温带半干旱大陆性气候,年均降水量356.9mm,年均蒸发量1 900mm,年均气温6.5℃,≥10℃年积温3 190℃,无霜期151d;年平均风速3.4m·s-1,年平均扬沙天气20~30d。地貌以高低起伏的沙丘地和平缓草甸或农田交错分布为特征,土壤多为风沙土或沙质草甸土。研究区天然植物群落以中旱生植物为主,主要植物种有沙米(Agriophyllumsquarrosum)、大果虫实(Corispermummarocarpum)、猪毛菜(Salsolacollina)、差巴嘎蒿(Artemisiahalodendron)、小叶锦鸡儿(Caraganamicrophylla)等,樟子松作为人工林常绿树种已在当地广泛种植。
1.2 试验设计
试验地设置于地处科尔沁沙地腹地的中国科学院奈曼沙漠化研究站野外风洞试验场内。试验材料选用长势良好,高矮基本一致的3 龄樟子松幼苗。在试验前一年(2012年)将其移栽至花盆中,通过适时适量浇水和冬季防冻等措施保证其安全越冬。风吹试验前测定其株高、基干直径等生物学特征,然后选择株高无显著差异植株作为试验材料。试验选择风级为8 级大风,风速为18 m·s-1,风沙流强度172.93g·cm-1·min-1。考虑到强风沙流具有短促脉冲性特点,并参考以往风吹研究报道[2-3,7-8],风吹时间设计10、20和30min等3个处理,并以非风吹处理为对照(CK),每个处理6个重复,每个重复为1株樟子松幼苗。
试验于2013年5月进行,测定日天气晴朗无风。为了保证土壤水分一致,风吹前夜等量浇水1次。风吹时间设定在清晨进行,光合测定前1h结束。风吹设备为自制野外便携式沙风洞(专利号:ZL 2008 10182207X)。风吹后即时取样测定叶片相对含水量,并于当日清晨6:00 开始利用Li-6400(Li-COR Inc.,Lincoln,NE,USA)在自然光下测定其光合蒸腾等特征,测定内容包括:净光合速率、蒸腾速率、气孔导度、胞间CO2浓度、叶温等。每2h测定1次,至18:00结束。测定时,每棵植株选测上部相邻2簇4个针叶,每次测定读取5个数据,取其平均值。由于所测针叶呈半椭圆形,且长度大于Li-6400叶室长度,因而采用直接测定叶室内叶片两端直径后,计算其叶面积。风吹后,将花盆去底后放回试验场地,各试验处理田间管理方法相同。生长特性测定于风吹后1个月后进行,主要测定指标为株高、基径和叶子脱落情况。为了定量评价叶子枯黄脱落情况,利用落叶指数进行评价,即按枯黄落叶量占植株总叶量的多少划分为枯黄落叶量<5%、枯黄落叶量占5%~10%、枯黄落叶量占10%~20%,枯黄落叶量大于20%等4个等级,并采取直接赋值法分别赋予其权值为0、1、2和3,通过目测确定各处理落叶指数变化。
1.3 数据分析
应用SPSS 13软件进行数据的统计分析。采用单因素方差分析(One-Way ANOVA)和最小显著差异法(LSD)比较不同数据组间的差异。
2 结果和分析
2.1 强风沙流吹袭对樟子松幼苗生长特性的影响
图1显示,随着风吹时间的增加,樟子松幼苗株高生长量趋于下降,基径生长量增加,落叶指数也随着增大。其中,与非风吹CK 相比,30min处理的株高生长量下降52.63%,基径生长量增加233.30%,落叶指数增加466.70%。但是,各风吹处理的株高生长量与CK 的差异未达到显著水平(P>0.05);30min处理的基径生长量,以及20和30min处理的落叶指数与CK 的差别均达到了显著水平(P<0.05)。说明强风沙流吹袭20min时造成樟子松幼苗部分落叶,已对其生长产生明显不利影响。
2.2 强风沙流吹袭对樟子松幼苗光合特征的影响
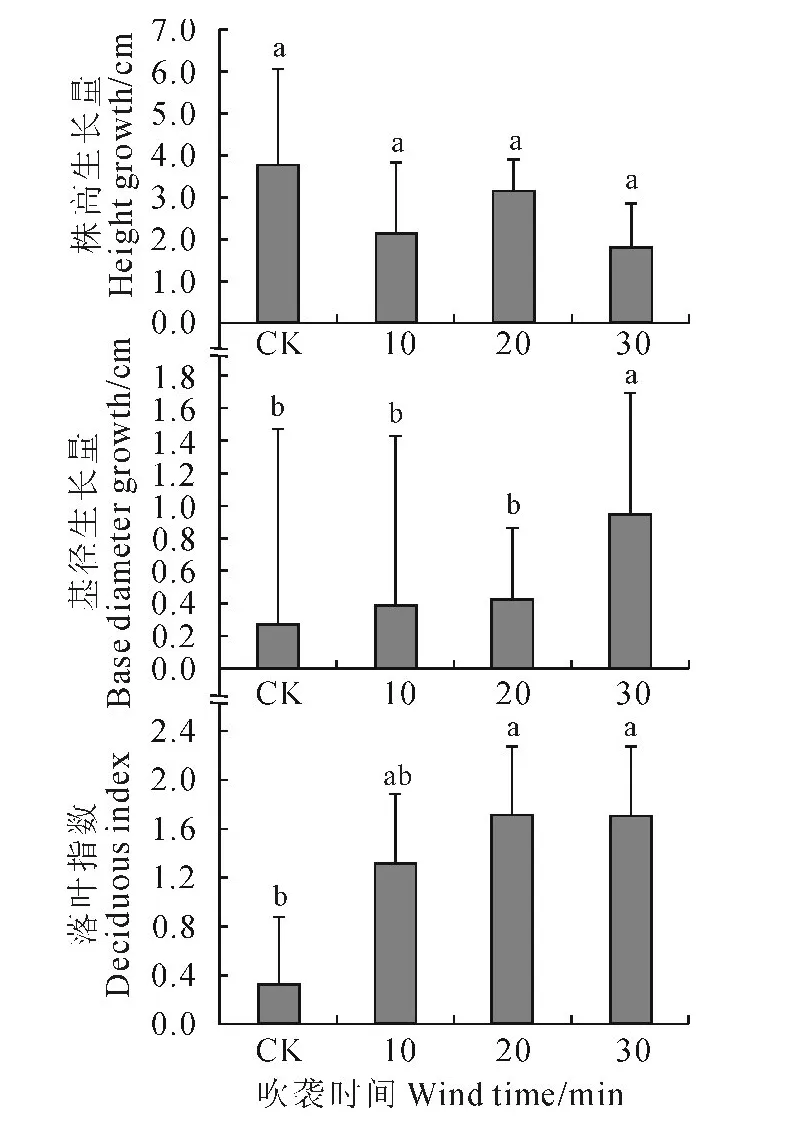
图1 强风沙流吹袭下樟子松幼苗株高、基径的增长量和落叶指数变化Fig.1 Changes of plant height,basal diameter and deciduous index of P.sylvestris var.mongolica
2.2.1 净光合速率 与非风吹CK 一样,各风吹处理的樟子松幼苗净光合速率日变化曲线均为双峰曲线(图2,A)。其中,各处理的第一峰值出现的时间均为8:00,但其第一峰值高低呈现随风吹时间增加而下降的趋势,如30 min处理的第一峰值(19.35 μmol·m-2·s-1)较CK(25.03μmol·m-2·s-1)下降了22.69%;随着风吹时间增加,幼苗光合“午休”时间有拉长趋势,而且30min处理的午后净光合速率回升幅度很小。同时,随着风吹时间增加,各处理幼苗的日均净光合速率趋于下降(图2,B),如30min处理较CK 下降了28.57%,但各处理与CK的差别均未达到显著水平(P>0.05)。
2.2.2 蒸腾速率 与CK 一样,各风吹时间处理樟子松幼苗的蒸腾速率日变化曲线均为双峰曲线(图3,A)。但CK的2个峰值分别出现在6:00和16:00,而3个风吹处理的2个峰值均分别出现在8:00和14:00;就最大峰值而言,CK 为9.69μmol·m-2·s-1,10、20和30min吹风处理分别为9.48、10.73和9.78μmol·m-2·s-1,其间差别很小。同时,从各处理幼苗的日均蒸腾速率来看(图3,B),3 个风吹时间处理均高于CK,但均与CK 的差异未达到显著水平(P>0.05)。
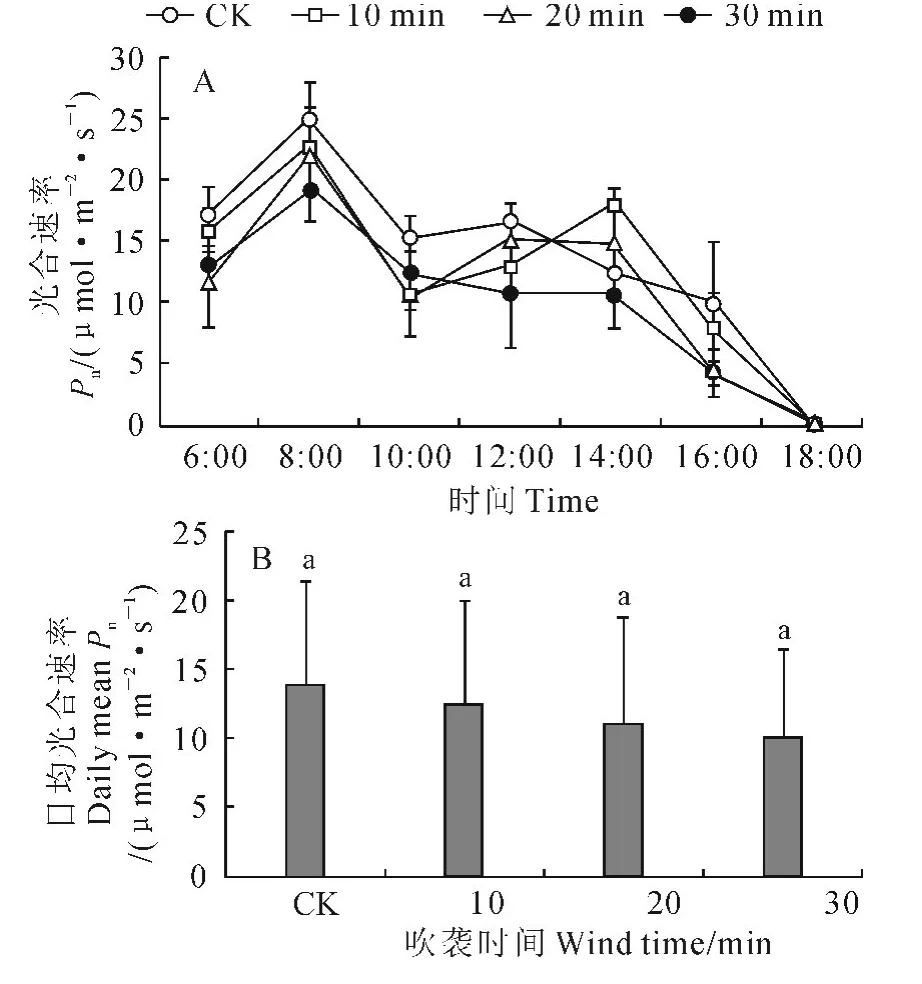
图2 强风沙流吹袭下樟子松幼苗光合速率日变化曲线(A)和日均值(B)变化Fig.2 Diurnal variation curves(A)and daily means(B)of net photosynthetic rate of P.sylvestris var.mongolica seedling with strong wind-sand flow blowing
2.2.3 气孔导度 图4是不同处理间气孔导度的日变化曲线和日均值比较。从图4,A 中可以看出,非风吹CK 的幼苗气孔导度日变化曲线属于不明显的双峰曲线,其先于6:00达到第一峰值,之后趋于下降,在16:00出现一个小的回升后再度下降;3个风吹处理的气孔导度日变化曲线和CK 一样也为双峰曲线,也呈先下降再回升再下降的变化趋势,不同的是其第一峰值均高于CK,而且回升峰值出现的时间逐步由16:00转变为12:00(图4,A)。同时,就气孔导度日均值而言(图4,B),仍是3个风吹处理不同程度地高于CK,但与CK 的差异并未达到显著水平(P>0.05)。
2.2.4 胞间CO2浓度 各风吹处理和CK 幼苗的胞间CO2浓度日变化曲线均为V 字形曲线,而且其最低值均出现在中午12:00,最大值均在18:00(图5,A)。不同的是,3个风吹处理的胞间CO2浓度日最小值均大于CK,而日最大值均低于CK。其中,30min处理的胞间CO2浓度日最小值较CK 提高248.89%,日最大值较CK 降低7.34%。同时,与日均气孔导度一样,3个风吹处理的日均胞间CO2浓度均高于CK,但与CK 的差异未达到显著水平(P>0.05)。
以上结果说明,虽然风沙流吹袭没有改变樟子松幼苗光合速率、蒸腾速率、气孔导度和胞间CO2浓度的日变化规律,但却导致了樟子松幼苗日最大光合速率和日均光合速率下降,日最大蒸腾速率和日均蒸腾速率、气孔导度和胞间CO2浓度的最大峰值及其日均值增加,而且还使光合“午休”时间加长,蒸腾“午休”时间缩短。
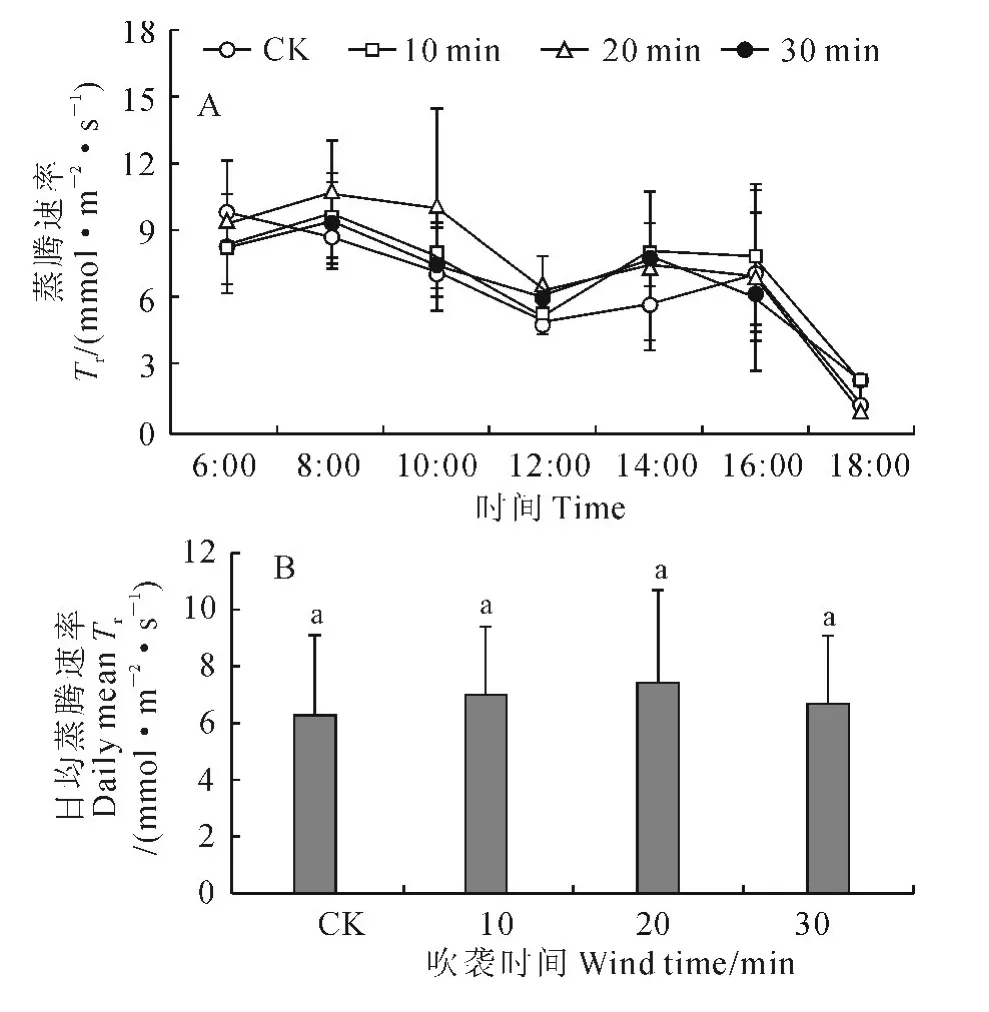
图3 强风沙流吹袭下樟子松幼苗蒸腾速率日变化(A)和日均值(B)变化Fig.3 Diurnal variation curves(A)and daily means(B)of transpiration rate of P.sylvestris var.mongolica seedling with strong wind-sand flow blowing
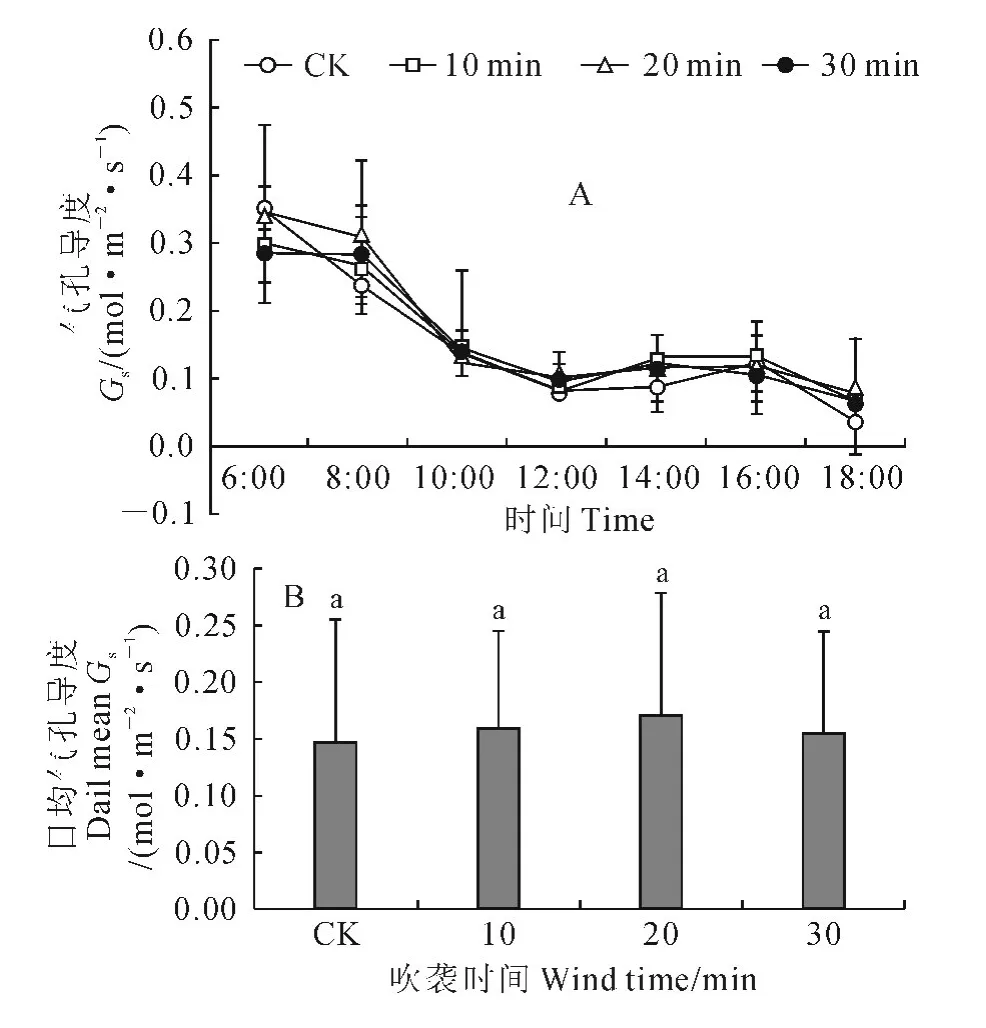
图4 强风沙流吹袭下樟子松幼苗气孔导度日变化曲线(A)和日均值(B)变化Fig.4 Diurnal variation curves(A)and daily means(B)of stomatal conductance of P.sylvestris var.mongolica seedling with strong wind-sand flow blowing
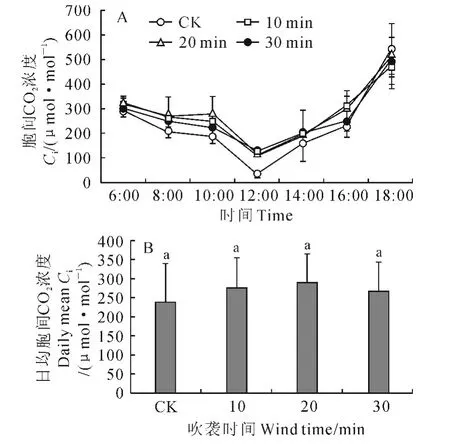
图5 强风沙流吹袭下樟子松幼苗胞间CO2浓度日变化(A)和日均值(B)变化Fig.5 Diurnal variation curves(A)and daily means(B)of intercellular CO2concentration of P.sylvestris var.mongolica seedling with strong wind-sand flow blowing
2.3 强风沙流吹袭对樟子松幼苗叶片含水量、水分利用效率和叶温的影响
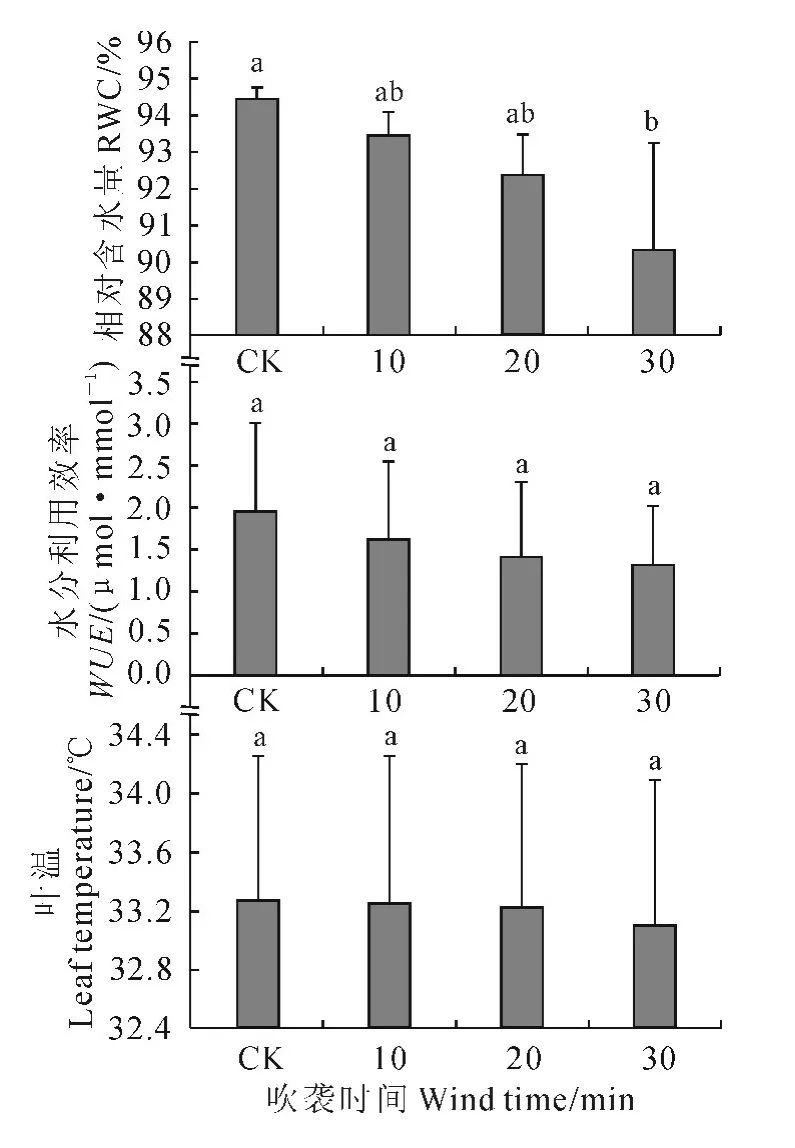
图6 强风沙流吹袭下樟子松幼苗叶片含水量、水分利用效率和叶温变化Fig.6 Changes of RWC,WUE and leaf temperature of P.sylvestris var.mongolica seedling with strong wind-sand flow blowing
随着强风沙流吹袭时间的增加,樟子松幼苗叶片含水量(RWC)、水分利用效率(WUE)和叶片温度均呈逐渐下降趋势(图6)。与CK 相比,30min处理的RWC和WUE分别下降了4.37%和31.58%,叶片温度下降了0.3℃。其中,除了30 min 处理的RWC与CK 的差异达到显著水平外(P<0.05),其他处理的RWC、WUE和叶温与CK 的差异均未达到显著水平(P>0.05)。这说明持续风沙流吹袭可以对樟子松幼苗叶片造成一定的水分胁迫和低温胁迫,降低其水分利用效率。
3 讨 论
本研究表明,随着强风沙流吹袭时间的增加,樟子松幼苗株高生长量趋于下降,基径生长速度加快,叶片脱落量增加;与CK 相比,吹风处理后1个月30 min处理的幼苗株高增长量减少52.63%,基径增长量增加233.30%,而落叶指数提高466.70%。这说明强风沙流吹袭对樟子松幼苗的生长有较大影响,而且这种影响随着吹袭时间的增加而增强。其中,强风沙流吹袭能够抑制樟子松幼苗的株高生长,造成其叶片发黄和脱落,这可能也是风沙活动强烈地区栽植樟子松幼苗叶片死亡脱落,成活率低的主要原因之一[12-13]。但是,在强风沙流作用下,樟子松幼苗基径生长速度明显加快,这应该属于对风沙流吹袭的一种适应,因为茎粗的快速增长有利于植物抵抗强风的吹袭,不易发生折断[11-12]。已有研究表明,风沙流吹袭对植物的影响主要来源于3个方面,一是风所携带的能量传递给植物,造成植株摇弋,叶片脱落或枝茎折断;二是流经植物枝叶表面气流速度加快,导致植物叶温下降,蒸腾加速;三是所携带沙粒对植株体表产生磨蚀危害,造成植物表皮细胞破损,导致植物生长受抑或死亡[3-4]。本研究结果一方面说明,强风沙流的持续吹袭使大量风能在植物体上转化为机械能,使植物发生强烈晃动,对其株高生长造成危害,但这种机械刺激也改变了植物的物质分配策略,使其将相对较多的物质和能量分配给了茎粗生长[3,10];另一方面说明,风沙流吹袭导致樟子松幼苗叶表面受到沙粒击打、沙割等磨蚀作用而损伤,使其枯黄脱落[11-12]。
本研究同时表明,非风吹处理的樟子松幼苗净光合速率、蒸腾速率和WUE日变化曲线均为双峰曲线,这和丁晓纲等[13]对樟子松幼苗光合速率日变化规律研究结果一致;在不同时间风沙流吹袭下,其净光合速率、蒸腾速率和WUE的日变化曲线形态未发生明显改变,仍然为双峰曲线,这和朱教君等[14]有关不同水分胁迫方式对樟子松幼苗光合影响的研究结果一致。但是,随着风吹时间的延长,其光合速率两个峰值出现的间隔时间延长,蒸腾速率2个峰值出现的间隔时间缩短,而且其净光合速率、WUE的日变化曲线的峰值及其日均值都趋于下降,蒸腾速率日变化峰值及其日均值略有增加。这一方面说明,30min以内的强风沙流吹袭对樟子松幼苗光合、蒸腾及WUE的日进程影响较小,没有改变其日变化规律,但其光合“午休”时间延长、蒸腾“午休”时间缩短;另一方面说明,30 min以内的强风沙流吹袭对樟子松幼苗的光合作用产生了一定的抑制作用,使其日最大光合能力和日均光合能力下降,同时也使其日最大蒸腾速率和日均蒸腾速率增加。植物净光合速率的高低反映着植物将CO2和H2O 转化为有机物并储存能量的能力[15],在风沙流作用下其日最大净光合速率和日均净光合速率的降低,光合“午休”时间延长,特别是落叶增加造成光合总面积的下降,意味着其物质生产和能量转化能力的降低,这可能也是风沙流吹袭下樟子松幼苗株高生长受到抑制的主要原因之一[4,16]。而蒸腾速率的增加,蒸腾“午休”时间的缩短,意味着植物耗水量的增加。沙漠地区气候干旱,水资源缺乏,植物耗水量的增加将不利于植物的生存和繁衍[3]。特别是日均WUE的降低,意味着单位耗水量生产的生物量下降,植物对于水资源的利用效率降低,这对于缺水的干旱半干旱地区来说,显然也是一种水资源的浪费[15-16]。植物光合、蒸腾速率的变化与环境变化有关,随着风速增加,导致蒸腾速率增加和叶片含水量降低,而叶片温度下降和含水量降低显然也会抑制光合速率[3,15]。但研究也发现,虽然随着风吹时间的增加,日均净光合速率和日均蒸腾速率与CK 的差异并未达到显著水平,这可能是由于吹袭时间较短,对其光合水分代谢影响较轻所致[9-10,17]。至于多长时间风沙流吹袭能够造成其光合、蒸腾速率的显著变化,还有待于进一步研究。
大量研究表明,植物的光合、蒸腾作用与气孔导度和胞间CO2浓度密切相关。气孔通过气孔运动(关闭、开张、收缩)和气孔阻力的变化来影响植物的蒸腾作用,同时也通过影响胞间CO2浓度影响着植物的光合作用[3,17]。本研究还表明,与光合、蒸腾作用表现一样,CK 及各风吹处理樟子松幼苗的气孔导度的日变化曲线也都呈双峰曲线,而胞间CO2浓度的日变化曲线则与之完全不同,呈V 字形;随风吹时间延长,其日均气孔导度和胞间CO2浓度均是20min处理>10min处理>30min处理>CK,这与日均蒸腾速率表现相似,而与日均净光合速率变化趋势明显不同。这一方面说明,30min以内的风沙流吹袭对于樟子松幼苗气孔导度和胞间CO2浓度的影响较小,没有改变其日变化规律,但风吹时间的增加却导致其日均气孔导度和日均胞间CO2浓度增加[15,18];另一方面说明,在风沙流吹袭下,各处理樟子松幼苗蒸腾速率的日变化规律和日均蒸腾速率的变化趋势均受控于气孔导度的变化,而其净光合速率日变化规律和日均变化趋势并不受控于胞间CO2浓度的变化,风沙流吹袭下胞间CO2浓度的增加并不意味着净光合速率下降,而是净光合速率的增加或下降导致了胞间CO2浓度的下降或增加[19-20]。
综上所述,在强风沙流吹袭下,随着风吹时间的增加,樟子松幼苗株高生长减缓,茎粗生长加快,叶片脱落数量增加,生长受到一定抑制;30 min以内的强风沙流吹袭对樟子松幼苗的光合速率、蒸腾速率、气孔导度、胞间CO2浓度和水分利用效率的日变化规律影响较小,对其日最大净光合速率、最大水分利用效率和最大蒸腾速率影响较大;随吹袭时间的增加,樟子松幼苗叶片含水量、叶片温度和日光合能力下降,日蒸腾速率加快,水分利用效率降低;在风沙流吹袭下,樟子松幼苗的蒸腾速率变化主要受制于气孔导度变化,而光合速率的降低导致胞间CO2浓度增加。
[1]吴正.风沙地貌学[M].北京:科学出版社,1987.
[2]WHITEHEAD F H.Experimental studies on the effect of wind on plant growth and development:Helianthusannuus[J].NewPhytologist,1962,61(1):59-62.
[3]GRACE J.Plant response to wind[M].London:Academic Press,1977.
[4]赵哈林.沙漠生态学[M].北京:科学出版社,2012.
[5]PAUL P H,REBECCA L.Simpson variable vegetation cover and episodic sand movement on longitudinal desert sand dunes[J].Geomorphology,2006,81(3-4):276-291.
[6]MONIER M,ABD E G,WAFAA M A.Soil-vegetation relationships in a coastal desert plain of southern Sinai,Egypt[J].JournalofArid Environments,2003,55(4):607-628.
[7]ZHAO H L(赵哈林),HE Y H(何玉慧),YUE G Y(岳广阳),etal.Effects of wind blow and sand burial on the seedling growth and photosynthetic and transpiration rates of desert plants[J].ChineseJournalofEcology(生态学杂志),2010,29(3):413-419(in Chinese).
[8]QU H(曲 浩),ZHAO X Y(赵学勇),YUE G Y(岳广阳),etal.Physiological response to wind of some common plants in Horqin Sand Land[J].JournalofDesertResearch(中国沙漠),2009,29(4):668-673(in Chinese).
[9]WANG Y H(王艳红),HE W M(何维明),YU F H(于飞海),etal.Advances in the responses of plants to wind-induced mechan ical stimulation[J].ActaEcologicaSinica(生态学报),2010,30(3):794-800(in Chinese).
[10]YU Y J(于云江).SHI P J(史培军),LU CH X(鲁春霞).Response of the eco-physiological characteristics of some plants under blown sand[J].ActaPhytoecologicaSinica(植物生态学报),2003,27(1):53-58(in Chinese).
[11]LI H Y(李宏印),LIU M G(刘明国).The development status ofPinussylvestrisvar.mongolicasand-fixation plantations[J].Journalof LiaoningForestryScience&Technology(辽宁林业科技),2003,(5):35-39(in Chinese).
[12]JIAO SH R(焦树仁).Review of afforestation technology ofPinussylvestrisvar.mongolica[J].ProtectionForestScienceandTechnology(防护林科技),2010,(6):52-54(in Chinese).
[13]DING X G(丁晓纲),HE X(何 茜),LI J Y(李吉跃),etal.The photosynthetic characteristics ofPinussylvestrisvar.mongolicaandPinustabulaeformisin Mu Us Sand Land[J].ResearchofSoilandWaterConservation(水土保持研究),2001,18(1):215-219(in Chinese).
[14]ZHU J J(朱教君),KANG H ZH(康宏樟),LI ZH(李 智).Comparison of different types of drought stresses affecting photosynthesis of Mongolian pine seedlings on sandy soils[J].JournalofBeijingForestryUniversity(北京林业大学学报),2006,28(2):57-62(in Chinese).
[15]FARQUHAR G D,SHARKEY T D.Stomatal conductance and photosynthesis[J].Annu.Rev.PlantPhysiol.,1982,33:317-345.
[16]RUSSELL G,GRACE J.The effect of wind on grassⅤ:Leaf extension,diffusive conductance,and photosynthesis in the wind tunnel[J].JournalofExperimentalBotany,1978,29(5):1 249-1 258.
[17]TELEWSKI F W,JAFFE M J.Thigmom ophogenesis:Field and laboratory studies ofAbiesfraseriinresponse to wind or mechanical perturbation[J].PhysiologiaPlantarum,1986,66(2):211-218.
[18]MITCHELL C A.Recent advances in plant response to mechanical stress:Theory and Application[J].HortScience,1996,31(1):31-35.
[19]ENNOS A R.Wind as an ecological factor[J].TrendsinEcology&Evolution,1997,12(3):108-111.
[20]GRACE J,MALCOLM D C,BRADBURY I K.The effect of wind and humidity on leaf diffusive resistance inSitkaspruceseedlings[J].JournalofAppliedEcology,1975,12(3):931-940.
