拟南芥AtCDPK1基因克隆与转化马铃薯的研究
2015-07-04聂利珍于肖夏李国婧鞠天华孙瑞芬崔阔澍
聂利珍,于肖夏,李国婧,鞠天华,孙瑞芬,崔阔澍,于 卓*
(1 内蒙古农业大学,呼和浩特010019;2 赤峰天泽生物科技有限公司,内蒙古赤峰025457;3 内蒙古农牧业科学院 生物技术研究中心,呼和浩特010031)
马铃薯(Solanumtuberosum)是一种粮、菜及工业原料等多种用途的经济作物,是世界上仅次于小麦、水稻、玉米的四大粮食作物之一。内蒙古是中国马铃薯的种薯和商品薯重要产地之一[1],但干旱缺水一直是马铃薯生产的主要限制因子,特别是内蒙古中西部地区几乎连年干旱,使得马铃薯产量低下,严重影响着当地农民的经济收入。因此培育抗旱、高产、优质的马铃薯新品种实属必要。利用转基因技术开展农作物育种是农业科技的发展方向和必然趋势[2]。国外Yeo等[3]从酵母中克隆出海藻糖-6-磷酸合成酶基因(TPSI),通过农杆菌介导转入马铃薯中,获得的转基因马铃薯抗旱能力明显提高。国内姜丽丽等[4]将来自耐旱物种厚叶旋蒴苣苔(Boeacrassifolfia)的蓝铜蛋白类似基因BcBCPI导入马铃薯,经干旱处理后发现转基因马铃薯植株的抗旱能力显著提高;张宁[5]从菠菜中克隆甜菜碱醛脱氢酶(BADH)基因,转化马铃薯获得了转基因植株,对其进行干旱和NaCl胁迫处理研究显示,转基因马铃薯的抗旱耐盐能力均显著提高。
CDPKs(calcium-dependent protein kinases,也称CPKs)是一类依赖钙离子而不依赖钙调素的蛋白激酶,其广泛存在于植物、藻类和部分原生生物中[6-8]。在植物体内CDPKs是主要的初级钙离子感受器之一,并受生物和非生物胁迫诱导激活,在植物参与非生物胁迫反应、光周期调节和激素信号转导中具有非常重要的作用[9]。CDPKs首先在豌豆中发现[10],它与细胞Ca2+信号传递有密切关系,是植物中研究较多、了解较清楚的一类蛋白激酶。Sheen等[11]利用效应基因和报告基因共表达的方法,研究发现在玉米原生质体中转化AtCDPK1和AtCDPK1a能激活受干旱和高盐胁迫诱导的启动子,去除AtCDPK1激酶区的突变体对干旱和盐胁迫以及ABA 刺激没有反应;过表达AtCDPK1 的拟南芥在低温、高盐和ABA 胁迫下,其耐受能力明显比野生型强[12];拟南芥T-DNA 插入突变体cdpk1对干旱胁迫比野生型拟南芥敏感,过表达AtCDPK1拟南芥可提高其对干旱胁迫的耐受能力[13]。从冰叶日中(Mesembryanrhemumcrystallinum)花中分离得到的McCPK1能响应盐害和脱水的胁迫作用[14]。AtCPK23敲除突变体提高了对干旱和盐胁迫的耐受性,而过表达AtCPK23 的拟南芥对干旱和盐胁迫更敏感[15]。这些结果都证实CDPKs参与了逆境信息的传递。
本试验拟从拟南芥中克隆抗旱基因AtCD-PK1,构建植物表达载体pCHF3-CDPK,并利用农杆菌介导法将AtCDPK1基因导入目前内蒙古地区种植较多的抗旱性较弱的马铃薯品种‘费乌瑞它’(Favorita)基因组,通过PCR 检测AtCDPK1基因在马铃薯的基因组中的整合情况,并用RT-PCR 检测AtCDPK1在马铃薯中的表达情况,旨在为选育抗旱性强的转基因马铃薯新品种奠定基础。
1 材料和方法
1.1 材 料
转基因受体材料为马铃薯品种‘费乌瑞它’(Favorita),由本课题提供。野生型拟南芥(Arabidopsisthaliana)Columbia 生 态 型(Col-0)种 子 及pCHF3植物表达载体由内蒙古农业大学李国婧教授馈赠。农杆菌LBA4404由本课题组保存。
1.2 马铃薯无菌苗的扩繁和试管薯诱导
将马铃薯无菌苗在无菌条件下剪成1.5cm 小段,每节茎段带1~2个腋芽,接种于MS培养基,在光强2 000勒克斯(lx)、光照时间16h/d、温度(22±2)℃条件下进行扩繁培养。无菌苗生长约14d时,在无菌条件下加入微型薯诱导培养基(MS液体培养基+8%蔗糖+4.0 mg/L 6-BA+0.02 mg/L NAA+500mg/L CCC),使其在黑暗条件下生长,大约30d左右长出微型薯。
1.3 AtCDPK 1基因克隆
根据NCBI数据库中At1g18890基因序列,利用Primer 3和VectorNTI 11.0软件,设计带有KpnⅠ与XbaⅠ双酶切位点的特异性引物CDPK1-P5(GAACCCGGGATGGGTAACTGTAACGCCTG)和CDPK1-P3(GCCTCTAGATTAAACAGGAACAGTTTGTC);以野生型拟南芥基因组DNA 为模板进行PCR 扩增,扩增片段总长度为2 269bp,反应程序为:98℃预变性3min,98℃变性30s,53℃退火30s,72℃延伸3min,30个循环,72℃延伸5min。对PCR 产物经0.8%琼脂糖凝胶电泳,利用DNA 纯化回收试剂盒(TaKaRa)胶回收。回收产物进行加核苷酸A 反应,DNA 片段利用T4DNA 连接酶(NEB)与pMD18-T Vector(TaKaRa)连接。用热激法将连接产物转化大肠杆菌Trans1-T1,经蓝白斑筛选、PCR 和酶切鉴定,鉴定正确后送上海生工有限公司测序,测序正确的保种备用。
1.4 植物表达载体的构建
经测序正确的含有AtCDPK1 基因的T-CDPK1重组载体,用KpnⅠ与XbaⅠ双酶切,回收目的基因片段。再将植物表达载体pCHF3用KpnⅠ(NEB)与XbaⅠ(NEB)双酶切,回收大片段。将二者回收的目的片段进行连接转化大肠杆菌Trans1-T1,PCR 和酶切鉴定重组载体,阳性克隆提取质粒,采用冻融法导入农杆菌LBA4404,经PCR 鉴定正确后保种,构建成植物表达载体pCHF3-CDPK1。
1.5 农杆菌介导法转化马铃薯
1.5.1 重组菌株的培养与活化 从-80℃冰箱取出保存的含有pCHF3-CDPK1载体的菌种,在相应抗生素平板上划线。挑取农杆菌单菌落接种到5 mL LB液体培养基(抗生素Rif 30mg/L,Spect 100 mg/L,Str 25mg/L)中,28℃条件下震荡培养16~20h,取1mL接种到50mL LB 液体培养基中(加抗生素同上),继续震荡培养到OD600为0.5~0.8。将其转至50mL离心管,5 000r/min离心10min,弃上清,菌体用MS培养基重悬。
1.5.2 马铃薯转化方法 选择直径在2cm 左右的微型薯,去掉芽眼和薯皮,切成2 mm 厚的薯片,放入农杆菌重悬液中浸泡10min,期间不断摇动菌液使其充分接触,取出后用无菌滤纸吸去薯片表面菌液,转入筛选出的分化培养基(MS+2 mg/L ZT+0.5mg/L 6-BA+1 mg/L IAA+0.2 mg/L GA3)上,于28℃黑暗下共培养2d,使农杆菌的T-DNA有效转移。共培养后将薯片转移到附加50 mg/L Kan+300 mg/L Cef的分化培养基上,在(22±2)℃、2 000lx连续光照条件下诱导芽分化。每隔15 d更换1次培养基,并淘汰褐化和死亡的薯片。待抗性芽长至1.0~1.5cm 时,切下转入附加50 mg/L Kan 和200 mg/L Cef的MS 培养基上,在(22±2)℃、2 000lx连续光照下诱导生根,获得完整抗性植株。
1.6 马铃薯转化植株的分子检测
剪取生根培养基上生长至10cm 左右的马铃薯幼苗叶片提取DNA,以CDPK-RT-F/R 为引物,以含有该基因的质粒为阳性对照,非转基因马铃薯‘费乌瑞它’无菌苗的基因组DNA 为阴性对照,对转基因植株进行PCR 鉴定。采用TRIzol(Invitroge)试剂提取转基因马铃薯植株叶片总RNA,用1%的琼脂糖凝胶电泳检测RNA 质量,选出条带完整且清晰的RNA,去除DNA 后,采用cDNA 合成试剂盒(天根)进行转基因植株的RT-PCR 检测。RT-PCR的 引 物CDPK-RT-F(CCTGTGTAAGGCCAGACTCAA)和CDPK-RT-R(ATAATAACTCCGGCACTCCAC),扩增片段跨AtCDPK1基因1个内含子,扩增cDNA 片段长度为742bp,扩增基因组DNA 的片段为875bp。马铃薯内参基因引物为EF-1α-F(CTCAAGAAGGTAGGATACAAC)和EF-1α-R(GAAGAGCTTCGTGGTGCAT)。
2 结果与分析
2.1 AtCDPK 1基因的克隆
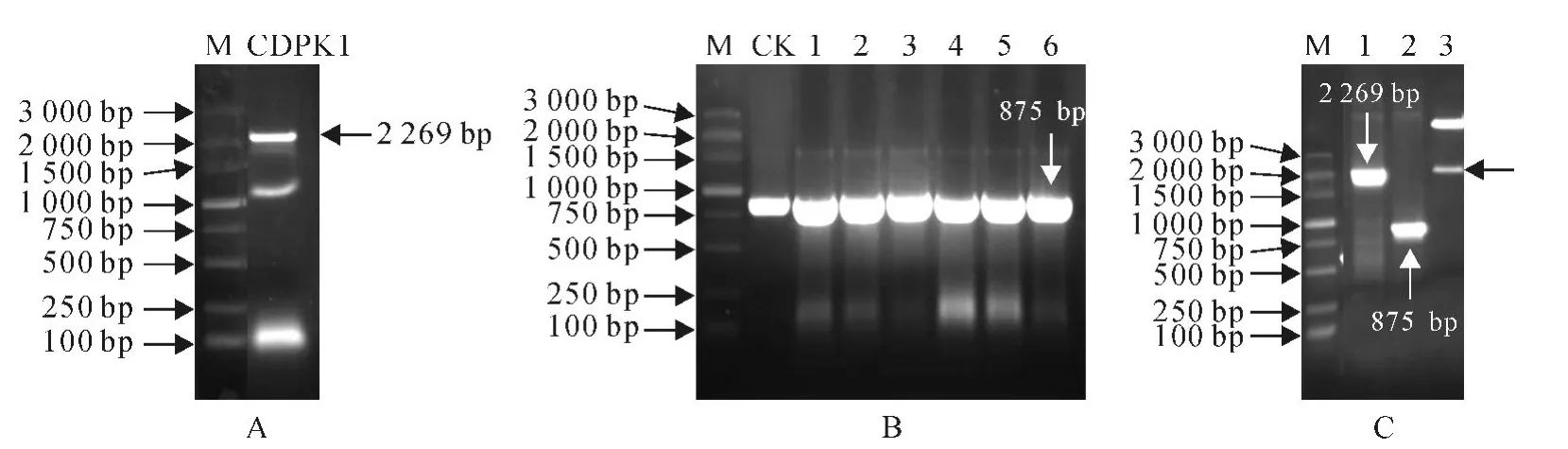
图1 AtCDPK1基因克隆及阳性克隆的鉴定Fig.1 Cloning of AtCDPK1and identification of plasmids recombinant
以拟南芥基因组DNA 为模板,用特异引物CDPK1-P5/P3进行扩增期。结果显示,扩增产物大小与预期片段一致,长度为2 269bp(图1,A)。将目的产物回收后进行加核苷酸A 反应,获得回收片段末端带有碱基A,利于目的片段与T 载体连接,将纯化回收的目的片段连接到pMD18-T 克隆载体上,转化大肠杆菌Trans1-T1,从转化的平板上挑取白色克隆进行菌落PCR,经检测扩增出大小约为875bp的条带(图1,B)。对阳性克隆进行菌液培养提取质粒DNA,然后做PCR 和酶切鉴定,酶切后获得长度为2 269bp 的条带(图1,C)。对质粒进行PCR 鉴定表明,引物CDPK1-P5/P3 和CDPK-RTF/R 分别扩增出2 269bp和875bp的条带(图1,C)。阳性克隆测序结果利用DNAStar软件分析,其DNA 序列与已知基因序列(At1g18890)完全相同(图2)。这表明拟南芥AtCDPK1基因全长克隆成功。
2.2 植物表达载体的构建与鉴定
重组载体T-CDPK1 和植物表达载体pCHF3分别用KpnⅠ与XbaⅠ双酶切(图3,A),回收目的片段后用T4DNA 连接酶(NEB)将目的基因片段与植物表达载体片段连接,连接产物转化大肠杆菌Trans1-T1,然后进行菌落PCR 鉴定,随机挑选6个单菌落进行PCR,结果显示,每一个单菌落都能扩增出1条875bp的条带(图3,B)。随机选PCR 鉴定正确的2 个菌落提取质粒进行相应位点的双酶切,结果显示,2个质粒都获得一条约2 269bp的条带(图3,C)。PCR 产物和酶切产物的目的条带与预期结果一致,这表明植物表达载体pCHF3-CDPK1是CaMV 35S 启动子驱动AtCDPK1 基因的植物表达载体(图3,D)。将构建好的植物表达载体采用冻融法转入农杆菌LBA4404菌株中用于转化马铃薯。
2.3 AtCDPK 1基因农杆菌介导转化马铃薯
AtCDPK1基因农杆菌介导转化马铃薯,结果(图4)表明,无菌苗经过暗培养后,形成微型薯(图4,A),微型薯去皮和芽眼后切成2mm 左右的薄片,薯片经共培养和诱导培养后长出再生芽(图4,B),将芽进行生根培养后长成完整植株(图4,C、D)。
2.4 转化马铃薯的PCR检测
对获得的50株抗性再生植株进行PCR 检测,提取抗性植株叶片的基因组DNA,利用AtCDPK1基因特异引物CDPK-RT-F/R 进行PCR。检测结果显示,在检测的50个植株中有36株呈阳性,这些阳性转基因植株能扩增出约875bp的目的条带,部分检测的电泳结果见图5,非转基因植株没有相应的条带,这表明AtCDPK1基因可能被成功导入马铃薯基因组中。
2.5 AtCDPK 1在转基因马铃薯中的表达
为验证PCR 鉴定为阳性的转基因马铃薯中AtCDPK1基因转录水平,随机挑选9个T0代转基因株系,利用AtCDPK1的特异引物CDPK-RT-F/R,以马铃薯的看家基因StEF-1α作为内参基因,进行RT-PCR 鉴定,检测AtCDPK1在转基因马铃薯中的表达。从图6 可以看出,AtCDPK1 基因在转基因马铃薯中都有一定量的表达,且各个株系的表达量也不同。其中1、2、3和10表达量较高,6和12表达量较低,4、5和13表达量中等。这表明AtCDPK1基因在转基因马铃薯中得到了正常表达。

图2 AtCDPK 1基因测序的DNA 序列Fig.2 AtCDPK 1DNA sequencing

图3 构建植物表达载体pCHF3-CDPK1Fig.3 Construction of AtCDPK1expression vector

图4 形成抗性再生植株Fig.4 Resistant regenerated plants
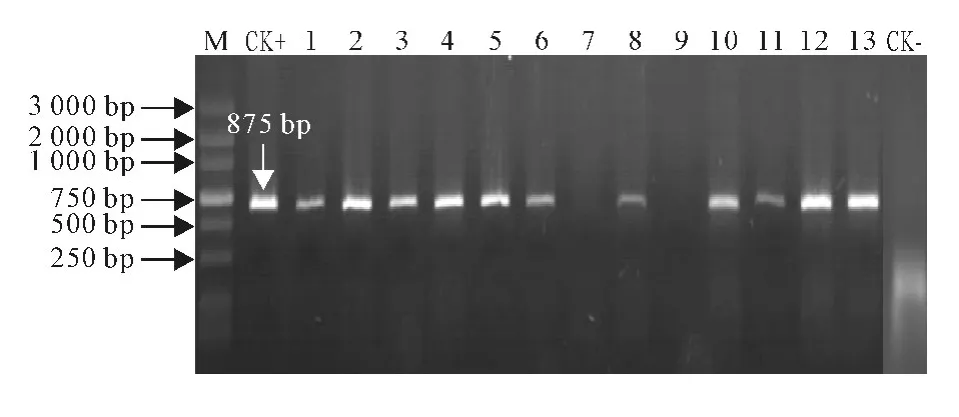
图5 再生植株的PCR 检测Fig.5 PCR detection of regenerated plants
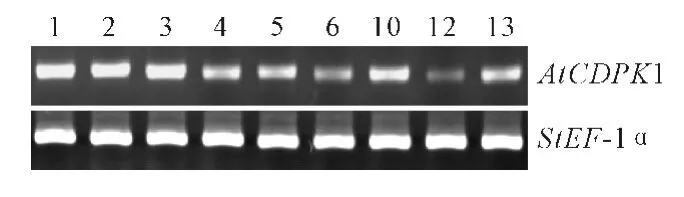
图6 T0 代转基因马铃薯AtCDPK1表达RT-PCR分析Fig.6 RT-PCR analysis of AtCDPK1expression in transgenic plants of S.tuberosum
3 讨 论
全球面临水资源日益短缺的境况,由干旱造成的农作物减产并因此带来的经济损失逐渐加剧。与传统的抗逆育种工作相比,基因工程育种以其特有的优势,如不受种属间的限制、周期短、效率高等特点,正得到越来越广泛的关注。干旱等非生物胁迫严重影响植物的生长发育[16],而植物在生长过程中有很多基因参与了植物响应逆境胁迫的过程[17-18],其中也包括CDPKs[19-20]。CDPKs是一类依赖钙离子而不依赖钙调素的蛋白激酶,它的酶活性是由Ca2+直接激活,不需要外源的CaM 激活。CDPKs与细胞Ca2+信号进一步传递有密切关系,是植物中与逆境信号传递关系最密切的蛋白之一。其种类也较多,目前已知的拟南芥基因组至少能编码34种不同亚型的CDPKs[21-22]。有研究[23-25]表明CDPKs介导了非生物胁迫的信号传递,在不同植物中都观察到非生物逆境可诱导不同CDPKs转录活性和激酶活性的升高。我们前期研究[26]表明,AtCDPK1基因受干旱、高盐等逆境胁迫诱导表达,并在拟南芥抗非生物胁迫介导的信号转导中具有正向调节作用。因此,推测拟南芥对干旱等非生物胁迫的抗性与AtCDPK1的表达有一定的正相关性。本试验以野生型拟南芥为供体材料克隆了AtCDPK1基因,并以抗旱性弱的马铃薯品种‘费乌瑞它’为基因受体材料进行了遗传转化研究,在获得的转基因植株中AtCDPK1基因能正常转录表达,这在RNA 水平上证实了目的基因在转基因马铃薯中正常表达,但转基因马铃薯对干旱等逆境胁迫的抗性如何还有待进一步研究验证。
马铃薯的遗传转化外植体常用叶片、茎段和薯块。本试验选用了脱毒试管微型薯薯片,观察发现因其不经过愈伤组织分化可直接由胚性细胞诱导产生再生植株,使得农杆菌侵染后易于转化。另外,脱毒试管微型薯薯片的污染率低,操作过程相对简单,可明显缩短植株再生时间,是马铃薯遗传转化研究的首选外植体材料。研究发现AtCDPK1基因在转基因马铃薯的各株系中表达量有所不同,这可能是由于不同株系转入基因的拷贝数不同,也可能是实验操作误差造成,此有待于利用Southern 杂交和qRT-PCR 进一步验证。
[1]LIU L(刘 玲).内蒙古马铃薯产业化问题研究[D].呼和浩特:内蒙古农业大学,2003.
[2]SUN G F(孙国凤),MA X(马 鑫).Development status and prospect of agricultural biotechnology[J].AgriculturalOutlook(农业展望),2010,(11):56-59(in Chinese).
[3]YEO E T,KWON H B,HAN S E,etal.Genetic engineering of drought-resistant potato plants by introduction of the trehalose-6-phosphate synthase(TPS1)gene fromSaccharomycescerevisiae[J].MolecularCells,2000,10(3):263-268.
[4]JIANG L L(姜丽丽),DI H(邸 宏),LIN ZH P(林忠平),etal.Agrobacterium-mediated transformation of potato with drought resistance geneBcBCP[J].ChinaVegetables(中国蔬菜),2009,(2):7-11(in Chinese).
[5]张 宁.应用甜菜碱醛脱氢酶基因工程提高马铃薯抗逆性的研究[D].兰州:甘肃农业大学,2004.
[6]ROBERTS D M,HARMON A C.Calcium-modulated proteins:targets of intracellular calcium signals in higher plants[J].AnnualReviewofPhysiolPlantMolecularBiology,1992,43:375-414.
[7]HRABAK E M.Plant Protein Kinases:Calcium-dependent protein kinases and their relatives[M]//KREIS M,WALKER J C.Advances in Botanical Sciences.New York:Academic Press,2000:185-223.
[8]HARMON A C,GRIBSKOV M,GUBRUM E,etal.The CDPK superfamily of protein kinases[J].NewPhytologist,2001,151:175-183.
[9]HARPER J F,BRETON G,HARMON A C.Decoding Ca2+signals through plant protein kinases[J].AnnualReviewofPlantBiology,2004,55:263-288.
[10]HETHERINGTON A,TREWAVAS A.Calcium-dependent protein kinase in pea shoot membranes[J].FEBSLetters,1982,145(1):67-71.
[11]SHEEN J.Ca2+-dependent protein kinases and stress signal transduction in plants[J].Science,1996,274:1 900-1 902.
[12]卢慧星.拟南芥AtCDPK1参与非生物胁迫响应和ABA 信号途径的证据[D].呼和浩特:内蒙古农业大学,2009.
[13]ZOU J J,WEI F J,WANG C,etal.Arabidopsiscalcium-dependent protein kinase CPK10functions in abscisic acid and Ca2+-mediated stomatal regulation in response to drought stress[J].PlantPhysiology,2010,154:1 232-1 243.
[14]PATHARKAR O R,CUSHMAN J C.A stress-induced calcium-dependent protein kinase fromMesembryanthemumcrystallinumphosphorylates a two-component pseudoresponse regulator[J].PlantJournal,2000,24(5):679-691.
[15]MA S Y,WU W H.AtCPK23functions inArabidopsisresponses to drought and salt stresses[J].PlantMolecularBiology,2007,65(4):511-518.
[16]XIONG L,SCHUMAKER K S,ZHU J K.Cell signaling during cold,drought,and salt stress[J].PlantCell,2002,14:S165-S183.
[17]ZHU J K,HASEGAWA P M,BRESSAN R A,etal.Molecular aspects of osmotic stress in plants[J].CriticalReviewsinPlantSciences,1997,16(3):253-277.
[18]HASEGAWA P M,BRESSAN R A,ZHU J K,etal.Plant cellular and molecular responses to high salinity[J].AnnualReviewofPlant PhysiologyandPlantMolecularBiology,2000,51:463-499.
[19]LI A L,ZHU Y F,TAN X M,etal.Evolutionary and functional study of theCDPKgene family in wheat(TriticumaestivumL.)[J].PlantMolecularBiology,2008,66(4):429-443.
[20]SAIJO Y,HATA S,KYOZUKA J K,etal.Over-expession of a single Ca2+-dependent protein kinase confers both cold and salt/drought tolerance on rice plants[J].PlantJorrnal,2000,23(3):319-327.
[21]CHENG S H,WILMANN M R,CHEN H C,etal.Calcium signaling through protein kinases.TheArabidopsiscalcium-dependent protein kinase gene family[J].PlantPhysiol.,2002,129:469-485.
[22]ALICE C H,MICHAEL G,HARPER J F.CDPKs-a kinase for ever Ca2+signal[J].TrendsinPlantScience,2000,5(4):154-159.
[23]ZHANG M,LIANG S,LU Y T.Cloning and functional characterization ofNtCPK4,a new tobacco calcium-dependent protein kinase[J].BiochBiophysActa,2005,1 729(3):174-185.
[24]YOON G M,CHO H S,HA H J,etal.Characterization ofNtCDPK1,a calcium-dependent protein kinase gene inNicotianatabacum,and the activity of its encoded protein[J].PlantMolecularBiology,1999,39(5):991-1 001.
[25]SHAO J,HARMON A C.In vivo phosphorylation of a recombinant peptide substrate of CDPK suggests involvement of CDPK in plant stress responses[J].PlantMolecularBiology,2003,53(5):691-700.
[26]聂利珍.拟南芥AtCDPK1在响应丁香假单胞菌和非生物胁迫中的功能分析[D].呼和浩特:内蒙古农业大学,2008.
