马铃薯对晚疫病水平抗性的组织细胞学观察
2015-07-04李惠霞刘永刚张俊莲
李惠霞,刘永刚,张俊莲,王 蒂*
(1 甘肃农业大学 草业学院,兰州730070;2 甘肃省作物遗传育种与种质创新重点实验室,兰州730070;3 甘肃省农业科学院植物保护研究所,兰州730070)
马铃薯晚疫病又称马铃薯瘟,是由致病疫霉(Phytophthorainfestans(Mont.)de Bary)引起的毁灭性病害,严重威胁着世界马铃薯生产[1,2]。致病疫霉属于异宗配合菌物,有A1 和A2 两种交配型,1956年墨西哥首次证实存在A2交配型,其他地区只有A1交配型。20世纪80年代以后,世界各地相 继 发 现A2 交 配 型[3,4],1996年 后 中 国 马 铃 薯 主栽区陆续出现A2交配型[5-7]。A2交配型的出现意味着病菌可进行有性生殖,引起群体结构发生变化,更易产生新的生理小种,从而使晚疫病的流行更为频繁。与此同时,国内外陆续报道该病原菌对常用的药剂甲霜灵产生了抗药性[8-10],化学防治效果受到了影响,因此,抗病品种的选育和利用显得尤为重要。
育种实践证明,由于晚疫病菌小种较多且变异迅速,很容易克服由一个或少数几个基因控制的垂直抗性,使多年培育的品种推广时间不长就失去了抗性[2],而病原小种的快速变异是导致垂直抗性丧失的根本原因。马铃薯抗晚疫病育种目标已转向利用多基因控制的非特异性的、抗性持久的水平抗性上。但对水平抗性的研究相对较少,特别是病原菌与寄主互作超微结构研究国内尚未见报道。本实验以水平抗性材料和感病品种为研究对象,对接菌后24~72h内寄主与病原菌的互作进行系统的观察和分析,探索其组织学和细胞学特征,揭示马铃薯水平抗性机理。
1 材料和方法
1.1 供试品种及来源
马铃薯晚疫病水平抗性材料LBr-12(CIP Code:387413.21,亲本来源:374080.5×AVRDC1287.19)试管苗由国际马铃薯中心驻京办事处谢开云博士惠赠;感病品种费乌瑞它(Favorite)试管苗由甘肃农业大学作物遗传育种与种质创新重点实验室保存。
1.2 供试病原菌
致病疫霉(P.infestans)分离自甘肃省定西、渭源和临洮等县马铃薯主栽地区病株的混合菌株,在黑麦培养基上18 ℃培养备用。
1.3 马铃薯培育与接种
MS培养基上扩繁的保存苗生长28d后,移栽至塑料钵(20cm×25cm)中,于18~25℃温室中培养。生长42d后选取自顶部以下第3-5叶,叶背朝上,置于铺有滤纸的搪瓷盘进行离体接种。游动孢子悬浮液制备参照朱杰华[11]的方法,游动孢子浓度约为5×104个/mL。接种后用塑料膜保湿24h,以清水处理为对照。接种后24、48和72h取样,用于固定或染色。
1.4 马铃薯叶片组织染色和观察
叶片接种后不同时间,用直径为6 mm 打孔器取样,每个品种取5个叶盘。按Bruzzese[12]方法整叶透明,苯胺蓝染色法进行处理,略加改动,固定染色48h,然后在饱和水合氯醛中脱色48~72h,乳酚油作浮载剂制片,镜检。
1.5 叶片组织中菌丝体观察
参考Eckhard[13]的方法将叶盘置于台盼蓝乳酚油混合液中加热煮沸约1 min,将叶盘转入饱和水合氯醛液中浸泡30min以上,在此期间更换1次饱和水合氯醛液。然后以40%甘油作浮载剂制片,用相差显微镜观察。
1.6 透射电镜样品的制备和观察
透射电镜样品的处理参考康振生[14]的方法进行。将叶片剪成小块,经3%戊二醛和1%四氧化锇双固定,系列乙醇脱水,用Epon812树脂包埋,超薄切片经醋酸双氧铀和柠檬酸铅染色后,置于JEM-100CX 型透射电镜下观察。
2 结果与分析
2.1 接种后叶片组织的变化
整叶透明结果显示,接种后24h,抗病品种LBr-12叶片在侵染点出现3~4 个细胞褐色坏死,即表现为过敏性反应(hypersensitive response,HR)(图1,A)。而感病品种费乌瑞它叶片在接种后24h可观察到侵染点及其相邻的细胞没有出现坏死,而是表现为细胞颜色加深,即为深绿色,且呈浸润状分布(图1,B)。接种48h后,2个品种叶片的病斑都进一步扩大,但抗病品种上扩展的速度明显小于感病品种(图1,C、D)。抗病品种出现褐色的小病斑,而感病品种则出现水渍状深绿色病斑。
2.2 接种后叶片组织中菌丝体的观察
台盼蓝染色和水合氯醛脱色后观察结果显示,接种后24h,病原菌只侵染少量LBr-12细胞,胞间菌丝被限制在几个细胞间,即受到过敏性坏死限制(图1,E),而胞间菌丝在费乌瑞它叶片细胞间迅速扩展,且产生多个分支(图1,F)。接种48h 后,LBr-12叶肉细胞侵染的数量增加,侵染点周围细胞表现为台盼蓝染色加深,出现细胞死亡的迹象(图1,G)。随着时间的推移,费乌瑞它接种72h后,胞间菌丝在寄主叶片组织中快速扩展,且产生的较多分支(图1,H)。
2.3 马铃薯与致病疫霉互作的超微结构变化
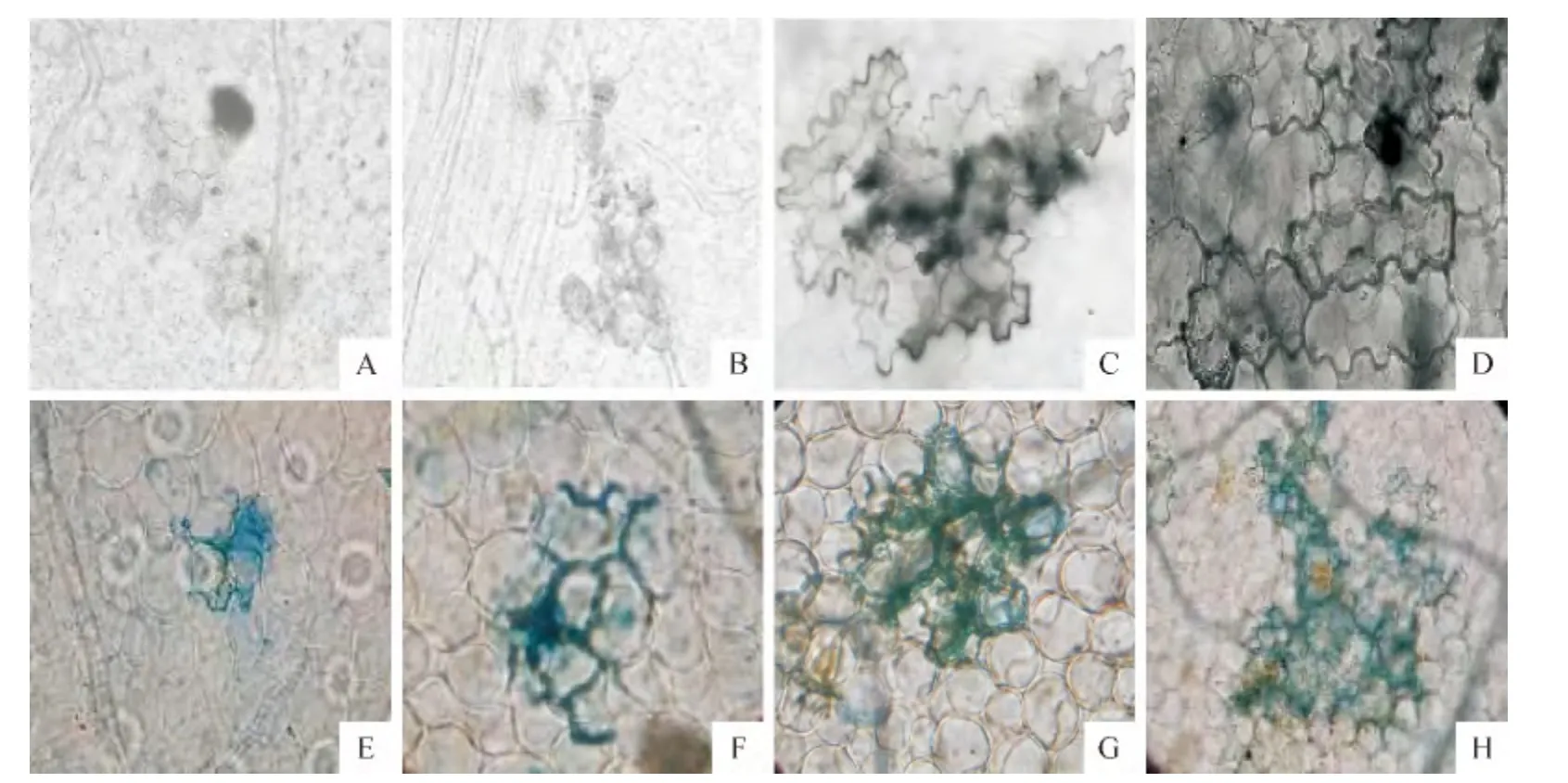
图1 马铃薯叶片组织中致病疫霉的显微观察Fig.1 Observation of P.infestans in the potato leaves after staining using microscope
2.3.1 胞间菌丝体的变化 在接种后24h,感病品种费乌瑞它中可观察到大量发育良好的菌丝细胞在感病品种细胞间隙扩展,具有多个细胞核,菌丝细胞线粒体、内质网等细胞器以及核膜、核仁以及染色质清晰可见(图2,A);抗病品种LBr-12 在接种后24h,胞间菌丝的形态基本正常,但液泡增多(图2,B)。接种36h 后,费乌瑞它中胞间菌丝细胞器正常,液泡增大(图2,C),抗病品种LBr-12胞间菌丝的细胞原生质的电子致密度加深,液泡增多,菌丝细胞中的线粒体、内质网等细胞器泡囊化,并融合形成大量泡状物(图2,D)。LBr-12 中同时可见泡状物与菌丝细胞质膜融和而沉积到菌丝壁上,使得菌丝细胞壁加厚,细胞质开始紊乱,线粒体肿胀,菌丝质膜和核膜变得模糊,有大量电子致密度高的物质从细胞渗出,菌丝细胞开始畸形坏死或细胞器部分解体,细胞质完全解体或变黑(图2,E)。随着时间的推移,LBr-12中泡囊化进一步加剧,细胞器和细胞核变得模糊不清,细胞出现质壁分离,或整个细胞也开始解体(图2,F、G)。
2.3.2 吸器和吸器母细胞的变化 电镜观察发现,接种后48h,在抗性品种上病菌的吸器外间质加宽,并有电子致密物质沉积,即形成吸器鞘(图版Ⅰ,1)。少数吸器畸形,吸器壁加厚,原生质染色加深,吸器扭曲和外间质膜形态异常、发育受抑或出现吸器质壁分离(图版Ⅰ,2)。根据吸器发育受抑的程度和吸器畸形的特点,可将吸器受抑的类型分为两类。一类为吸器发育早期受抑型,吸器体一般不能正常膨大,仅产生一些不规则的分枝而呈畸形(图版Ⅰ,3);另一类为吸器发育后期受抑,初形成的吸器形态和结构正常,但进一步发育后,吸器内出现一系列的异常变化。包括吸器质膜与细胞核质膜电子致密度加深,原生质内液泡增多且逐渐增大,线粒体肿大破裂和吸器外间质不规则加宽并出现致密度深的物质,吸器内的细胞器坏死。在吸器生长受阻和坏死过程中,吸器外间质加宽,产生电子致密的颗粒状物(图版Ⅰ,4~6)。
2.3.3 寄主细胞结构的变化 当致病疫霉侵染不同抗病品种后,寄主细胞的反应较为复杂,其抗病反应主要涉及寄主细胞新的防卫结构的形成和寄主细胞的过敏性坏死反应。水平抗性品种受侵染后,细胞壁染色加深以及沉积物的产生,对于增强细胞壁机械强度,限制病原菌扩展,具有较强的抵抗作用。电镜观察发现,抗病品种寄主细胞膜内侧产生抗侵入的乳突状结构(图版Ⅰ,7),为抵抗病菌的进一步扩展,寄主细胞壁和细胞膜极度增厚(图版Ⅰ,8、9),而感病品种在入侵部位未见乳突状结构。
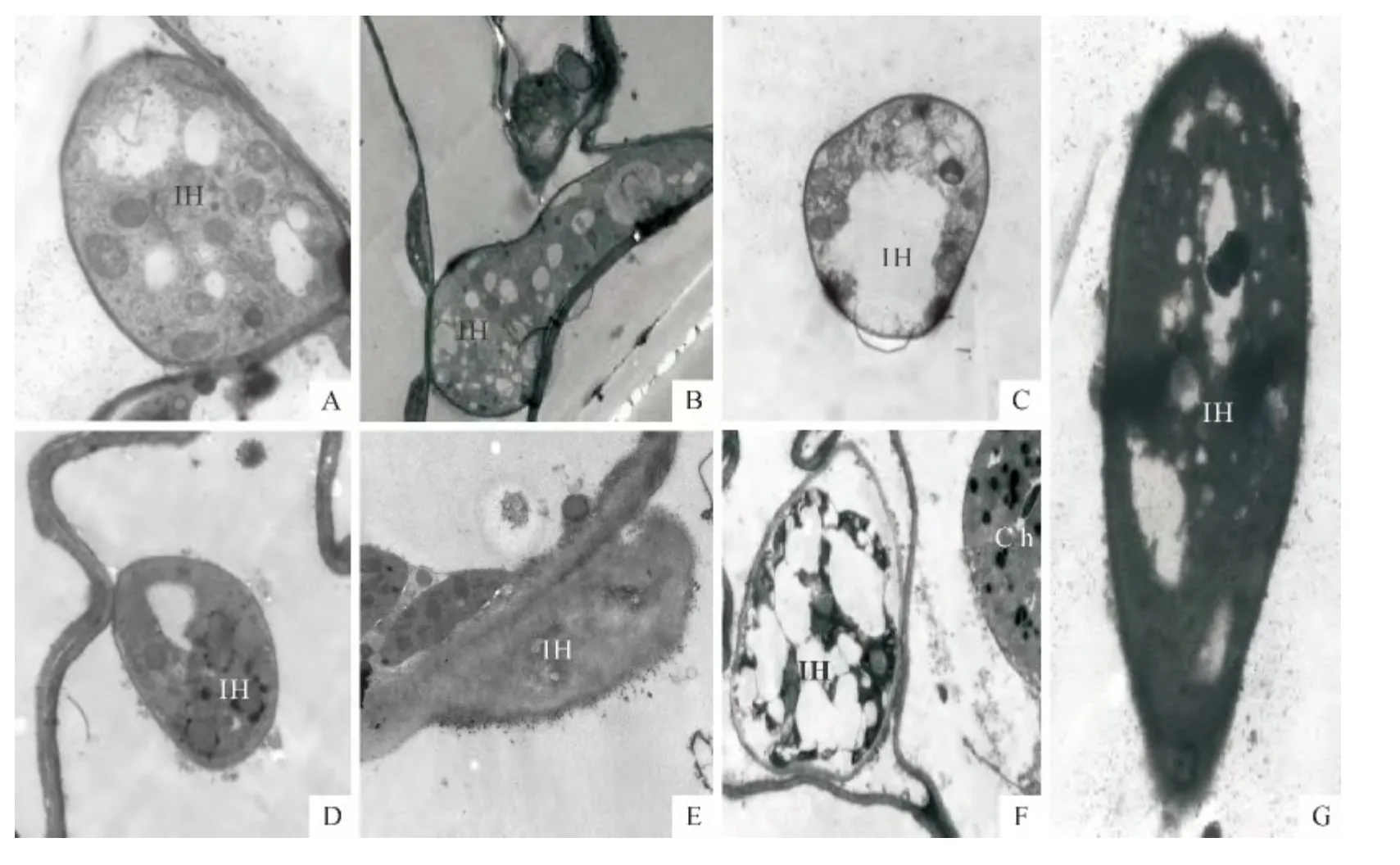
图2 马铃薯叶片中致病疫霉菌丝的超微结构Fig.2 Ultrastructure of hyphae of P.infestans in potato leaves
3 讨 论
水平抗性品种虽然其反应型表现为中抗,但相对于感病品种,却表现为病原菌扩展缓慢、病斑较小、产量损失较小等特点。这种抗病性在生产实践中具有重要的应用价值。水平抗病性机制相当复杂,至今尚未得出一致的观点。本研究表明,其主要组织细胞学机制表现为寄主叶肉细胞过敏性坏死(即HR反应),被侵染的细胞可产生HR反应,病菌被限制在侵染点的几个细胞中。与感病品种相比,抗病品种中菌丝产生的分支和吸器较少,病菌的扩展受到抑制。在细胞水平,抗病寄主植物产生细胞壁沉积物,使细胞壁增厚,或在病菌的入侵处产生乳突状结构来阻止病菌的侵入;另外通过细胞壁在吸器鞘产生沉积物,使病菌的吸器外间质加宽,产生纤维状或颗粒状物电子致密物质[15],使吸器的功能受到影响。
过敏性反应是寄主植物最典型的抗病性机制。研究表明[16],在超微结构上,无论是水平抗性还是垂直抗病性,其过敏性反应的细胞学死亡过程是一致的。Kowalski等[17]在亚麻锈病中将这种数量性状抗病性的过敏性反应,称之为“不完全过敏性反应”(incomplete hypersensitivity),它在侵染过程的晚期表达,而且仅出现在部分受侵细胞中,他认为不同类型抗病性发生过敏性反应的本质是一样的。Vleeshouwers等[18]研究显示,不同马铃薯品种出现HR 反应的时间差别显著,从参与HR 反应的细胞数目看,抗性水平与HR 效率存在相关性。水平抗性与垂直抗病性的主要区别是,HR 反应出现时间和程度的差异,表现为效率较低的HR。他认为这可能由于弱化的R 基因对病菌激发子识别缓慢或识别能力不足造成的,这表明在致病疫霉与马铃薯互作体系中,过敏性坏死反应是水平抗性马铃薯抗晚疫病的重要机制之一。
植物细胞受到病原菌侵染时会出现细胞壁沉积物,使细胞壁增厚,这被认为是植物抵抗病菌的重要防卫反应之一[19]。Coffey等[20]对抗病马铃薯组织的超微结构观察表明,感病互作中寄主的细胞壁缺乏胼胝质的积累,而在抗病互作中,进入细胞的吸器周围沉积大量次生产物,形成一个鞘状包被,将吸器与寄主细胞的细胞质隔开,使菌丝扩展受到抑制。蒋选利等[21]采用细胞化学方法就对小麦与锈菌互作中胞壁沉积物进行分析,抗病品种中过氧化物酶的活性在侵染点细胞以及远离侵染点的叶肉细胞壁和细胞间隙中均显著升高。这些物质不仅可以作为抵抗病菌侵入的机械屏障,而且可以激活防御酶类,提高寄主细胞的抵抗能力。因此,细胞壁沉积物的产生可能是马铃薯抗晚疫病的结构防卫反应之一。
除此之外,寄主植物还有其它类型的防卫反应,如在病菌入侵部位及寄主细胞内侧出现抗侵入的乳突状结构,寄主细胞的坏死频率较低,能在一定程度上阻止病菌的扩展。病菌的吸器外间质加宽,出现大量电子致密物沉积。这些超微结构在小麦和锈菌的抗病性互作的报道较多[19,20,22],但其结构和功能还有待进一步研究。

图版Ⅰ 致病疫霉吸器和LBr-12细胞超微结构PlateⅠ Ultrastructures of P.infestans haustorium and LBr-12cells
[1] FRY W E,GOODWIN S B,DYER A T,etal.Historical and recent migrations ofPhytophthorainfestans:chrology,pathways and implications[J].PlantDisease,1993,77(7):653-661.
[2] GOODWIN S B,SUJKOWSKI L S,FRY W E.Rapid evolution of pathogenicity within clonal lineages of the potato late blight disease fungus[J].Phytopathology,1995,85(6):669-676.
[3] DEAL K I,GOTH R W,etal.Occurrence of the A2mating type ofPhytophthorainfestansin potato fields in the United States and Canada[J].AmericanPotatoJournal,1991,68(11):717-725.
[4] GOODWIN S B,DRENTH A.Origin of the A2 mating type ofPhytophthorainfestansoutside Mexico[J].Phytopathology,1997,87(10):992-999.
[5] ZHANG ZH M(张志铭),LI Y Q(李玉琴),TIAN SH M(田世民),etal.The occurrence of potato late blight pathogen(phytophthora infestans)A2mating type in China[J].JournalofAgricultureUniversityofHebei(河北农业大学学报),1996,19(4):62-66(in Chinese).
[6] ZHAO ZH J(赵志坚),HE Y K(何云昆),LI CH Y(李成云).Occurrence of the A2mating type ofPhytophthorainfestanson potato in Yunnan[J].SouthwestChinaJournalofAgriculturalSciences(西南农业学报),1999,12(3):1-3(in Chinese).
[7] ZHANG ZH M(张志铭),ZHU J H(朱杰华),SONG B F(宋伯符),etal.Further investigation on A2mating type of onPhytophthorainfestansin China[J].JournalofAgricultureUniversityofHebei(河北农业大学学报),2001,24(2):32-37(in Chinese).
[8] DEAHL K L,INGLIS D A,DEMUTH S P.Testing for resistance to metalaxyl inPhytophthorainfestansisolated from Washington[J].AmerianPotatoJournal,1993,70(6):779-795.
[9] GOODWIN S B,SUJKOWSKI L S,FRY W E.Wide spread distribution and probable origin of resistance to metalaxyl clonal genotypes ofPhytophthorainfestansin the United States and Western Canada[J].Phytopathlogy,1996,86(7):793-800.
[10] LI W(李 炜),ZHANG ZH M(张志铭),LI CH(李 川),etal.Study on the Resistance ofPhytophthorainfestansin potato to Metalaxyl[J].JournalofAgricultureUniversityofHebei(河北农业大学学报),1998,21(3):53-60(in Chinese).
[11] ZHU J H(朱杰华),ZHANG ZH M(张志铭),YANG ZH H(杨志辉).General research methods on pathogen of potato late blight[J].JournalofAgricultureUniversityofHebei(河北农业大学学报),2001,24(2):112-114(in Chinese).
[12] BRUZZESE E,HASAN S.A whole leaf clearing and staining technique for host specificity studies of rust fungi[J].PlantPathology,1983,32(3):335-338.
[13] ECKHARD KOCH,SLUSARENKO A.Arabidopsisis susceptible to infection by a downy mildew fungus[J].ThePlantCell,1990,2(5):437-445.
[14] 康振生.植物病原真菌的超微结构[M].北京:中国科学技术出版社,1996:7-8.
[15] CUYPERS B,HALDBROCK K.Immunohistochemical studies of compatible and incompatible interactions of potato leaves withPhytophthorainfestansand nohost response toPhytophthoramegasperma[J].CanadianJournalofBotany,1988,66(4):700-705.
[16] KAMOUN S,HUITEMA E,VLEESHOUWERS VGAA.Resistance to oomycetes:ageneral role for the hypersensitive response[J].TrendsinPlantScience,1999,4(5):196-200.
[17] KOWALSKA A,NIKS R E.Histology of quantitative resistance in flax to the flax rust fungus(Melampsoralini)[J].CanadianJournal ofPlantPathology,1999,21(4):354-360.
[18] VLEESHOUWERS VGAA,DOOIJEWEERT W V,GOVERS F,etal.The hypersensitive response is associated with host and nohost resistance toPhytophthorainfestans[J].Planta,2000,210(6):853-864.
[19] KANG ZH SH(康振生),WANG Y(王 瑶),etal.Histology and ultrastructure of incompatible combination betweenPucciniastriiformisand wheat cultivars with resistance of low reaction type[J].ScientiaAgriculturaSinica(中国农业科学),2003,36(9):1 026-1 031(in Chinese).
[20] COFFEY M D,WILSON U E.An ultrastructural study of the late blight fungusPhytophthorainfestansand its relation with the foliage of two potato cultivars possession different levels of general resistance[J].CanadianJournalofBotany,1988,61(10):2 669-2 685.
[21] JIANG X L(蒋选利),LI ZH Q(李振岐),KANG ZH SH(康振生).Cytochemistry of peroxidase in the interaction between wheat and stripe rust[J].ActaBotanicaBoreail-OccidentaliaSinica(西北植物学报),2002,22(3):516-520(in Chinese).
[22] MA Q(马 青),SHANG H SH(商鸿生).Ultrastructural of an incompatible interaction between wheat andPucciniastriiformis[J].ActaPhytopathologicaSinica(植物病理学报),2002,32(4):306-311(in Chinese).
