水杨酸对植物光合作用影响的研究进展
2015-07-04唐艳萍刘明洁
唐艳萍,文 涛,孙 歆,刘明洁
(四川农业大学 农学院,成都611130)
水杨酸(Salicylic Acid,SA),即邻羟基苯甲酸,是一种植物体内产生的简单酚类物质,参与调节植物呼吸代谢、种子萌发、成花诱导、衰老及抗逆生理等[1-2]。水杨酸可以通过交互影响一些功能分子或其他信号分子,参与复杂的应激响应,如诱导逆境相关基因的表达、激活植物过敏反应和系统获得性抗性,以及调节细胞抗氧化机制等,从而增强植物对生物和非生物胁迫的耐受性[3]。
近年来,众多研究表明水杨酸对植物光合作用有明显影响,并提出调节光合作用是水杨酸提高植物环境适应能力的重要途径之一[4]。同时,叶绿体内水杨酸异分支酸合成途径与水杨酸结合蛋白3(salicylic acid-binding-proteins,SABP3)的 发 现 揭示出水杨酸与光合作用可能有非常密切的关系[5-6]。最初认为水杨酸是通过调节气孔运动来影响植物叶片净光合速率(Pn)的。后来的研究发现水杨酸对光合碳同化重要酶类1,5-二磷酸核酮糖羧化加氧酶(ribulose-1,5-diphosphate carboxylase/oxygenase,Rubisco)、磷 酸 烯 醇 式 丙 酮 酸 羧 化 酶(phosphoenolpyruvate carboxylase,PEPC)和 碳 酸 酐 酶(carbonic anhydrase,CA)等 的 活 性 均 有 影 响[7-8]。水杨酸还具有影响植物光合色素含量、调节光合电子传递和光合能量转化、维持光合器官稳定性的作用[9-11]。此外,水杨酸处理的长期效果还表现为改变叶片的解剖结构及叶绿体的超微结构。例如,研究发现水杨酸处理降低了大麦(HordeumvulgareL.)叶片表皮组织和叶肉组织的厚度,尤其降低了上表皮细胞的宽度和泡状细胞的体积,同时增大了叶绿体体积,使叶绿体基质凝固和基粒类囊体膜不同程度地增大,进而对光合作用产生影响[12]。本文将分别从气孔运动、光合色素含量、光合机构的性能及光合碳同化酶活性等方面来讨论水杨酸对光合作用的影响。
1 水杨酸对植物气孔运动的调节
气孔是植物体与外界环境进行气体交换的通道,与植物体的光合作用密切相关。研究发现水杨酸能促进植物气孔关闭,且有明显的剂量效应。低浓度的水杨酸处理使植物气孔开度减小以增强对逆境的适应能力,但是高浓度的水杨酸则给植物细胞造成不可逆的伤害,使气孔不可逆的关闭。水杨酸预处理增加了干旱胁迫导致的银沙槐(Ammodendronargenteum)气孔开度的降低程度,且相同干旱程度下气孔孔径随着水杨酸浓度的增加而减小[13],说明一定浓度范围内水杨酸浓度的增加可以提高植物的抗旱性。0.001~10mmol·L-1的水杨酸处理蚕豆(ViciafabaL.)表皮,水杨酸诱导气孔关闭的作用随着浓度的升高而增强,且0.01mol/L的水杨酸诱导气孔关闭不可逆,表明高浓度的水杨酸给植物细胞造成了伤害[14]。但Rai等[15]的研究发现水杨酸溶液可以诱导鸭跖草(Commelinacommunis)气孔张开,且会减弱脱落酸(ABA)介导的气孔关闭作用。这也许是水杨酸不同的使用浓度、使用方式或者不同环境产生的差异。另外,水杨酸对气孔关闭的诱导作用还与溶液pH 值有关,以pH 值分别为8、7、6的水杨酸溶液培养黄瓜(CucumissativusL.),其子叶表皮气孔开度抑制率分别为90.2%、93.8%和96.3% ,表明气孔开度随水杨酸溶液pH值升高而升高[16]。
关于水杨酸调节气孔运动的信号机制(图1),王棚涛等[17]认为活性氧(ROS)信号特别是H2O2在水杨酸诱导的气孔关闭中起着重要作用,水杨酸通过抑制CAT 活性和诱导NADPH 氧化酶的活性来诱导蚕豆保卫细胞H2O2的产生。质膜NADPH氧化酶抑制剂二亚苯基碘(DPI)能够逆转水杨酸对保卫细胞内向K+电流的抑制作用,暗示H2O2可能通过抑制质膜内向K+电流而介导水杨酸诱导气孔关闭[11]。Khokon等[18]认为在水杨酸诱导拟南芥(Arabidopsisthaliana)气孔关闭过程中NO 也 是ROS的下游信号。水杨酸诱导胞外对水杨基羟肟酸(SHAM)敏感的过氧化酶产生ROS,胞外ROS进入保卫细胞造成胞内ROS的积累,进而通过一氧化氮合酶(NOS)途径诱导NO的产生[19]。Poór等[20]也发现低浓度的水杨酸诱导番茄(Solanum lycopericumL.)叶片气孔关闭也与胞外ROS产生和NO 的积累有关,但高浓度的水杨酸诱导的气孔关闭却是由于保卫细胞叶绿体内ROS急剧积累导致光合速率的降低引起的,这与保卫细胞渗透调节物质糖和淀粉含量变化以及与离子运输相关的ATP 产量的降低有关[21]。另外,低浓度水杨酸诱导蚕豆的气孔关闭与保卫细胞细胞质Ca2+的积累也相关,水杨酸可诱导胞内钙库的Ca2+流入细胞质进而引起气孔关闭[22]。
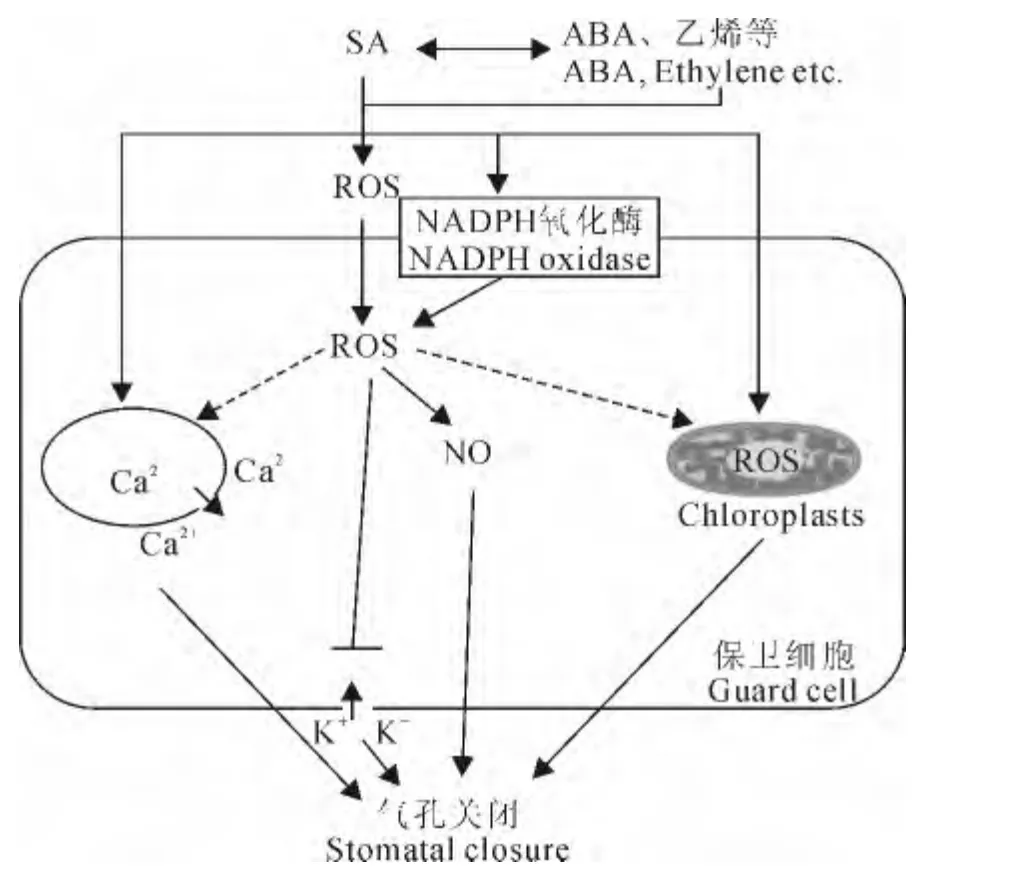
图1 水杨酸调节气孔运动的信号机制Fig.1 The regulation signaling of SA on stomatal movement
水杨酸也可通过与其他植物激素的相互作用来调节气孔运动。水杨酸和乙烯利都可以诱导蚕豆气孔关闭,并且两者能够相互增强作用强度[23]。脱落酸合成抑制剂氟草酮能阻断水杨酸诱导的H2O2的积累和胞质Ca2+的升高,进而阻断水杨酸诱导的小麦(TriticumaestivumL.)叶片气孔关闭,而外源加入ABA 则可恢复水杨酸诱导的这些过程[24],说明植物内源ABA 参与了水杨酸诱导的气孔关闭。
2 水杨酸对植物光合色素含量的影响
水杨酸对植物光合色素含量的影响有明显的剂量效应。低浓度(0.01 mmol·L-1)的水杨酸预处理小麦种子和芥菜(BrassicajunceaCzern &Coss cv.Varuna)叶片能够显著提高幼苗的色素含量[25-26],0~1.00 mmol·L-1水杨酸处理的青蒿(ArtemisiaannuaL.)叶片叶绿素和类胡萝卜素含量也显著升高[9]。但高浓度的水杨酸降低了向日葵(HelianthusannuusL.)的叶绿素和类胡萝卜含量[27]。Moharekar等[28]报道水杨酸降低了小麦叶绿素含量和叶绿素a/b值,而促进了类胡萝卜素和叶黄素的生物合成,增强了去环氧化作用的速率。
在环境胁迫下,水杨酸能够减轻植物光合色素含量的下降程度,保持较高的光合速率从而保证植物正常生长。水杨酸可以减轻干旱胁迫下烤烟(NicotianatabacumL.)叶绿素的分解[29],提高水分胁迫下扁蓿豆(Melilotoidesruthenica)幼苗叶片叶绿素含量及叶绿素a/b值[30],增强光合速率。水杨酸能有效抑制NaCl胁迫下番茄幼苗叶绿素和类胡萝卜素含量的降低,增加春小麦抗盐品种叶绿素a含量,提高叶绿素a/b值,使盐胁迫下植株保持较高的光合速率[31-32]。水杨酸显著提高了高温胁迫下半夏(PinelliaternataBreit)叶片的叶绿素含量和叶绿素a/b的值[33],使镉胁迫下甜瓜(CucumismeloL.)的叶绿素含量恢复到正常水平[34]。水杨酸对镉胁迫下叶绿素的保护作用可能与其降低镉胁迫下叶绿素酶活性而促进与叶绿素合成相关的δ-氨基乙酰丙酸和原叶绿素酸脂还原酶复合体的生物合成相关[35]。水杨酸还能降低农药百草枯和烯草酮等对光合色素的破坏。研究发现0.5mmol·L-1水杨酸预处理大麦幼苗可减轻百草枯引起的叶绿素含量的降低程度[36]。水杨酸预处理可以提高烯草酮处理的玉米(ZeamaysL.)光合色素含量,特别提高了保护其他色素不被氧化损伤的类胡萝卜素含量,使烯草酮处理的玉米叶片保持较高水平的光合速率[37]。
3 水杨酸对光合机构性能的影响
3.1 水杨酸保护光合机构
水杨酸能够保护光系统,主要体现在保护光系统Ⅱ(PSⅡ)上。Wang等[11]通过考察荧光诱导动力学OJIP 阶段曲线的变化发现,水杨酸对热胁迫和胁迫后恢复阶段PSⅡ的保护作用是由于水杨酸保护了PSⅡ放氧复合体。水杨酸也能够保护PSⅡ反应中心,逆境对光合机构破坏的关键部位是叶绿体PSⅡ反应中心,其中又以D1蛋白最为敏感,而水杨酸对D1蛋白有保护作用。马培芳等[38]的研究表明水杨酸预处理能有效抑制高温强光下D1蛋白的净降解,保持较高的D1蛋白磷酸化水平,证明水杨酸可通过调节小麦叶绿体D1蛋白的周转,减轻高温强光胁迫对叶片光合机构的损伤,从而保证PSⅡ的正常运转。郑静静等[39]的研究也表明水杨酸预处理不仅能够抑制高温强光下小麦叶绿体Deg1蛋白酶和D1蛋白降解,维持较高的PSⅡ原初光化学效率和净光合速率,而且加快了胁迫后正常条件下PSⅡ功能的恢复。除此之外,水杨酸还可通过提高渗透胁迫下D1蛋白基因psbA、D2蛋白基因psbB和LHC蛋白基因Cab的表达量来保护PSⅡ[40]。
水杨酸对光合膜也具有保护作用。光合膜是细胞内所有膜中不饱和脂质含量最高的,类囊体膜中高含量的不饱和脂肪酸所提供的适宜程度的膜流动性对亲脂化合物的扩散有重要作用,这可能是保证光合作用顺利进行的途径。Moradkhani等[41]发现水杨酸处理可以减轻镉胁迫下不饱和脂肪酸的降低程度,抑制胁迫下不饱和脂肪酸的过氧化,保证光合膜的流动性,从而维持正常的渗透性和稳定性,这可能是由于水杨酸提高了植物组织的抗氧化能力。环境胁迫往往导致过量活性氧(ROS)的产生,而叶绿体是细胞内产生ROS的主要场所之一,ROS 积累造成的氧化损伤光合膜首当其冲。李天来等[42]对番茄的研究发现,喷施水杨酸能够明显提高抗氧化酶SOD 和POD 的活性,降低亚高温胁迫对细胞膜的破坏作用,保护光合机构使其免受活性氧的伤害。在对黄瓜、扁蓿豆和花椒(Zanthoxylumbungeanum)的研究中,水杨酸处理能够提高植物抗氧化能力,保护植物光合器官免受干旱胁迫的损伤,从而降低干旱胁迫下光合速率的下降程度[43-45]。
3.2 水杨酸调节光合电子传递和光合能量转化
低浓度的水杨酸使番茄保卫细胞叶绿体保持较高的电子传递速率,而高浓度的水杨酸处理则破坏光合电子传递[21]。即水杨酸对光合电子传递的影响有明显的剂量效应,高浓度的水杨酸对光合电子传递不利。Sahu等[46]研究发现水杨酸能提高围绕PSⅡ的电子传递速率,而对围绕PSⅠ的电子传递的影响则有显著的剂量效应,低浓度的水杨酸能够轻微地提高围绕PSⅠ的电子传递速率,高浓度的水杨酸则明显抑制PSⅠ电子传递。Janda等[10]用水杨酸注射烟草叶片发现,0.1~2mmol·L-1的水杨酸降低了PSⅡ量子产量(ФPSⅡ)和PSⅠ量子产量(ФPSⅠ),但发现ФPSⅡ的降低程度远远大于ФPSⅠ。通过P700+还原动力学发现ФPSⅠ的降低是由于水杨酸抑制了PSⅠ供体侧到PSⅠ反应中心的电子传递。进一步研究发现水杨酸处理增加了P700+还原动力学慢速阶段的振幅,而降低了快速阶段的振幅,说明水杨酸增强了围绕PSⅠ的光合环式电子传递而降低了线性电子传递。Janda等[10]推测线性电子传递的降低不仅仅与PSⅡ光化学效率降低有关,也与水杨酸诱导的细胞色素b6/f复合体处PQH2氧化速度的降低相关。而围绕PSⅠ环式电子传递的增加则与水杨酸引起的气孔关闭、卡尔文循环受阻导致的NADPH 的积累有关。水杨酸培养小麦幼苗和注射烟草叶片均会改变光合电子传递,而水杨酸直接处理分离的叶绿体类囊体膜却不影响光合电子传递[10,46],说明水杨酸对光合电子传递的影响是间接的。
同时,水杨酸能改变光系统对光能的捕获效率,还影响光合能量转化。水杨酸处理减轻了低温弱光下黄瓜叶片、高温胁迫下半夏PSⅡ最大光化学效率(Fv/Fm)的降低程度[33,47],说明水杨酸能够增强逆境下植物叶片PSⅡ反应中心的光能捕获效率,使更多的光能进入光合系统。水杨酸提高了黄瓜幼苗叶片的光化学淬灭系数(qP)[47],使PSⅡ反应中心保持开放状态,从而使更多的能量被利用,增加光能利用效率。水杨酸和乙酰水杨酸处理降低了黄瓜和长春 花(Catharanthusroseus)的 非 光 化 学 淬 灭(NPQ),使干旱、UV-B 辐射等环境胁迫下的NPQ升高幅度降低[48,49]。说明水杨酸能够降低光合系统能量耗散,使更多的光能用于光化学反应。但高浓度的水杨酸会减弱光合系统对能量耗散的调节能力,Janda等[10]发现随着光强的增强,水杨酸处理使NPQ 的增加速度降低,推测其可能与水杨酸对叶黄素循环的调节相关。水杨酸处理可使光氧化胁迫下叶黄素循环库增加,耗散过剩的光能,从而保护叶片光合机构不受破坏。孙艳等[50]的研究发现0.2 mmol·L-1的水杨酸处理黄瓜叶片减弱了光氧化胁迫下非光化学猝灭系数(NPQ)和叶黄素环脱环氧化状态(A+Z)/(V+A+Z)的升高程度。
此外,对水杨酸有明显响应的交替呼吸及其末端氧化酶(alternative oxidase,AOX)也能影响光合电子传递和能量耗散。水杨酸减弱细胞色素呼吸途径而增强抗氰呼吸,增加交替呼吸电子传递比例[51-53]。近来的研究发现,线粒体内的交替途径对于消耗叶绿体内过剩的光能,防止光破坏有重要作用。叶绿体内NADPH 可以通过苹果酸-草酰乙酸穿梭(malate-OAA 穿梭)系统转运进入线粒体,而AOX途径在消耗线粒体内过量的NAD(P)H 和维持Malate-OAA 穿梭系统的活性方面具有重要作用[54]。孟祥龙等[55]的研究表明AOX 交替呼吸途径在杂交酸模(RumexK-1)叶片的光破坏防御过程中起着重要作用,而且强光下AOX 途径对叶片的光破坏防御作用是叶绿体内其他光破坏防御途径所不能代替的。AOX 缺乏的拟南芥aox1a突变体在高光强下具有较低的PSⅡ实际光化学效率,同时加强了围绕PSⅠ的光合环式电子传递(CET-PSⅠ)[56]。高光强下抑制AOX 途径会导致PSⅡ受体侧的过度还原、降低PSⅡ能量转移效率,损伤了PSⅡ的供体侧电子传递,大幅度减少了光合电子受体,同时AOX 途径的受抑导致杂交酸模叶片光合性能指标、实际光化学效率(ФPSⅡ)、光化学淬灭(qP)和光合O2合成速度的降低[57]。因此可以推测,逆境下水杨酸对光合电子传递和能量耗散的调节作用与水杨酸诱导的AOX 基因的表达与抗氰呼吸活性的变化有着重要关系。
4 水杨酸对光合碳同化酶的影响
Khan等[7]研究发现,水杨酸处理增加了玉米和大豆(Glycinemax)叶片的光合速率、气孔导度和蒸腾速率,却降低了胞间CO2浓度。这说明水杨酸处理能够提高叶绿体内CO2固定相关酶的活性,这些酶包括1,5-二磷酸核酮糖羧化加氧酶(Rubisco)、磷酸烯醇丙酮酸羧激酶(PEPC)和碳酸酐酶(CA)等,水杨酸对这些酶活性的调节作用对植物适应环境胁迫、提高光合速率有重要作用。水杨酸预处理显著提高了水分胁迫下黄瓜叶片中Rubisco含量及其基因转录水平[58],而水杨酸合成抑制剂多效唑喷施干旱胁迫的黄瓜幼苗,叶片Rubisco小亚基(RbcS)和CA 的基因表达水平降低[59]。水杨酸预处理可以明显减轻镉胁迫对大麦Rubisco活性的抑制作用,并使PEPC的活性高出无胁迫对照2 倍[60]。另外的研究也发现水杨酸浸泡处理豌豆(Pisumsativum)6 h能够显著降低镉胁迫对CO2固定的抑制作用[61]。此外,水杨酸能够提高芥菜幼苗光合羧化效率,加快CO2同化速率[62]。这可能是通过抑制Rubisco的降解、诱导CA 的从头合成来提高Rubisco和CA的活性来实现的[9,63]。
水杨酸对光合碳同化酶的作用同样存在着明显的剂量效应。低浓度水杨酸(0.01 mmol·L-1)喷施芥菜或者浸泡处理小麦种子,叶片的CA 活性能够显著提高,但是高浓度的水杨酸则抑制该酶的活性[25-26]。Pancheva等[64]的研究发现,随着水杨酸浓度的增加Rubisco的活性不断降低,且发现高浓度的水杨酸(1~5 mmol·L-1)使大麦Rubisco的活性降低是由于Rubisco蛋白水平降低引起的[63]。
5 总结和展望
水杨酸作为一种信号分子,对植物许多生理代谢都有直接或间接的影响。总结大量的研究发现这样一种现象,正常生长条件下一定浓度的水杨酸处理可能不会影响植物光合速率甚至会降低光合速率,但是当有环境胁迫存在时,水杨酸具有维持较高光合速率的作用。水杨酸对植物光合作用的影响因环境、外源水杨酸水平和植物种类等不同而不同。陈志强等[65]用不同浓度的水杨酸处理野生型拟南芥和胁迫条件下内源水杨酸含量较高的cpr5突变体和较低的eds-4突变体发现,不高于300μmol·L-1较低浓度的外源水杨酸对野生型拟南芥和eds-4突变体的光合作用都有一定的促进作用,而对cpr5叶片的光合会产生抑制,形成一种胁迫,高浓度的水杨酸对3种拟南芥叶片均形成胁迫,进而降低叶片光合效能。可以推测,不同浓度水杨酸对不同植物种类或不同基因型植物的不同影响与植物自生内源水杨酸水平相关,这构成了植物对水杨酸的敏感性。
综合上述水杨酸对光合作用的影响,我们不难推测,处理初期水杨酸对光合作用的影响可能首先表现在调节气孔运动上(图2)。水杨酸使叶片气孔关闭,CO2进入受阻,卡尔文循环受到抑制,使ATP和NADPH 积累从而激发ΔpH 的形成,改变光合电子传递和光合能量转化。但随着处理时间的增长,水杨酸诱导产生的ROS及其他信号可诱导光合相关基因表达,调节光合相关酶活性,从而影响光合作用其他因素如光合色素含量、光合器官性能及碳同化效率等,进一步改变光合电子传递和光合能量耗散。水杨酸处理初期,植物光合速率会因为气孔关闭而有所降低,但水杨酸处理的后期效果却因植物种类或环境条件的不同而表现出不同的效果。水杨酸单独处理时可能会降低植物光合速率,但适宜浓度的水杨酸却可以作为一种胁迫信号增强植物抗逆性,从而提高逆境下植物的光合速率。
同时,由于水杨酸对植物生长发育影响的剂量效应及环境效应,使得水杨酸在农业生产中的有效应用受到限制,寻求一个快捷灵敏并能反应不同环境下、不同植物种类对水杨酸敏感性的指标,对水杨酸投入生产非常重要。而光合作用对环境变化敏感,能够很好地反映植物的生长状况。然而,目前有关水杨酸调节光合作用的具体机制还不清楚,水杨酸调节光合作用的信号途径、对光合作用相关基因表达的影响及调节基因表达的机制等方面还需要更深入的探索。怎样用光合作用指标的变化来准确反 应植物对水杨酸的敏感性还需要进一步的探索。

图2 水杨酸对植物光合作用影响的示意图Fig.2 Schematic representation of the effects of SA on photosynthetic processes
[1] HAYAT S,AHMAD A,ALYEMENI M N,etal.Salicylic Acid-Mediated Abiotic Stress Tolerance[M]//HAYAT S,AHMAD A,ALYEMENI M N.Salicylic Acid.Springer Netherlands,2013:183-247.
[2] HAYAT Q,HAYAT S,IRFAN M,etal.Effect of exogenous salicylic acid under changing environment:A review[J].Environmentaland ExperimentalBotany,2010,68(1):14-25.
[3] YUAN S,LIN H H.Role of salicylic acid in plant abiotic stress[J].Z.Naturforsch.C,2008,63:313-320.
[4] JANDA T,GONDOR O K,YORDANOVA R,etal.Salicylic acid and photosynthesis:signaling and effects[J].ActaPhysiologiaePlantarum,2014,36(10):2 537-2 546.
[5] WILDERMUTH M C,DEWDNEY J,WU G,etal.Isochorismate synthase is required to synthesize salicylic acid for plant defense[J].Nature,2001,414(6 863):562-565.
[6] SLAYMAKER D H,NAVARRE D A,CLARK D,etal.The tobacco salicylic acid-binding protein 3(SABP3)is the chloroplast carbonic anhydrase,which exhibits antioxidant activity and plays a role in the hypersensitive defense response[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2002,99(18):11 640-11 645.
[7] KHAN W,PRITHIVIRAJ B,SMITH D L.Photosynthetic responses of corn and soybean to foliar application of salicylates[J].Journalof PlantPhysiology,2003,160(5):485-492.
[8] RIVAS-SAN V M,PLASENCIA J.Salicylic acid beyond defence:its role in plant growth and development[J].JournalofExperimental Botany,2011,62(10):3 321-3 338.
[9] AFTAB T,MASROOR M,KHAN A,etal.Salicylic acid acts as potent enhancer of growth,photosynthesis and artemisinin production inArtemisiaannuaL.[J].JournalofCropScienceandBiotechnology,2010,13(3):183-188.
[10] JANDA K,HIDEG E,SZALAI G,etal.Salicylic acid may indirectly influence the photosynthetic electron transport[J].Journalof PlantPhysiology,2012,169(10):971-978.
[11] WANG L J,FAN L,LOESCHER W,etal.Salicylic acid alleviates decreases in photosynthesis under heat stress and accelerates recovery in grapevine leaves[J].BMCPlantBiology,2010,10:34.
[12] UZUNOVA A N,POPOVA L P.Effect of salicylic acid on leaf anatomy and chloroplast ultrastructure of barley plants[J].Photosynthetica,2000,38(2):243-250.
[13] XU P(徐 萍),LI J(李 进),LH Y(吕海英),etal.Effect of salicylic acid on stomata aperture of epidermis inAmmodendronargenteumcotyled under drought stress[J].PlantPhysiologyJournal(植物生理学报),2014,50(4):510-518(in Chinese).
[14] LI F L(李凤玲),HE J H(何金环).Effect of salicylic acid on stomatal movement and K+current on plasma membrane of guard cell inViciafabaL.[J].JournalofNorthwestA&FUniversity(Natural Science Edition)(西北农林科技大学学报˙自然科学版),2009,37(7):191-198(in Chinese).
[15] RAI V,SHAMA S,SHARAA S.Reversal of ABA-induced stomatal closure by phenolic compounds[J].JournalofExperimentalBotany,1986,37(1):129-134.
[16] WANG X L(王晓黎),CUI SH M(崔世茂),ZHANG ZH G(张志刚),etal.Regulation of salicylic acid on stomata aperture of epidermis in cucumber cotyledon[J].ActaBotanicaBoreali-occidentaliaSinica(西北植物学报),2011,31(2):305-314(in Chinese).
[17] 王棚涛.过氧花氢参与了水杨酸诱导的蚕豆气孔关闭过程[D].河南开封:河南大学,2001.
[18] KHOKON A R,OKUMA E,HOSSAIN M A,etal.Involvement of extracellular oxidative burst in salicylic acid-induced stomatal closure inArabidopsis[J].Plant,Cell&Environment,2011,34(3):434-443.
[19] LIU X,ZHANG SH Q,LOU CH H.Involvement of nitric oxide in the signal transduction of salicylic acid regulating stomatal movement[J].ChineseScienceBulletin,2003,48(5):449-452.
[21] LAWSON T.Guard cell photosynthesis and stomatal function[J].NewPhytologist,2009,181(1):13-34.
[22] LIU X(刘 新),MENG F X(孟繁霞),ZHANG SH Q(张蜀秋),etal.Ca2+is involved in the signal transduction during stomatal movement inViciafabaL.induced by salicylic acid[J].JournalofPlantPhysiologyandMolecularBiology(植物生理与分子生物学学报),2003,29(1):59-64(in Chinese).
[23] LIU X(刘 新),ZHANG SH Q(张蜀秋).Relationships between salicylic acid,jasmonic acid and ethylene in the regulation of stomatal movements ofViciafabaL.[J].ActaPhytophysiologicaSinaica(植物生理学报),2000,26(6):487-491(in Chinese).
[24] HAYAT S,AHMAD A,ALYEMENI M N,etal.Endogenous ABA as a Hormonal Intermediate in the Salicylic Acid Induced Protection of Wheat Plants Against Toxic Ions[M]//HAYAT S,AHMAD A,ALYEMENI M N.Salicylic Acid.Springer Netherlands,2013:119-140.
[25] HAYAT S,FARIDUDDIN Q,ALI B.Effect of salicylic acid on growth and enzyme activities of wheat seedlings[J].ActaAgronomica Hungarica,2005,53(4):433-437.
[26] FARIDUDDIN Q,HAYAT S,AHMAD A.Salicylic acid influences net photosynthetic rate,carboxylation efficiency,nitrate reductase activity and seed yield inBrassicajuncea[J].Photosynthetica,2003,41(2):281-284.
[28] MOHAREKAR S T,LOKHANDE S D,HARA T,etal.Effects of salicylic acid on chlorophyll and carotenoid contents on wheat and moong seeding[J].Photosynthetica,2003,41(2):315-317.
[29] ZHANG H H(张会慧),JIN W W(金微微),MAO W J(毛卫佳),etal.Effects of exogenous salicylic acid on cell membrane and chlorophyll fluorescence characteristics in leaves of tobacco seedling under drought stress[J].JournalofDesertResearch(中国沙漠),2012,32(1):117-121(in Chinese).
[30] CUI X M(崔秀妹),LIU X B(刘信宝),LI Z H(李志华),etal.Effects of salicylic acid on growth and photosynthetic characteristics ofMelilotoidesruthenicain branching stage under different water stress[J].ActaAgrestiaSinica(草地学报),2013,21(1):127-134(in Chinese).
[31] SUN D Z(孙德智),YANG H S(杨恒山),PENG J(彭 靖),etal.Effects of exogenous salicylic acid and nitric oxide on growth,photosynthesis,and ion distribution in tomato seedlings under NaCl stress[J].ActaEcologicaSinica(生态学报),2014,34(13):3 519-3 528(in Chinese).
[32] ARFAN M,ATHAR H R,ASHRAF M.Does exogenous application of salicylic acid through the rooting medium modulate growth and photosynthetic capacity in two differently adapted spring wheat cultivars under salt stress?[J].JournalofPlantPhysiology,2007,164(6):685-694.
[33] XUE J P(薛建平),WANG X(王 兴),ZHANG A M(张爱民),etal.Effects of salicylic acid on photosynthesis and chlorophyll fluorescence inPinelliaternateleaves under high temperature[J].ChinesePharmaceuticalJournal(中国药学杂志),2008,43(24):1 855-1 858(in Chinese).
[34] ZHANG Y,XU S,YANG S,etal.Salicylic acid alleviates cadmium-induced inhibition of growth and photosynthesis through upregulating antioxidant defense system in two melon cultivars(CucumismeloL.)[J].Protoplasma,2015,252(3):911-924.
[35] VAN ASSCHE F,CLIJSTERS H.Effects of metals on enzyme activity in plants[J].Plant,Cell&Environment,1990,13(3):195-206.
[36] ANANIEVA E A,ALEXIEVA V S,POPOVA L P.Treatment with salicylic acid decreases the effects of paraquat on photosynthesis[J].JournalofPlantPhysiology,2002,159(7):685-930.
[37] RADWAN D E,SOLTAN D M.The negative effects of clethodim in photosynthesis and gas-exchange status of maize plants are ameliorated by salicylic acid pretreatment[J].Photosynthetica,2012,50(2):171-179.
[38] MA P F(马培芳),LI L H(李利红),YANG Y J(杨亚军),etal.Effects of salicylic acid on D1protein phosphorylation and PSⅡperform in wheat leaf chloroplasts under high temperature and high light stress[J].ChineseJournalofAppliedEcology(应用生态学报),2008,19(12):2 632-2 636(in Chinese).
[39] ZHENG J J(郑静静),ZHAO H J(赵会杰),HU W W(胡巍巍),etal.Effect of heat and high irradiation stress on Deg1protease and D1 protein in wheat chloroplasts and regulation role of salicylic acid[J].ActaEcologicaSinica(生态学报),2013,33(9):2 930-2 935(in Chinese).
[40] LUO M H,YUAN S,CHEN Y E,etal.Effects of salicylic acid on the photosystem 2of barley seedlings under osmotic stress[J].BiologiaPlantarum,2009,53(4):663-669.
[41] MORADKHANI S,KHAVARI NEJAD R A,DILMAGHANI K,etal.Effects of salicylic acid treatment on cadmium toxicity and leaf lipid composition in sunflower[J].JournalofStressPhysiology&Biochemistry,2012,8(4):78-89.
[42] LI T L(李天来),LI M(李 淼),LI Y Q(李益清),etal.Effect of CaCl2and salicylic on the photosynthesis in the leaves of tomato under daytime sub-high temperature[J].ActaAgricultureaBoreali-occidentalisSinica(西北农业学报),2009,18(4):284-289(in Chinese).
[43] HAO J H(郝敬虹),YI Y(易 旸),SHANG Q M(尚庆茂),etal.Effects of exogenous salicylic acid on membrane lipid peroxidation and photosynthetic characteristics ofCucumisstativusseedlings under drought stress[J].ChineseJournalofAppliedEcology(应用生态学报),2012,23(3):717-723(in Chinese).
[44] 崔秀妹.水分胁迫下水杨酸对扁蓿豆生长、光合生理及饲草产量和品质的影响[D].南京:南京农业大学,2012.
[45] 李 明.外源水杨酸对花椒光合作用及抗旱能力的影响[D].兰州:甘肃农业大学,2010.
[46] SAHU G K,KAR M,SAHAT SC.Electron transport activities of isolated thylakoids from wheat plants grown in salicylic acid[J].Plant Biology,2002,4(3):321-328.
[47] WANG X L(王晓黎),HAO J H(郝敬虹),DONG CH J(董春娟),etal.Effect of exogenous salicylic acid on PSⅡactivity and absorbed light allocation in leaves of cucumber seedling[J].ActaBotanicaBoreali-OccidentaliaSinica(西北植物学报),2011,31(8):1 644-1 650(in Chinese).
[48] 易 旸.水杨酸对水分胁迫下黄瓜(CucumissativusL.)幼苗光合及氮代谢的调节作用[D].北京:中国农业科学院,2009.
[49] ZHANG Y H(张扬欢),SUN J CH(孙金春),WEN Q(温 泉),etal.Effects of acetosalicylic acid on photosynthesis and antioxidant enzyme activities inCatharanthusroseusleaves under enhanced UV-B radiation[J].JournalofSouthwestUniversity(Natural Science Edition)(西南大学学报·自然科学版),2011,33(2):17-22(in Chinese).
[50] SUN Y(孙 艳),FAN A L(樊爱丽),XU W J(徐伟君).Effects of salicylic acid and oxalate on photosynthetic system and xanthophylls cycle in cucumber leaves under photooxidative stress[J].ActaHorticulturaeSinica(园艺学报),2005,(6):1 034-1 038(in Chinese).
[51] MATOS A R,MENDES A T,SCOTTI-CAMPOS P,etal.Study of the effects of salicylic acid on soybean mitochondrial lipids and respiratory properties using the alternative oxidase as a stress-reporter protein[J].PhysiologiaPlantarum,2009,137(4):485-497.
[52] DAI Q L(代其林),GUO Y M(郭云梅),HE L(何 礼),etal.A comparative study on induction of the CN-resistant respiration and the expression of alternative oxidase in different organs of bean seedling treated by salicylic acid[J].JournalofSichuanUniversity(Natural Science Edition)(四川大学学报·自然科学版),2004,41(1):174-178(in Chinese).
[53] LEI T,FENG H,SUN X,etal.The alternative pathway in cucumber seedlings under low temperature stress was enhanced by salicylic acid[J].PlantGrowthRegulation,2010,60(1):35-42.
[54] DINAKAR C,RAGHAVENDRA A S,PADMASREE K.Importance of AOX pathway in optimizing photosynthesis under high light stress:role of pyruvate and malate in activating AOX[J].PhysiologiaPlantarum,2010,139(1):13-26.
[55] MENG X L(孟祥龙),ZHANG L T(张立涛),ZHANG Z SH(张子山),etal.Role of mitochondrial alternative oxidase(AOX)pathway in photoprotection in Rumex K-1leaves[J].ChinesesJournalofAppliedEcology(应用生态学报),2012,23(7):1 803-1 808(in Chinese).
[56] YOSHIDA K,WATANABE C K,TERASHIMA I,etal.Physiological impact of mitochondrial alternative oxidase on photosynthesis and growth inArabidopsisthaliana[J].Plant,CellandEnvironment,2011,34(11):1 890-1 899.
[57] ZHANG L T,GAO H Y,ZHANG Z S,etal.Multiple effects of inhibition of mitochondrial alternative oxidase pathway on photosynthetic apparatus inRumexK-1leaves[J].BiologiaPlantarum,2012,56(2):365-368.
[58] HUANG Q Q(黄清泉),SUN X(孙 歆),ZHANG N H(张年辉),etal.Effects of salicylic acid on leaves of cucumber seedlings under water stress[J].ActaBotanicaBoreali-OccidentaliaSinica(西北植物学报),2004,24(12):2 202-2 207(in Chinese).
[59] LI L(李 亮),DONG C J(董春娟),SHANG Q M(尚庆茂).Role of endogenous salicylic acid in responding of cucumber leaf photosynthetic systems to low temperature stress[J].ActaHorticulturaeSinica(园艺学报),2013,40(3):487-497(in Chinese).
[60] KRANTEV A,YORDANOVA R,JANDA T,etal.Treatment with salicylic acid decreases the effect of cadmium on photosynthesis in maize plants[J].JournalofPlantPhysiology,2008,165(9):920-931.
[61] POPOVA L P,MASLENKOVA L T,YORDANOVA R Y,etal.Exogenous treatment with salicylic acid attenuates cadmium toxicity in pea seedlings[J].PlantPhysiologyandBiochemistry,2009,47(3):224-231.
[62] FARIDUDDIN Q,HAYAT S,AHMAD A.Salicylic acid influences net photosynthetic rate,carboxylation efficiency,nitrate reductase activity,and seed yield inBrassicajuncea[J].Photosynthetica,2003,41(2):281-284.
[63] PANCHEVA T V,POPOVA L P.Effect of salicylic acid on the synthesis of ribulose-1,5-bisphosphate carboxylase/oxygenase in barley leaves[J].JournalofPlantPhysiology,1998,152(4-5):381-386.
[64] PANCHEVA T V,POPOVA L P,UZUNOVA A M.Effect of salicylic acid on growth and photosynthesis in barley plants[J].Journal ofPlantPhysiology,1996,149(1-2):57-63.
[65] CHEN Z Q(陈志强),CHEN W L(陈文利),YANG CH W(阳成伟).Effects of exogenous salicylic acid on photosynthesis inArabidopsisleaves based on fluorescence spectra and delayed fluorescence technique[J].SpectroscopyandSpectralAnalysis(光谱学与光谱分析),2009,29(8):2 208-2 212(in Chinese).
