茉莉酸与茉莉酸甲酯预处理对干旱胁迫下棉花种子萌发和种苗生理特性的影响
2015-07-04张雪妍李付广张富春
杨 艺,常 丹,王 艳*,张雪妍,李付广,张富春
(1棉花生物学国家重点实验室,河南安阳455000;2新疆生物资源基因工程重点实验室,新疆大学 生命科学与技术学院,乌鲁木齐830046)
中国西北地区是主要的干旱荒漠区,平均每年的受旱面积约2 100万hm2[1]。新疆栽种的棉花面积和产量占全国的一半左右,作为典型的干旱、半干旱地区,棉花的生长发育在任何时期都可能遭受干旱胁迫的影响,因而干早已经成为影响新疆棉花生产的主要灾害之一[2]。
茉莉酸类物质(JAs)是广泛存在于植物体内的一类生长调节物质,包括茉莉酸(jasmonic aicd,JA)、茉莉酸甲酯(methyl jasmonat,MeJA)及其相关衍生物,近年研究发现JA 和MeJA 均能够参与植物的抗逆反应[3-4]。茉莉酸类物质具有应答外界刺激,传导逆境信号及启动抗逆基因表达等生理效应,并在抵御非生物胁迫和生物胁迫方面发挥作用,外施JA 及MeJA 在一定程度上能减缓干旱胁迫对植株造成的伤害,有效地提高植株的抗旱能力[5-7]。Ranjan等发现,0.1~1mmol/L 的外源JA 处理可以促进参薯种子的萌发,而用30~100mmol/L JA处理则抑制种子萌发,说明低浓度JA 对种子萌发有促进作用,而高浓度有抑制作用[8]。邹燕等研究表明,外源MeJA 能显著提高渗透胁迫下油菜种子发芽率、发芽势、发芽指数和活力指数,降低丙二醛(MDA)含量,在一定程度上能缓解渗透胁迫造成的氧化损伤,维持细胞质膜的完整性,有效促进渗透胁迫下油菜种子的萌发和幼苗生长[9]。潘瑞炽等用MeJA 处理花生幼苗后发现,其植株矮化,叶小而厚,叶片贮水细胞变大,蒸腾减弱,内源脱落酸和脯氨酸含量增多,因此减少了水分丧失,从而加大叶片中水分的贮存,提高了幼苗的抗旱性[10]。
茉莉酸类物质JA 和MeJA 对植物生长具有极为广谱的生理效应,研究显示MeJA 对水稻和油菜种子的萌发具有调节作用,但JA 和MeJA 对干旱胁迫下棉花种子的萌发和生化特性的影响未见报道。本试验以新疆主栽棉花品种‘新陆早17’(XLZ17)为实验材料,研究外源施加JA 及MeJA对干旱胁迫下棉花种子萌发、种苗生长、脯氨酸含量以及叶片氧化损伤的影响,旨在探讨茉莉酸和茉莉酸甲酯对棉花抗逆性的调控作用,为其实践应用奠定理论基础。
1 材料和方法
1.1 材 料
试验材料为新疆棉花主栽品种‘新陆早17’(XLZ17),是早熟陆地抗病品系,在新疆早熟棉区生育期120d左右。试验种子由新疆农业科学院经济作物研究所提供。
1.2 种子处理
1.2.1 PEG-6000浓度筛选 挑选籽粒饱满、大小一致棉花种子,用70%乙醇消毒1min,蒸馏水冲洗3~4次,再用15%过氧化氢浸种5h,蒸馏水冲洗3~4次,然后分别播种到底部垫有2层滤纸(分别加有4 mL 14.5%、18.7%、23%、25.1%、27.4%、29.6%和31.7%胁迫溶液)培养皿中,以蒸馏水培养种子为对照(CK1),种子上覆盖2 层滤纸(加有与底部相应浓度2mL胁迫溶液)保湿于(25±2)℃培养箱中萌发。培养过程中光暗周期为光照16h/d,光照强度为56μmol·m-2·s-1,隔天揭开保湿滤纸,底部加入2mL对应浓度胁迫处理液,最后在保湿滤纸再加入2 mL 胁迫处理液以保持湿润,持续胁迫,直至萌发终止。每处理播种20粒,4次重复。
1.2.2 JA 和MeJA 预处理 棉花种子用上述方法消毒后,分别采用不同浓度JA 和MeJA[0(蒸馏水)、0.025、0.25、2.5、25 和250μmol/L]处理液浸种36h,而后播种到底部垫有2 层滤纸(加有4 mL 23%PEG-6000胁迫溶液)的培养皿中,以23%PEG-6000处理的种子为对照(CK2),种子上面覆盖2 层滤纸(加有2mL 23%PEG-6000的胁迫溶液),按上述条件在培养箱中萌发,直至萌发终止,每个处理播种20粒,4次重复。
1.3 测定指标及方法
1.3.1 种子萌发率和根长 处理后以胚根大于种子长度的1/2为萌发标准,每天统计发芽个数,隔天测量种子的根长,直至萌发数不再改变则终止萌发(第9天)。第4天计算发芽势,第9天计算发芽率、发芽指数和活力指数。
发芽势=种子发芽试验初期(第4天)全部正常发芽种子数/供试种子数×100%
发芽率=发芽终期全部正常发芽的种子数/供试种子×100%
发芽指数=∑Gt/Dt
式中,Gt为第t天发芽数,Dt为相应发芽试验天数
活力指数=发芽指数×种苗长度(全长)
1.3.2 根系和植株相对水含量 待萌发终止后分别取棉花种苗及其新鲜的根,用吸水纸吸干表面水分,称其鲜重(Wf);然后将其放入蒸馏水中浸泡数小时,期间不断称重,直至达到恒重为其饱和鲜重(Wt);最后将材料放入150℃的烘箱中,烘干至恒重,然后分别称干重(Wd),试验均重复4次。
相对水含量=(Wf-Wd)/(Wt-Wd)×100%
自然饱和亏=1-相对水含量
1.3.3 种苗根活力、游离脯氨酸、MDA含量及渗透势 萌发终止后(第9天)取种苗根部,采用TTC法测定种苗根活力,取整株幼苗测定游离脯氨酸、丙二醛(MDA)含量及渗透势。游离脯氨酸含量采用磺基水杨酸提取、酸性茚三酮染色法测定,MDA 含量采用硫代巴比妥酸法测定[11-12],渗透势采用组织研磨器破碎种苗细胞,用冰点渗透压仪测定组织液的渗透压。所用试剂均为分析纯,试验均重复3次。
1.4 数据统计分析
用Microsoft Excel 2003和prism 5.0 分析软件进行统计学分析,采用ANOVA 的方法比较均值之间的差异显著性,并采用Turkey test进行多重比较(P<0.05)。图表中所有数据均表示为x±s。
2 结果与分析
2.1 干旱胁迫对棉花种子萌发的影响
如图1所示,利用不同浓度PEG-6000对‘新陆早17’(XLZ17)棉花种子进行胁迫,棉花种子的萌发率随着PEG-6000浓度的升高而逐渐降低,直到31.7%时降为零。当PEG-6000浓度在23%时,萌发率为46.67%,接近萌发率一半,是胁迫抑制萌发的节点,因而本试验选取该浓度作为棉花种子干旱处理的胁迫浓度。
2.2 外源JA及MeJA预处理对干旱胁迫下棉花种子萌发的影响
图1显示,棉花种子萌发率随PEG 浓度升高而显著降低,发芽率下降约一半时PEG 浓度为23%(CK2)。由表1可以看出,23%PEG 模拟干旱胁迫条件下,预处理XLZ17棉花种子各项萌发指标均随着JA 和MeJA 浓度的增加而先升高后降低,且除250μmol/L浓度外均有不同程度促进作用,但仍明显低于蒸馏水对照。其中,与CK2(23% PEG)相比,0.025和0.25μmol/L JA 预处理的种子萌发率和活力指数、0.025μmol/L JA 预处理的发芽势、0.25μmol/L JA 预处理发芽指数均显著升高(P<0.05),其余浓度预处理各发芽指数大多无显著变化;发芽率和发芽势均在0.025μmol/L JA 下最高,比对照分别提高46.41%和49.99%,而发芽指数和活力指数均在0.25μmol/L JA 处理下最高,分别比对照提高68.14%和190.29%。对于MeJA 预处理而言,种子萌发率、发芽势、发芽指数和活力指数均在2.5μmol/L 浓度处理下达到最大值,并分别显著高 于CK2对 照 组49.99%、72.70%、51.29%、150.61%,其余浓度处理的发芽指数大多与CK2对照无显著差异。可见,适宜浓度的JA 和MeJA 预处理能一定程度上促进干旱胁迫下棉花种子的萌发,浓度过高则会减弱这种促进作用,甚至转为显著抑制作用,并以0.025、0.25μmol/L JA和2.5μmol/L MeJA 的处理效果最佳,但各浓度JA 和MeJA 预处理均不能完全解除干旱胁迫的影响。

图1 不同浓度PEG-6000胁迫下棉花(XLZ17)种子萌发的变化Fig.1 The seed germination ratio of cotton(XLZ17)under different PEG-6000concentrations
2.3 外源JA 及MeJA预处理对干旱胁迫下棉花根和种苗水分含量的影响
JA 和MeJA 预处理对干旱胁迫下棉花种苗和根的水分含量影响不同(表2)。与CK2对照相比,0.25 和2.5μmol/L JA 和0.025、0.25、2.5、25 μmol/L MeJA 预处理的棉花种子胚根相对含水量显著增加,而自然饱和亏显著降低(P<0.05),且JA 和MeJA 的最佳浓度均为2.5μmol/L,此浓浓度下相对含水量比CK2对照分别提高20.21%和32.86%,自然饱和亏分别比PEG 对照降低了51.54%和83.78%;其他浓度的JA 和MeJA 预处理虽然对胚根的相对含水量和自然饱和亏都有一定的促进作用,但随着浓度升高促进程度开始降低,直至250μmol/L JA 处理对种子水分含量表现出抑制作用,但与CK2对照相比无显著性差异。就整体而言,MeJA 处理对种子水分的作用效果要强于JA。另外,干旱胁迫下JA 和MeJA 预处理对棉花种苗的相对水含量和自然饱和亏均无显著影响,这可能与干旱胁迫下种子不能挣脱种皮密切相关。
2.4 干旱胁迫下外源JA 及MeJA对棉花种苗根长和根活力的影响
在干旱胁迫条件下,JA 和MeJA 处理棉花种子根长均随浓度增加而呈先升高后降低的变化趋势,并分别在0.25和2.5μmol/L 浓度下达到最大值(图2)。其中,0.025、0.25、2.5和25μmol/L JA,以及0.025、0.25和2.5μmol/L MeJA 处理的种子根长均比PEG 对照显著增加(P<0.05),增加幅度分别为21.92%~72.07%和29.95%~61.86%;而25μmol/L MeJA 处理的种子根长虽比CK2对照增加但无显著性差异;当JA 和MeJA 的浓度升高至250μmol/L时根的伸长反而受到了抑制,但与对照组相比均无显著性差异。外源JA和MeJA预处理整体上对棉花根长的作用效果一致,即适宜浓度促进,过高浓度则抑制。

表1 JA和MeJA预处理对干旱胁迫下棉花(XLZ17)种子萌发的影响Table 1 Effect of JA and MeJA pretreatment on seed germination of cotton(XLZ17)under drought stress
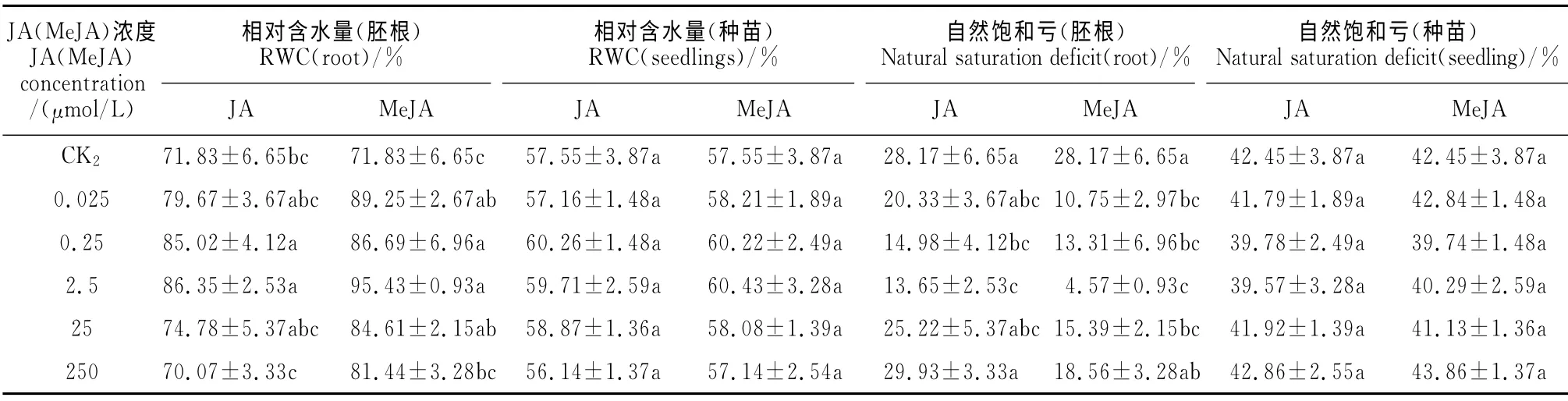
表2 JA和MeJA预处理对干旱胁迫下棉花(XLZ17)根和种苗水分含量的影响Table 2 Effect of JA and MeJA pretreatment on water content of root and seedling of cotton(XLZ17)under drought stress
另外,在干旱胁迫条件下,各浓度JA 和MeJA预处理均可显著提高棉花种子的根系活力(P<0.05),且均以2.5μmol/L 浓度的促进作用最佳,与CK2对照相比分别提高266.68%和219.26%,但随着JA 和MeJA 浓度继续升高,这种对种子根系活力促进作用随之减小(图3);尽管最适浓度下JA 处理的种子根系活力比MeJA 高,但就整体上MeJA 处理对种子根系活力的促进作用要比JA 处理更大。
2.5 干旱胁迫下外源JA 及MeJA 对棉花种苗脯氨酸含量和渗透势的影响

图2 JA 和MeJA 预处理对干旱胁迫下棉花(XLZ17)种苗根长的影响Fig.2 Effect of JA and MeJA pretreatment on root length of cotton(XLZ17)under drought stress

图3 JA 和MeJA 预处理对干旱胁迫下棉花(XLZ17)种苗根活力的影响Fig.3 Effect of JA and MeJA pretreatment on root activity of cotton(XLZ17)under drought stress
在干旱胁迫条件下,除250μmol/L 的MeJA处理外,各浓度JA和MeJA处理均可不同程度增加棉花种苗的脯氨酸含量(图4,A)。其中,0.025、0.25和25μmol/L JA处理的种苗的脯氨酸含量比CK2对照组显著上升(P<0.05),并以0.25μmol/L JA 处理脯氨酸含量最高(33.47μg/g),相较CK2对照组增加了50.49%;对于MeJA 的处理而言,0.025、0.25和2.5μmol/L也均能显著增加种苗脯氨酸含量,且以2.5μmol/L MeJA 处理效果最佳,相较CK2对照组增加了67.63%;其他浓度的JA和MeJA 预处理虽然也能增加种苗的脯氨酸含量,但随着浓度继续升高脯氨酸含量的增加幅度随之减小,甚至250μmol/L MeJA 处理种苗脯氨酸含量比CK2对照降低,但无显著性差异。就整体表现而言,MeJA 处理组较JA 处理组种苗中的脯氨酸含量更高。
另外,JA 和MeJA 预处理可使干旱胁迫下棉花种苗的渗透势降低(图4,B)。0.25和2.5μmol/L JA 处理的棉花种苗渗透势比CK2对照显著下降(P<0.05),并以0.25μmol/L JA 处理种苗的渗透势最低,相较CK2对照组降低了19.72%,其他浓度的JA 均能降低种苗渗透势,但与CK2对照组相比无显著性差异;对于MeJA 处理而言,0.25、2.5和25 μmol/L处理的种苗渗透势均比CK2对照组显著降低,且以2.5μmol/L MeJA 处理渗透势最低,相较CK2对照组降低了19.40%,而250μmol/L MeJA处理种苗的渗透势却比CK2对照组升高,但未达到无显著水平。就整体表现而言,MeJA处理组对种苗降低细胞渗透势及增强吸水能力的作用效果较JA 处理组更明显。
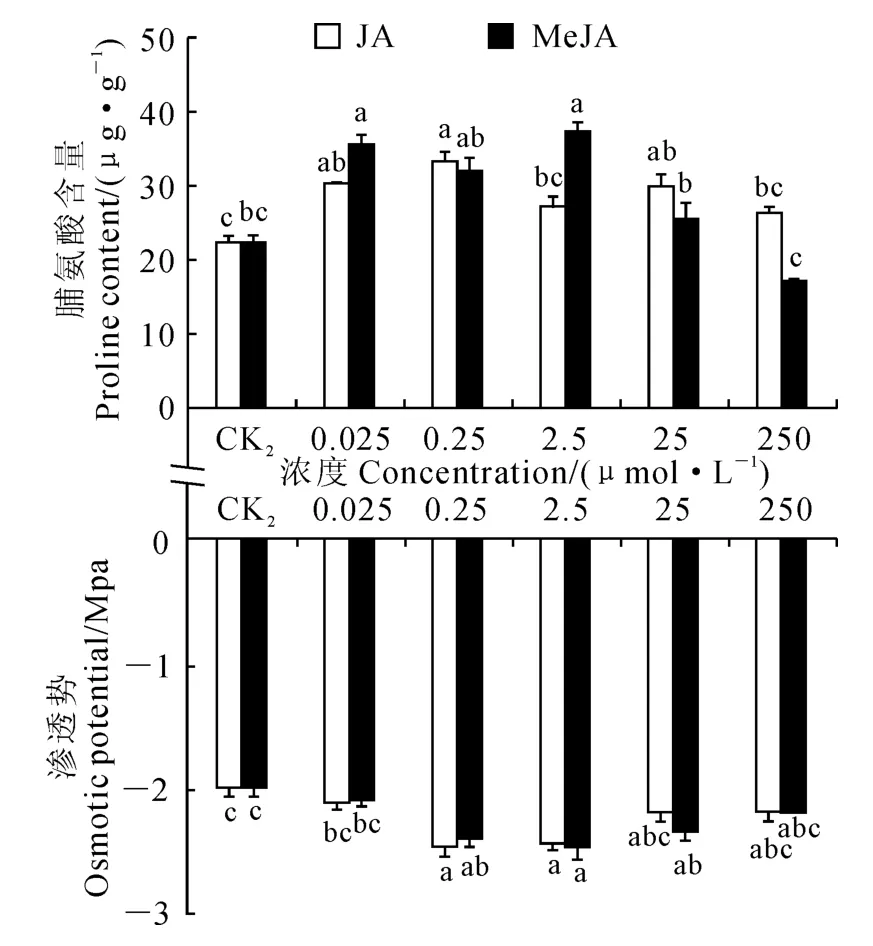
图4 JA 和MeJA 预处理对干旱胁迫下棉花(XLZ17)种苗脯氨酸含量和渗透势的影响Fig.4 Effect of JA and MeJA pretreatment on proline content and osmotic potential of cotton(XLZ17)under drought stress
2.6 外源JA 及MeJA对干旱胁迫下棉花种苗丙二醛含量的影响
图5表明,在干旱胁迫条件下,除250μmol/L JA 的处理外,其他浓度的JA 和MeJA 处理均可显著降低棉花种苗的丙二醛(MDA)含量(P<0.05)。其中,当JA 浓度为25μmol/L、MeJA 浓度为0.25 μmol/L 时,棉花种苗的MDA 含量水平最低,比CK2对照组分别显著降低了43.13%和49.05%;整体而言,外源MeJA 处理减轻棉花种苗内膜脂过氧化物的效果比外源JA 处理更明显。
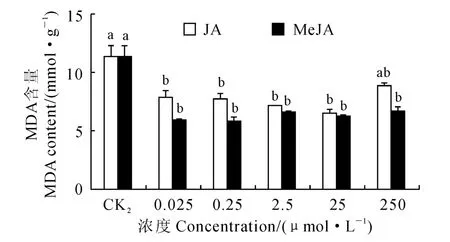
图5 JA 和MeJA 预处理对干旱胁迫下棉花(XLZ17)种苗MDA 含量的影响Fig.5 Effect of JA and MeJA pretreatment on MDA content of cotton(XLZ17)under drought stress
3 讨 论
茉莉酸类物质作为一种植物信号转导分子,不仅与种子萌发、开花、果实成熟、衰老等各种生长发育过程密切相关而且在植物胁迫防御中也起重要的作用[13-15]。研究发现与其他植物激素一样,微量的JA 和MeJA 便可以在植物的生长发育及代谢过程中起到重要作用,但是不同浓度对植物有不同的影响,适宜浓度会促进植物的生长或缓解胁迫对植物造成的伤害,高浓度则可能会起抑制作用[16]。
本研究采用不同浓度的PEG-6000模拟干旱胁迫处理新疆主栽棉花‘新陆早17’,棉花种子发芽率显著降低,最终选取胁迫抑制萌发的节点23%PEG作为本试验的胁迫浓度。种子萌发试验中,适宜浓度的JA和MeJA均可在一定程度上缓解干旱胁迫对棉花种子的萌发抑制,且可显著促进种子的萌发率、发芽势、发芽指数和活力指数,这与MeJA 对油菜种子[9]和紫苏种子[17]萌发影响的研究结果相一致。在本研究浓度范围内,MeJA 的最适浓度比JA高且作用效果也较明显,然而随着JA 和MeJA 浓度的升高,其对干旱胁迫下棉花种子萌发的促进作用也逐渐减弱,甚至高浓度JA 和MeJA 对种子的萌发有一定的抑制作用,表明植物激素具有微量高效的特点,浓度过高则抑制植物的生长。此外,经一定浓度JA 和MeJA 处理能促进棉花种苗根的伸长以及增强根系活力,这与Hummel等[18]研究结果一致。植物体内脯氨酸含量的升高能够降低细胞水势,改变细胞渗透势,保持或吸收水分[19]。本研究结果表明,经JA 和MeJA 处理能显著增加种苗脯氨酸含量,降低渗透势,这与董桃杏等[20]研究结果一致。由此增强了棉花胚根的抗脱水能力,提高相对水含量,减缓了干旱胁迫对棉花生长的影响,从而提高其抗旱性,且整体上MeJA 的作用效果要强于JA 处理,这与Brossa[21]和潘瑞炽等[22]研究结果基本一致。
干旱等胁迫条件下植物体内会产生活性氧物质而引发膜脂过氧化,丙二醛MDA 是膜脂过氧化的最终分解产物,它能与酶蛋白发生链式反应聚合,使膜系统变性,影响膜结合酶的功能,引起膜伤害。本研究结果显示,干旱胁迫使棉花种苗MDA 的含量升高,而经JA 和MeJA 处理能显著降低MDA 的含量,有效缓解干旱胁迫造成的氧化损伤,这与邹燕[9]和董桃杏[23]等研究结果一致。
综上所述,适宜浓度的外源JA 和MeJA 能缓解干旱胁迫对棉花‘新陆早17’的伤害,其主要可能通过增加胁迫下种子根的水分含量,提高根系活性,增加渗调物质的含量及减少干旱胁迫造成的氧化损伤等方式进行调节;同时,MeJA 处理的缓解效果要比JA 处理更好,这可能与JA 发生甲基化或与氨基酸结合时活性受到影响有关[24]。在本实验模拟的干旱胁迫条件下,‘新陆早17’种子萌发及种苗生长的最适MeJA 预处理浓度为2.5μmol/L,而0.025 μmol/L JA 则为棉花种子萌发的最适作用浓度,0.25和2.5μmol/L则分别为种苗生长过程中促进作用最明显的浓度。本研究结果可为MeJA 和JA在棉花生产中的合理使用提供科学依据。
[1]WANG J S(王劲松),GUO J Y(郭江勇),ZHOU Y W(周跃武),etal.Progress and prospect on drought indices research[J].AridLand Geography(干旱区地理),2007,30(1):60-65(in Chinese).
[2]MAO SH CH(毛树春).Research and application of cotton culture and tillage technology in China[J].CottonScience(棉花学报),2007,19(5):369-377(in Chinese).
[3]ZHU J H(朱家红),PENG SH Q(彭世清).Jasmonic acid and its signal transmission[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2006,26(10):2 166-2 172(in Chinese).
[4]WANG X W(汪新文).Jasmonic acid involved in plant adversity stress[J].AnhuiAgriculturalScienceBulletin(安徽农学通报),2008,14(6):29-35(in Chinese).
[5]CHEONG J J,CHOI Y D.Methyl jasmonate as vital substance in plants[J].TrendsinGenetics,2003,19(7):409-413.
[6]BERGER S.Jasmonate-related mutants ofArabidopsisas tools for studying stress signaling[J].Planta,2002,214(4):497-504.
[7]ARIMURA G,OZAWA R,SHIMODA T,etal.Herbivory-induced volatiles elicit genes in lima bean leaves[J].Nature,2000,406:512-515.
[8]RANJAN R,MIERSCH O,SEMBDNER G,etal.Presence and role of jasmonate in apple embryos[J].PhysiologiaPlantarum,1994,90(3):548-552.
[9]ZOU Y(邹 燕),WANG R X(王瑞雪),SHEN L Y(沈亮余),etal.Effects of exogenous MeJA on physiological characteristics ofBrassicanapusunder osmotic stress[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2011,31(3):564-568(in Chinese).
[10]PAN R CH(潘瑞炽),GU H Q(古焕庆).Effect of Methyl Jasmonate on the growth and resistance in peanut seedlings[J].PlantPhysiologyJournal(植物生理学报),1995,21(3):215-220(in Chinese).
[11]张志良.植物生理学实验指导[M].北京:高等教育出版社,2003.
[12]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[13]JIANG K J(蒋科技),PI Y(皮 妍),HOU R(侯 嵘),etal.Jasmonate biosynthetic pathway:its physiological role and potential application in plant secondary metabolic engineering[J].ChineseBulletinofBotany(植物学报),2010,45(2):137-148(in Chinese).
[14]GAO X P,WANG X F,L U Y F,etal.Jasmonic acid is involved in the water-stress-induced betaine accumulation in pear leaves[J].Plant,CellandEnvironment,2004,27:497-507.
[15]XUE R H(薛仁镐),JIN SH A(金圣爱).Methyl Jasmonate:A vital signaling molecule[J].LettersinBiotechnology(生物技术通讯),2006,17(6):985-988(in Chinese).
[16]CAI K ZH(蔡昆争),DONG T X(董桃杏),XU T(徐 涛).The physiological roles and resistance control in stress environment of jasmonates[J].EcologyandEnvironment(生态环境),2006,15(2):397-404(in Chinese).
[17]LI R CH(李荣冲),SHEN L Y(沈亮余),LIANG J L(梁晶龙),etal.Effects of exogenous MeJA on germination and physiological characteristics ofPerillafrutescensseed under high temperature and air humidity stress[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2012,32(2):312-317(in Chinese).
[18]HUMMEL G M,NAUMANN M,SCHURR U,etal.Root growth dynamics ofNicotianaattenuataseedlings are affected by simulated herbivore attack[J].Plant,CellandEnvironment,2007,30:1 326-1 336.
[19]YANG J(杨 洁),HU Y Y(胡云云),LI Y L(李应丽),etal.Effect of NaCl stress on osmotic adjustment solute inChenopodiumglaucumL.[J].JournalofAnhuiAgriculturalSciences(安徽农业科学),2013,41(6):2 358-2 362(in Chinese).
[20]DONG T X(董桃杏),CAI K ZH(蔡昆争),ZHANG J X(张景欣),etal.The physiological roles of methyl jasmonate(MeJA)in drought resistance of rice seedlings[J].EcologyandEnvironment(生态环境),2007,16(4):1 261-1 265(in Chinese).
[21]BROSSA R,LOPEZ-CARBONELL M,JUBANY-MARI T,etal.Interplay between abscisic acid and jasmonic acid and its role in wateroxidative stress in wild-type,ABA-deficient,JA-deficient,and ascorbate-deficientArabidopsisplants[J].JournalofPlantGrowthRegulation,2011,30(3):322-333.
[22]PAN R CH(潘瑞炽),DOU ZH J(豆志杰),YE Q SH(叶庆生).Effect of methyl jasmonate on SOD activity and membrane-lipid peroxidation in peanut seedlings during water stress[J].PlantPhysiologyJournal(植物生理学报),1995,21(3):221-228(in Chinese).
[23]DONG T X(董桃杏),CAI K ZH(蔡昆争),ZENG R S(曾任森).Effects of methyl jasmonate on membrane permeability and inorganic ions content in rice leaves under drought stress[J].ActaAgriculturaeBoreali-Sinica(华北农学报),2010,25(1):136-140(in Chinese).
[24]LI Q Q(李清清),LI D P(李大鹏),LI D Q(李德全).The research progress in biosynthesis and regulation of jasmonates[J].BiotechnologyBulletin(生物技术通报),2010,(1):53-62(in Chinese).
