刺槐林魔芋健康高产的土壤微生态机制
2015-07-04张忠良刘列平薛泉宏
何 斐,张忠良,刘列平,崔 鸣,薛泉宏
(1 西北农林科技大学 生命科学学院,陕西杨陵712100;2西北农林科技大学 林学院,陕西杨陵712100;3陕西省岚皋县魔芋局,陕西岚皋725400;4 陕西省安康市农业技术推广中心,陕西安康725000;5 秦巴魔芋研究开发中心,陕西安康725000;6 西北农林科技大学 资源环境学院,陕西杨陵712100)
1 材料和方法
1.1 材 料
采样区概况:采样区岚皋县位于陕西省安康市西南部、大巴山北麓,属北亚热带季风性气候,年均气温15.1℃,年均降水量1 058 mm,全县60%以上行政村海拔为800~1 300m[3]。
供试样品:为有效减轻魔芋病害,充分利用林地资源及遮荫,选择刺槐林下套种魔芋(称刺槐林魔芋)和农田玉米下套种魔芋(称农田魔芋)。其中,刺槐林地海拔650m,刺槐树龄5年,株行距1.5m×2 m,郁闭度60%,魔芋株行距40cm×40cm。农田中玉米套种魔芋行数比例为玉米∶魔芋=1∶2,荫闭度60%,魔芋株行距40cm×40cm。于2011-08-19在岚皋县蔺河乡立新村刺槐林下,采集健康刺槐林魔芋全植株及其根区、根表及根外土壤;同时采集相同生态条件下农田中与玉米间作的健康农田魔芋全植株及其根区、根表与根外土壤,作为刺槐林魔芋对照。将样品带回实验室参照周永强等[9]方法及时分离。
培养基:牛肉膏蛋白胨、马铃薯蔗糖及高氏1号培养基[10]。
1.2 方 法
1.2.1 土壤微生物分离计数 采用稀释平板涂抹法分离计数微生物数量。细菌、真菌及放线菌分别采用牛肉膏蛋白胨、马铃薯蔗糖及高氏1号培养基,均设3个稀释度,每个稀释度重复3皿,28℃倒置培养,细菌2d,真菌3d,放线菌8d后计数,同时挑取优势菌纯化后于斜面培养基保藏。
1.2.2 土壤pH 及养分测定 使用DELTA 320pH 计测定土壤pH(水∶土=5∶1);重铬酸钾氧化-外加热法测定有机质含量;NH4-N 采用2 mol·L-1KCl浸提,流动分析仪测定;速效P 含量采用0.5mol·L-1NaHCO3浸提,钼锑抗比色法测定;速效K 含量采用1mol·L-1NH4OAc浸提,火焰光度法测定[11]。
1.2.3 优势菌株鉴定 细菌、放线菌总DNA 提取参照徐丽华等[12-15]方法。均采用细菌16SrRNA 通用 引 物PA(5′-AGAGTTTGATCCTGGCTCAG-3′)、PB(5′-AAGGAGGTGATCCAGCCGCA-3′)进行PCR 扩增,得到1.4~1.5kp片段。PCR 条件:94℃预变性4min,94℃变性1min,57℃退火55 s,72℃延伸2min,变性至延伸30个循环,72℃延伸10min,4℃保存。
真菌:参照文献[16~18]方法提取真菌总DNA。采用真菌通用引物ITS1、ITS4 对rDNAITS序列进行扩增(ITS1:5′-TCCGTAGGTGAAC-CTGCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′),得到400~500bp 片段。PCR 反应条件:94℃预变性5min,94℃变性30s,50℃退火30 s,72℃延伸40s,变性至延伸30个循环,72℃延伸10min,4℃保存。扩增产物送南京金斯瑞生物科技有限公司测序,采用BLAST 方法和CLUSTALX 2.0软件将获得的序列与NCBI中高相似度序列进行同源性比对,Mega 5.0软件中Neighbor-Joining法构建系统进化树。
(2)语言文字:来稿力求做到文字通顺、精炼,逻辑性强,避免口语化和非专业用语。使用国家规范汉字,不用繁体字和非规范的简化字,遵守规范化的标点符号使用规则。
1.2.4 数据处理 采用SPSS 17.0软件进行数据分析,Duncan法进行差异显著性检验(P<0.05)。刺槐林魔芋各项指标较农田的增率均用⊿CK%表示,用公式(1)计算。供试样品中某种优势细菌数量占该样品中细菌总数的比例用P%表示,按公式(2)计算;某种优势真菌及放线菌所占比例计算与细菌相同。

2 结果与分析
2.1 魔芋根域微生物区系
由表1可知,刺槐林魔芋根外土中细菌、真菌及放线菌数量与农田魔芋无明显差异,但刺槐林魔芋根区土中真菌数量较农田魔芋减少74.4%;细菌和放线菌数量分别较农田魔芋减少14.2%和6.4%,但差异均不显著;刺槐林魔芋根表土壤细菌数量较农田魔芋增加588.9%,放线菌数量显著减少23.0%,但二者真菌数量无显著差异。
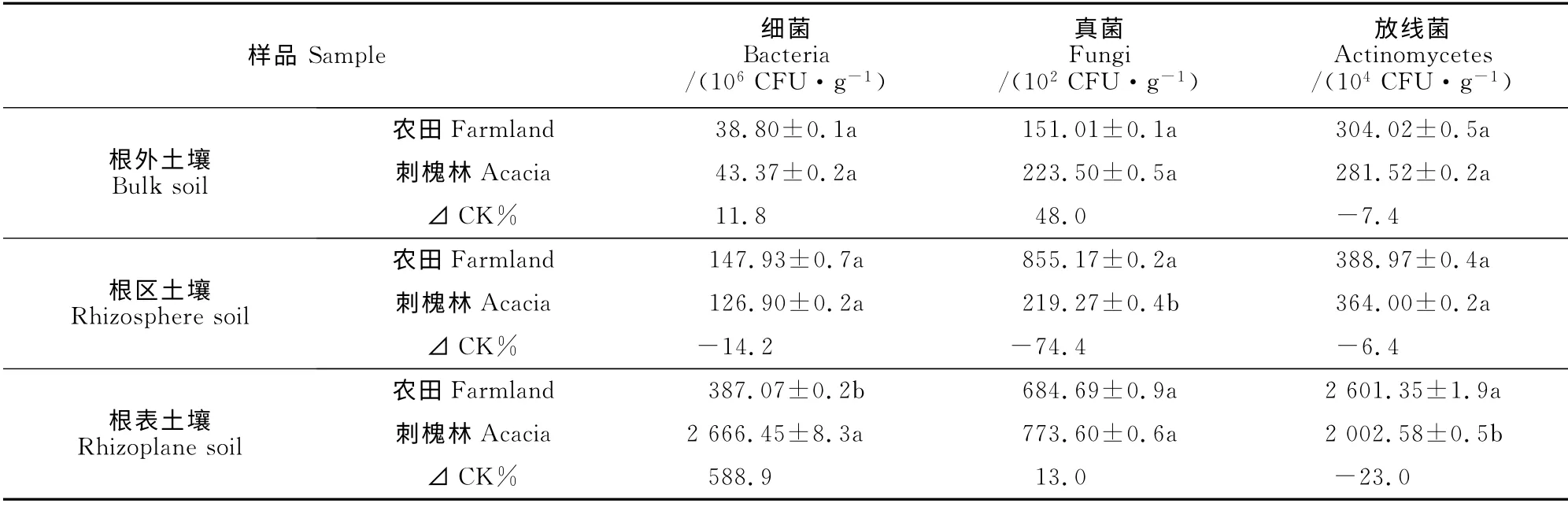
表1 魔芋根区、根表及根外土壤微生物数量Table 1 Microbial quantity in the rhizosphere,rhizoplane and bulk soils of A.konjac
2.2 优势微生物
由表2可知,从魔芋根外、根区及根表土壤中共获得17株优势菌株,其中优势细菌和优势真菌各6株,优势放线菌5 株。采用16SrRNA 和rDNAITS基因序列分析技术对优势菌进行分子鉴定。
2.2.1 优势细菌 由表3可知,刺槐林地土壤与农田土壤中优势细菌不同。刺槐林魔芋根外土壤中各优势细菌数量与农田魔芋存在明显差异:其中,刺槐林魔芋根外土中放射型根瘤菌(R.radiobacter)和苏云金芽孢杆菌(B.thuringiensis)数量分别较农田魔芋增加140.5%和28.3%;而产吲哚金黄杆菌(C.indologenes)、变形假单胞菌(P.plecoglossicida)及寡养食单胞菌(S.pavani)分别较农田魔芋减少100.0%、12.3%及12.7%。
由表3可知,根区土壤中,刺槐林土壤与农田土壤中优势细菌数量也呈类似趋势:刺槐林魔芋根区土中苏云金芽孢杆菌和摩氏假单胞菌(P.mosselii)数量均高于农田魔芋,其中苏云金芽孢杆菌较农田高107.4%,而产吲哚金黄杆菌、变形假单胞菌及寡养食单胞菌分别较农田魔芋减少57.4%、83.1%及100.0%。
从表3可知,4株优势细菌数量在刺槐林魔芋与农田魔芋根表土中的差异更为明显:刺槐林魔芋根表土中放射型根瘤菌、苏云金芽孢杆菌数量分别为农田魔芋根表土的25.7、13.0倍;摩氏假单胞菌在刺槐林魔芋根表土中数量高达2.64×108CFU·g-1,但在农田魔芋根表土壤中未检出。表明优势细菌放射型根瘤菌、苏云金芽孢杆菌及摩氏假单胞菌的大量存在与维持刺槐林魔芋健康高产有关。产吲哚金黄杆菌在刺槐林下魔芋根表土中未检出,但在农田魔芋根表土中检出量为3.52×107CFU·g-1。
从表3 中6 种优势细菌占细菌总数的比例来看,放射型根瘤菌、苏云金芽孢杆菌、摩氏假单胞菌在魔芋根表及根外土壤细菌总数中所占比例均表现为刺槐林大于农田魔芋的趋势。产吲哚金黄杆菌、变形假单胞菌、寡养食单胞菌在魔芋根区、根表及根外土壤细菌总数中所占比例均表现为农田魔芋大于刺槐林的趋势。
此外,从表3可知,刺槐林和农田魔芋根表土中6种优势细菌的总数量高于根区、根外土壤,其分别是根区土壤的31.9倍和1.3倍,根外土壤的62.1倍和4.4倍,表明根表土中优势细菌数量多,对魔芋生长的影响起关键作用。若优势菌为有益菌,则魔芋健康高产;若为有害菌,则多病低产。
2.2.2 优势真菌 由表4可知,刺槐林与农田魔芋根外、根区及根表土中各优势真菌数量差异均呈现相同趋势:即在刺槐林魔芋根区、根表及根外土壤中,优势真菌黒附球菌(E.nigrum)、疣孢青霉(P.verruculosum)数量远高于农田魔芋;而在农田魔芋根区、根表及根外土壤中,腐皮镰刀菌(F.solani)、尖孢镰刀菌(F.oxysporum)、变灰青霉(P.canescen)及烟曲霉(A.fumigatus)数量均高于刺槐林。结果表明,优势真菌黒附球菌、疣孢青霉的存在与维持魔芋健康生长有关,其余4 种真菌中的腐皮镰刀菌(F.solani)和尖孢镰刀菌(F.oxysporum)则是已知病原菌。
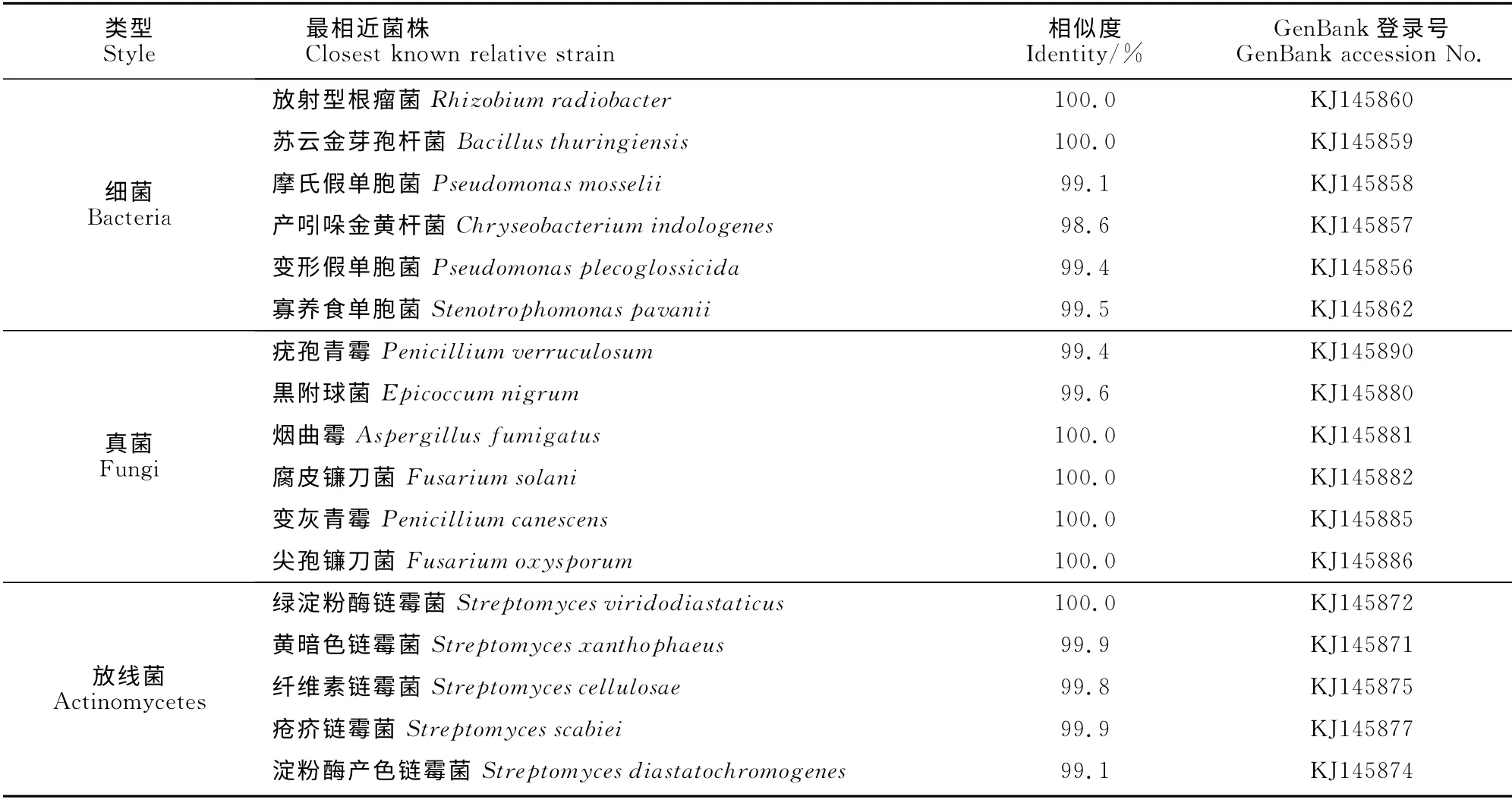
表2 魔芋根区、根表及根外土壤优势微生物Table 2 Dominant microorganisms in the rhizosphere,rhizoplane and bulk soils of A.konjac
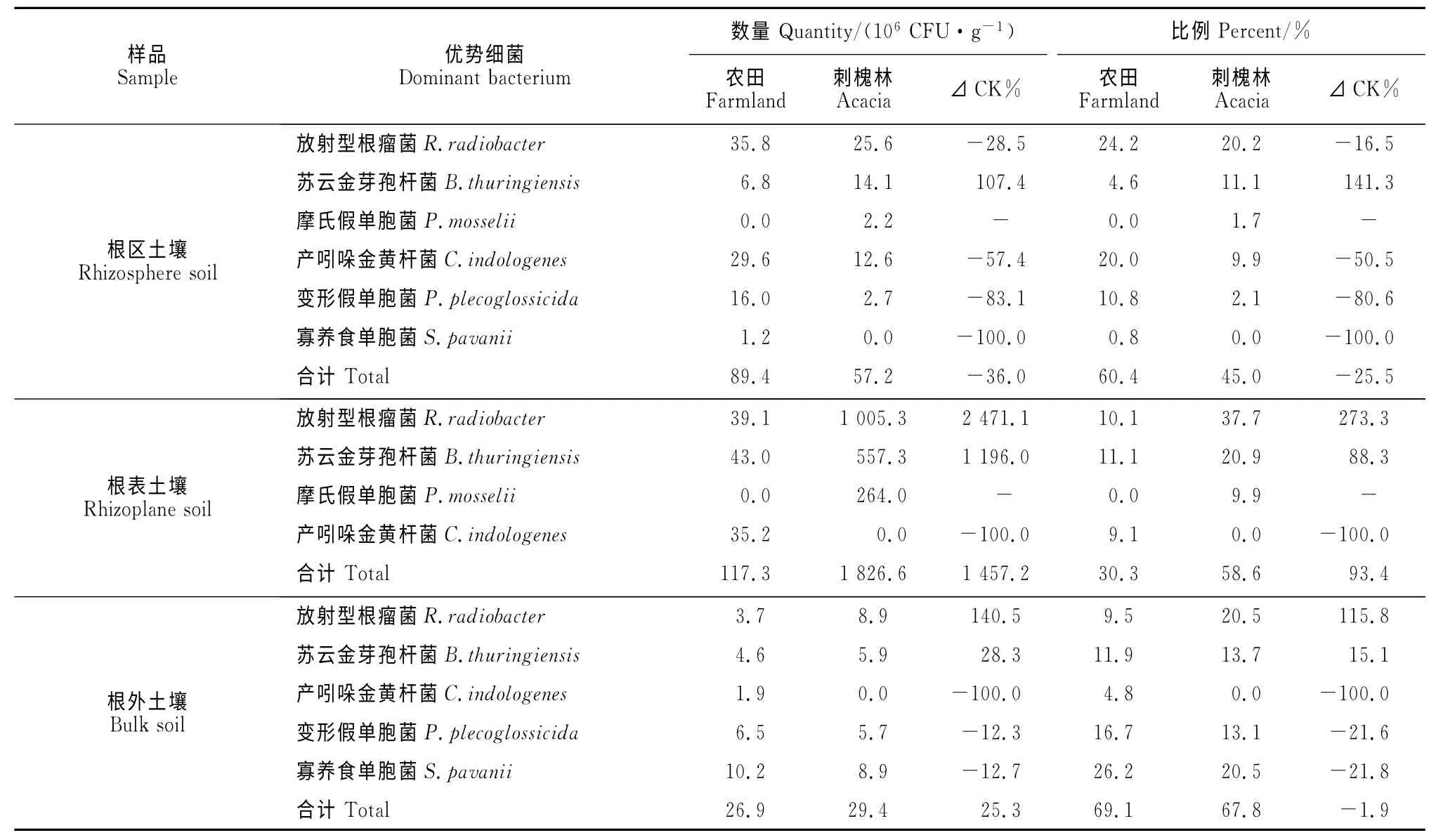
表3 魔芋根区、根表及根外土壤优势细菌数量和比例Table 3 Quantity and percent of dominant bacteria in the rhizosphere,rhizoplane and bulk soils of A.konjac
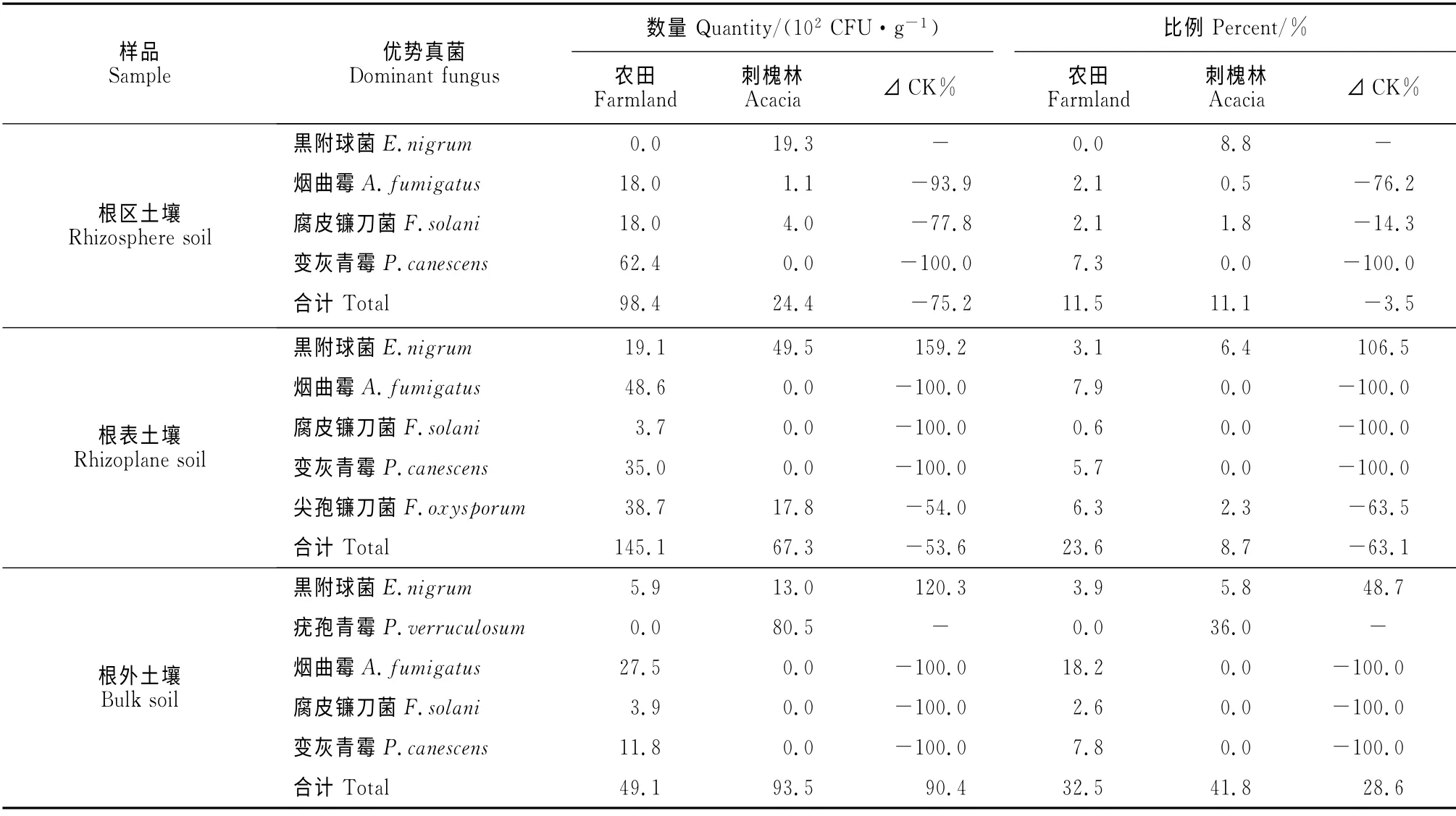
表4 魔芋根区、根表及根外土壤优势真菌数量和比例Table 4 Quantity and percent of dominant fungi in the rhizosphere,rhizoplane and bulk soils of A.konjac
从优势真菌占真菌总数的比例来看,刺槐林和农田魔芋根外、根区及根表土壤优势真菌所占比例的高低与二者数量的大小趋势一致。
2.2.3 优势放线菌 由表5可知,在根外土中,刺槐林魔芋根外土中优势放线菌绿淀粉酶链霉菌(S.viridodiastaticus)和 淀 粉 酶 产 色 链 霉 菌(S.diastatochromogenes)数量均为1.07×105CFU·g-1,而这两种菌在农田魔芋根外土壤中均未检出。根外土壤中优势放线菌疮疥链霉菌(S.scabiei)的数量呈现农田大于刺槐林的趋势。根区土壤中,优势放线菌绿淀粉酶链霉菌和疮疥链霉菌在刺槐林和农田魔芋根区土壤中的数量差异与根外土壤中呈现类似趋势:即绿淀粉酶链霉菌的数量表现为刺槐林大于农田;而疮疥链霉菌的数量表现为农田魔芋大于刺槐林的趋势。与根外土壤趋势相反,优势放线菌淀粉酶产色链霉菌的数量在根区土壤中表现为农田魔芋大于刺槐林。
由表5可知,根表土壤中,4种优势放线菌的数量表现出明显的规律性:即黄暗色链霉菌(S.xanthophaeus)、纤维素链霉菌(S.cellulosae)及疮疥链霉菌(S.scabiei)数量呈现农田魔芋大于刺槐林的趋势;而绿淀粉酶链霉菌的数量在根表土中与其根外、根区土中的规律一致,即刺槐林数量较多,但农田魔芋根表土中未检出。
从优势放线菌占放线菌总数的比例来看,刺槐林与农田魔芋根外、根区及根表土壤优势放线菌所占比例的高低与二者数量大小一致。
2.3 魔芋根区土壤养分含量
由表6可知,刺槐林魔芋根区土壤有机质和铵态氮含量分别较农田显著提高39.6%和14.0%,但速效磷和速效钾含量分别较农田显著降低91.3%和13.0%。刺槐林魔芋根区土壤pH 与对照无明显差异。此外,刺槐林魔芋根外土壤pH 和有机质含量分别较农田显著增加25.5%和167.6%,但铵态氮、速效磷及速效钾含量均显著低于农田,降幅分别为44.0%、85.6%及12.4%。

表5 魔芋根区、根表及根外土壤优势放线菌数量和比例Table 5 Quantity and percent of dominant actinomycetes in the rhizosphere,rhizoplane and bulk soils of A.konjac
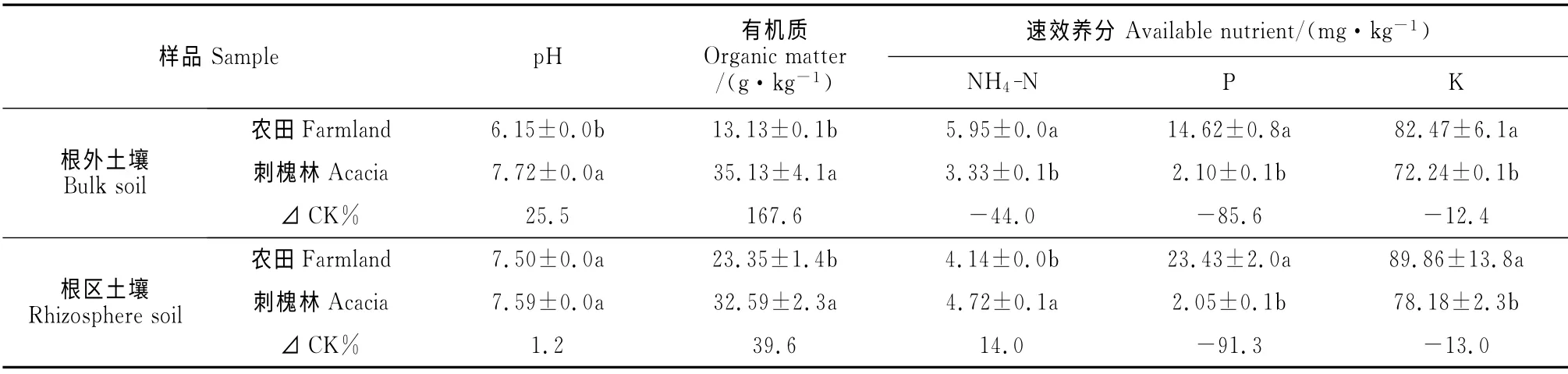
表6 魔芋根区及根外土壤养分含量Table 6 Soil nutrition contents in the rhizosphere and bulk soils of A.konjac
3 讨 论
魔芋健康高产与其根际微生态系统中微生物群落结构密切相关。但目前对魔芋根际土壤微生态研究很少[19],尚无对刺槐林魔芋根区、根表土壤微生态特性的系统研究,难以对刺槐林魔芋健康高产现象作出解释,限制了对刺槐林魔芋健康高产栽培技术的深入研究及对刺槐林下土壤资源的高效利用。
本研究发现,刺槐林魔芋根区、根表及根外土壤微生物区系与农田存在显著差异:(1)刺槐林魔芋根区土壤真菌数量远低于农田,根表土壤细菌数量远高于农田。(2)刺槐林魔芋根表、根外土壤中的优势细菌均为放射型根瘤菌和苏云金芽孢杆菌,根区土壤中为苏云金芽孢杆菌和摩氏假单胞菌,刺槐林魔芋根表土壤中放射型根瘤菌数量约为农田的26倍,而农田魔芋根表、根外及根区土壤中上述3种细菌数量很少或未检出。(3)刺槐林魔芋根外、根区及根表土中各优势真菌黒附球菌数量远高于农田,根外土壤中疣孢青霉数量远高于农田;而在农田魔芋根区、根表及根外土壤中,腐皮镰刀菌、尖孢镰刀菌、烟曲霉及变灰青霉数量均高于刺槐林。(4)刺槐林魔芋根外、根区及根表土中各优势放线菌为绿淀粉酶链霉菌,而农田土壤未检出该菌。刺槐林土壤中大量存在的3种优势细菌、3种优势真菌和1种优势放线菌可能是刺槐林魔芋健康高产的主要原因之一,农田土壤中大量存在的4种优势真菌是农田魔芋多病低产的主要原因之一。
已有研究[20-25]支持了上述推论。在上述刺槐林土壤优势微生物中,2种优势细菌及2种优势真菌具有抑菌或促生效应。其中放射型根瘤菌具有广谱抑菌活性,能抑制番茄青枯雷尔氏菌、西瓜果斑病菌及棉花黄萎病大丽轮枝菌,尤其对西瓜果斑病菌具有极好的抑菌效果,抑菌圈直径高达53.0 mm[20];放射型根瘤菌还能产生具有促生活性的代谢产物,其无细胞发酵滤液以及细胞悬液均能显著促进甜瓜幼苗生长[21]。苏云金芽孢杆菌是目前世界上应用范围最广、效果最好的绿色环保型微生物杀虫剂,其胞内毒蛋白对多种害虫有杀灭作用[22-23]。该菌数量多,可能通过减少魔芋根区、根表土壤害虫数量及害虫对魔芋根系侵害减轻病原微生物侵染,降低软腐病发病率。放射型根瘤菌和苏云金芽孢杆菌能产生抗菌活性物质,抑制魔芋软腐病原菌生长,在盆栽条件下亦有一定的防病促生作用(拟另文报道)。疣孢青霉对真菌性番茄早疫病菌、苹果干腐病菌及苹果腐烂病菌的抑菌率高达80%以上[24]。黒附球菌是防治作物病害较理想的生防菌[25]。这4 种优势菌在刺槐林下魔芋根区、根表及根外土壤中数量较多,对抑制土壤中有害微生物生长,增强魔芋抗病性及促进魔芋生长有益。
此外,在刺槐林下魔芋根区、根表及根外土壤中,优势细菌摩氏假单胞菌和优势放线菌绿淀粉酶链霉菌数量较多,但在农田魔芋根区、根表及根外土壤中未检出,表明这两株菌也可能与刺槐林魔芋健康高产有关。但目前尚无这2种菌的防病促生或抑菌功能的报道,其对刺槐林魔芋健康高产的影响尚待进一步研究。
本研究还发现,在农田魔芋根区、根表及根外土壤中,优势真菌为腐皮镰刀菌、尖孢镰刀菌及烟曲霉;优势细菌为产吲哚金黄杆菌和变形假单胞菌;优势放线菌为疮疥链霉菌。这些优势菌数量远高于刺槐林土壤。这6种菌的大量存在与农田魔芋软腐病发病率高、产量低有关。已有研究[26-33]也支持了该推论。其中,腐皮镰刀菌是一类分布广泛的植物病原菌,可侵染辣椒、马铃薯、黄瓜等,导致作物地下根腐、地上枯萎等病害发生[26-27]。尖孢镰刀菌是引起甘蔗、黄瓜等作物枯萎病的主要致病菌[28-32]。疮疥链霉菌是引起马铃薯疮疥病的植物源病原菌[33]。即这3种菌的有害作用是确定的。烟曲霉为人类真菌性疾病的致病菌[34],该菌也可产生一些抑制免疫反应的真菌毒素如烟曲霉素、烟曲霉酸及内毒素等[35]。产吲哚金黄杆菌是人类疾病的致病菌[36]。变形假单胞菌是鱼类败血症致病菌[37]。但这3 种优势菌对植物有无致病性尚无报道。
此外,寡养食单胞菌、变灰青霉、淀粉酶产色链霉菌、黄暗色链霉菌、纤维素链霉菌在农田魔芋根区、根表及根外土壤中数量较多,但目前尚无这些菌的致病性或影响根系吸收功能的报道,其对魔芋生长有何影响尚待进一步研究。
本研究还发现,刺槐林土壤速效NPK、有机质及pH 与农田存在显著差异。其中刺槐林根外土壤有机质含量远高于农田,速效NPK 则远低于农田。魔芋根区土壤与之类似。该现象表明,与土壤微生物数量种类及土壤有机质相比,土壤速效NPK 对魔芋健康高产的影响较小。
综上所述,刺槐林魔芋健康高产的微生态机制为:(1)土壤具有健康有益的微生物区系。(2)土壤有机质含量高。刺槐的枯枝落叶及根系分泌物可能是土壤中有益优势微生物大量繁殖的主要原因,但该推测尚待进一步研究证实。
本研究通过对比刺槐林与农田魔芋根区、根表、根外土壤微生物区系及养分差异,首次揭示了刺槐林魔芋健康高产的微生态机制,该结果可为刺槐林魔芋健康高产栽培研究提供理论依据。
[1]HE J(和 军),WEI L Y(魏凌云),ZHOU L J(周立军).Effect of intercropping pattern and woodland type onKonjacdisease and yield[J].ShaanxiForestScienceandTechnology(陕西林业科技),2012,(3):37-38,41(in Chinese).
[2]LIU L P(刘列平),ZHENG M(郑 敏),ZOU A(邹 安),etal.Effect of intercropping pattern on disease and yield ofAmorphophallus konjac[J].ForestBy-ProductandSpecialityinChina(中国林副特产),2012,5:58-59(in Chinese).
[3]ZHANG ZH L(张忠良),LIU L P(刘列平),ZHENG M(郑 敏).Cultivation techniques ofAmorphophallusrivieriunderRobiniapseudoacaciaforest[J].NorthernHorticulture(北方园艺),2012,13:148-150(in Chinese).
[4]CUI M(崔 鸣).Practice and understanding ofAmorphophalluskonjacunderstory planting[J].ShaanxiJournalofAgriculturalSciences(陕西农业科学),2012,3:157-159.
[5]WIELAND G,NEUMANN R,BACKHAUS H.Variation of microbial communities in soil,rhizosphere,and rhizoplane in response to crop species,soil type,and crop development[J].AppliedandEnvironmentalMicrobiology,2001,67(12):5 849-5 854.
[6]HAMEL C,VUJANOVIC V,JEANNOTTE R,etal.Negative feedback on a perennial crop:Fusariumcrown and root rot of asparagus is related to changes in soil microbial community structure[J].PlantandSoil,2005,268(1):75-87.
[7]WANG L N(王玲娜),XUE Q H(薛泉宏),TANG M(唐 明),etal.Microbial ecological study about the root-zone soil of the healthy and diseased celery plant in Inner Mongolia[J].JournalofNorthwestA&FUniversity(Nat.Sci.Edi.)(西北农林科技大学学报·自然科学版),2010,38(8):167-181,172(in Chinese).
[8]WU J P,DIAO Y,GU Y C,etal.Infection pathways of soft rot pathogens onAmorphophalluskonjac[J].AfricanJournalofMicrobiologyResearch,2010,4(14):1 495-1 499.
[9]ZHOU Y Q(周永强),XUE Q H(薛泉宏),YANG B(杨 斌),etal.Adjusted effect of inoculating with biocontrol actinomyces on microbial flora of watermelon rooting zone[J].JournalofNorthwestA&FUniversity(Nat.Sci.Edi.)(西北农林科技大学学报·自然科学版),2008,36(4):143-150(in Chinese).
[10]程丽娟,薛泉宏,来航线.微生物学实验技术[M].北京:科学出版社,2012.
[11]鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000.
[12]徐丽华,李文均,刘志恒,等.放线菌系统学-原理方法及实践[M].北京:科学出版社,2007.
[13]SAITO H,MIURA K I.Preparation of transforming deoxyribonucleic acid by phenol treatment[J].BiochimicaetBiophysicaActa(BBA)-SpecializedSectiononNucleicAcidsandRelatedSubjects,1963,72:619-629.
[14]EI KARKOURI A,EI HASSANI F Z,EI MZIBRI M,etal.Isolation and identification of an actinomycete strain with a biocontrol effect on the phytopathogenicErwiniachrysanthemi3937Ⅷresponsible for soft rot disease[J].AnnalsofMicrobiology,2010,60:263-268.
[15]INTRA B,MUNGSUNTISUK I,NIHIRA T,etal.Identification of actinomycetes from plant rhizospheric soils with inhibitory activity againstColletotrichumspp.,the causative agent of anthracnose disease[J].BMCResearchNotes,2011,4:98.
[16]SAGHAI M A,SOLIMAN K M,JORGENSEN R A,etal.Ribosomal DNA spacer-length polymorphism in barley:Mendelian inheritance,chromosomal location and population dynamics[J].ProceedingoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1984,81:8 014-8 018.
[17]SUN G Y(孙广宇),ZHANG Y M(张雅梅),ZHANG R(张 荣).Sequence comparison and phylogenetic analysis of BRN1gene fromExserohilumspecies[J].Myco-systema(菌物学报),2004,23(4):480-486(in Chinese).
[18]INGLE A,INGLE R.Isolation and Identification ofFusariumoxysporuminfecting Musa plants in Maharashtra region and their molecular characterization[J].AslaticJournalofBiotechnologyResources,2013,4:28-34.
[19]JIA G M(贾国梅),LÜH SH(吕红胜),TANG Q ZH(唐巧珍),etal.Effect ofKonjacon soil microbial community composition[J].JournalofAnhuiAgriculturalSciences(安徽农业科学),2008,36(21):9 176-9 178(in Chinese).
[20]ZHU Y J(朱育菁),CHEN L(陈 璐),LAN J L(蓝江林),etal.Isolation,identification and the biocontrol potential of endophyte in theasienensis(Camelliasinensis)[J].JournalofFujianAgricultureandForestryUniversity(Nat.Sci.Edi.)(福建农林大学学报·自然科学版),2009,38(2):129-134(in Chinese).
[21]DUAN J L,LI X J,GAO J M,etal.Isolation and identification of endophytic bacteria from root tissues ofSalviamiltiorrhizaBge.and determination of their bioactivities[J].AnnalsofMicrobiology,2013,63:1 501-1 512.
[22]LI Y P(李怡萍),LIANG G M(梁革梅),WU J X(仵均祥),etal.Progress in insecticidal mechanism of Bt and resistance mechanism of pest insect to Bt[J].JournalofNorthwestA&FUniversity(Nat.Sci.Edi.)(西北农林科技大学学报·自然科学版),2010,38(9):118-128(in Chinese).
[23]LIU SH Q(刘石泉),SHAN SH P(单世平),XIA L Q(夏立秋).Advances on high performance insecticide ofBacillusthuringiensis[J].Microbiology(微生物学通报),2008,35(7):1 091-1 095(in Chinese).
[24]李 川.白魔芋种子发芽过程中的生理生化研究[M].重庆:西南大学,2006.
[25]TIAN X L(田雪亮),LIU M T(刘鸣韬),YANG J R(杨家荣).Seed germination and growth of various resistant cucumber seedlings underFusariumoxysporumcrude toxin stress[J].ChineseJournalofEco-Agriculture(中国生态农业学报),2008,16(6):1 495-1 498(in Chinese).
[26]DE OLIVEIRA V C,COSTA J L S.Restriction analysis of rDNA(ARDRA)can differentiateFusariumsolanif.sp.phaseolifromF.solanif.sp.glycines[J].FitopatologiaBrasileira,2002,27:631-634.
[27]POLTRONIERI L S,TRINIDAD D R,ALBUQUERQUE F C,etal.Incidence ofFusariumsolaniin annulled in the state of Pará,Brazil[J].FitopatologiaBrasileira,2002,27:544.
[28]RAGAB M M,ASHOUR A M A,ABDEL-KADER M M,etal.In vitro evaluation of some fungicides alternatives againstFusariumoxysporumthe causal of wilt disease of pepper(CapsicumannumL.)[J].InternationalJournalofAgricultureandForestry,2012,2:70-77.
[29]KOSURI N R,GROVE M D,YATES SG,etal.Response of cattle to mycotoxins ofFusariumtricinctumisolated from corn and fescue[J].JournaloftheAmericanVeterinaryMedicalAssociation,1970,157:938-940.
[30]ZHANG SH M(张淑梅),ZHAO X Y(赵晓宇),ZHANG X CH(张先成),etal.Molecular detection ofFusariumoxysporumin cucumber,watermelon and melon[J].ActaPhytopathologicaSinica(植物病理学报),2010,40(6):636-641(in Chinese).
[31]WU F ZH(吴凤芝),WANG X ZH(王学征),PAN K(潘 凯).Effects of wheat and soybean stubbles on soil microbial ecological characteristics in cucumber field[J].ChineseJournalofAppliedEcology(应用生态学报),2008,19(4):794-798(in Chinese).
[32]LIANG J G(梁建根),ZHANG B X(张炳欣),YU J Q(喻景权),etal.Population fluctuation of main pathogens and their antagonistic bacteria in cucumber rhizosphere[J].ChineseJournalofAppliedEcology(应用生态学报),2005,16(5):911-914(in Chinese).
[33]PARK J I,JUNG H J,BAE Y H,etal.Antimicrobial activity against potato common scab(Streptomycesscabiei)of green manure crop extracts[J].KoreanJournalofPlantResources,2011,24:622-627.
[34]JIA ZH Y(贾震宇),LI D D(李德东),JIANG Y Y(姜远英),etal.Key virulence factors ofAspergillusfumigatus:an update[J].Chinese JournalofMycology(中国真菌学杂志),2013,8(4):241-245(in Chinese).
[35]TOMEE J F C,KAUFFMAN H F.Putative virulence factors ofAspergillusfumigatus[J].ClinicalandExperimentalAllergy,2000,30(3):476-484.
[36]KODAMA Y,NISHIMURA M,NAKASHIMA K,etal.Central intravenous catheter-related bacteremia due toChryseobacteriumindologenesafter cord blood transplantation[J].TheJapaneseJournalofClinicalHematology,2013,54:305-310.
[37]NISHIMORI E,KITA-TSUKAMOTO K,WAKABAYASHI H.Pseudomonasplecoglossicidasp.Nov.,the causative agent of bacterial haemorrhagic ascites of ayu.Plecoglossusaltivelis[J].InternationalJournalofSystematicandEvolutionaryMicrobiology,2000,50:83-89.
