NaCl胁迫对滨梅扦插苗生物量和水分积累的影响
2015-07-04刘勇军王小敏吴文龙李维林
朱 泓,黄 涛,刘勇军,王小敏,吴文龙,李维林*
(1 江苏省中国科学院植物研究所,南京210018;2 江苏省仪征市农业委员会,江苏仪征211400)
滨梅(PrunusmaritimaMarshall)是蔷薇科李属的一种盐生灌木,原产于美国大西洋沿岸,被认为是最耐盐碱的果树之一。滨梅植株根系发达,具有耐旱、耐贫瘠、耐盐碱等方面的抗逆性[1-2],可用于海岸滩涂的修复和沙丘的固定,是一种花果两用的耐盐新经济树种。滨梅自引种以来,国内已开展栽培、种子繁殖、组培扩繁、遗传变异等方面研究[3-6],但迄今为止,其耐盐特性及耐盐机制仍缺乏完整深入的探讨。因此,本实验在温室盆栽条件下,考察了人工模拟NaCl胁迫环境对滨梅扦插苗不同部位Na+含量、K+含量、生物量及水分积累的影响,为深入阐明滨梅的耐盐机制提供有效的数据支撑。
1 材料和方法
1.1 试材及其培养
试验用塑料盆的底径为13.5cm、口径15cm、高18cm,盆栽用土为轻壤质黄棕壤,其pH 为7.10,速效钾含量为100.35 mg/kg,有机质含量27.04g/kg,有效磷含量为40.10mg/kg,全氮含量为1.47g/kg,每盆装入磨细过筛的轻壤质干土3 kg。每盆栽种1年生地径0.25cm、高25cm 且生长均匀的滨梅1株,置于简易大棚温室,先用淡水浇灌,4月中旬待苗木恢复正常生长后,用不同浓度NaCl溶液处理。试验共设7个处理,即NaCl质量浓度分别为0g·L-1(CK)、1.5g·L-1(0.15%)、2.9g·L-1(0.29%)、5.8g·L-1(0.58%)、8.8 g·L-1(0.88%)、11.7 g·L-1(1.17%)、14.6 g·L-1(1.46%),每处理重复3次,随机区组排列。每盆每次浇300mL 处理溶液,每隔4d浇1次,处理持续40d,之后停止浇灌盐溶液。从浇灌盐溶液之日起,每20d取植物样品分析,直至80d后结束取样。
1.2 测定指标及方法
1.2.1 土壤电导率(EC 1∶5) 开始盐溶液处理后20、40、60d,分别用土钻采集深度为10cm 盆土测定电导率,土壤电导率用雷磁牌电导率仪测定(水土比为5∶1)[7]。
1.2.2 离子含量 开始盐溶液处理后80d分别取5盆滨梅根、茎、叶,烘干(105℃下杀青15 min,80℃下烘干至恒重)磨碎过筛后各称取样品0.10g,加8.0mL浓硫酸放置过夜后270℃消煮。待消煮液全部清亮后滴加H2O2至无色透明,继续消煮10 min,冷却。将消煮液用水定容至50.0 mL 容量瓶中。在消煮的同时做两份空白测定。吸取定容后的消煮液5.0mL,用水定容至25.0mL,在火焰光度计上测定数值。另外,在测定前分别称取1.885 9g NaCl、1.582 9g KCl于105℃下烘6h后分别溶于去离子水中并定容到1L,制成1 000mg·L-1标准液;然后将标准液分别稀释到0、5、10、20、30、40、50 mg·L-1于火焰光度计(FP640型)上测定数值并绘制标准曲线;待火焰光度计预热稳定后,分别用50 mg·L-1钠、钾离子标液调满标(窗口显示100)和低标(窗口显示0),重复调试直至满标和低标显示值稳定;植物钠、钾离子含量=(ρ×V×Ts)/(m×103),式中,ρ为钾钠离子质量浓度(mg·L-1),V为测读液体积(mL),Ts为测度液稀释倍数,m为烘干样品质量。
1.2.3 生长指标 开始处理后20、40、60、80d分别取5盆滨梅,测定一年生茎、二年生茎及根系的鲜重,经杀青、烘干测得干重(105℃下杀青15min,80℃下烘干至恒重)后计算含水率。
含水率=(鲜重-干重)/鲜重
1.2.4 根系活力 开始盐溶液处理后20、40d分别取5盆滨梅,采用氯化三苯基四氮唑(TTC)比色法测定根系活力。
1.3 数据处理
数据用Excel 2007 和SPSS 19.0 统计分析,Duncan’s法进行多重比较(P<0.05)。
2 结果与分析
2.1 NaCl溶液处理对盆栽土壤含盐量的影响
试验土壤电导率变化趋势与NaCl胁迫强度呈线性正相关关系(图1),该结果表明通过浇灌不同浓度盐溶液能有效改变盆栽土壤的含盐量。土壤电导率趋势线斜率随试验时间的推移而逐渐增大,表明在固定浓度NaCl溶液多次浇灌条件下,盆栽土壤中盐分有明显的积累现象,这种积累的趋势在停止浇灌NaCl溶液20d后依然存在。
2.2 NaCl胁迫对滨梅植株Na+、K+含量的影响
由图2可知,在高浓度(>0.58%)盐胁迫80d后,滨梅植株各器官Na+含量均显著升高(P<0.05)。其中,在0~0.58% NaCl胁迫水平下,植株根系Na+含量均显著高于茎、叶;当盐浓度达到0.88%时,叶中的Na+含量快速增加并显著高于根、茎,此时根系Na+含量增速已显著低于叶,根、茎、叶中的Na+含量分别为对照的6.98、7.82 和27.22倍。同时,与Na+含量随盐胁迫浓度提高而快速增加趋势相反,在高浓度盐胁迫80d后,植株根、茎的K+含量均比对照显著降低(P<0.05),而叶片的K+含量无显著变化,如根、茎和叶片中的K+含量当盐浓度达到0.88%时分别为对照的64.24%、45.28%和90.79%;当盐浓度增加时,根、茎中的K+含量平稳下降,叶中K+含量始终显著远高于根、茎并且显示出升高趋势,茎中的K+含量又始终低于根;不同处理组间叶中K+含量差异在1.17% NaCl胁迫下才达到显著水平。此外,植株根、茎、叶K+/Na+均随盐浓度增加而显著降低,且各盐浓度处理下叶具有更高的K+/Na+值。
2.3 NaCl胁迫对滨梅植株生物量的影响
NaCl溶液胁迫80d后,各浓度处理滨梅植株地上部叶片、一年生茎、二年生茎、地下部干重均表现出不同程度的差异性变化。

图1 NaCl胁迫下的土壤电导率Fig.1 The change of soil electric conductivity under NaCl stress
2.3.1 叶片生物量 从图3,A 可见,经不同浓度NaCl溶液处理80d后滨梅全叶生物量差异达到显著水平(P<0.05);随着盐胁迫强度的增加,全叶生物量呈先增加后减少的趋势。低浓度的NaCl胁迫能促进叶片干物质积累,如0.15% NaCl溶液处理植株的全叶干重在胁迫60d后较CK 增加1.93%,在胁迫80d后增加4.00%;高浓度NaCl胁迫则显著抑制了叶片干物质的积累,如1.46% NaCl溶液处理的植株全叶干重在胁迫60d 后较CK 降低13.22%,在胁迫80d后则比CK 降低60.80%。同时,随着盐胁迫时间的延续,0.15%~0.58% NaCl胁迫滨梅植株全叶干重均呈逐渐积累趋势,但均未达到显著水平;在0.88%NaCl溶液处理下,叶片干重在不同胁迫时间均停止积累;当处理浓度超过0.88%时,植株全叶干重随着胁迫时间的延长而显著下降,如1.17%和1.46% NaCl溶液处理植株全叶干重在80d 后分别比胁迫40d 时显著降低17.56%和60.80%。
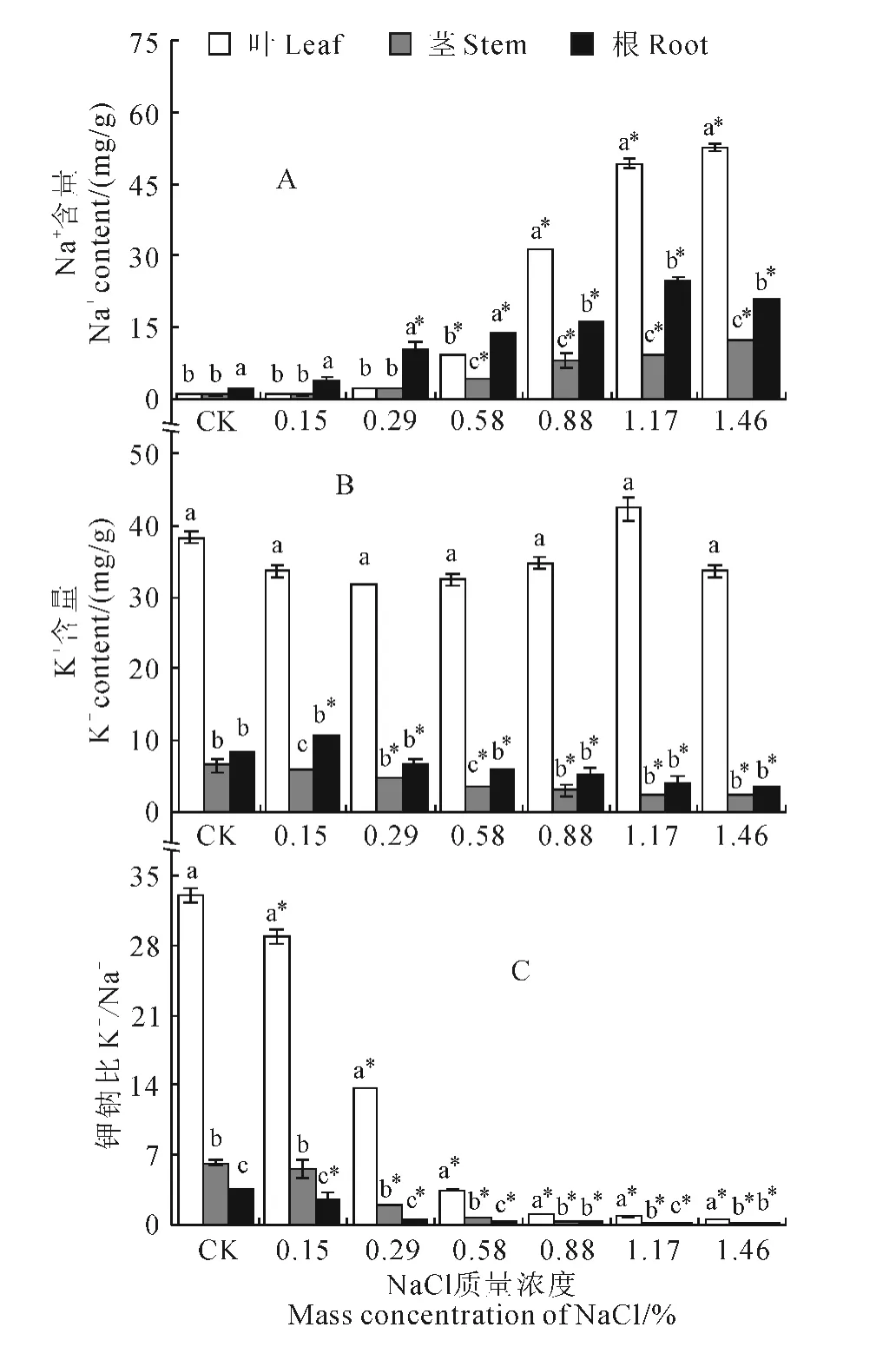
图2 NaCl胁迫下滨梅植株各器官的离子含量Fig.2 Effect of NaCl on Na+and K+contents under stress for 80days
2.3.2 一年生茎生物量 图3,B 显示,各浓度NaCl溶液处理60d的滨梅一年生茎生物量差异达到显著水平(P<0.05)。低浓度的NaCl在促进一年生茎生长的同时也促进了其干物质积累,如0.15% NaCl溶液处理植株一年生茎干重在胁迫60 d后较CK 增加23.95%,在胁迫80 d 后增加13.27%。高浓度NaCl胁迫显著抑制了一年生茎干物质的积累,如1.17%和1.46% NaCl溶液处理的植株一年生茎干重在胁迫60d后分别比CK 降低81.82%和77.00%,在80d后则分别比CK 降低75.84%和87.77%。另外,随着盐胁迫时间的延续,0.15%~0.58% NaCl胁迫植株一年生茎干重均呈逐渐积累趋势,并在0.58%的NaCl溶液处理下达到显著水平;而在0.88% NaCl溶液处理下,植株一年生茎干重在不同胁迫时间均停止积累;当盐处理浓度超过0.88%时,植株一年生茎干重随着胁迫时间的延长而显著下降,如1.17%NaCl溶液处理植株一年生茎干重在胁迫60、80d后比胁迫40d时分别降低73.2%和53.01%,1.46% NaCl溶液处理下则分别比胁迫40d时降低62.93%和71.64%。
2.3.3 二年生茎生物量 从图3,C 来看,各浓度NaCl胁迫对滨梅植株二年生茎干重的影响不及一年生茎,除0.15% NaCl溶液处理(胁迫60d 后,0.15% NaCl溶液处理二年生茎干重较CK 增加58.00%可能是实验中的偶然偏差)外,其余同期盐胁迫处理之间差异均未达到显著水平,且各处理均低于相应CK;其中,盐胁迫60 d 后,1.17%和1.46% NaCl溶液处理二年生茎干重分别较CK显著降低36.50% 和50.63%;盐胁迫80 d 后,0.15%、1.17%和1.46% NaCl溶液处理二年生茎干重分别较CK 降低25.44%、65.44%和54.30%。同时,与一年生茎表现相同的是,植株二年生茎干物质在低盐胁迫条件下随处理时间延长表现出一定的积累,并同样在0.58% NaCl溶液处理下达到显著水平;与一年生茎表现显著不同的是,随着胁迫时间的延长,二年生茎干重在高盐胁迫下变化不明显,如1.17% NaCl溶液处理植株二年生茎干重在胁迫60、80d后分别比处理40d时增加9.93%和降低28.05%,而在1.46%的NaCl溶液处理下干重则分别比处理40d时降低9.53%和增加0.52%。

图3 滨梅植株叶、一年生茎、二年生茎及根系生物量对NaCl胁迫的响应Fig.3 Physiological responses in leaf,shoot and root of P.maritima under NaCl stress
2.3.4 根系生物量 从图3,D 可知,滨梅根系对NaCl胁迫敏感性比茎干更强。其中,盐胁迫20d后,低浓度(0.15%~0.58%)NaCl溶液处理根干重均已高于CK,如0.15% NaCl溶液处理干重较CK增加22.43%;胁迫60d后,0.15% NaCl溶液处理根系干重较CK 增加54.12%;胁迫80d后,0.15%NaCl溶液处理根系干重较CK 增加18.28%。与一年生茎生物量表现类似,高浓度NaCl胁迫也显著抑制了根系干物质的积累,1.17%和1.46% NaCl溶液处理根系干重在盐胁迫60d后分别比CK 降低61.53%和78.85%,在胁迫80d后则分别比CK降低61.37%和81.10%。另外,在同一盐胁迫水平下,根系干重在不同胁迫时间均呈下降趋势并达到显著水平。该结果暗示滨梅根系受到的盐胁迫伤害具有时间积累效应,即随着处理时间的增加而增强,这与图1中土壤电导率随时间变化的趋势相一致。
2.4 NaCl胁迫对滨梅植株水分含量的影响
不同浓度NaCl溶液胁迫80d后,植株地上部叶片、一年生茎、二年生茎和地下部含水率均表现不同程度的差异性变化。
2.4.1 叶水分含量 表1显示,在高浓度NaCl溶液胁迫下,滨梅叶片含水率显著降低,如盐胁迫60、80d后,1.17% NaCl溶液处理叶片含水率分别较CK 降低16.39%和24.02%,1.46% NaCl溶液处理则分别降低18.70%和24.73%;随着胁迫时间的延长,高浓度处理滨梅叶片含水率也显著降低,如1.17%和1.46% NaCl溶液处理叶片含水率在胁迫80d 后分别比胁迫20d 时显著降低23.18%和24.13%(表1)。
2.4.2 一年生茎水分含量 由表1可以看出,随着NaCl溶液浓度的提高,滨梅一年生茎含水率呈先升高后降低的趋势,但除1.46% NaCl溶液胁迫40、60d外,其余处理间差异均不显著;在胁迫60、80d后,0.15% NaCl溶液处理一年生茎含水率分别较CK 降低1.83%和增加3.15%,1.17% NaCl溶液处理则分别较CK 降低11.25%和4.06%,1.46%NaCl溶液处理分别降低32.38%和5.61%。同时,随着胁迫时间的延长,各盐处理滨梅一年生茎含水率明显降低,如0.15%、1.17% 和1.46% NaCl溶液处理植株一年生茎含水率在胁迫80d后分别比胁迫20d时降低28.78%、37.73%和30.47%(表1)。
2.4.3 二年生茎水分含量 NaCl胁迫对滨梅二年生茎含水率影响强度不及一年生茎(表1)。随着NaCl溶液浓度的提高,二年生茎含水率未呈现明显变化趋势,除0.88%、1.17%处理二年生茎含水率在处理20d显著提高外,其余同期处理间差异均不显著;胁迫60、80d后,0.15% NaCl溶液处理二年生茎含水率分别为较CK增加0.65%和4.62%,1.17%NaCl溶液处理则分别增加6.21%和0.30%,1.46%NaCl溶液处理分别较CK 增加4.43%和22.36%。同时,随着盐处理时间的延长,滨梅植株二年生茎含水率明显降低,如胁 迫80d 后,0.15%、1.17%和1.46% NaCl溶液处理二年生茎含水率比胁迫20d时分别降低27.74%、38.80%和16.88%。
2.4.4 根系水分含量 表1显示,与一、二年生茎不同,随NaCl溶液浓度的提高,滨梅根系含水率均显著升高,除0.88%、1.17%、1.46%处理含水率显著高于CK 外,0.15%处理也表现出了较高的根系含水率;盐胁迫60、80d后,0.15% NaCl溶液处理根系含水率分别为较CK增加14.25%和74.25%,1.17% NaCl溶液处理分别增加29.26%和99.33%,1.46% NaCl溶液处理分别为较CK 增加131.49%和119.99%。另外,相同盐胁迫条件下,根系含水率随胁迫时间的延长未呈现明显降低趋势,这也与一、二年生茎含水率变化趋势不同;如盐胁迫80d后,0.15%、1.17%和1.46% NaCl溶液处理根系含水率分别比胁迫20d 时增加6.30%、76.28%和33.64%(表1)。
2.5 NaCl胁迫对滨梅根系活力的影响
图4显示,滨梅根系活力对NaCl处理的响应随胁迫时间延长而增强。其中,盐胁迫20d后,各盐胁迫处理主根系和须根系活力与CK 差异均不显著;而胁迫40d后,低盐处理组主根系和须根系活力仍与CK 差异不显著,而同期高盐处理组主根系和须根系活力均有显著提升,如1.17%和1.46%NaCl溶液处理主根根系活力分别较CK 显著提高184.86%和265.59%,1.17% NaCl浓度处理须根根系活力也较CK 显著提高212.85%。
3 讨 论
滨梅根、茎、叶中K+、Na+含量高于白榆[8],低于盐地碱蓬[9]。土壤盐含量提高时,滨梅根、茎、叶中Na+含量显著增加,同时K+/Na+则显著降低,这与多数盐生植物在NaCl胁迫下的生理变化规律相一致;盐浓度低于0.88%时,我们发现植株根Na+含量显著高于茎、叶,该结果表明滨梅能通过根系富集Na+来减轻地上部分所受的离子毒害,同时根系K+/Na+低也证明其受到了较强的胁迫影响。此前,作者已经通过嫁接试验证明滨梅与李属其他植物具有较高的亲和性[10],而该结果从耐盐机制上进一步显示滨梅具有作为耐盐砧木的潜力。此外,滨梅叶也具有较强的耐盐能力。Rieger发现在对叶造成伤害的Na+含量阈值方面,滨梅高于桃树(Prunuspersica)和巨树李(Prunusmexicana),并认为其有最好的潜力来提高桃树(Prunuspersica)的叶子对Na+的胁迫耐受性[1]。本试验发现滨梅叶K+含量能随盐胁迫强度的提升而显著增加,因此,尽管盐浓度高于0.88%时叶中Na+含量快速增加,但其依然能保持正常的生理活性,并能保持较为稳定的全叶干重,直至盐浓度达到1.46%时才有明显发黄枯萎迹象。

图4 NaCl胁迫对滨梅根系活力的影响Fig.4 The change of root activity of P.maritima under NaCl stress
除植物体内离子变化外,随土壤盐渍度提高,滨梅生物量下降幅度增大、根系活力增强、含水率显著提升,这些生理变化明确呈现出植株通过消耗体内营养物质以提高抗盐能力的趋势。生物量是植物对盐胁迫反应的综合体现,也是植物耐盐性的直接指标之一[11-12]。本试验中滨梅植株生物量随土壤盐渍程度增加呈先升后降的趋势,这与王利民等[13-14]的研究结果基本一致。进一步分析植株不同部位生物量变化发现:滨梅叶片、一年生茎、二年生茎以及根系不仅对NaCl胁迫的响应强度呈现显著差异,且具有相异的响应变化规律,即NaCl胁迫下生物量变化幅度从大到小分别为根系、一年生茎、叶片、二年生茎。有文献报道,植物在盐碱、干旱等逆境下进行渗透调节及渗透势的维持均需要耗能[15-17],而这种能量消耗常表现为植物体干物质从积累到消耗的转变。随着胁迫时间的延长,滨梅根系干物质在相对较低的盐浓度胁迫下已从积累转变为消耗,但值得关注的是,植株地上部分干物质的显著消耗需要在0.88%的高浓度盐胁迫下才会发生,该结果既表明除去根系后滨梅地上部分仍具有较强的耐盐能力[18],又表明根系对地上部分的盐胁迫起到了较好的保护作用,这与本实验通过观测植物体内离子变化所得到的结论相一致。
不同于盐角草、盐地碱蓬等典型稀盐盐生植物,滨梅根、茎、叶在盐胁迫下均未呈现肉质化趋势,且地上部分含水率也并未随盐胁迫强度的增加而显著提升。与地上部分相比,根系是植物吸收土壤水分和营养物质的器官,也是抵抗土壤盐渍胁迫的初始屏障。杨静等[19]发现在9g·L-1NaCl胁迫下滨梅根系细胞依然能保持较为完整的细胞结构和细胞器形态,而美国白蜡(对照)根系细胞在3g·L-1NaCl胁迫下就受到严重破坏。本试验中不同浓度NaCl胁迫下滨梅根系含水率显著提升,同时盐胁迫还引起了根系活力的增加[20]。另外,进一步比较滨梅须根系和主根系的活力变化趋势发现,吸收水分能力更强的主根系活力随盐胁迫强度的增加显著提升,而须根系活力则呈现先升高后降低的趋势,这些根系生理变化均表明滨梅根系具有稀释盐分从而抵御盐胁迫的能力。已有数据显示滨梅根系生理状态的改变对其耐盐能力的提升有明显驱动作用[21],本研究结果也证实滨梅根系的聚盐、稀盐能力在植株抗盐胁迫过程中占重要地位。此外,滨梅二年生茎含水率在不同浓度NaCl处理下无显著差异,虽然随土壤盐胁迫时间延长而不断降低,但仍较对照高,说明滨梅二年生茎可能具有与根系类似的稀盐保护能力;叶片与一年生茎的含水率在不同浓度NaCl短期处理下无显著差异,但较对照降低,同时随土壤NaCl胁迫时间延长不断降低并达到显著水平,说明滨梅叶片与当年新生茎对盐胁迫较为敏感,也从一个侧面反映根系对植株地上部分保护的必要性。
[1]RIEGER M.Salt stress resistance of peach and four North AmericanPrunusspecies[J].ISHSActaHorticulturae,2001,557:181-192.
[2]RIEGER M,DUEMMEL M J.Comparison of drought resistance amongPrunusspecies from divergent habitats[J].TreePhysiology,1992,11(4):369-380.
[3]FANG K(方 逵),GONG J P(龚津平),YAN D L(闫道良),etal.The micropropagation establishment ofPrunusmaritime[J].Journal ofNanjingUniversity(Nat.Sci.Edi.)(南京大学学报·自然科学版),2006,42(5):490-498(in Chinese).
[4]YAN D L(闫道良),WANG G(王 光),FANG K(方 逵),etal.Tissue culture and rapid propagation ofPrunusmaritimaMarshall[J].PlantPhysiologyCommunications(植物生理学通讯),2006,42(5):921-921(in Chinese).
[5]FU S J(付素静),ZHOU Y ZH(周玉珍).Tissue culture technology forPrunusmaritimeMarshall[J].GuangxiAgricultureSciences(广西农业科学),2009,40(8):969-971(in Chinese).
[6]TENG SH Y(滕士元),HE Y F(何云芳),SHI J Q(史骥清).Genetic variation ofPrunusmaritimacollected from different provenances[J].ChinaForestryScienceandTechnology(林业科技开发),2009,23(1):75-77(in Chinese).
[7]LI D SH(李冬顺),YANG J S(杨劲松),ZHOU J(周 静).Determination and conversion of extracting liquid conductivity of saline soil from Huanghuaihai Plain[J].ChineseJournalofSoilScience(土壤通报),1996,27(6):285-287(in Chinese).
[8]LIU B X(刘炳响),WANG ZH G(王志刚),LIANG H Y(梁海永),etal.Effects of salt stress on physiological characters and salt-tolerance ofUlmuspumilain different habitats[J].ChineseJournalofAppliedEcology(应用生态学报),2012,23(6):1 481-1 489(in Chinese).
[9]ZHAO M(赵 勐),FAN H(范 海),ZHAO K F(赵可夫).Effects of NaCl,KCl and NaNO3on the growth and ion composition and distribution inSuaedasalsa(L.)pall[J].PlantPhysiologyCommunications(植物生理学通讯),2008,44(2):263-267(in Chinese).
[10]WANG X M(王小敏),ZHANG CH H(张春红),WU W L(吴文龙),etal.Develop beach plum as a new multipurpose crop for coastal beach and waste land in China[J].ForestInventoryandPlanning(林业调查规划),2012,37(2):73-75(in Chinese).
[11]WANG D M(王东明),JIA Y(贾 媛),CUI J ZH(崔继哲).Advances in research on effects of salt stress on plant and adaptive mechanism of the plant to salinity[J].ChineseAgriculturalScienceBulletin(中国农学通报),2009,25(4):124-128(in Chinese).
[12]XIA Y(夏 阳),LIN SH(林 杉),ZHANG F S(张福锁),etal.Effect of foliar leaching on growth and mineral nutrient contents of soybean under NaCl stress[J].ActaPedologicaSinica(土壤学报),2003,40(1):155-159(in Chinese).
[13]WANG L M(王利民),CHEN J L(陈金林),LIANG ZH H(梁珍海),etal.Responses of beach plum(Prunusmaritima)seedlings to NaCl stress using pot culture experiments[J].JournalofNanjingForestryUniversity(Nat.Sci.Edi.)(南京林业大学学报·自然科学版),2010a,34(3):89-92(in Chinese).
[14]LI J N(李婧 男),LIU Q(刘 强),JIA ZH K(贾志宽),etal.Effects of salt stress on growth and physiological characteristic ofAmmopiptanthusmongolicusseedlings[J].BulletinofBotanicalResearch(植物研究),2009,29(5):553-558(in Chinese).
[15]赵可夫,李法曾.中国盐生植物[M].北京:科学出版社,1999:17-75,173-177.
[16]XU Y L(徐云岭),YU SH W(余叔文).Plant energy consumption in the process of adapting to salt stress[J].PlantPhysiologyCommunications(植物生理学通讯),1990,6:70-73(in Chinese).
[17]YANG G P(杨根平),WANG SH T(王韶唐).Effects of osmotic stress on the respiration of wheat roots[J].ActaPhytophysiologica Sinica(植物生理学报),1989,15(2):178-183(in Chinese).
[18]YAN D L(闫道良),GUO Y Q(郭予琦),ZAI X M(宰学明),etal.Effects of different concentrations of NaCl on growth and some physiological indexes of stem segments in beach plum(PrunusmaritimeMarshall)[J].PlantPhysiologyCommunications(植物生理学通讯),2008,44(2):273-275(in Chinese).
[19]YANG J(杨 静),CHEN J L(陈金林),XU B S(徐柏森),etal.Effect of salt stress on root ultrastructure ofFraxinusamericanaandPrunusmaritima[J].JournalofSouthwestForestryUniversity(西南林学院学报),2009,29(5):23-27(in Chinese).
[20]SECHENBATER(斯琴巴特尔),WU H Y(吴红英).Effect of different stress on roots activity and nitrate reductaseactivity inZeamaysL[J].AgriculturalResearchintheAridAreas(干旱地区农业研究),2001,19(2):67-70(in Chinese).
[21]ZAI X M(宰学明),ZHANG H SH(张焕仕),QIN P(钦 佩).Effect of AM fungi on growth and nutrient absorption ofPrunusmaritimaseedlings under NaCl stress[J].SouthChinaFruits(中国南方果树),2013,42(1):25-28(in Chinese).
