干旱胁迫对金花茶幼苗光合生理特性的影响
2015-07-04柴胜丰唐健民王满莲陈宗游蒋运生
柴胜丰,唐健民,王满莲,陈宗游,蒋运生,韦 霄
(广西壮族自治区中国科学院广西植物研究所,广西桂林541006)
水分是影响植物生长的重要环境因子之一,它对植物的生长、生存和发育非常重要[1]。植物对环境的适应取决于环境的水分供应状况,树木对水分条件的要求和适应是其水分关系上的重要特性。与非濒危植物相比,濒危植物在生理生态学方面存在生存力、适应力较差的共性[2],多数濒危植物表现出不耐干旱的生理特性。经常性的干旱胁迫可能是华山新麦草濒危的原因之一[3];重度水分胁迫是制约夏蜡梅生存的重要环境因子[4];干旱是云南金钱槭分布的主要限制因素[5];珙桐幼苗对土壤干旱胁迫极为敏感[6];较高的土壤湿度有利于焕镛木的生长[7]。对濒危植物水分生理的研究不仅有利于揭示其濒危机制,而且可为其迁地保护和引种栽培提供理论依据。
金花茶(Camelliapetelotii)为山茶科(Theaceae)山茶属(Camellia)金花茶组(Sect.ChrysanthaChang)常绿灌木或小乔木,是世界珍稀的观赏植物和种质资源,被誉为“茶族皇后”,亦是培育黄色系山茶新品种的珍贵材料,具有极高的观赏价值和科研价值[8]。该物种已列入国家一级保护植物和国际生物多样性公约附属II物种[9-10]。目前,关于金花茶的研究主要集中在居群生物学[11]、生殖生态学[12-13]、光合生理[14-15]、保护遗传学[16-17]、引种栽培及繁殖[18-19]等方面,而关于金花茶水分生理,仅见杨期和[20]对不同水势Hoagland营养液下生长的金花茶幼苗的净光合速率的报道,结果表明金花茶不耐干旱,即使轻度水分亏缺也会抑制其光合作用。然而,该试验未能分析金花茶在干旱胁迫下光合速率下降的原因,以及金花茶对干旱胁迫的耐受极限。为此,本试验采用盆栽控水模拟不同程度的土壤水分状况,研究干旱胁迫对金花茶幼苗气体交换参数、叶绿素荧光参数、叶片相对含水量以及光合色素、脯氨酸、丙二醛含量等光合生理指标的影响,探讨其光合作用对干旱胁迫的响应规律,以确定影响其苗木生长的土壤含水量阈值,为金花茶的保护及开发利用提供科学依据,也为揭示其濒危机制奠定基础。
1 材料和方法
1.1 材料处理
试验在广西植物研究所苗圃玻璃房内进行,棚内光照强度为自然光强的20%左右。6月选取长势基本一致的一年生实生苗,移栽于内径30cm、深25 cm 的塑料花盆中,每盆1株,栽培基质为表层田园土,每盆土重约5kg,土壤田间持水量为30.08%。从栽种之日起至开始试验这段时间,保证土壤水分充足,确保苗木成活和试验处理的一致性。试验共设置4种土壤水分处理,它们的土壤含水量分别为田间持水量的85%~90%(25.50%~27.10%)、65%~70%(19.55% ~21.06%)、50% ~55%(15.04% ~16.54%)、35% ~40%(10.53% ~12.03%),依次用CK、T1、T2、T3表示。每处理10盆,共40株。9月初所有试验盆土都达到预定含水量后即开始控水,每天18:00称取盆重,补充当天失去的水分,使各处理土壤含水量保持在设定的水平,干旱胁迫15d后测定各处理植株的光合生理指标。
1.2 测定项目与方法
干旱胁迫结束后,选择植株顶端向下第3~5片成熟功能叶,进行气体交换参数、叶绿素荧光参数、叶片相对含水量、光合色素、丙二醛和脯氨酸含量等各项指标的测定。本试验中金花茶幼苗在T3处理下因干旱全部死亡,所以仅对其余3个处理进行了光合生理指标的测定。
1.2.1 气体交换参数 采用Li-6400便携式光合测定系统分析仪(USA,LI-COR)测定苗木在不同干旱胁迫条件下的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)等光合特性指标,并计算水分利用效率(WUE=Pn/Tr)和气孔限制值(Ls=1-Ci/Ca,其中Ca为空气CO2浓度)。测定时间为9:00~11:00,测定时光合有效辐射设置为200μmol·m-2·s-1,控制叶室温度为28℃,样本室CO2浓度为370μmol·mol-1。每处理测定5株,每株测定3片叶,取其平均值。
1.2.2 叶绿素荧光参数 采用Li-6400的荧光叶室测定叶片叶绿素荧光参数。叶片暗适应20 min后,测定初始荧光(F0)、最大荧光(Fm)和PSⅡ最大光化学效率(Fv/Fm);并测定光适应下(最少20 min)的PSⅡ实际光化学量子效率(ΦPSⅡ)。每处理测定5株,每株测定3片叶,取其平均值。
1.2.3 光合色素含量 用95%乙醇提取叶片光合色素,测定提取液在波长665、649和470nm 下吸光值,按公式[21]计算出叶绿素a(Chl a)、叶绿素b(Chl b)和类胡萝卜素(Car)的含量及叶绿素a与叶绿素b的比值(Chl a/Chl b)、类胡萝卜素与叶绿素的比值(Car/Chl)。
1.2.4 叶片相对含水量、丙二醛和脯氨酸含量 叶片相对含水量(RWC)按邹琦[22]方法测定。取鲜叶称其鲜质量,然后在蒸馏水中浸泡24h后称饱和鲜质量,最后在105℃下烘干称其干质量。计算公式为:相对含水量(RWC,%)=[(鲜质量-干质量)/(饱和鲜质量-干质量)]×100%。丙二醛(MDA)含量采用硫代巴比妥酸比色法测定,脯氨酸(Pro)含量采用磺基水杨酸法测定[21]。
1.3 数据处理
数据利用SPSS13.0软件进行方差分析及显著性检验(Duncan法),用Sigma Plot 9.0绘图。
2 结果与分析
2.1 干旱胁迫对金花茶幼苗气体交换参数的影响
实验过程中,在重度干旱胁迫(T3处理)下,金花茶植株都因干旱而死亡。表明金花茶幼苗对干旱胁迫的耐受极限为田间持水量的50%~55%(土壤含水量为15.04%~16.54%)。
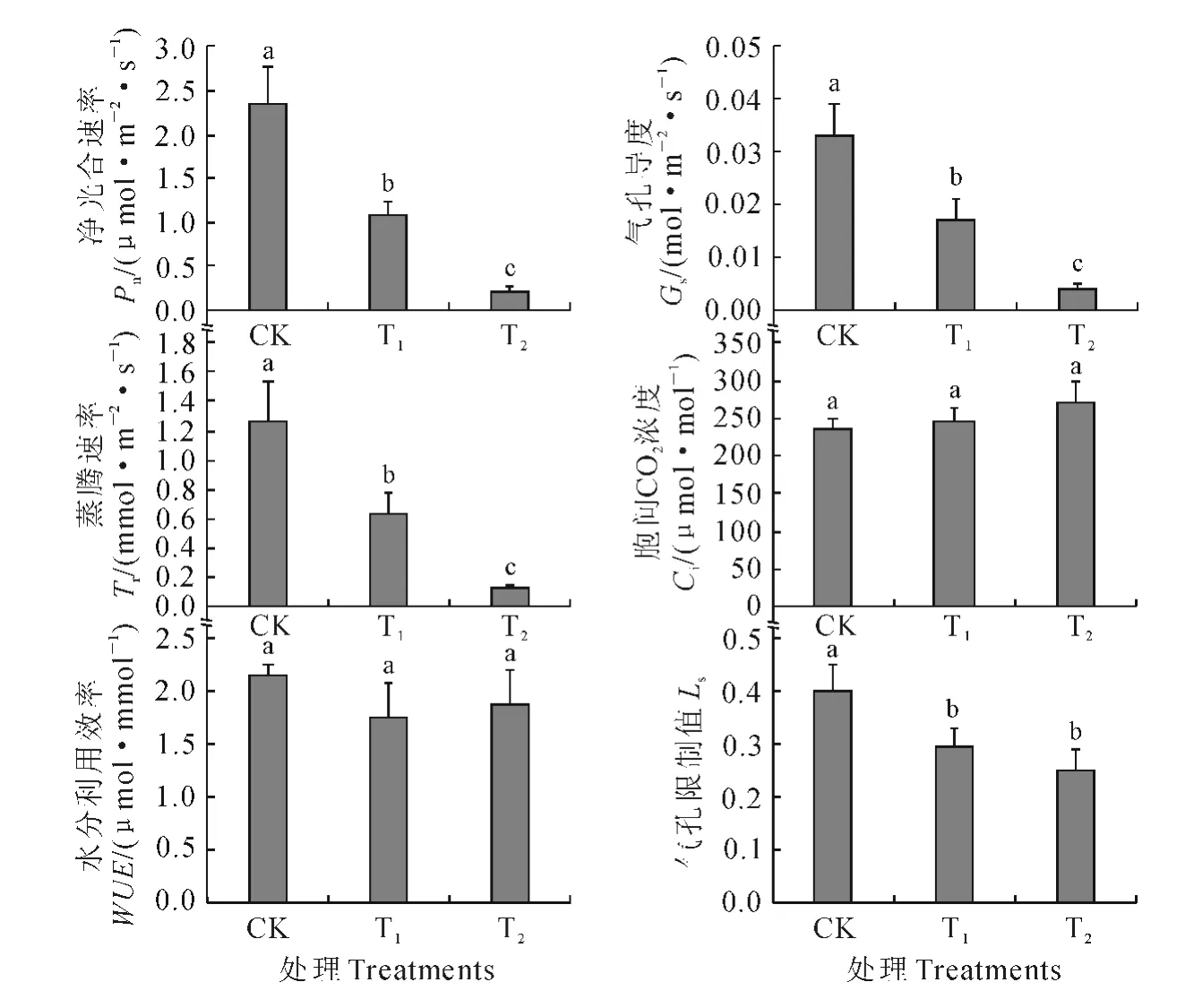
图1 干旱胁迫下金花茶幼苗气体交换参数的变化Fig.1 The gas-exchange parameters in C.petelotii seedlings under drought stress
干旱胁迫对金花茶幼苗的气体交换参数有重要影响(图1)。其中,金花茶幼苗Pn、Gs、Tr和Ls均随干旱胁迫程度的升高而显著(P<0.05)降低。与CK 相 比,T1处理的Pn、Gs和Tr分别显著下降54.5%、48.5%和50.0%,T2处理下则分别显著下降90.6%、87.9%和90.5%。在干旱胁迫条件下,金花茶幼苗Ci略有升高,WUE呈降低趋势,但变化均不显著(P<0.05)。这表明金花茶对干旱胁迫十分敏感,轻度水分亏缺即可引起光合速率的迅速大幅下降。
2.2 干旱胁迫对金花茶幼苗叶绿素荧光参数的影响
初始荧光(F0)是PSⅡ反应中心处于完全开放时的荧光产量,其减少表明天线色素的热耗散增加,其增加则表明PSⅡ反应中心遭受可逆失活或破坏[23];最大荧光(Fm)是PSⅡ反应中心处于完全关闭时的荧光产量,可反映通过PSⅡ的电子传递情况[24];PSⅡ最大光化学效率(Fv/Fm)反映PSⅡ反应中心原初光能转化效率,该值降低表明植物在胁迫下PSⅡ受到伤害,是反映光抑制程度的良好指标[25]。表1显示,随着干旱胁迫程度的加剧,金花茶幼苗F0升高,而Fm和Fv/Fm则呈下降趋势,且它们在T2处理下与CK 相比均差异显著(P<0.05)。这表明干旱胁迫条件下,尤其是在T2处理下,金花茶PSⅡ的结构与功能受到了一定程度的损伤与破坏。
PSⅡ实际光化学量子效率(ΦPSⅡ)反映PSⅡ反应中心部分关闭情况下的实际光能捕获效率[26]。随着干旱胁迫程度的加剧,金花茶幼苗ΦPSⅡ均比CK 显著降低(P<0.05),T1和T2处理的降幅分别为29.2%和56.9%(表1)。可见,干旱胁迫使得金花茶PSⅡ反应中心的开放比例下降,叶绿体吸收的光能用于光化学转换的比例减少,光合电子传递能力降低,光合速率降低。
2.3 干旱胁迫对金花茶幼苗叶片光合色素含量的影响
叶片中的光合色素参与光合作用过程中光能的吸收、传递和转化,光合色素含量直接影响植物的光合能力。随着干旱胁迫程度的加剧,金花茶幼苗叶片Chl a含量、Chl b含量、Chl总量和Car含量均显著降低(P<0.05),Chl a/Chl b和Car/Chl亦呈下降趋势,且大多与对照差异达到显著水平(表2)。即不同程度的干旱胁迫都显著影响着金花茶的光合色素含量及其比例,从而制约了其光合能力。
2.4 干旱胁迫对金花茶幼苗叶片RWC、MDA 和Pro含量的影响
叶片相对含水量(RWC)能真实反映土壤缺水时植物体内水分的亏缺程度。随着干旱胁迫程度的加剧,金花茶幼苗叶片RWC显著降低(图2),其在T1和T2处理下分别比CK 下降了11.84%和30.59%,表明在干旱胁迫条件下金花茶叶片的保水能力较差。同时,丙二醛(MDA)是脂质过氧化作用的主要产物之一,其含量的高低在一定程度上反映脂膜过氧化作用水平和膜结构的受害程度。图2 显示,与CK相比,T2处理下金花茶幼苗叶片MDA 含量显著升高11.79%(P<0.05),即T2处理下金花茶光合机构膜系统受到明显破坏。另外,脯氨酸(Pro)具有较强的水合力,它的积累可增加植物的抗旱或抗渗透胁迫能力。与CK 相比,T1处理下金花茶幼苗叶片Pro含量显著(图2)升高,这是金花茶对轻度干旱胁迫的生理适应机制;而T2处理下Pro含量又稍低于CK,表明此时干旱胁迫的程度已超出金花茶的耐受限度,金花茶抵抗干旱胁迫的能力较弱。
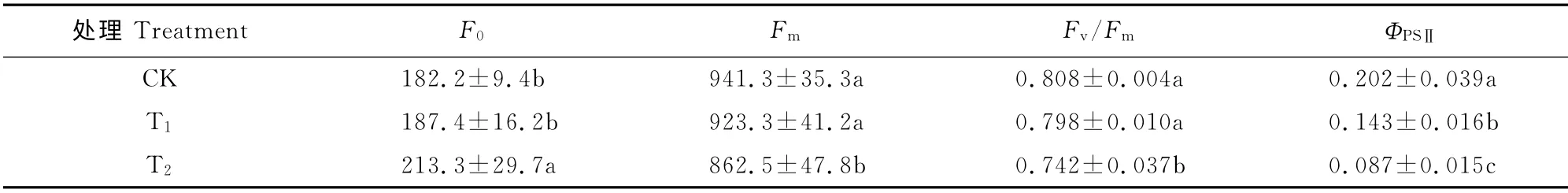
表1 干旱胁迫下金花茶幼苗叶绿素荧光参数的变化Table 1 The chlorophyll fluorescence parameters in C.petelotii seedlings under drought stress

表2 干旱胁迫下金花茶幼苗叶片光合色素含量及比例的变化Table 2 The concentration and ratio of photosynthetic pigments in leaves of C.petelotii seedlings under drought stress
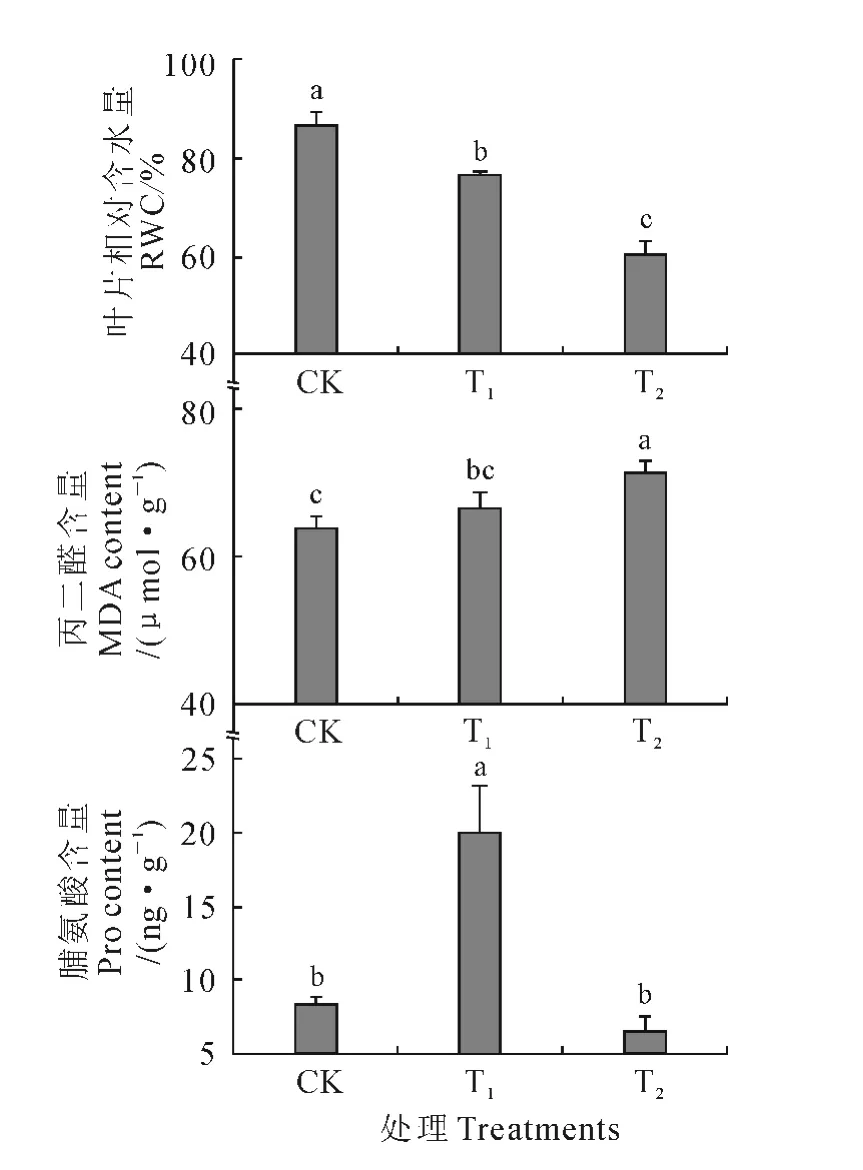
图2 干旱胁迫下金花茶幼苗叶片相对含水量、丙二醛和脯氨酸含量变化Fig.2 The RWC,MDA and Pro contents in leaves of C.petelotii seedlings under drought stress
3 结论与讨论
干旱胁迫抑制植物的光合作用,使光合速率下降。这种影响分为气孔因素和非气孔因素,前者指由于干旱胁迫引起植物叶片气孔导度下降,使CO2从大气向叶片扩散减少进而对植物光合作用的影响;后者指叶肉细胞的光合能力直接受到的影响[27]。Farquhar等[28]认为,引起光合速率降低的气孔和非气孔限制因素可以根据Ci和Ls的变化来判断,其中Ci是关键因子。只有Pn下降伴随着Ci降低和Ls升高时,才可以认为Pn的下降主要是受气孔限制所致;反之,如果Pn下降的同时,Ci升高或者不变,同时Ls降低,则光合作用的主要限制因素是非气孔因素,即叶肉细胞光合能力的下降。本研究结果显示,随着干旱胁迫程度的加剧,金花茶幼苗叶片Pn快速降低,而Ci略有升高,且Ls下降,表明金花茶幼苗Pn的降低主要为非气孔限制因素所致。一般认为,在轻度干旱胁迫下Pn的下降主要是气孔限制,中度到严重干旱胁迫时,主要限制转化为非气孔因素。本试验中,金花茶在轻度干旱胁迫(T1处理)下即表现为非气孔限制,这与其它大多数植物的相关研究结果并不一致[29-31],表明金花茶对干旱胁迫十分敏感,轻度水分亏缺即可引起叶肉细胞光合能力的迅速下降,干旱胁迫导致了核酮糖1,5 二磷酸羧化酶/加氧酶(Rubisco)活性降低,CO2与核酮糖-1,5-二磷酸(RuBP)的羧化反应速率降低[32]。在中度干旱胁迫(T2处理)下,Pn的下降达到90%以上,部分植株的Pn甚至出现负值,此时金花茶幼苗已达到其干旱耐受极限。在重度干旱胁迫(T3处理)下,金花茶植株都因干旱而死亡。表明金花茶幼苗对干旱胁迫的耐受极限为田间持水量的50%~55%(土壤含水量为15.04%~16.54%),低于此含水量后将不能生存。这与金花茶在野外的分布范围相一致,金花茶多见于较荫蔽的沟谷两旁和林下溪边,对水湿条件的要求较高,其不耐干旱的生理特性可能是限制其种群扩散的一个重要原因。
干旱胁迫对植物光合作用的影响是多方面的,不仅直接引发光合机构的损伤,同时也影响光合电子传递和光合磷酸化以及暗反应的有关酶系[33]。利用叶绿素荧光动力学方法可快速、灵敏、无损伤探测干旱胁迫对植物光合作用的影响[34]。本研究结果显示,金花茶幼苗叶片F0、Fm、Fv/Fm在T1处理下与CK 无显著差异,而在T2处理下,F0显著高于CK,Fm和Fv/Fm则显著低于CK。结合叶片MDA含量在T2处理下显著高于CK 的表现,可以推测金花茶幼苗的PSⅡ反应中心在T1处理下并未遭到破坏,其光合速率的下降可能与叶绿体和光合酶活性降低、光合磷酸化受到影响有关;而在T2处理下,金花茶幼苗叶肉细胞受到损伤,PSⅡ反应中心受到不可逆破坏,光合酶的活性降低,光合作用光反应中光能转换、电子传递、光合磷酸化和光合作用暗反应等一系列过程受到抑制,导致植株光合速率降低。另外,本实验中干旱胁迫下叶片ΦPSⅡ显著低于CK,表明干旱胁迫致使金花茶PSⅡ光化学量子产量下降,用于光化学反应的比例减少,PSⅡ原初受体QA的氧化态数量降低,从而降低了QA与QB间的电子传递速率,使整个电子传递链的电子传递速率下降,叶片吸收的光能中有较大比例通过非光化过程而散失。这是金花茶在干旱胁迫下光合速率降低的重要原因,亦是其保护光合机构的方式之一。
叶绿素含量的高低在一定程度上能反映叶片的光合能力,如能在适度干旱下保持叶绿素含量的稳定或有所提高,将有助于植物在逆境中生存生长[35]。而在本试验中,T1处理下金花茶幼苗叶片Chl a、Chl b、Chl总量和Car含量均显著低于CK,表明金花茶叶片光合色素含量对干旱胁迫十分敏感,进一步说明金花茶不耐干旱。同时,Chl a/Chl b值反映了植物对干旱胁迫的敏感性及抗旱性[36],在本实验中,干旱胁迫下金花茶幼苗叶片Chl a/Chl b值显著降低,这与其不耐干旱的特性相吻合。
叶片相对含水量是衡量植物耐旱性的一个重要指标,且其值越大,干旱胁迫条件下其下降速率越小,则植物抗旱性越强[29]。而Pro是植物体内的重要渗透调节物质之一,干旱胁迫下它在植物体内累积量可增加到原始含量的几十倍到几百倍,从而保护植物免受脱水伤害[37]。本试验中,金花茶幼苗叶片相对含水量在T1处理下就显著低于CK,在T2处理下,叶片下垂严重,部分叶片枯萎脱落;而T1处理下金花茶幼苗叶片的Pro含量仅为CK 的2.39倍,T2处理下甚至还低于CK。这表明金花茶并没有较好地适应干旱的生理机制,充分证明了金花茶不耐干旱。
综上所述,金花茶幼苗对干旱胁迫极为敏感,水分稍有亏缺,便会明显抑制其光合作用。干旱胁迫下金花茶幼苗光合速率降低的主要原因是由非气孔因素所致。金花茶幼苗对干旱胁迫的耐受极限为田间持水量的50%~55%(土壤含水量为15.04%~16.54%),其不耐干旱的生理特性可能是限制其种群扩散的一个重要原因。
[1]LI X(李 霞),YAN X F(阎秀峰),YU T(于 涛).Effects of water stress on protective enzyme activities and lipid peroxidation inPhellodendronamurenseseedlings[J].ChineseJournalofAppliedEcology(应用生态学报),2005,16(12):2 353-2 356(in Chinese).
[2]ZHANG W H(张文辉),ZU Y G(祖元刚),LIU G B(刘 国彬).Population ecological characteristics and analysis on endangered cause of ten endangered plant species[J].ActaEcologySinica(生态学报),2002,22(9):1 512-1 520(in Chinese).
[3]LI Q(李 倩),WANG M(王 明),WANG W W(王雯雯),etal.Response of photosynthetic characteristics ofPsathyrostachyshuashanicaKeng to drought stress[J].ActaEcologySinica(生态学报),2012,32(12):4 278-4 284(in Chinese).
[4]KE SH SH(柯世省),JIN Z X(金则新).Effects of water stress and temperature on gas exchange and chlorophyll fluorescence ofSinocalycanthuschinensisleaves[J].ChineseJournalofAppliedEcology(应用生态学报),2008,19(1):43-49(in Chinese).
[5]DENG Y(邓 云),WANG B(王 冰),SU W H(苏文华),etal.Adaptability of endangered plantDipteroniadyeranaunder irradiance and water stress[J].ChineseJournalofEcology(生态学杂志),2008,27(6):888-893(in Chinese).
[6]WANG N N(王宁宁),HU Z H(胡增辉),SHEN Y B(沈应柏).Photosynthetic characteristics ofDavidiainvolucrataBaill.seedlings under soil drought stress[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2011,31(1):101-108(in Chinese).
[7]ZENG X P(曾小平),ZHAO P(赵 平),CAI X A(蔡锡安),etal.Physioecological characteristics ofWoonyoungiaseptentrionalisseedlings under various soil water conditions[J].ChineseJournalofEcology(生态学杂志),2004,23(2):26-31(in Chinese).
[8]梁盛业.金花茶[M].北京:中国林业出版社,1993.
[9]傅立国.中国植物红皮书[M].北京:科学出版社,1992.
[10]HUANG F P(黄付平).Study on community types ofCamellianitidissima[J].GuangxiForestryScience(广西林业科学),2001,30(1):35-38(in Chinese).
[11]HUANG M CH(黄明钗),SHI Y C(史艳财),WEI X(韦 霄),etal.Point pattern analysis of rare and endangered plantCamellianitidissimaChi.[J].ChineseJournalofEcology(生态学杂志),2013,32(5):1 127-1 134(in Chinese).
[12]CHAI SH F(柴胜丰),WEI X(韦 霄),JIANG Y SH(蒋运生),etal.The flowing phenology and characteristics of reproductive modules of endangered plantCamellianitidissima[J].JournalofTropicalandSubtropicalBotany(热带亚热带植物学报),2009,17(1):5-11(in Chinese).
[13]YANG Q H,WEI X,ZENG X L,etal.Seed biology and germination ecophysiology ofCamellianitidissima[J].ForestEcologyandManagement,2008,255:113-118.
[14]CHAI SH F(柴胜丰),WEI X(韦 霄),SHI Y C(史艳财),etal.Effect of strong light stress on the growth,biomass and chlorophyll fluorescence parameters in seedlings of endangered plantCamellianitidissima[J].BulletinofBotanicalResearch(植物研究),2012,32(2):159-164(in Chinese).
[15]WEI X,JIANG Y S,JIANG S Y,etal.Photosynthetic characteristics of an endangered speciesCamellianitidissimaand its widespread congenerCamelliasinensis[J].Photosynthetica,2008,46(2):312-314.
[16]TANG S Q,BIN X Y,WANG L,etal.Genetic diversity and population structure of Yellow Camellia(Camellianitidissima)in China as revealed by RAPD and AFLP markers[J].BiochemicalGenetics,2006,44:449-461.
[17]WEI X,CAO H L,JIANG Y S,etal.Population genetic structure ofCamellianitidissima(Theaceae)and conservation implications[J].BotanicalStudies,2008,49:147-153.
[18]ZHANG Z X(张宗享),HUANG Q B(黄启斌).Propagation ofCamellianitidissima[J].Guihaia(广西植物),1981,1(2):34-39(in Chinese).
[19]WEI J Q(韦记青),JIANG Y SH(蒋运生),TANG H(唐 辉),etal.Cutting techniques ofCamellianitidissima[J].JournalofGuangxiNormalUniversity(Nat.Sci.Edi.)(广西师范大学学报·自然科学版),2010,28(3):70-74(in Chinese).
[20]YANG Q H(杨期和),LI X Q(李旭群),YANG H SH(杨和生),etal.Photosynthetic ecophysiological characteristics ofCamellianitidissimaseedlings[J].JournalofBeijingForestryUniversity(北京林业大学学报),2010,32(2):57-63(in Chinese).
[21]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[22]邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[23]KRAUSE G H.Photoinhibition of photosynthesis:an evaluation of damaging and protective mechanisms[J].PhysiologiaPlantarum,1988,74:566-574.
[24]WU G L(吴甘霖),DUAN R Y(段仁燕),WANG ZH G(王志高),etal.Effects of drought stress and rehydration on chlorophyll fluorescence characteristics inFragaria×ananassaDuch[J].ActaEcologySinica(生态学报),2010,30(14):3 941-3 946(in Chinese).
[25]ZHANG SH R(张守仁).A discussion on chlorophyll fluorescence kinetics parameters and their significance[J].ChineseBulletinofBotany(植物学通报),1999,16(4):444-448(in Chinese).
[26]WANG Y(王 琰),CHEN J W(陈建文),DI X Y(狄晓艳).Characterization of the responses of photosynthetic and chlorophyll fluorescence parameters to water stress in seedlings of six provenances of Chinese Pine(PinustabulaeformisCarr.)[J].ActaEcologySinica(生态学报),2011,31(23):7 031-7 038(in Chinese).
[27]ZHAN Y N(詹妍妮),YU S L(郁松林),CHEN P Q(陈培琴).Review of progress in response to fruit tress under water stress[J].ChineseAgriculturalScienceBulletin(中国农学通报),2006,22(4):239-243(in Chinese).
[28]FARQUARH G D,SHARKEY T D.Stomatal conductance and photosynthesis Ann Rev[J].PlantPhysiology,1982,33:317-345.
[29]YAO SH F(姚史飞),YIN L(尹 丽),HU T X(胡庭兴),etal.Effect s of drought stress on photosynthetic characteristic and growth ofJatrophacurcasL.seedlings[J].JournalofSichuanAgriculturalUniversity(四川农业大学学报),2009,27(4):444-449(in Chinese).
[30]LI J(李 娟),PENG ZH H(彭镇华),GAO J(高 健),etal.Photosynthetic parameters and chlorophyll fluorescence characteristics ofPleioblastuskongosanensisf.aurestriausunder drought stress[J].ChineseJournalofAppliedEcology(应 用生态学报),2011,22(6):1 395-1 402(in Chinese).
[31]PEI B(裴 斌),ZHANG G C(张光灿),ZHANG SH Y(张淑勇),etal.Effects of soil drought stress on photosynthetic characteristics and antioxidant enzyme activities inHippophaerhamnoidesLinn.seedlings[J].ActaEcologySinica(生态学报),2013,33(5):1 386-1 396(in Chinese).
[32]LAL A,KU M S B,EDWARDS G E.Analysis of inhibition of photosynthesis due to water stress in the C3speciesHordeumvulgareandViciafaba:electron transport,CO2fixation and carboxylation capacity[J].PhotosyntheticResearch,1996,49:57-69.
[33]GUO CH F(郭春芳),SUN Y(孙 云),TANG Y H(唐玉海),etal.Effect of water stress on chlorophyll fluorescence in leaves of tea plant(Camelliasinensis)[J].ChineseJournalofEco-Agriculture(中国生态农业学报),2009,17(3):560-564(in Chinese).
[34]LI X(李 晓),FENG W(冯 伟),ZENG X CH(曾晓春).Advances in chlorophyll fluorescence analysis and its uses[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2006,26(10):2 186-2 196(in Chinese).
[35]AN Y Y(安玉艳),LIANG Z S(梁宗锁),HAN R L(韩蕊莲),etal.Effect of soil drought on seedling growth and water metabolism of three tree species in Loess Plateau[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2007,27(1):91-97(in Chinese).
[36]ZHANG M SH(张明生),TAN F(谈 锋).Relationship between ratio of chlorophyll a and b under water stress and drought resistance of different sweet potato varieties[J].Seed(种子),2001,116:23-25(in Chinese).
[37]LI Z J(李在军),LENG P SH(冷平生),CONG ZH F(丛者福).The physiological response ofPistaciachinensisBunge to drought stress[J].JournalofPlantResourcesandEnvironment(植物资源与环境学报),2006,15(3):47-50(in Chinese).
