Pt系催化剂在丙烷脱氢反应中的研究进展
2015-07-02刘昌呈马爱增荣峻峰达志坚
刘 杰,刘昌呈,马爱增,荣峻峰,达志坚
(中国石化 石油化工科学研究院,北京 100083)
Pt系催化剂在丙烷脱氢反应中的研究进展
刘 杰,刘昌呈,马爱增,荣峻峰,达志坚
(中国石化 石油化工科学研究院,北京 100083)
丙烯是重要的有机化工原料和石油化工中间体。近年来,受丙烯下游产业的拉动,国内外对丙烯的需求持续增长。丙烷直接脱氢技术是只以丙烷为原料生产丙烯的工艺,具有收率高、技术成熟、投资成本低的特点,受到广泛重视。综述了针对丙烷直接脱氢技术的Pt系催化剂的作用机理、制备方法、动力学及失活行为,初步讨论了新型纳米碳材料催化剂在该技术中的应用研究,总结了目前催化剂研究中存在的一些问题,并提出了相应的改进方法。
丙烷脱氢;Pt系催化剂;纳米碳材料;有序介孔碳;纳米金刚石
丙烯主要用以生产聚丙烯、环氧丙烷、丙烯腈、丙烯酸等,是仅次于乙烯的重要的有机化工原料和石油化工中间体。近年来,受丙烯下游产业的拉动,全球丙烯需求持续增长[1]。在全球丙烯需求中,中国占了15%以上,并且消费量仍以每年5%~6%的速度增长[2]。
目前,丙烯主要来源于石脑油蒸汽裂解制乙烯的联产及石油催化裂化的副产。近年来,随着页岩气的开采与应用,生产乙烯的原料由高价的石脑油转向廉价的乙烷,以降低生产成本。但这种变化导致丙烯产量降低为原来的1/6左右;另外,尽管降低裂解深度可以增产丙烯,但丙烯与乙烯之比不宜超过0.65,否则总低碳烯烃收率下降,影响经济性,再则石脑油的供给也存在限制。这两个因素导致了丙烯产量的大幅减少[1, 3]。炼油厂催化裂化副产是丙烯的第二大来源,但丙烯只占催化裂化装置产量的3%~6%,尽管通过优化运行可以提高丙烯收率,但需要牺牲汽、柴、煤等成品油作为代价,导致丙烯增幅有限[3]。总的来说,传统丙烯生产方法不能满足其持续增长的需求,寻找新型丙烯生产方法迫在眉睫。
除石脑油蒸汽裂解制乙烯的联产及催化裂化的副产外,还有一些生产丙烯的新工艺,主要包括丙烷直接脱氢(PDH,以下简称丙烷脱氢)、深度催化裂化(DCC)、甲醇制丙烯(MTP)、高碳烯烃裂解、烯烃歧化等。DCC工艺通过改变催化裂化的工艺条件以增产丙烯,可提高汽油质量,但成本高且汽油收率低;MTP工艺通过煤制得甲醇,再由甲醇催化制得丙烯,其优点是原料丰富,但投资高,依赖煤和水资源;高碳烯烃裂解工艺主要以C4~C8烯烃为原料,投资小,成本适中,但副产物多,技术成熟度低;烯烃歧化工艺依靠乙烯和丁二烯歧化生产丙烯,多用于石脑油裂解装置的改造以增产丙烯,该法装置改造费用低,但盈利受制于乙烯价格。
丙烷脱氢工艺是只用一种原料丙烷生产单一产品丙烯的工艺,具有收率高、技术成熟度高、投资成本较低的特点,是目前最具竞争力的丙烯生产工艺[1]。丙烯和丙烷间较大的价差保证了国内丙烷脱氢项目的获利能力。另外,在我国,丙烷大量存在于天然气、油田轻烃及炼厂气中,一般只用于民用燃烧甚至放空;在天然气资源丰富而石油资源较匮乏的国情下,开展低价值原料(天然气等)的高附加值化(生成丙烯等)研究很有必要[4]。
目前,世界上丙烷脱氢的工艺主要有UOP的Oleflex工艺、ABB Lummus的Catofin工艺、Krupp Uhde公司的Star工艺、俄罗斯Yarsintez与意大利Snamprogetti工程公司联合开发的FBD工艺、德国Linde公司和BASF共同开发的二代PDH工艺等[1, 5-6],其中已经实现工业化的主要有UOP的Oleflex工艺、ABB Lummus的Catofin工艺及仅有一套工业化装置的Star工艺[7-8]。
1 丙烷脱氢反应的热力学
丙烷脱氢的主反应如式(1)所示,式(2)~(4)为其主要的副反应[9]。丙烷脱氢为强吸热、分子数增加的可逆反应,从热力学看,高温和低压有利于脱氢反应的进行;但温度过高会导致丙烷裂解及丙烷深度脱氢程度加剧,使丙烯选择性降低,同时也会加剧催化剂表面积炭,进而导致催化剂失活[8]。降低压力虽然可使丙烯收率有所增加,但会造成设备投资费用的增加。另外,丙烷转化率取决于热力学平衡,平衡常数随温度的升高而增大,但该反应的平衡常数即使在高温下数值也较小(见表1)[8, 10]。另外,表2也列出了几种主要的丙烷脱氢工艺的技术特点。
C3H8(g)↔C3H6(g)+H2(g)
(1)
C3H8(g)↔CH4(g)+C2H4(g)
(2)
C2H4(g)+H2(g)↔C2H6(g)
(3)
C3H8(g)+H2(g)↔CH4(g)+C2H6(g)
(4)
丙烷脱氢反应常用的催化剂主要有Pt系、Cr系及其它新材料类催化剂。Cr系催化剂失活速率较快,再生频繁,且毒性较大,易污染环境,导致其使用受到限制[11]。Pt系催化剂是丙烷脱氢反应的主要催化剂之一,UOP的Oleflex工艺采用的即是此类催化剂,以下主要针对Pt系催化剂展开综述。
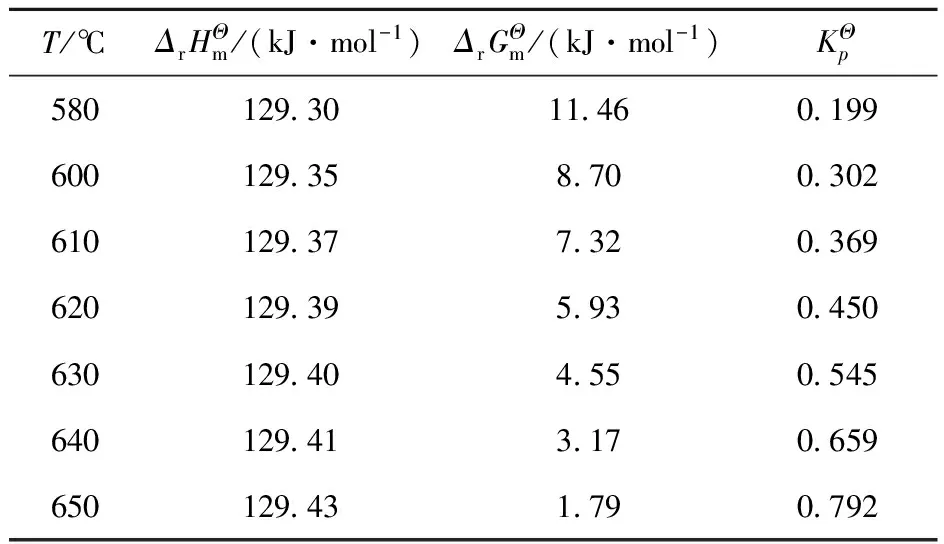
表1 丙烷脱氢反应的热力学数据[9]
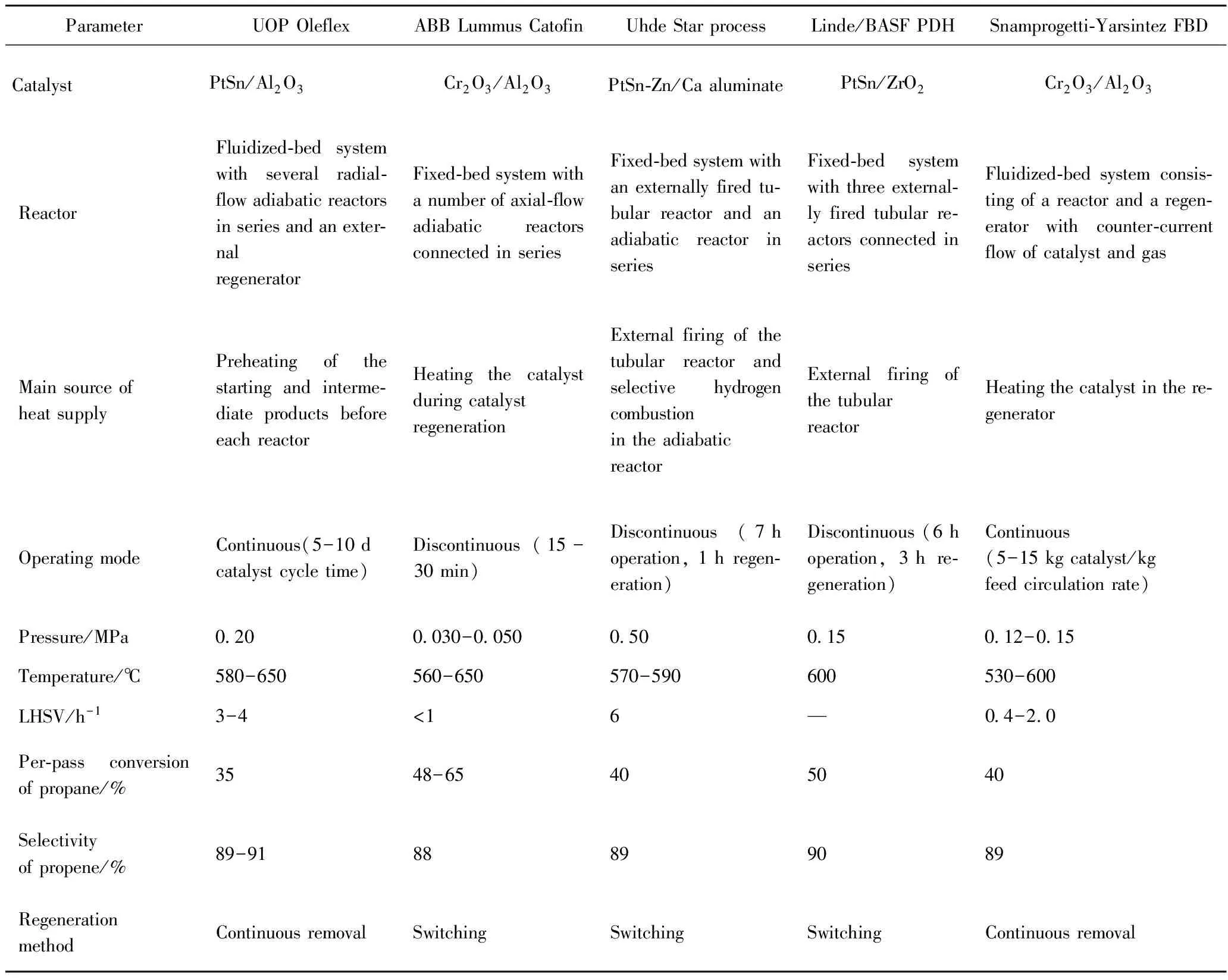
表2 丙烷脱氢技术的主要工艺特点[7-8]
2 用于丙烷脱氢反应的Pt系催化剂
2.1 Pt/Al2O3型催化剂
Pt/Al2O3型催化剂表面存在Pt中心以及酸性中心,Pt中心又可分为单Pt中心(M2中心)和多Pt中心(M1中心)。Pt/Al2O3催化剂表面存在多Pt中心,适于催化氢解、积炭等结构敏感的反应。含Pt的双组分催化剂中存在着单Pt中心,适于催化脱氢和异构化等结构不敏感的反应[12]。负载型Pt催化剂中,Pt的分散度增加时可获得更多的单Pt中心,一般加入助剂可以提高Pt的分散度;另外,烯烃与Pt之间的相互作用较强,烯烃在Pt催化下的反应要快于烷烃,引入助剂可以减弱烯烃与Pt的相互作用,从而提高催化剂整体的脱氢活性;载体的酸性中心则易引起骨架异构化、裂解及烯烃聚合等反应,进而引起结焦反应[13-14],一般需引入碱或碱土金属等加以中和,从而增加催化剂的活性和稳定性。
2.1.1 Pt/Al2O3型催化剂的助剂
该类催化剂的助剂一般以Sn为主,在此基础上再添加碱金属(Li、Na、K)、过渡金属(Zn、Cr、Zr、Y)或稀土金属(La、Ce)等。Sn的作用主要表现在“几何效应”和“电子效应”两个方面[15]。“几何效应”是指,Sn可以将催化剂表面的Pt物种分割为尺寸较小的Pt原子簇,减少受较大尺寸Pt原子簇催化的氢解和积炭反应的发生,防止纳米颗粒的烧结,同时增加Pt物种的分散度[16-18]。林励吾等[12]认为,Pt/Al2O3催化剂表面存在活性中心M1,即Pt直接固定在Al2O3表面,如图1所示。在Sn的作用下,PtSn/Al2O3催化剂表面不仅有M1中心,还出现了M2中心,即Sn在Al2O3表面单层分散,Pt负载在Sn的表面,形成Pt-Sn-Al2O3“夹心结构”,如图2所示。“电子效应”是指,Pt表面的电子转移至Sn物种表面,或者由于PtSn合金不同的电子结构而导致Pt电子密度发生变化,从而影响反应物和产物的吸附-脱附步骤和吸附热[19-20]。Sn的加入也可以产生“排除效应”,从而使积炭前驱体由Pt活性位点转移至载体Al2O3表面,使Pt活性位点远离积炭,提高催化剂的容炭量,进而提高催化剂的稳定性[21]。Vu等[22]认为,Pt颗粒表面有利于产生积炭前驱体的低配位活性点受到了Sn的抑制,由此导致PtSn/Al2O3催化剂的积炭量及失活速率下降。Sn的添加还可以增加吸附氢气的流动性,并毒化载体Al2O3表面的酸性位点[23]。

图1 Pt/Al2O3催化剂M1中心的结构示意图[12]

图2 PtSn/Al2O3催化剂M2中心的结构示意图[12]
目前,对Sn助剂作用的主要分歧在于,还原后的催化剂中是否有0价Sn生成,0价Sn是否与Pt形成合金,合金态还是氧化态的Sn对活性组分Pt起积极作用。大部分研究人员认为,氧化态的Sn有利于提高Pt催化剂催化丙烷脱氢性能,而与Pt形成合金的0价Sn则使Pt催化剂中毒而导致其部分失活,游离态的0价Sn对Pt催化剂的活性没有明显影响[24-26]。也有作者持相反意见。Pisduangdaw等[20]认为,由火焰溅射法制备PtSn催化剂时形成的PtSn合金使催化剂表现出较高的丙烷脱氢催化活性及稳定性。Vu等[27]也认为,PtSn合金的类型及稳定性与该催化剂催化丙烷脱氢反应活性及稳定性正相关。Kumar等[28]将制备的PtSn/SBA-15催化丙烷脱氢反应时发现,添加的Sn与Pt形成了PtSn合金,从而提高了Pt的分散度,进而提高了催化活性。Hauser等[29]采用密度泛函理论研究丙烷脱氢的反应路径时发现,当1个Sn原子替代Pt4团簇中的1个Pt原子而形成Pt3Sn合金时,会减小速率控制步骤净活化能,从而提高催化剂的活性。Yang等[30]采用第一性原理计算研究了PtSn催化剂的丙烷脱氢催化性能,发现Pt3Sn合金的形成有利于催化丙烷脱氢反应。
近来,Han等[31]制备了PtCu/Al2O3催化剂,将其用于催化丙烷脱氢反应时发现,Cu的加入也可以提高丙烯的选择性,降低催化剂的失活速率,并提高其抗积炭能力。这是因为Pt-Cu之间的相互作用可以抑制丙烯的吸附,并且提高C—C键断裂的能垒。减少丙烯吸附可以降低结焦及小分子烃类的生成,提高C—C键断裂能垒则会导致甲烷等的生成。
虽然Sn等的加入可以在一定程度上提高Pt系催化剂的活性和稳定性,但是由于结焦而引起的催化剂失活依然不可避免,PtSn/Al2O3的寿命仍较短,烧焦再生及还原操作仍需频繁进行[32]。因此碱金属、碱土金属、过渡金属及稀土金属等常被用作第二助剂,以进一步改善催化剂的性能。碱或碱土金属的加入有助于调节表面酸性,提高Pt的分散度和抗烧结能力,促进氢溢流,减少金属活性位点及载体的积炭,增加积炭后裸露金属Pt表面占有载体表面的比例,并且稳定酸性高价Sn(如SnO2等),从而提高催化剂的脱氢活性和产物选择性[33-35]。过渡金属及稀土金属等也常被用作第二助剂以改善PtSn/Al2O3型催化剂的脱氢性能。它们可以提高Pt的分散度,增强表面金属之间的相互作用,减少载体表面的积炭,从而改善催化剂的脱氢活性和稳定性[16, 36-39]。
2.1.2 载体Al2O3的改进
Al2O3作为载体在反应过程、输送及再生过程中表现出优异的热稳定性和良好的机械强度。它可以极大地提高Pt的分散度,这对催化剂获得较高的脱氢活性及产物选择性来说至关重要[13]。近年来,人们还采用后处理、掺杂及与分子筛共混等方法对Al2O3进行改进,使其更好地发挥脱氢催化剂载体的功能。
Mironenko等[40]发现,γ-Al2O3载体经过水热处理后,其表面的低频桥接OH量和L酸的浓度增加。当采用其负载Pt时,所得催化剂表面还原态Pt量增加,Pt分散度降低。他们认为,碱性高频OH是锚定Pt配合物的位点,但水热处理后,它们的量减少了。在这种思想的指导下,他们采用经150℃、3 h水热处理的载体制备Pt/γ-Al2O3,并将其用于丙烷脱氢反应,与未经水热处理的载体制备的催化剂相比,在丙烷转化率相近时,丙烯的选择性提高了10%(质量分数)。采用焙烧等方法可以获得不同晶型的Al2O3(θ-Al2O3、α-Al2O3等)。Kogan等[41]研究了PtSn/α-Al2O3及PtIn/α-Al2O3催化丙烷脱氢反应的性能,发现二者在水蒸气环境中的活性高于H2环境,因为在水蒸气环境中OH参与了H消除反应。同时他们发现,以α-Al2O3作为载体的催化剂的积炭量远少于以θ-Al2O3为载体的催化剂。
向Al2O3中掺杂其他元素也将影响其制备的Pt催化剂的丙烷脱氢催化性能。Vu等[27]将以稀土(La,Ce,Y)掺杂的 Al2O3为载体制备的负载型PtSn催化剂用于催化丙烷脱氢反应,发现La、Y可形成分散相,而Ce则聚集形成了CeO2;PtSn/La-Al2O3和PtSn/Ce-Al2O3表面分别形成了PtSn和PtSn2合金,由于结焦量较低、合金的稳定性较好、Pt的分散度损失较少,使得这两种催化剂的活性及稳定性较好。Long等[42]采用Ca掺杂的Al2O3制备了PtSnIn/xCa-Al2O3,将其用于丙烷脱氢反应时发现,当x=1.5、反应25 h,丙烷的转化率仍大于58.0%。这是因为Ca的加入可以中和载体表面的酸性位点,影响表面金属和载体间相互作用,可维持Sn的氧化态,并且不影响催化剂的结构。Shi等[43]采用嫁接法和浸渍法制备Mg-Al2O3。采用嫁接法时,Mg物种和载体间形成Mg—O—Al键并位于载体内部孔道中;采用浸渍法时,Mg物种疏松地附着在载体的外表面并聚集形成MgO。采用嫁接法制备PtSn/Mg(0.5%)-Al2O3,可以改变载体的酸度,更好地稳定Sn的氧化态,增强Pt、Sn、载体之间的相互作用,相应地,催化剂的丙烷脱氢活性和稳定性较高。
也有研究人员研究了含有Al2O3的混合载体制备的催化剂的丙烷脱氢催化性能。Huang等[44]制备了PtSn/Al2O3-SBA-15,发现该催化剂的丙烷脱氢催化活性高于PtSn/SBA-15,稳定性高于PtSn/γ-Al2O3。这是因为Al2O3修饰了SBA-15的孔道,增加了Sn和Al2O3-SBA-15载体之间的相互作用,并且使积炭后的载体表面仍保持较高的金属Pt裸露度。Nawaz等[45]将Al2O3作为黏结剂加入SAPO-34,用其作为载体制备的PtSn/Al2O3-SAPO-34催化剂具有较高的丙烷脱氢催化活性,丙烷转化率达40%,丙烯选择性95%。这是因为Al2O3的加入提高了Pt的分散度,修饰了金属和载体间的相互作用。
2.2 Pt/ZSM-5型催化剂
2.2.1 ZSM-5载体的优势
丙烷脱氢反应通常需要高温低压的环境才能获得较高的丙烯收率。苛刻的反应条件会增加裂解等副反应,并使催化剂积炭严重[46],因此开发具有高活性、选择性及稳定性的催化剂至关重要,寻找性能优异的载体是方法之一。
ZSM-5分子筛是具有较低铝含量的微孔硅铝酸盐,具有分布均匀的十元环孔道,可以抑制较大烃类分子的形成,进而阻止炭沉积,从而有利于提高催化剂稳定性[47]。Zhang等[48]发现,由于ZSM-5具有较大的比表面积及特殊的孔道结构,其所制备的PtSn/ZSM-5催化剂在催化丙烷脱氢反应时,容炭量高于PtSn/γ-Al2O3催化剂的。张一卫[49]采用PtSnNaLa/ZSM-5催化丙烷脱氢反应,在连续运行880 h之后,丙烷转化率依然维持在30%以上,而PtSnNaLa/γ-Al2O3在连续运行480 h后,丙烷转化率已低于30%。
另外,ZSM-5分子筛还具有可调硅/铝比及较大的比表面积,便于调节催化剂的酸性和获得较高的金属分散度[50]。
2.2.2 ZSM-5载体的改进
近年来,研究人员采用金属掺杂、离子交换以及与其他载体共混的方法对ZSM-5进行修饰,用于改善其作为脱氢催化剂载体的性能。Zhang等[51]采用水热法合成了Sn修饰的ZSM-5,并将其作为载体制备了PtNa/Sn-ZSM-5,用于催化丙烷脱氢反应。他们发现,ZSM-5骨架中Sn的引入增强了Sn和载体间的相互作用,稳定了Sn的氧化态,改变了Pt和载体的界面特性,从而促进了氢溢流的发生,进而有利于Pt的还原。与PtNa/ZSM-5、PtSnNa/ZSM-5催化剂相比,该催化剂失活值最低(6.2%),并且反应9 h后丙烯的选择性仍可达到98%,丙烷转化率的可达39%。Li等[52]制备了Co交换的HZSM-5类催化剂,发现该催化剂催化丙烷脱氢反应速率比HZSM-5催化剂的高10倍还多,丙烯的选择性也高。Waku等[53]制备了Pt/Na-Fe-ZSM-5催化剂,将其用于催化丙烷脱氢反应,获得了较高的烯烃选择性和接近平衡的烯烃收率,并具有超高稳定性。Zhou等[54]采用固态研磨法制备了MgO-Al2O3/ZSM-5载体。MgO-Al2O3相的聚集层在ZSM-5孔的内表面形成并均匀分散,随着Mg/Al物种进入孔道,其内部也形成了介孔结构,载体表面出现了新的酸性位点,总酸量也发生了变化。该载体提高了Pt的分散度和总酸量,进而提高了催化剂的活性。
2.3 Pt/SBA-15型催化剂
SBA-15具有高比表面积(600~1000 m2/g),可提供大量反应位点,也有利于活性组分的分散,并且具有较厚的孔壁(3.1~6.4 nm)及较大的孔径(5~30 nm);其热稳定性及水热稳定性高,耐化学试剂,孔道结构容易维持;其酸性较低,有利于降低脱氢反应的积炭量[55-56]。余长林[56]制备了PtSn/Ce-Al2O3和PtSn/Ce-SBA-15催化剂,并用于催化丙烷脱氢反应,发现后者的活性略低于前者,但后者所得的丙烯选择性较高,可达99%。Yu等[57]还制备了PtSnZn/SBA-15,发现Pt的分散度较高,且部分负载组分可进入SBA-15的孔道;载体的弱酸性、活性组分和助剂与载体间的相互作用以及Zn对Pt的电子调变作用使得该三组分催化剂稳定性和产物选择性较高,且积炭量较低。
2.4 尖晶石类催化剂(ZnAl2O4、MgAl2O4)
尖晶石类载体热稳定性较好、机械强度较高且酸性较低,有利于苛刻条件下催化低碳烷烃的脱氢反应[58-59]。de Miguel等[60]将制备的PtSnGa/ZnAl2O4用于催化丙烷脱氢反应,获得了较高的丙烯收率及较低的积炭量,认为Ga的加入及ZnAl2O4的使用提高了催化剂的活性。Wang等[61]制备了PtSn/ZnO-MgAl2O4催化剂,用于催化丙烷脱氢反应,发现该催化剂的稳定性、活性及丙烯选择性均优于PtSn/MgAl2O4和PtSn/Al2O3。这是因为ZnO修饰的MgAl2O4提高了Pt的分散度,增强了金属和载体间的相互作用。
2.5 载体和Pt粒径及形貌对Pt系催化剂丙烷脱氢催化性能的影响
2.5.1 载体的影响
不同的载体对Pt系催化剂催化丙烷脱氢反应活性的影响较大。Zhang等[62]比较了由不同载体(ZSM-5、γ-Al2O3、介孔Al2O3及SBA-15)制备的PtSn型催化剂的丙烷脱氢反应催化活性。根据XRD结果可知,载体是影响催化剂孔结构及酸性性质的主要因素。当以介孔Al2O3为载体时,催化剂表面金属颗粒尺寸均匀,且分布较窄,该载体也促进了氢溢流的发生,并加强了Sn和载体间的相互作用,因此稳定了Sn的氧化态,促进了活性相的转变,最终导致了催化剂稳定性及选择性的提高。但是,ZSM-5载体表面较强的酸性易引发裂解反应,γ-Al2O3的孔结构易导致积炭,SBA-15载体则易引起金属颗粒的聚集及表面Sn物种的还原,这些都不利于催化剂性能的提高。
2.5.2 Pt粒径及形貌的影响
Kumar等[63]制备了不同Pt粒径的Pt/SBA-15催化剂,用于催化丙烷脱氢反应,发现粒径约为3 nm 的Pt颗粒相比21 nm的Pt颗粒具有较高的活性及较低的产物选择性,结焦速率、结焦选择性及结焦量也较高。这可能是因为小颗粒Pt有利于C—C键活化,即倾向于发生裂解反应,容易结焦;大颗粒Pt对C—H键活化的选择性较高,即脱氢反应的选择性较高。
Li等[64]研究了Pt催化剂的Pt粒径对其催化丙烷脱氢反应中结焦的影响,发现小颗粒Pt催化剂的结焦速率明显大于大颗粒Pt催化剂,前者生成焦的石墨化程度较高,且含有较少的氢,其对应焦的前驱体也不易发生迁移。具有不同粒径Pt颗粒的Pt催化剂表现出的不同结焦性能与Pt晶面的反应活性相关。在给定Pt颗粒形状的情况下,Pt颗粒越小,其 (211)晶面原子越多,(111)面原子越少。密度泛函理论(DFT)结果表明,(211)晶面具有很高的脱氢活性,易发生深度脱氢生成焦,且焦的含氢量较低。(111)面原子的脱氢活性远低于(211)面的,不易生成焦,且焦的含氢量也较高。一般烃类与(211)面的结合能高于(111)面,随着Pt粒径减小,(211)面原子比例增加,从而导致小颗粒Pt催化剂对应的焦前驱体不易发生迁移[65-66]。
Yang等[67]合成了尺寸相近的八面体(12.0 nm,(111))及立方体(11.5 nm,(100))形貌的Pt颗粒,用于催化丙烷脱氢反应,并采用密度泛函理论进行了计算,发现相对于Pt(100)及Pt(211)面,Pt(111)面(八面体Pt颗粒)和丙烯间的结合强度较低,且C—H键断裂的能垒较高,从而减少了深度脱氢产物的生成,进而提高了八面体Pt颗粒对产物的选择性。
2.6 Pt系催化剂的制备方法
负载型Pt催化剂的制备方法主要包括浸渍法、共沉淀法、离子交换法、溶胶凝胶法、微乳法、电沉积法、反相胶团-溶胶凝胶法等[6, 68]。浸渍法过程简单,是最常用的制备方法。Bai等[69]研究了浸渍法中竞争吸附剂(盐酸、乳酸及柠檬酸)对PtSnNaMg/ZSM-5催化丙烷脱氢反应性能的影响,发现以盐酸作为竞争吸附剂时,载体表面的金属分布均匀,Pt、Sn、载体间的相互作用较强,制备的催化剂的活性及稳定性也较好。Salmones等[70]分别采用浸渍法、共沉淀-浸渍法及溶胶凝胶法制备了PtSn/MgAl2O4催化剂,发现采用溶胶凝胶法制备的催化剂具有较窄的孔径分布、较强的酸性,且金属在载体表面分布均匀;将所制备的3个催化剂用于催化丙烷脱氢反应,溶胶凝胶法制备的催化剂能获得较高的产物选择性,但稳定性略低。Sault等[71]将Pt粒子反胶团技术、SiO2和Al2O3的溶胶凝胶过程相结合制备了Pt纳米簇丙烷脱氢催化剂。和传统溶胶凝胶法制备的催化剂不同,该法所得的Pt粒子并未包裹在载体结构中,所有的Pt颗粒都可被用于催化丙烷脱氢反应,所得转化率与传统浸渍法制备的催化剂相当,但抵抗失活的能力增强,其失活行为不同于单Pt催化剂而与PtSn型催化剂相似。Pisduangdaw等[20]采用一步火焰溅射分解法制备了PtSn/Al2O3,和传统方法不同的是,该法制备的γ-Al2O3载体具有单晶结构、初始尺寸为10~18 nm,并且只包含大孔。由于载体及催化剂的制备同时进行,导致金属颗粒表面被Al—O覆盖,促进了具有较高催化活性的PtSn原子簇的形成。该法制备的催化剂的丙烷脱氢催化活性及稳定性优于浸渍法制备的,但产物选择性相当。载体中大孔的存在促进反应物及产物的扩散,并减少了积炭量。黄等[72]对比研究了PtSn原子簇催化剂和浸渍法制备的PtSn型催化剂的丙烷脱氢催化性能,发现前者比后者具有更高的催化活性、稳定性及产物选择性。
2.7 Pt系催化剂的反应动力学
2.7.1 Pt系催化剂的脱氢动力学
Lobera等[14]研究了PtSnK/Al2O3催化丙烷脱氢反应的全部动力学过程。假设如式(5)~(7)所示的3个反应平行进行,并假设催化剂对丙烯有较强的吸附,对丙烷无吸附,由此得出的Langmuir-Hinshelwood-2模型可以描述丙烷脱氢动力学过程。
C3H8↔C3H6+H2
(5)
C3H8→Cracking products
(6)
C3H8→Coke
(7)
Farjoo等[73]研究了PtSn/γ-Al2O3催化丙烷脱氢反应的动力学过程,也发现Langmuir-Hinshelwood机理可以用来描述丙烷脱氢主反应的动力学行为,并认为丙烷吸附是该反应的速率控制步骤。Larsson等[74]采用幂律模型描述了脱氢反应动力学过程。Li等[75]提出PtSn/Al2O3催化的丙烷脱氢反应遵循如式(8)~(11)所示的步骤,采用Langmuir-Hinshelwood机理描述该反应,得到丙烷表面的脱氢反应是速率控制步骤,并推导了反应速率方程。Gómez-Quero等[76]根据Langmuir-Hinshelwood-Hougen-Watson机理,认为描述PtSn/Al2O3催化丙烷脱氢反应的动力学模型为,丙烷进行非解离吸附并且同时释放氢气,反应速率控制步骤也为表面反应。陈等[77]提出了PtSn/Al2O3催化丙烷脱氢反应的速率方程,发现该方程与实验数据吻合较好,还推导出该反应的活化能Ea值为170.1 kJ/mol。李庆[78]认为丙烷脱氢的活化能在30~170 kJ/mol范围,数值的差异可能与催化剂的形貌及Pt颗粒尺寸大小有关。
C3H8+2S→C3H7S+HS
(8)
C3H7S+S→C3H6S+HS
(9)
C3H6S→C3H6+S
(10)
2HS→H2+2S
(11)
2.7.2 Pt系催化剂焦的性质及结焦动力学
Sattler等[79]发现,丙烷原料中加入适量H2可以提高催化剂的活性,并降低结焦量,而且改变了丙烷脱氢过程中焦的本质。当原料中H2分压增加时,拉曼光谱结果显示,焦中出现了缺陷较少、较小的石墨晶体。Bao等[80]发现,Pt/Al2O3和PtSn/Al2O3作为丙烷脱氢催化剂时,产生了类石墨前体的炭,而且随着Sn含量的增加,TPO曲线中积炭的氧化峰向高温方向移动,意味着更多的积炭转移到了载体表面。Larsson等[81]采用TPO技术分析了PtSn/Al2O3催化丙烷脱氢反应时生成积炭的种类,它们分别是位于金属及金属附近的积炭、位于载体表面的积炭以及位于载体表面的石墨状积炭。前两种积炭随着温度及丙烯分压的升高而增加,H2的增加则起抑制作用,石墨状积炭量随温度及丙烷分压的增加而增加。金属及金属附近的积炭在反应了15 h后达到平衡,而位于载体表面的积炭量则继续增加。催化剂失活仅涉及其中的一部分积炭。H2的存在可以抑制积炭的形成及催化剂的失活,但不能清除催化剂表面已形成的积炭。Li等[82]研究了PtSn/Al2O3催化丙烷脱氢反应的结焦过程,发现存在位于金属表面及载体表面的两种焦,第1种焦由于含有较多氢而质地较后者软。金属表面焦的生成速率和丙烯、H2分压的关联较小,但与丙烷压力正相关;载体表面焦的生成速率随丙烷及丙烯压力增加而增加,但随着H2压力增加而减小。他们认为,丙烯二聚是形成金属表面焦的决定因素,也提出了PtSn/Al2O3催化丙烷脱氢反应时金属表面结焦机理,如式(12)~(16)所示,并推出了其速率方程,如式(17)所示。图3为载体表面结焦机理示意图。图3显示,丙烷首先在金属表面发生解离,然后通过脱氢反应生成积炭前驱体,接着在金属表面转化成“软焦”;金属表面的积炭前驱体可以迁移至酸性位点表面,并与其吸附的丙烯通过聚合/低聚、缩合、环化反应等生成“硬焦”。
C3H8(g)+2*→C3H7*+H*
(12)
C3H7*+*→C3H6*+H*
(13)
C3H6*→C3H6(g)+*
(14)
2C3H6*→C6H12*+*
(15)
H*+H*↔H2+2*
(16)
(17)
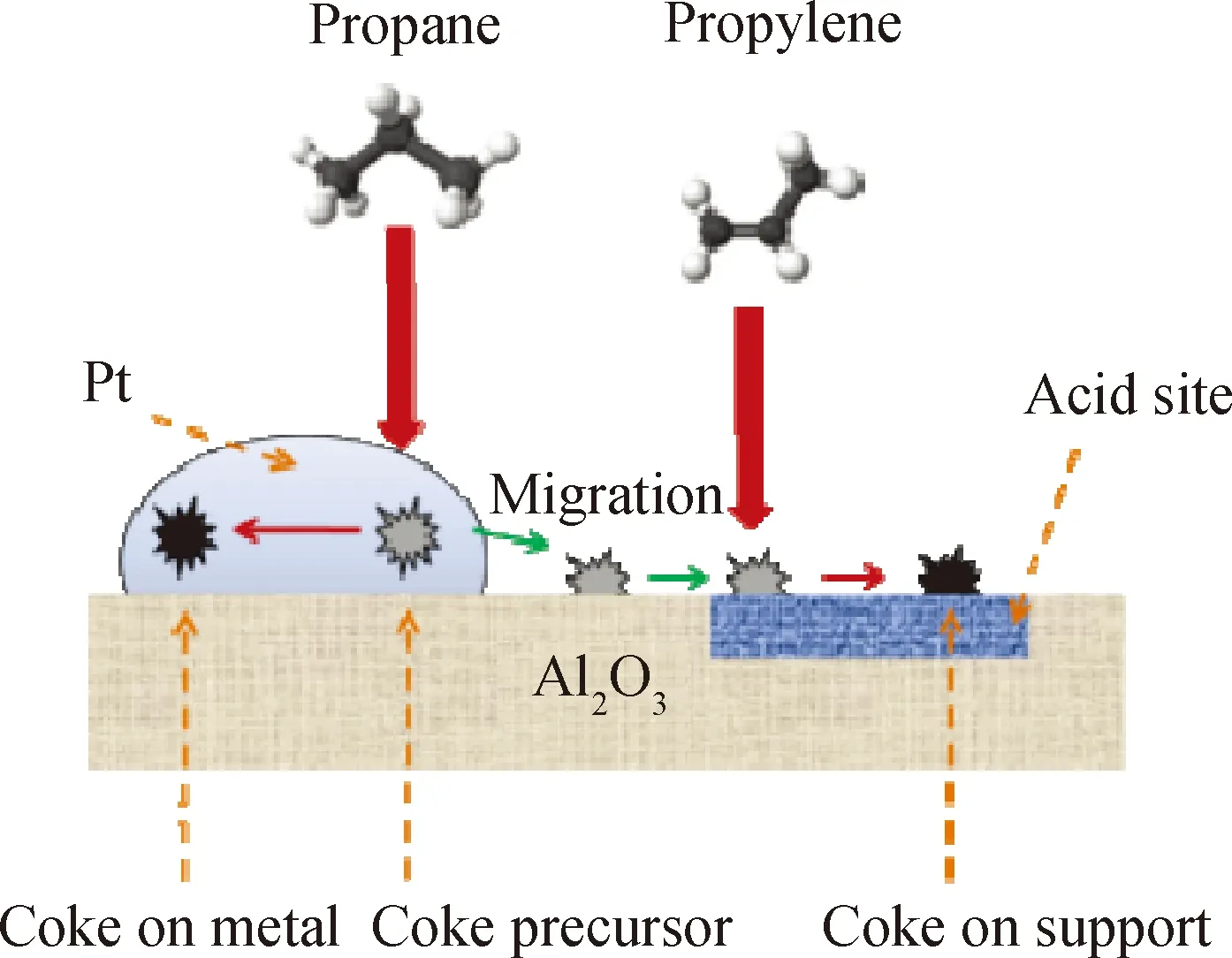
图3 载体表面结焦机理示意图[82]
van Sint Annaland等[83]考察了Pt/γ-Al2O3在催化丙烷脱氢反应中的结焦动力学,发现初始阶段尤其是在温度和丙烯浓度较低时,焦炭的形成速率以平方形式增加,且丙烯的表观反应序数较高。经过较长时间,焦炭的形成速率降低至常数。据此,他们提出了焦炭生长的动力学模型,如式(18)所示,并推测积炭前驱体是通过丙烯低聚形成的。
(18)
式(18)中,MC为结焦量,mg/(mg catalyst),其下标C代表丙烯在吸附位点的吸附反应;ω为单层最大结焦量,mg/(mg catalyst);kR为丙烯二聚的反应速率,s-1,其下标R代表丙烯二聚反应;kCP为生成结焦前驱体的速率,s-1,其下标CP代表生成结焦前驱体的反应;θC3H6为丙烯所占表面总吸附位点的百分数。
Lobera等[14]用单-多层焦理论描述了PtSnK/Al2O3催化剂在催化丙烷脱氢反应中的结焦动力学。他们认为,催化剂表面的结焦速率由单层结焦及同时进行的多层结焦两部分组成,如式(19)所示。单、多层结焦速率方程为式(20)、(21),对应的阿伦尼乌斯方程如式(22)所示。
(19)
(20)
(21)
(22)
式(19)~(22)中,CC、Cm、CM、Cmax分别为每mg催化剂上总焦、单层结焦、多层结焦和单层最大结焦的mg量;h、n分别为单层结焦和多层结焦的反应序数;kiC为速率常数,单层结焦时i值为1,多层结焦时i值为2,k1C、k2C均为温度和烷烃的函数,mmol/(g·min·MPa)。经过与实验数据拟合得到,h值为2,n值为0,单层结焦的活化能为38.4 kJ/mol,而多层结焦的活化能为125.5 kJ/mol。
2.7.3 Pt系催化剂烧焦动力学
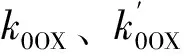
1-XC=(1-XC0)exp
(23)
2.8 Pt系催化剂催化丙烷脱氢反应的机理
Biloen等[84]提出了Pt催化剂单Pt原子为反应活性位的丙烷脱氢反应机理,如图4所示。丙烷首先在单Pt原子的两个吸附位点上进行解离吸附生成H原子及丙基,接着丙基通过β-H消除反应生成含π键的丙烯,最后是丙烯的脱附。反应的速率控制步骤是β-H的消除反应。陈光文等[77]研究了PtSn/Al2O3催化丙烷脱氢反应的动力学过程,并提出了如式(24)~(27)所示的机理,并认为式(25)所示反应是反应的速率控制步骤。
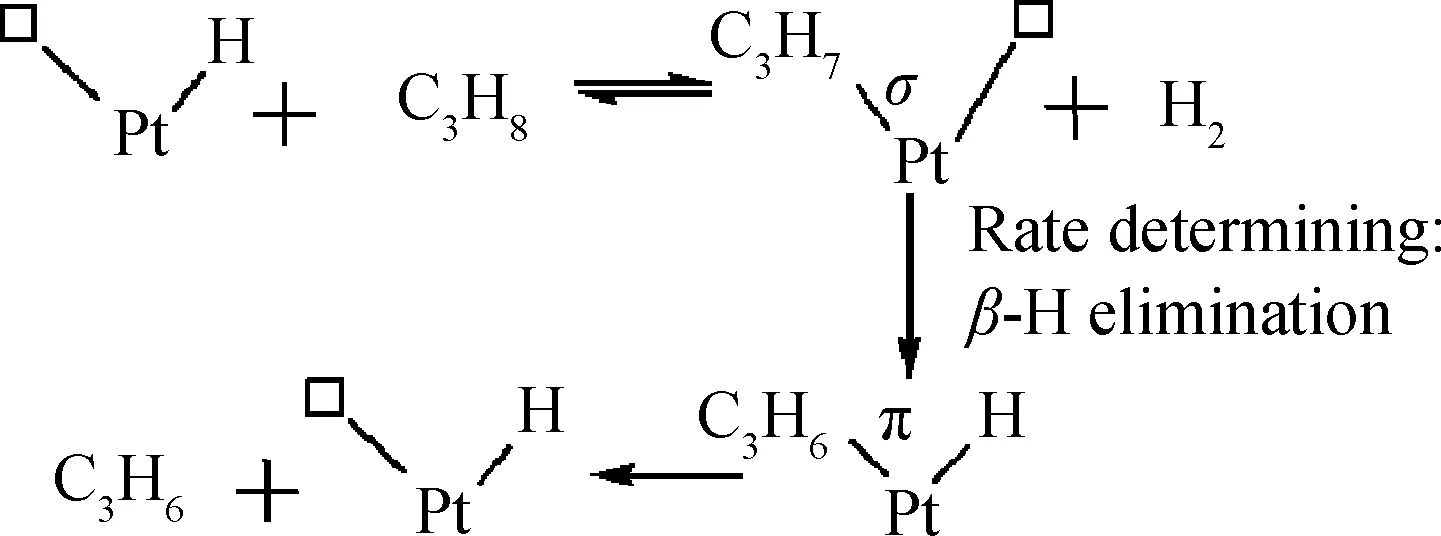
图4 单Pt催化剂催化丙烷脱氢反应机理[84]
C3H8+*→C3H8*
(24)
C3H8*+*→C3H6*+H2*
(25)
C3H6*→C3H6+*
(26)
H2*→H2+*
(27)
杨维慎等[26]则认为,PtSn/Al2O3催化丙烷脱氢反应时,Pt、Sn间存在协同催化作用。首先SnO2/Al2O3中心用于活化丙烷形成活化中间体RI,然后Pt/Al2O3中心用于从RI上通过反溢流过程移去H2,从而使其分解生成SnO2/Al2O3及脱氢产物丙烯,使得该反应过程能够循环进行,如图5所示。
2.9 Pt系催化剂的失活行为
在丙烷脱氢过程中,积炭是催化剂失活的主要原因。Sokolov等[85]研究了PtSn/Al2O3在丙烷脱氢反应中的失活行为,发现金属活性中心结构的变化,即生成了含Sn量较高的合金以及少量Pt中心的烧结,导致了催化剂的失活。Sattler等[86]采用原位拉曼光谱研究了H2的加入对Pt/Al2O3及PtSn/Al2O3催化丙烷脱氢失活行为的影响,发现随着H2浓度的增加,结焦量降低,且焦的石墨化程度(形成颗粒较小的、缺陷较少的石墨晶体)增加。对于Pt/Al2O3,H2的作用与Sn类似,它的加入导致丙烷的转化率及丙烯的选择性增加;对于PtSn/Al2O3,H2的加入可使活性中心远离积炭,从而明显减缓催化剂的失活,增加催化剂的稳定性。
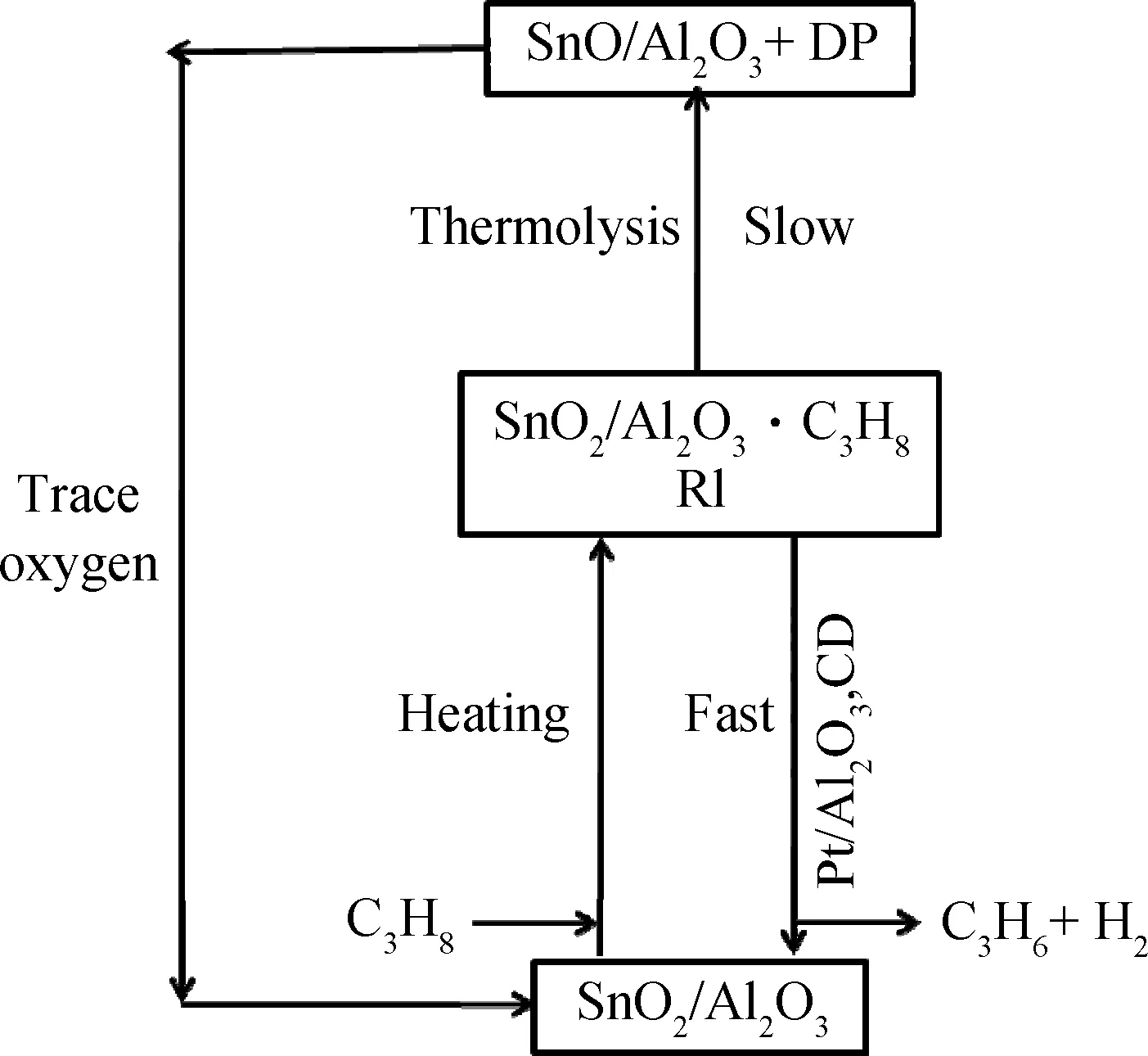
图5 PtSn/Al2O3催化丙烷脱氢反应时Pt、Sn组分间的协同催化作用[26]
3 纳米碳材料催化剂
传统催化剂载体,诸如Al2O3等高温时机械性能及热性能不稳定,易与其表面金属相互作用,导致金属颗粒的烧结[87]。近年来研究较热的纳米碳材料具有良好的孔结构、较少的缺陷和杂质含量、良好的抗氧化性能以及较好的电子及热传递功能[88]。作为载体,纳米碳材料同时具有传统催化剂载体所不具备的特性,如耐酸、碱介质,表面化学性质可调,可根据特定反应得到需要的孔分布,通过表面官能团促进金属前驱体在碳材料表面的分配等。纳米材料作为Pt原子簇载体可能是未来脱氢催化剂发展的趋势之一。纳米碳材料通常包括碳纳米管(CNTs)、石墨烯、纳米金刚石、纳米角、纳米葱、富勒烯等,它还包括具有纳米结构的碳材料,如有序介孔碳材料等。
目前与脱氢催化剂相关的纳米碳材料主要有CNTs、碳纳米纤维(CNF)、活性碳(AC)、介孔碳材料、纳米金刚石(ND)、纳米葱以及石墨烯氧化物(GO)。
McGregor等[89]认为,高度有序的表面积炭具有烷烃脱氢反应活性,证实了未经修饰的碳纳米纤维与被积炭覆盖的VOx/Al2O3具有水平相当的烷烃脱氢活性,碳材料催化剂是脱氢反应及氧化脱氢反应的新型催化剂。Zhang等[90]采用纳米金刚石催化乙苯直接脱氢反应,发现具有sp2-sp3杂化结构的纳米金刚石具有较高的活性和稳定性,5个循环周期即约120 h后,转化率和选择性分别大于20.5%和97.3%,且不出现积炭现象。他们的这个发现揭示了纳米碳材料有可能在烷烃脱氢领域有较强的应用前景。Liu等[91]以柠檬酸作为催化剂,采用自组装的方法制备了有序介孔碳材料,并将其用于丙烷脱氢反应。结果表明,与以盐酸为催化剂制备的介孔碳材料、活性碳、碳纳米管及石墨相比,该材料表现出较高催化活性及稳定性,经过50 h运转,丙烷转化率可达12.1%,丙烯选择性为95.1%。经过进一步研究[92]他们发现,有序介孔碳材料表面的羰基是丙烷脱氢反应的活性物种,该材料有序的介孔结构也有利于反应过程中物质的传递,从而使其稳定性较好;经过100 h运转,丙烯的选择性仍约为88%。他们[93]采用HNO3处理得到的有序介孔碳材料作为丙烷脱氢反应催化剂,反应50 h后,丙烷转化率可达22.4%,丙烯选择性为86.6%。他们认为,HNO3活化引入的羰基/醌基官能团是反应的活性位点,有利于脱氢反应的进行。丙烯选择性略微降低由催化剂表面的酸性官能团增加引起。Wang等[94]研究了具有不同比例的金刚石内核(sp2)/石墨外壳(sp3)的复合纳米碳材料的丙烷脱氢催化性能,发现该材料的性能优于单一的纳米金刚石及石墨。他们认为,该材料的性能取决于其结构缺陷度及酮基的活性,锚定在缺陷/空穴上的酮基基团是生成丙烯的活性位点。
4 结束语
(1)丙烷脱氢技术是目前最具竞争力的丙烯生产工艺之一,Pt系催化剂是丙烷脱氢反应使用的主要催化剂。Pt催化剂活性高,但其催化丙烷脱氢反应的烯烃选择性低,且易结焦,通过加入Sn等助剂可以提高催化剂的活性和稳定性,但催化剂的结焦速率依然过快,失活依然不可避免;使用分子筛(ZSM-5、SBA-15等)及尖晶石(ZnAl2O4、MgAl2O4等)作为替代性载体,对催化剂的丙烷脱氢催化性能的改善空间有限。另外,针对Pt系催化剂,Al2O3载体的酸性对丙烷脱氢性能的影响,Pt和助剂之间的作用形式,Pt活性中心的结构及对丙烷脱氢性能的影响,丙烷脱氢的反应动力学以及反应机理等,还有待进一步深入研究。
(2)纳米材料作为Pt原子簇载体是脱氢催化剂发展的趋势之一。高度有序的表面积炭具有烷烃脱氢反应催化活性,根据前人将有序介孔碳等纳米碳材料应用于脱氢反应中的研究结果,可以预见,纳米碳材料或结合碳材料与Pt等传统型脱氢活性组分形成的复合材料,可进一步发挥纳米碳材料的结构、物化性质等以及金属等的特性,将在进一步提高丙烷脱氢催化剂的活性、稳定性以及加深对丙烷脱氢反应的认识等方面发挥一定的作用。
[1] 魏乃新, 于国良. 丙烷脱氢制丙烯的技术经济性探讨[J].中国石油和化工经济分析, 2012, (11):42-47.(WEI Naixin, YU Guoliang.A review of the technicality and economy of the propane dehydrogenation to propene[J].Economic Analysis of China Petroleum and Chemical Industry, 2012, (11):42-47.)
[2] 陶炎. 丙烯大量减少丙烷脱氢走热[N].中国石化报, 2013-6-4 (008).(TAO Yan.A substantial reduction in propene and the popularity of propane dehydrogenation[N].China Petrochemical News, 2013-06-04 (08).)
[3] 陶炎. 丙烷脱氢为何受热捧[J].中国石油石化, 2013, (18):36-37.(TAO Yan.Why does the propane dehydrogenation come into fashion[J].Chinese Petrochemical, 2013,(18):36-37.)
[4] 阿古拉. 介孔氧化物负载铬和钒基纳米催化剂及丙烷脱氢制丙烯催化性能[D].天津: 南开大学, 2011.
[5] 赵万恒. 低碳烷烃脱氢技术评述[J].化工设计, 2000, 10(3):11-13.(ZHAO Wanheng.Technology development in dehydrogenation of light alkanes[J].Chemical Engineering Design,2000, 10(3):11-13.)
[6] 柏林洋. PtSnNa/ZSM-5催化剂的改性及其丙烷脱氢性能研究[D].南京: 东南大学, 2009.
[7] CASPARY K J, GEHRKE H, HEINRITZ-ADRIAN M, et al.Dehydrogenation of Alkanes[M].Handbook of Heterogeneous Catalysis: Wiley-VCH Verlag GmbH & Co.KGaA.2008.
[8] 董文生, 王心葵, 彭少逸.丙烷脱氢制丙烯研究进展[J].合成化学, 1997, 5(3):246-250.(DONG Wensheng, WANG Xinkui, PENG Shaoyi.New progress in propane dehydrogenation to propene[J].Chinese Journal of Synthetic Chemistry, 1997, 5(3):246-250.)
[9] 刘昌呈, 王春明, 马爱增.工艺条件对Pt-Sn-K/Al2O3催化剂丙烷脱氢性能的影响[J].石油炼制与化工, 2013, 44(4):34-38.(LIU Changcheng, WANG Chunming, MA Aizeng.Influence of operating conditions on performance of Pt-Sn-K/Al2O3catalyst for propane dehydrogenation[J].Petroleum Processing and Petrochemicals, 2013, 44(4):34-38.)
[10] 刘淑鹤, 方向晨, 张喜文, 等.丙烷脱氢催化反应机理及动力学研究进展[J].化工进展, 2009, 28(2):259-266.(LIU Shuhe, FANG Xiangchen, ZHANG Xiwen, et al.Advances in catalytic mechanisms and kinetics of propane dehydrogenation[J].Chemical Industry and Engineering Progress, 2009, 28(2):259-266.)
[11] 张一卫, 周钰明, 许艺, 等.丙烷临氢脱氢催化剂的研究进展[J].化工进展, 2005, 24(7):729-732.(ZHANG Yiwei, ZHOU Yuming, XU Yi, et al.Research progress of propane dehydrogenation catalysts[J].Chemical Industry and Engineering Progress, 2005, 24(7):729-732.)
[12] 林励吾, 杨维慎, 贾继飞, 等.负载型高分散双组分催化剂的表面结构及催化性能研究[J].中国科学(B辑), 1999, 29(2):109-117.(LIN Liwu, YANG Weishen, JIA Jifei, et al.The surface structure of the supported and highly dispersed two-component catalysts and its propeties[J].Science in China (Series B), 1999, 29 (2):109-117.)
[13] BHASIN M, MCCAIN J, VORA B, et al.Dehydrogenation and oxydehydrogenation of paraffins to olefins[J].Appl Catal A, 2001, 221(1):397-419.
[14]LOBERA M P, TELLEZ C, HERGUIDO J, et al.Transient kinetic modelling of propane dehydrogenation over a Pt-Sn-K/Al2O3catalyst[J].Appl Catal A, 2008, 349(1-2):156-164.
[15] LLORCA J, HOMS N, LEON J, et al.Supported Pt-Sn catalysts highly selective for isobutane dehydrogenation: Preparation, characterization and catalytic behavior[J].Appl Catal A, 1999, 189(1):77-86.
[16] YU C, XU H, GE Q, et al.Properties of the metallic phase of zinc-doped platinum catalysts for propane dehydrogenation[J].J Mol Catal A: Chem, 2007, 266 (1):80-87.
[17] BURCH R. Platinum-tin reforming catalysts: I.The oxidation state of tin and the interaction between platinum and tin[J].J Catal, 1981, 71(2):348-359.
[18] SIRI G J, RAMALLO-L PEZ J M, CASELLA M L, et al.XPS and EXAFS study of supported PtSn catalysts obtained by surface organometallic chemistry on metals: Application to the isobutane dehydrogenation[J].Appl Catal A, 2005, 278(2):239-249.
[19] PARERA J, BELTRAMINI J, QUERINI C, et al.The role of Re and S in the Pt-Re-S/Al2O3catalyst[J].J Catal, 1986, 99(1):39-52.
[20] PISDUANGDAW S, PANPRANOT J, METHASTIDSOOK C, et al.Characteristics and catalytic properties of Pt-Sn/Al2O3nanoparticles synthesized by one-step flame spray pyrolysis in the dehydrogenation of propane[J].Appl Catal A, 2009, 370(1):1-6.
[21] IGLESIAS-JUEZ A, BEALE A M, MAAIJEN K, et al.A combined in situ time-resolved UV-Vis, Raman and high-energy resolution X-ray absorption spectroscopy study on the deactivation behavior of Pt and PtSn propane dehydrogenation catalysts under industrial reaction conditions[J].J Catal, 2010, 276(2):268-279.
[22] VU B K, SONG M B, AHN I Y, et al.Location and structure of coke generated over Pt-Sn/Al2O3in propane dehydrogenation[J].J Ind Eng Chem, 2011, 17(1):71-76.
[23] MARGITFALVI J L, HEGED S M, T LAS E.Reactions of methylcyclopentane on Pt/Al2O3and Sn-Pt/Al2O3catalysts[J].J Mol Catal, 1989, 51(3):279-284.
[24] 杨维慎, 吴荣安, 林励吾.丙烷在负载型催化剂上脱氢反应的研究Ⅴ.丙烷在PtSn/Al2O3催化剂上的脱氢反应模型[J].催化学报, 1992, 13(3):161-166.(YANG Weishen, WU Rongan, LIN Liwu.The activities of supported catalysts in propane dehydrogenation Ⅴ The reaction model of PtSn/Al2O3in propane dehydrogenation[J].Chinese Journal of Catalysis, 1992, 13(3):161-166.)
[25] BARI S O A, HOLMEN A, BLEKKAN E A.Propane dehydrogenation over supported Pt and Pt-Sn catalysts: Catalyst preparation, characterization, and activity measurements[J].J Catal, 1996, 158(1):1-12.
[26] 杨维慎, 林励吾. 负载型铂锡催化剂的研究进展[J].石油化工, 1993, 5(5):347-352.(YANG Weishen, LIN Liwu.Research progress of the supported Pt-Sn catalysts[J].Petrochemical Technology, 1993, 5(5):347-352.)
[27] VU B K, SONG M B, AHN I Y, et al.Propane dehydrogenation over Pt-Sn/Rare-earth-doped Al2O3: Influence of La, Ce, or Y on the formation and stability of Pt-Sn alloys[J].Catal Today, 2011, 164(1):214-220.
[28] KUMAR M S, CHEN D, HOLMEN A, et al.Dehydrogenation of propane over Pt-SBA-15 and Pt-Sn-SBA-15: Effect of Sn on the dispersion of Pt and catalytic behavior[J].Catal Today, 2009, 142(1-2):17-23.
[29] HAUSER A W, GOMES J, BAJDICH M, et al.Subnanometer-sized Pt/Sn alloy cluster catalysts for the dehydrogenation of linear alkanes[J].Phys Chem Chem Phys, 2013, 15(47):20727-20734.
[30] YANG M L, ZHU Y A, ZHOU X G, et al.First-principles calculations of propane dehydrogenation over PtSn catalysts[J].ACS Catal, 2012, 2(6):1247-1258.
[31] HAN Z, LI S, JIANG F, et al.Propane dehydrogenation over Pt-Cu bimetallic catalysts: The nature of coke deposition and the role of copper[J].Nanoscale, 2014, 6 (17):10000-10008.
[32] IGLESIAS-JUEZ A, BEALE A M, MAAIJEN K, et al.A combined in situ time-resolved UV-Vis, Raman and high-energy resolution X-ray absorption spectroscopy study on the deactivation behavior of Pt and Pt-Sn propane dehydrogenation catalysts under industrial reaction conditions[J].J Catal, 2010, 276(2):268-279.
[33] HE S, SUN C, BAI Z, et al.Dehydrogenation of long chain paraffins over supported Pt-Sn-K/Al2O3catalysts: A study of the alumina support effect[J].Appl Catal A, 2009, 356(1):88-98.
[34] 董群, 王鉴, 武显春, 等.Pt-Sn-K/Al2O3丙烷脱氢催化剂中各组分的作用[J].大庆石油学院学报, 1995, 19(3):61-63.(DONG Qun, WANG Jian, WU Xianchun, et al.The role of each component of Pt-Sn-K/Al2O3in propane dehydrogenation[J].Journal of Daqing Petroleum Institute, 1995, 19(3):61-63.)
[35] 杨维慎, 吴荣安, 林励吾.PtSn/Al2O3负载型催化剂丙烷脱氢性能的改进[J].石油化工, 1992, 21(8):511-515.(YANG Weishen, WU Rongan, LIN Liwu.The modification of the supported PtSn/Al2O3catalyst in propane dehydrogenation[J].Petrochemical Technology, 1992, 21(8):511-515.)
[36] 余长林, 葛庆杰, 徐恒泳, 等.Cr对Pt-Sn/γ-Al2O3催化剂丙烷脱氢性能的影响[J].燃料化学学报, 2006, 34(2):209-213.(YU Changlin, GE Qingjie, XU Hengyong, et al.Effect of Cr promoter on the performance of Pt-Sn/γ-Al2O3catalyst for propane dehydrogenation[J].Journal of Fuel Chemistry and Technology, 2006, 34(2):209-213.)
[37] DEL ANGEL G, BONILLA A, PENA Y, et al.Effect of lanthanum on the catalytic properties of PtSn/γ-Al2O3bimetallic catalysts prepared by successive impregnation and controlled surface reaction[J].J Catal, 2003, 219 (1):63-73.
[38] YU C, GE Q, XU H, et al.Effects of Ce addition on the Pt-Sn/γ-Al2O3catalyst for propane dehydrogenation to propylene[J].Appl Catal A, 2006, 315:58-67.
[39] PISDUANGDAW S, PANPRANOT J, CHAISUK C, et al.Flame sprayed tri-metallic Pt-Sn-X/Al2O3catalysts (X=Ce, Zn, and K) for propane dehydration[J].Catal Commun, 2011, 12 (12):1161-1165.
[40] MIRONENKO R M, BELSKAYA O B, TALSI V P, et al.Effect ofγ-Al2O3hydrothermal treatment on the formation and properties of platinum sites in Pt/γ-Al2O3catalysts[J].Appl Catal A, 2014, 469:472-482.
[41] KOGAN S, HERSKOWITZ M.Selective propane dehydrogenation to propylene on novel bimetallic catalysts[J].Catal Commun, 2001, 2 (5):179-185.
[42] LONG L L, LANG W Z, LIU X, et al.Improved catalytic stability of PtSnIn/xCa-Al catalysts for propane dehydrogenation to propylene[J].Chem Eng J, 2014, 257:209-217.
[43] SHI J, ZHOU Y, ZHANG Y, et al.Synthesis of magnesium-modified mesoporous Al2O3with enhanced catalytic performance for propane dehydrogenation[J].J Mater Sci, 2014, 49 (16):5772-5781.
[44] HUANG L, XU B, YANG L, et al.Propane dehydrogenation over the PtSn catalyst supported on alumina-modified SBA-15[J].Catal Commun, 2008, 9(15):2593-2597.
[45] NAWAZ Z, WEI F.Pt-Sn-based catalyst’s intensification using Al2O3-SAPO-34 as a support for propane dehydrogenation to propylene[J].J Ind Eng Chem, 2011, 17 (3):389-393.
[46] DUAN Y, ZHOU Y, ZHANG Y, et al.Effect of sodium addition to PtSn/AlSBA-15 on the catalytic properties in propane dehydrogenation[J].Catal Lett, 2011, 141(1):120-127.
[47] ZHANG Y, ZHOU Y, YANG K, et al.Effect of hydrothermal treatment on catalytic properties of PtSnNa/ZSM-5 catalyst for propane dehydrogenation[J].Microporous Mesoporous Mater, 2006, 96(1-3):245-254.
[48] ZHANG Y, ZHOU Y, QIU A, et al.Propane dehydrogenation on PtSn/ZSM-5 catalyst: Effect of tin as a promoter[J].Catal Commun, 2006, 7(11):860-866.
[49] 张一卫. 以ZSM-5分子筛为载体的新型丙烷脱氢催化剂的研究[D].南京: 东南大学, 2006.
[50] LIU H, ZHOU Y, ZHANG Y, et al.Effect of preparation processes on catalytic performance of PtSnNa/ZSM-5 for propane dehydrogenation[J].Ind Eng Chem Res, 2009, 48(12):5598-5603.
[51] ZHANG Y, ZHOU Y, HUANG L, et al.Sn-Modified ZSM-5 as support for platinum catalyst in propane dehydrogenation[J].Ind Eng Chem Res, 2011, 50 (13):7896-7902.
[52] LI W, YU S Y, MEITZNER G D, et al.Structure and properties of cobalt-exchanged H-ZSM5 catalysts for dehydrogenation and dehydrocyclization of alkanes[J].J Phys Chem B, 2001, 105(6):1176-1184.
[53] WAKU T, BISCARDI J A, IGLESIA E.Active, selective, and stable Pt/Na-Fe ZSM5 catalyst for the dehydrogenation of light alkanes[J].Chem Commun, 2003, (14):1764-1765.
[54] ZHOU S, ZHOU Y, SHENG X, et al.Synthesis of MgO-Al2O3/ZSM-5 by solid state reaction for propane dehydrogenation[J].China Petroleum Processing & Petrochemical Technology, 2013, 15(3):50-56.
[55] 余长林, 徐恒泳, 陈喜蓉, 等.PtZn-Sn/SBA-15合成、表征及对丙烷催化脱氢性能[J].燃料化学学报, 2010, 38(3):308-312.(YU Changlin, XU Hengyong, CHEN Xirong, et al.Preparation, characterization, and catalytic performance of PtZn-Sn/SBA-15 catalyst for propane dehydrogenation[J].Journal of Fuel Chemistry and Technology, 2010, 38(3):308-312.)
[56] 余长林. 丙烷脱氢铂催化剂与反应性能的研究[D].大连: 中国科学院大连化学物理研究所, 2007.
[57] YU C, XU H, CHEN X, et al.Preparation, characterization, and catalytic performance of PtZn-Sn/SBA-15 catalyst for propane dehydrogenation[J].Journal of Fuel Chemistry and Technology, 2010, 38 (3):308-312.
[58] PADRO C L, DE MIGUEL S R, CASTRO A A, et al.Stability and regeneration of supported PtSn catalysts for propane dehydrogenation[J].Stud Surf Sci Catal, 1997, 111:191-198.
[59] BOSCH P, VALENZUELA M A, ZAPATA B, et al.High temperature treated Pt/Sn-ZnAl2O4catalysts[J].J Mol Catal, 1994, 93(1):67-78.
[60] DE MIGUEL S R, JABLONSKI E L, CASTRO A A, et al.Highly selective and stable multimetallic catalysts for propane dehydrogenation[J].J Chem Technol Biotechnol, 2000, 75(7):596-600.
[61] WANG Y, WANG Y, WANG S, et al.Propane dehydrogenation over PtSn catalysts supported on ZnO-modified MgAl2O4[J].Catal Lett, 2009, 132 (3-4):472-479.
[62] ZHANG Y, ZHOU Y, SHI J, et al.Comparative study of bimetallic Pt-Sn catalysts supported on different supports for propane dehydrogenation[J].J Mol Catal A, 2014, 381:138-147.
[63] KUMAR M S, CHEN D, WALMSLEY J C, et al.Dehydrogenation of propane over Pt-SBA-15: Effect of Pt particle size[J].Catal Commun, 2008, 9(5):747-750.
[64] LI Q, SUI Z, ZHU Y A, et al.Formation of coke on Pt catalysts during propane dehydrogenation: Effect of Pt particle size and Sn addition[J].Journal of Chemical Industry and Engineering (China), 2013, 64(2):524-531.
[65] YANG ML, ZHU YA, FAN C, et al.Density functional study of the chemisorption of C1, C2and C3intermediates in propane dissociation on Pt (111)[J].J Mol Catal A, 2010, 321 (1):42-49.
[66] YANG M L, ZHU Y A, FAN C, et al.DFT study of propane dehydrogenation on Pt catalyst: Effects of step sites[J].Phys Chem Chem Phys, 2011, 13(8):3257-3267.
[67] YANG M L, ZHU J, ZHU Y A, et al.Tuning selectivity and stability in propane dehydrogenation by shaping Pt particles: A combined experimental and DFT study[J].J Mol Catal A, 2014, 395:329-336.
[68] YU W, POROSOFF M D, CHEN J G.Review of Pt-based bimetallic catalysis: From model surfaces to supported catalysts[J].Chem Rev, 2012, 112(11):5780-5817.
[69] BAI L, ZHOU Y, ZHANG Y, et al.Influence of the competitive adsorbates on the catalytic properties of PtSnNaMg/ZSM-5 catalysts for propane dehydrogenation[J].Ind Eng Chem Res, 2011, 50 (8):4345-4350.
[70] SALMONES J, WANG J A, GALICIA J A, et al.H2reduction behaviors and catalytic performance of bimetallic tin-modified platinum catalysts for propane dehydrogenation[J].J Mol Catal A, 2002, 184(1):203-213.
[71] SAULT A G, MARTINO A, KAWOLA J S, et al.Novel sol-gel-based Pt nanocluster catalysts for propane dehydrogenation[J].J Catal, 2000, 191(2):474-479.
[72]黄宁表,田金忠, 刘强,等.铂锡双金属催化剂上丙烷脱氢反应研究[J].燃料化学学报, 1996, 24(2):108-113.(HUANG Ningbiao, TIAN Jinzhong, LIU Qiang, et al.Bi-components Pt-Sn catalysts for propane dehydrogenation[J].Journal of Fuel Chemistry and Technology, 1996, 24(2):108-113.)
[73] FARJOO A, KHORASHEH F, NIKNADDAF S, et al.Kinetic modeling of side reactions in propane dehydrogenation over Pt-Sn/γ-Al2O3catalyst[J].Scientia Iranica, Transactions C: Chemistry and Chemical Engineering, 2011, 18(1):458-464.
[74] LARSSON M, HENRIKSSON N, ANDERSSON B.Investigation of the kinetics of a deactivating system by transient experiments[J].Appl Catal A, 1998, 166 (1):9-19.
[75] LI Q, SUI Z, ZHOU X, et al.Kinetics of propane dehydrogenation over Pt-Sn/Al2O3catalyst[J].Appl Catal A, 2011, 398(1-2):18-26.
[76] G MEZ-QUERO S, TSOUFIS T, RUDOLF P, et al.Kinetics of propane dehydrogenation over Pt-Sn/Al2O3[J].Catalysis Science and Technology, 2013, 3(4):962-971.
[77] 陈光文, 阳永荣, 戎顺熙.在Pt-Sn/Al2O3催化剂上丙烷脱氢反应动力学[J].化学反应工程与工艺, 1998, 14(2):130-137.(CHEN Guangwen, YANG Yongrong, RONG Shunxi.Study on the intrinsic kinetics of propane dehydrogenation over Pt-Sn/Al2O3catalyst[J].Chemical Reaction Engineering and Technology, 1998, 14(2):130-137.)
[78] 李庆. Pt催化剂上丙烷脱氢反应与结焦动力学[D].上海: 华东理工大学, 2012.
[79] SATTLER J J, BEALE A M, WECKHUYSEN B M.Operando Raman spectroscopy study on the deactivation of Pt/Al2O3and Pt-Sn/Al2O3propane dehydrogenation catalysts[J].Phys Chem Chem Phys, 2013, 15 (29):12095-12103.
[80] BAO KHANH V, SONG M B, AHN I Y, et al.Location and structure of coke generated over Pt-Sn/Al2O3in propane dehydrogenation[J].J Ind Eng Chem, 2011, 17(1):71-76.
[81] LARSSON M, HULTEN M, BLEKKAN E A, et al.The effect of reaction conditions and time on stream on the coke formed during propane dehydrogenation[J].J Catal, 1996, 164 (1):44-53.
[82] LI Q, SUI Z, ZHOU X, et al.Coke formation on Pt-Sn/Al2O3catalyst in propane dehydrogenation: coke characterization and kinetic study[J].Top Catal, 2011, 54(13-15):888-896.
[83] van SINT ANNALAND M, KUIPERS J, van SWAAIJ W.A kinetic rate expression for the time-dependent coke formation rate during propane dehydrogenation over a platinum alumina monolithic catalyst[J].Catal Today, 2001, 66(2):427-436.
[84] BILOEN P, DAUTZENBERG F M, SACHTLER W M H.Catalytic dehydrogenation of propane to propene over platinum and platinum-gold alloys[J].J Catal, 1977, 50 (1):77-86.
[85] SOKOLOV S, STOYANOVA M, RODEMERCK U, et al.Comparative study of propane dehydrogenation over V-, Cr-, and Pt-based catalysts: Time on-stream behavior and origins of deactivation[J].J Catal, 2012, 293:67-75.
[86] SATTLER J J H B, BEALE A M, WECKHUYSEN B M.Operando Raman spectroscopy study on the deactivation of Pt/Al2O3and Pt-Sn/Al2O3propane dehydrogenation catalysts[J].Phys Chem Chem Phys, 2013, 15(29):12095-12103.
[87] NHUT JM, VIEIRA R, PESANT L, et al.Synthesis and catalytic uses of carbon and silicon carbide nanostructures[J].Catal Today, 2002, 76(1):11-32.
[88] SU D S, PERATHONER S, CENTI G.Nanocarbons for the development of advanced catalysts[J].Chem Rev, 2013, 113(8):5782-5816.
[89] MCGREGOR J, HUANG Z, PARROTT E P, et al.Active coke: Carbonaceous materials as catalysts for alkane dehydrogenation[J].J Catal, 2010, 269(2):329-339.
[90] ZHANG J, SU D S, BLUME R, et al.Surface chemistry and catalytic reactivity of a nanodiamond in the steam-free dehydrogenation of ethylbenzene[J].Angew Chem Int Ed, 2010, 49(46):8640-8644.
[91] LIU L, DENG Q F, AGULA B, et al.Synthesis of ordered mesoporous carbon materials and their catalytic performance in dehydrogenation of propane to propylene[J].Catal Today, 2012, 186(1):35-41.
[92]LIU L, DENG Q F, AGULA B, et al.Ordered mesoporous carbon catalyst for dehydrogenation of propane to propylene[J].Chem Commun, 2011, 47(29):8334-8336.
[93] LIU L, DENG Q F, LIU Y P, et al.HNO(3)-activated mesoporous carbon catalyst for direct dehydrogenation of propane to propylene[J].Catal Commun, 2011, 16(1):81-85.
[94] WANG R, SUN X, ZHANG B, et al.Hybrid nanocarbon as a catalyst for direct dehydrogenation of propane: formation of an active and selective core-shellsp2/sp3nanocomposite structure[J].Chem Eur J, 2014, 20(21):6324-6331.
New Progress in Pt-based Catalysts for Propane Dehydrogenation
LIU Jie, LIU Changcheng, MA Aizeng, RONG Junfeng, DA Zhijian
(ResearchInstituteofPetroleumProcessing,SINOPEC,Beijing100083,China)
Propylene is one of the most important chemicals used as feedstock for a variety of polymers and intermediates in organic chemical and petrochemical industry. Lately, powered by the downstream part of the propylene business, the demand of propylene keeps increasing at home and abroad. There is a technology of propane dehydrogenation with propane as the only raw material to produce the single product of propylene, by which of technological maturity the high yield was obtained, while the investment costs was low. The mechanisms, preparation methods, dynamics and deactivation about the Pt catalysts were reviewed, and the application of nano-carbons in the propane dehydrogenation was discussed. At last, some key problems to be solved were summarized and corresponding suggestions for improvement were proposed.
propane dehydrogenation; Pt catalysts; nanocarbons; ordered mesoporous carbons; nanodiamond
2014-07-22
刘杰,女,博士研究生,从事丙烷脱氢催化剂的研究;Tel:010-82368911
达志坚,男,教授级高级工程师;从事催化新材料与反应工程的集成研究;Tel:010-82368390;E-mail:dazhijian.ripp@sinopec.com
1001-8719(2015)05-1218-14
TQ06
A
10.3969/j.issn.1001-8719.2015.05.029
