箬竹叶提取物对烟草病原真菌的抑制作用
2015-07-02李俊超杨春雷胡国元杨锦鹏
李俊超,胡 坚,杨春雷,胡国元,余 君,杨锦鹏
(1.湖北省烟草科学研究院,湖北武汉 430030;2.华中农业大学植物科技学院,湖北武汉 430070; 3.武汉工程大学化工与制药学院,湖北武汉 430074)
箬竹叶提取物对烟草病原真菌的抑制作用
李俊超1,2,胡 坚3,杨春雷1,胡国元3,余 君1,杨锦鹏1
(1.湖北省烟草科学研究院,湖北武汉 430030;2.华中农业大学植物科技学院,湖北武汉 430070; 3.武汉工程大学化工与制药学院,湖北武汉 430074)
采用菌丝生长速率法和孢子萌发法,对选用无水乙醇、冰乙酸和蒸馏水混合溶剂浸提所得的箬竹叶粗提物以及依次采用石油醚、乙酸乙酯和正丁醇进行液-液萃取所得的萃取物进行了抑菌活性测试。结果表明:箬竹叶粗提物对烟草链格孢菌和烟草疫霉菌菌丝生长均具有抑制活性,其对两种真菌抑制的EC50值分别为3.98 mg·mL-1和0.88 mg ·mL-1、EC90值分别为7.33mg·mL-1和1.73mg·mL-1;对烟草链格孢菌孢子萌发抑制的EC50值和EC90值分别为4.68 mg·mL-1和9.09 mg·mL-1。2 mg·mL-1的石油醚、乙酸乙酯、正丁醇萃取物和萃余水相对烟草链格孢菌菌丝生长的抑制率分别为31.27%、36.18%、6.06%和-7.05%;对烟草疫霉菌菌丝生长的抑制率分别为56.82%、81.53%、12.32%和-18.10%。乙酸乙酯萃取物对烟草链格孢菌和烟草疫霉菌菌丝生长的抑制活性明显高于箬竹叶粗提物,其对两种真菌抑制的EC50值分别为2.99 mg·mL-1和0.80 mg·mL-1、EC90值分别为5.41 mg·mL-1和2.83 mg·mL-1。乙酸乙酯萃取物对烟草链格孢菌孢子萌发抑制的EC50值和EC90值分别为1.03 mg·mL-1和3.54 mg·mL-1。
箬竹;烟草链格孢菌;烟草疫霉菌;抑菌活性
近年来对箬竹(Indocalamus tessellatus)叶提取物抑菌作用的研究报道较多[1-4]。张慧等[1]以箬竹叶水提物和丙酮提取物对大肠杆菌、枯草芽孢杆菌等7种菌进行了抑菌活性研究,结果表明,箬竹叶提取物对细菌具有一定的抑制作用。杨卫东等[4]研究表明,箬竹叶的乙酸乙酯提取物对酿酒酵母菌和白色假丝酵母菌等5种供试菌表现出较强的抑制作用。但是,目前关于箬竹叶提取物对烟草链格孢菌和烟草疫霉菌抑制作用的报道较少。作者以箬竹叶为原料,采用无水乙醇、冰乙酸和蒸馏水为混合溶剂进行恒温浸提,然后以石油醚、乙酸乙酯和正丁醇对粗提物依次进行液-液萃取,测定了箬竹叶粗提物和萃取物对烟草链格孢菌和烟草疫霉菌的抑制作用。
1 实验
1.1 材料、试剂与培养基
箬竹叶由湖北省烟草科学研究院提供,经60℃烘干,粉碎过40目筛(孔径0.45 mm)后,贮存于棕色玻璃瓶,置于干燥器中备用。
烟草链格孢菌(Alternaria alternate)和烟草疫霉菌(Phytophthora parasitica),均由湖北省烟草科学研究院提供,实验室保藏。
无水乙醇、石油醚(60~90)、乙酸乙酯、正丁醇、蔗糖、七水硫酸亚铁、四水氯化锰、七水硫酸锌,均为分析纯;琼脂(040010),Japan。
马铃薯蔗糖琼脂(PSA)培养基[5],用于烟草链格孢菌的活化与培养;燕麦琼脂(OA)培养基[5],用于烟草疫霉菌的活化与培养。
1.2 方法
1.2.1 箬竹叶的浸提
称取30 g预处理后的箬竹叶粉置于500 mL锥形瓶中,按料液比3∶5∶3∶12(g∶mL∶mL∶mL)的比例加入无水乙醇、冰乙酸和蒸馏水,即溶剂体系共计200 mL,密封后置于40℃恒温摇床150 r·min-1振荡浸提2 d,抽滤,将滤液于60℃负压真空浓缩至浸膏状;滤渣再重复浸提一次。两次所得浸膏合并,用无水乙醇溶解并抽滤,滤液浓缩至浸膏状,称重后用无水乙醇溶解粗提物,定容至400 mg·mL-1,即得到箬竹叶粗提液,于4℃冰箱冷藏备用[6]。
1.2.2 箬竹叶粗提物的萃取
取箬竹叶粗提液,浓缩成浸膏,加4倍体积的蒸馏水超声溶解,调pH值至6.5[7]。依次用石油醚、乙酸乙酯和正丁醇进行萃取,前3次萃取剂用量为水溶液的1/2,后续减半至1/4萃取[8],以萃取剂不改变颜色为萃取终点[9]。各相萃取液和萃余水相在60℃下真空浓缩至浸膏状,称重后分别用无水乙醇定容至400 mg·mL-1,密封,于4℃冰箱冷藏备用。
1.2.3 真菌活性检测方法
1.2.3.1 菌丝生长速率法
向与待测菌相对应的培养基内加入备用的400 mg·mL-1的药液,制成一定质量浓度的含药培养基平板,每组设3个重复,对照组则加入相同体积的分析纯无水乙醇。用直径7.68 mm打孔器切取在供试菌平板上(28±1)℃培养7 d的菌碟,用接种针挑取菌饼轻放于含药培养基中央(每皿1块,菌丝面朝下),于(28±1)℃恒温培养144 h后,观测菌丝生长。用十字交叉法测量菌落直径,按式(1)计算菌丝生长抑制率[6],比较抑制效果。

1.2.3.2 载玻片孢子萌发法
将烟草链格孢菌接种到PSA平板上(28±1)℃培养14 d,用无菌水洗下分生孢子,4层纱布过滤除去菌丝体及破碎培养基,振荡均匀。借助低倍显微镜用无菌蒸馏水对孢子悬浮液进行稀释,将目镜(10×10)视野内的烟草链格孢菌孢子数控制在100个[5]。用体积分数为2%的吐温80水溶液将制备好的药剂配成5个不同浓度的药液,对照组则加入相同体积的分析纯无水乙醇,在90℃水浴条件下将溶剂彻底挥发[10]后,与等量的孢子悬浮液混匀,分别滴在凹玻片上,每个样品设3个平行,并用体积分数为2%的吐温80水溶液作对照。(28±1)℃培养6 h后(培养终点时对照组孢子萌发率理论上应达到80%以上[11]),每个处理重复随机观察3个以上视野,分别记录孢子萌发数(孢子芽管长度大于孢子的短半径视为萌发)与不萌发数。按式(2)、(3)计算萌发率及孢子萌发抑制率[12],比较抑制效果。


1.2.3.3 对病原真菌菌丝生长或孢子萌发的毒力测定
按照倍比稀释法的原则,在一定范围内设置5组药剂浓度梯度值,并采用菌丝生长速率法或载玻片孢子萌发法测定每组对应的抑菌活性。利用浓度梯度值(x)和菌丝生长抑制率或孢子萌发抑制率的几率值(y),用OFFICE 2012软件拟合直线毒力回归方程,并求出对应供试菌抑制率达到50%和90%时所对应箬竹叶粗提物或萃取物的浓度值EC50值和EC90值[6],以评价箬竹叶粗提物和萃取物对不同烟草病原真菌菌丝生长或孢子萌发的毒力大小。
2 结果与讨论
2.1 箬竹叶粗提物对烟草链格孢菌和烟草疫霉菌菌丝生长的毒力(图1)
由图1可知,箬竹叶粗提物对烟草链格孢菌和烟草疫霉菌的菌丝生长抑制活性随着加药浓度的增大而增强;相同浓度的箬竹叶粗提物对烟草疫霉菌菌丝生长的抑制作用明显强于烟草链格孢菌;8 mg·mL-1的箬竹叶粗提物对烟草链格孢菌菌丝生长的抑制率高达99.90%,其毒力回归方程为y=11.921x+2.5879,相关系数R2=0.9951,计算得出EC50值为3.98 mg· mL-1、EC90值为7.33 mg·mL-1;2 mg·mL-1的箬竹叶粗提物对烟草疫霉菌菌丝生长的抑制率高达99.93%,其毒力回归方程为y=47.054x+8.4629,相关系数R2=0.9908,计算得出 EC50值为0.88 mg· mL-1、EC90值为1.73 mg·mL-1。
2.2 箬竹叶粗提物对烟草链格孢菌孢子萌发的毒力(表1)
由表1可知:箬竹叶粗提物对烟草链格孢菌孢子萌发的抑制活性随加药浓度的增大而增强;然而,要达到同等的抑制率,抑制孢子萌发实验所需箬竹叶粗提物的加药浓度要高于抑制菌丝生长实验;10 mg· mL-1的箬竹叶粗提物对烟草链格孢菌孢子萌发的抑制率达到96.86%,其毒力回归方程为y=9.0820x+ 7.4671,相关系数 R2=0.9970;计算得出 EC50值为4.68 mg·mL-1、EC90值为9.09 mg·mL-1。
2.3 萃取物对烟草链格孢菌和烟草疫霉菌菌丝生长的抑制活性(图2)

图1 箬竹叶粗提物对烟草链格孢菌(a)和烟草疫霉菌(b)菌丝生长的毒力Fig.1 Antifungal toxicity of primary components from Indocalamus tessellatus leaves tom ycelium grow th rate of A.alternate(a)and P.parasitica(b)
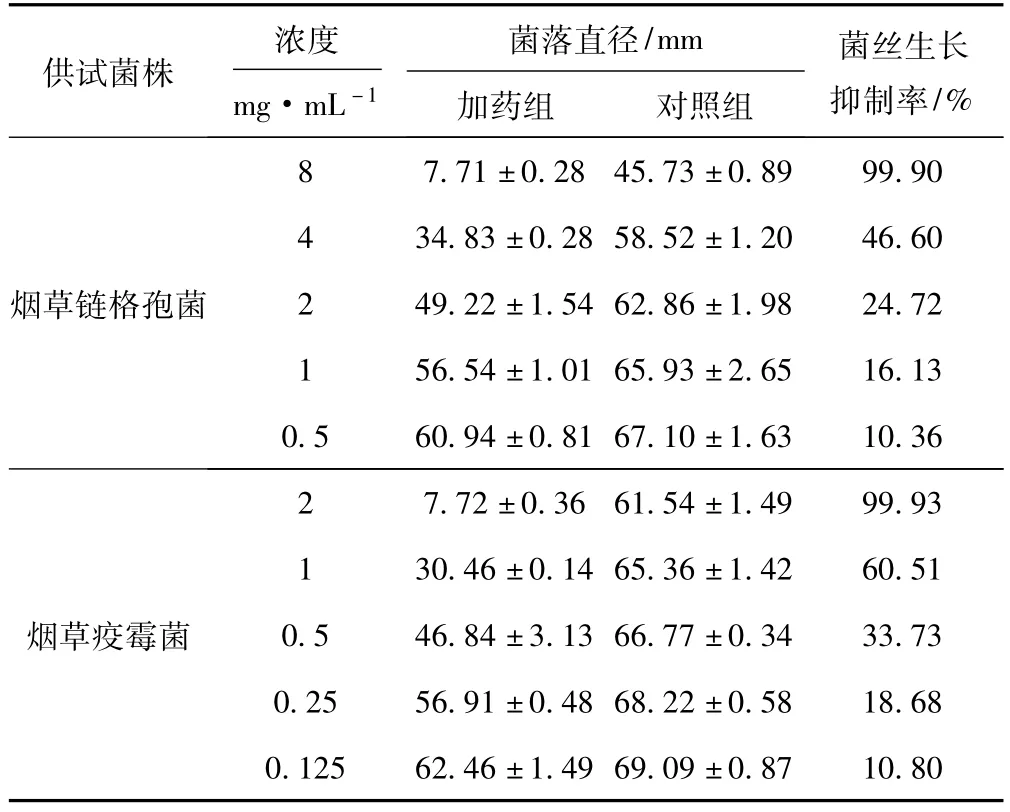
菌落直径/mm供试菌株浓度mg·mL-1加药组 对照组菌丝生长抑制率/%烟草链格孢菌8 7.71±0.28 45.73±0.89 99.90 4 34.83±0.28 58.52±1.20 46.60 2 49.22±1.54 62.86±1.98 24.72 1 56.54±1.01 65.93±2.65 16.13 0.5 60.94±0.81 67.10±1.63 10.36烟草疫霉菌2 7.72±0.36 61.54±1.49 99.93 1 30.46±0.14 65.36±1.42 60.51 0.5 46.84±3.13 66.77±0.34 33.73 0.25 56.91±0.48 68.22±0.58 18.68 0.125 62.46±1.49 69.09±0.87 10.80
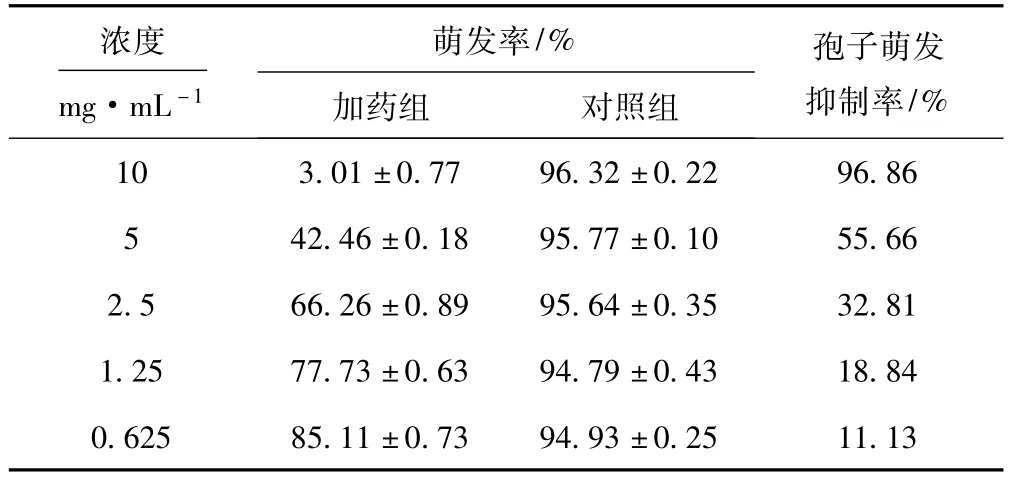
表1 箬竹叶粗提物对烟草链格孢菌孢子萌发的毒力Tab.1 Antifungal toxicity of primary com ponents from Indocalamus tessellatus leaves to spore germ ination of A.alternate
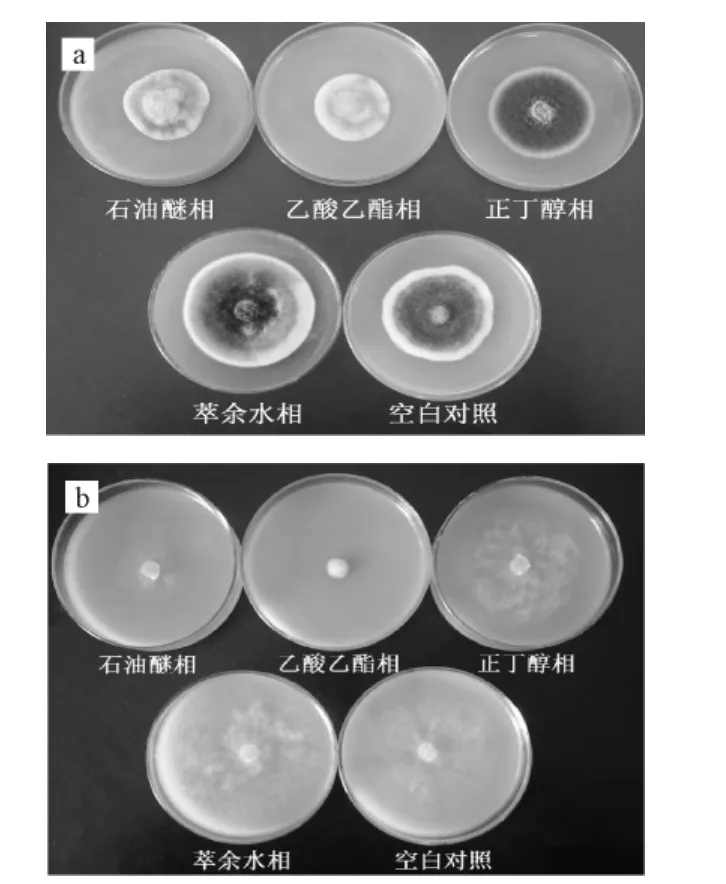
图2 萃取物对烟草链格孢菌(a)和烟草疫霉菌(b)菌丝生长的抑制活性Fig.2 The inhibitory activity of extraction components to m ycelium grow th rate of A.alternate(a)and P.parasitica(b)
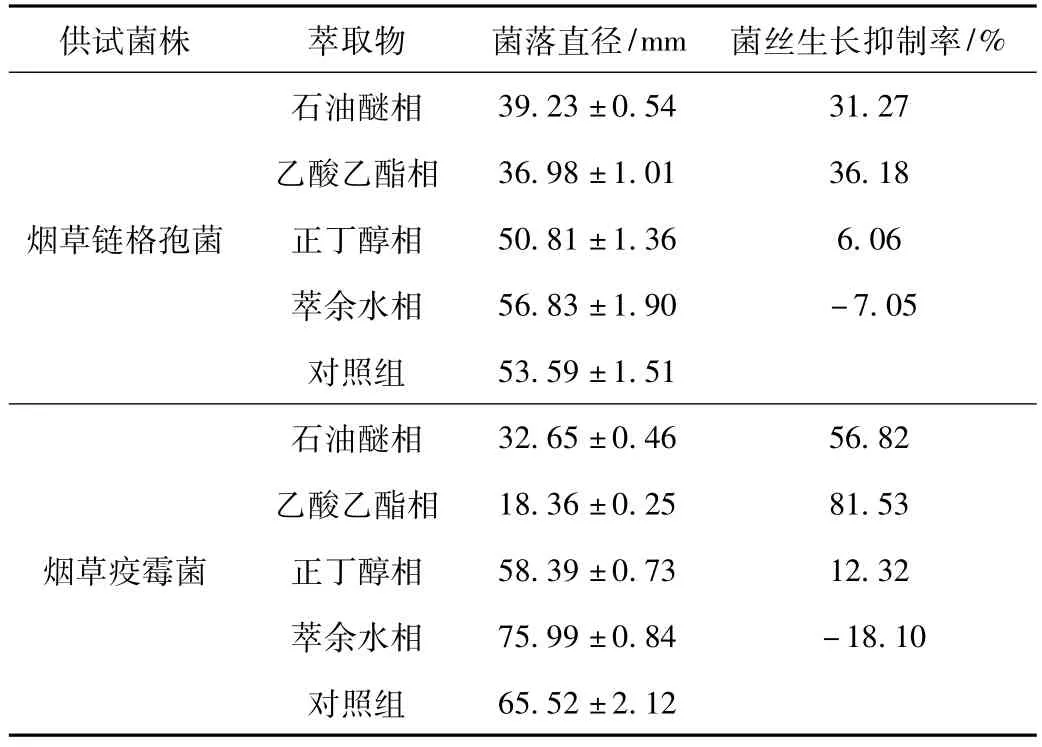
注:萃取物浓度为2 mg·mL-1。
由图2可知,3种有机相萃取物对烟草链格孢菌和烟草疫霉菌菌丝生长均表现出不同程度的抑制活性,但萃余水相却都表现出一定的促进作用。在2 mg ·mL-1时,4种萃取物对烟草链格孢菌和烟草疫霉菌菌丝生长的抑制率大小顺序依次为:乙酸乙酯相>石油醚相>正丁醇相>萃余水相。
2.4 乙酸乙酯萃取物对烟草链格孢菌和烟草疫霉菌菌丝生长的毒力(图3)

图3 乙酸乙酯萃取物对烟草链格孢菌(a)和烟草疫霉菌(b)菌丝生长的毒力Fig.3 Antifungal toxicity of ethyl acetate phase component tom ycelium grow th rate of A.alternate(a)and P.parasitica(b)

供试菌株 浓度mg·mL菌落直径/mm-1加药组 对照组菌丝生长抑制率/%烟草链格孢菌4 17.14±0.25 37.47±0.66 68.25 2 37.22±1.45 50.03±1.94 30.25 1 65.19±1.31 76.73±0.67 16.72 0.5 75.99±0.84 75.50±1.13 11.95 0.25 76.48±0.84 78.46±1.13 4.21烟草疫霉菌4 7.71±0.17 55.65±2.12 99.93 2 18.36±0.25 65.52±2.12 81.53 1 40.27±1.43 78.35±1.02 53.89 0.5 52.33±2.26 79.08±0.82 37.46 0.25 75.99±0.84 79.42±1.03 11.95
由图3可知,乙酸乙酯萃取物对烟草链格孢菌和烟草疫霉菌的菌丝生长抑制活性随着加药浓度的增大而增强;相同浓度的乙酸乙酯萃取物对烟草疫霉菌菌丝生长的抑制作用明显高于烟草链格孢菌;4 mg· mL-1的乙酸乙酯萃取物对烟草链格孢菌菌丝生长的抑制率高达68.25%,其毒力回归方程为y=16.517x +0.6746,相关系数R2=0.9907,计算得出EC50值为2.99 mg·mL-1、EC90值为5.41 mg·mL-1;4 mg· mL-1的乙酸乙酯萃取物对烟草疫霉菌菌丝生长的抑制率高达99.93%,其毒力回归方程为y=21.196x+ 24.060,相关系数 R2=0.9947,计算得出 EC50值为0.80 mg·mL-1、EC90值为2.83 mg·mL-1。
2.5 乙酸乙酯萃取物对烟草链格孢菌孢子萌发的毒力(表2)
由表2可知:乙酸乙酯萃取物对烟草链格孢菌孢子萌发的抑制活性随着加药浓度的增大而增强;然而,要达到同等的抑制率,孢子萌发实验所需乙酸乙酯萃取物的加药浓度要高于菌丝生长实验;5mg·mL-1的乙酸乙酯萃取物对烟草链格孢菌孢子萌发的抑制率高达98.12%,其毒力回归方程为y=17.066x+23.135,相关系数R2=0.9938,计算得出EC50值为1.03 mg· mL-1、EC90值为3.54 mg·mL-1。
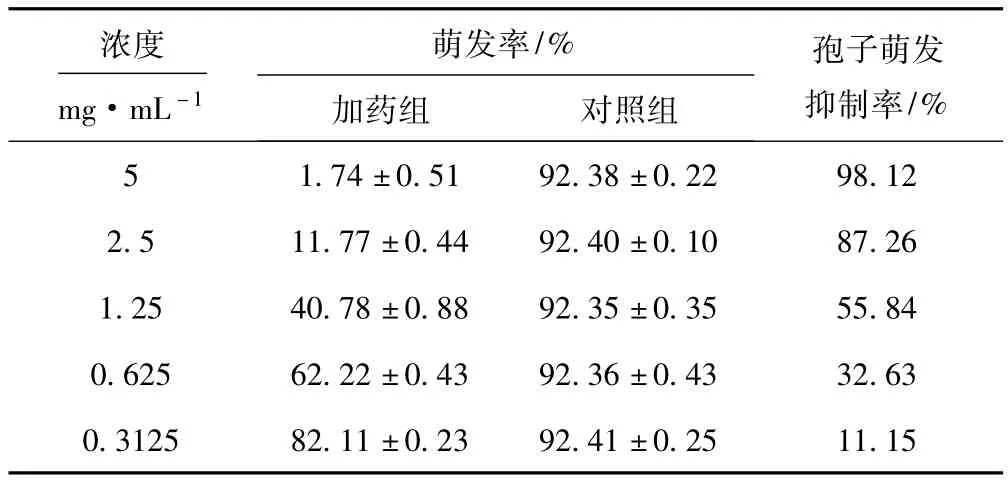
表2 乙酸乙酯萃取物对烟草链格孢菌孢子萌发的毒力Tab.2 Antifungal toxicity of ethyl acetate phase component to spore germ ination of A.alternate
2.6 讨论
1)箬竹叶粗提物对两种烟草病原真菌菌丝具有较强的抑制活性,且随着浓度的增大抑制率逐渐上升;对比发现其对烟草疫霉菌的防效优于烟草链格孢菌,为植物源农药在烟草病害的防治工作方面奠定了一定的基础。此外,箬竹叶粗提物对烟草链格孢菌孢子萌发也表现出较强的抑制活性,与张志英等[13]的研究结果相似。
2)箬竹叶粗提物中对两种烟草病原真菌起到抑制效果最高的萃取组分均出现在乙酸乙酯相的萃取液中,与黄亚利[3]的研究结果相似。
3)乙酸乙酯萃取物抑制烟草链格孢菌菌丝生长和孢子萌发的EC50值和EC90值均明显低于对应箬竹叶粗提物。表明箬竹叶抑菌活性成分通过萃取工艺,达到了预期的提纯效果。
3 结论
采用菌丝生长速率法和孢子萌发法,对选用无水乙醇、冰乙酸和蒸馏水混合溶剂浸提所得的箬竹叶粗提物以及依次采用石油醚、乙酸乙酯和正丁醇进行液-液萃取所得的萃取物进行了抑菌活性测试。结果表明:箬竹叶粗提物对烟草链格孢菌和烟草疫霉菌菌丝生长均具有抑制活性,其对两种真菌抑制的EC50值分别为3.98 mg·mL-1和0.88 mg·mL-1、EC90值分别为7.33 mg·mL-1和1.73 mg·mL-1;对烟草链格孢菌孢子萌发抑制的EC50值和EC90值分别为4.68 mg· mL-1和9.09 mg·mL-1。2 mg·mL-1的石油醚、乙酸乙酯、正丁醇萃取物和萃余水相对烟草链格孢菌菌丝生长的抑制率分别为31.27%、36.18%、6.06%和-7.05%;对烟草疫霉菌菌丝生长的抑制率分别为56.82%、81.53%、12.32%和-18.10%。乙酸乙酯萃取物对烟草链格孢菌和烟草疫霉菌菌丝生长的抑制活性明显高于箬竹叶粗提物,其对两种真菌抑制的EC50值分别为2.99 mg·mL-1和0.80 mg·mL-1、EC90值分别为5.41 mg·mL-1和2.83 mg·mL-1。乙酸乙酯萃取物对烟草链格孢菌孢子萌发抑制的 EC50值和EC90值分别为1.03 mg·mL-1和3.54 mg·mL-1。
[1] 张慧,林海萍,盛恩浩,等.箬竹提取物抑菌活性研究[J].浙江林业科技,2010,30(3):38-41.
[2] 陆志科.竹叶生物活性成分提取分离及其抗菌活性研究[D].长沙:中南林学院,2004.
[3] 黄亚利.毛竹提取物抗菌活性成分研究[D].合肥:安徽农业大学,2008.
[4] 杨卫东,费学谦,王敬文.不同溶剂对竹叶提取物抑菌作用的影响[J].食品工业科技,2006,27(1):77-79.
[5] 李超影,胡国元,胡坚,等.艾蒿提取物对烟草病原菌的抑制作用[J].湖北大学学报(自然科学版),2013,35(4):469-473.
[6] 胡坚.箬竹叶提取物对烟草病原菌的抑制活性研究[D].武汉:武汉工程大学,2013.
[7] 黄文,王益,胡筱波,等.竹叶提取物抑菌特性的研究[J].林产化学与工业,2002,22(1):68-70.
[8] 曾建国.植物提取物标准化研究:方法与示范[M].北京:化学工业出版社,2011:219-220.
[9] 郝严雷.番茄茎叶中抑菌活性成分研究[D].莱阳:莱阳农学院,2006.
[10] 张芊.臭蒿茎叶中抑菌活性成分研究[D].武汉:武汉工程大学,2014.
[11] 江茂生,许文耀.艾蒿提取物对13种植物病原菌物的抑制作用[J].福建农林大学学报(自然科学版),2007,36(4):352-356.
[12] 胡国元,胡坚,李超影,等.壳寡糖对烟草赤星病病原菌的抑制作用[J].武汉工程大学学报,2012,34(12):4-7.
[13] 张志英,杜相革.竹醋液复合硅对番茄叶霉病菌室内抑菌效果的研究[J].中国农学通报,2012,28(24):231-235.
Inhibitory Activity of Indocalamus Tessellatus Leaves Against Pathogenic Fungi of Tobacco
LI Jun-chao1,2,HU Jian3,YANG Chun-lei1,HU Guo-yuan3,YU Jun1,YANG Jin-peng1
(1.Tobacco Research Institute of Hubei Province,Wuhan 430030,China; 2.College of Plant Science and Technology,Huazhong Agricultural University,Wuhan 430070,China; 3.School of Chemical Engineering and Pharmacy,Wuhan Institute of Technology,Wuhan 430074,China)
After being dipped by ethanol,acetic acid and distilled water and then extracted with petroleum ether,ethyl acetate and n-butyl alcohol in sequence,the antifungal ingredients of Indocalamus tessellatus leaves were isolated. The antifungal activity was investigated bymeans ofmycelium growth rate and spore germination.Results indicated that primary components of Indocalamus tessellatus leaves exhibited inhibitory activity to both fungus,the value of EC50and EC90of primary components tomycelium growth rate of A.alternate were 3.98 mg·mL-1and 7.33 mg·mL-1;and to mycelium growth rate of P.parasitica were 0.88 mg·mL-1and 1.73 mg·mL-1;and to spore germination of A.alternate were 4.68 mg·mL-1and 9.09 mg·mL-1.The inhibitory rate of extraction phase of petroleum ether,ethyl acetate,n-butyl alcohol and raffinatewater phasewith the concentration of2mg·mL-1tomycelium growth rate of A.alternate were 31.27%,36.18%,6.06%and-7.05%;and to mycelium growth rate of P.parasitica were 56.82%,81.53%,12.32%and-18.10%.The inhibitory activity of ethyl acetate extraction phase against pathogenic fungi of tobacco was obviously higher than primary components of Indocalamus tessellatus leaves.The value of EC50and EC90of ethyl acetate extraction phase tomycelium growth rate of A.alternate were 2.99mg·mL-1and 5.41mg·mL-1;and to mycelium growth rate of P.parasitica were 0.80 mg·mL-1and 2.83 mg·mL-1;and to spore germination of A.alternate were 1.03 mg·mL-1and 3.54 mg·mL-1.
Indocalamus tessellatus;Alternaria alternate;Phytophthora parasitory;antifungal activity
Q 949.2
A
1672-5425(2015)02-0043-05
10.3969/j.issn.1672-5425.2015.02.011
国家科技重点项目(中烟办[2013]212号)
2014-10-27
李俊超(1990-),男,湖北武汉人,硕士研究生,研究方向:植物源农药,E-mail:lijunchao0124@webmail.hzau.edu.cn;通讯作者:杨春雷,研究员,E-mail:ycl193737@163.com;胡国元,博士,教授,E-mail:hgy701@163.com。
