肺癌患者外周血调节性B细胞的表达及其临床意义
2015-06-28陈葆国梅丽萍郑瑞李伯利
陈葆国,梅丽萍,郑瑞,李伯利
肺癌患者外周血调节性B细胞的表达及其临床意义
陈葆国,梅丽萍,郑瑞,李伯利
目的 检测肺癌患者外周血调节性B细胞(CD19+CD5+CD1d+B细胞,Bregs)的表达及其临床意义。方法收集72例肺癌患者和29例健康体检者的外周血,采用流式细胞仪检测Bregs细胞数量,ELISA法检测外周血清IL-10和TGF-β的水平。比较肺癌患者与健康对照,肺癌Ⅰ+Ⅱ期与Ⅲ+Ⅳ期患者Bregs细胞比例、外周血IL-10和TGF-β水平的差异;分析肺癌患者Bregs细胞比例与外周血IL-10和TGF-β水平的相关性。结果 肺癌患者外周血Bregs细胞比例明显高于健康对照 (5.01%±1.20% vs 2.78%±0.56%,P<0.01),Ⅲ+Ⅳ期患者高于Ⅰ+Ⅱ期患者(5.63%±1.04% vs 4.13%±0.78%,P<0.01)。肺癌患者外周血清IL-10和TGF-β水平明显高于健康对照(2.34±0.79pg/ml vs 1.29±0.51pg/ml,56.64±6.93ng/ ml vs 22.42±4.42ng/ml,P<0.01),Ⅲ+Ⅳ期患者高于Ⅰ+Ⅱ期患者(2.79±0.60pg/ml vs 1.71±0.59pg/ml,59.88±6.63ng/ml vs 52.10±4.37ng/ml,P<0.01)。相关分析显示,肺癌患者外周血Bregs细胞比例与IL-10水平呈正相关(r=0.69,P<0. 01),而与TGF-β水平无明显相关性。结论 肺癌患者外周血Bregs细胞比例及血清IL-10、TGF-β水平增高,提示Bregs细胞可能与肺癌的进展相关。
肺肿瘤;B淋巴细胞,调节性;白细胞介素10;转化生长因子β
肺癌是我国常见的恶性肿瘤之一,临床生存期短,目前发病机制仍不清楚。近年研究表明免疫系统功能失衡可导致肺癌的发生发展[1-4]。最近有研究显示调节性B细胞(regulatory B cells,Bregs)参与了机体的免疫耐受调节,与肿瘤免疫逃逸密切相关[1]。Bregs有多种亚型[5],其中CD19+CD5+CD1d+亚型主要分泌抑制性细胞因子IL-10,其分泌的IL-10占B细胞来源IL-10的绝大部分,故CD19+CD5+CD1d+亚型又被称为B10细胞。除主要分泌IL-10的Bregs以外,还有一类主要分泌TGF-β的Bregs,具有独特的生物学功能。本研究通过检测肺癌患者外周血CD19+CD5+CD1d+Bregs细胞亚群的表达情况,探讨其在肺癌患者免疫调节中的作用及临床意义。
1 资料与方法
1.1 研究对象 收集2011年5月-2013年12月在浙江省台州医院呼吸科和胸外科住院的72例肺癌患者的临床资料,其中男43例,女29例,年龄41~79(中位值64)岁。72例中鳞癌42例,腺癌19例,小细胞癌11例。根据2009年国际抗癌组织联盟(UICC)的分期标准[2],Ⅰ期12例,Ⅱ期18例,Ⅲ期20例,Ⅳ期22例。入选患者均为初治,经细胞学或病理学证实为肺癌且不伴自身免疫性疾病,未经化疗及其他生物治疗。29名健康志愿者作为对照组,性别、年龄均与肺癌组匹配。所有入组患者和对照者均签署知情同意书。
1.2 主要仪器和试剂 CD19-Percp-Cy5.5、CD1d-PE、CD5-FITC、IgG2a-FITC、IgG1-PE单克隆抗体购自美国BD公司;IL-10、TGF-β ELISA试剂盒购自深圳晶美生物工程有限公司。固定液:1%多聚甲醛。流式细胞仪FACScantoⅡ购自美国BD公司。
1.3 标本采集、处理及检测 所有观察对象均在清晨空腹采集不抗凝静脉血3ml,分离血清,–20℃保存,同时采集EDTA抗凝静脉血2ml。①取 Falcon 管2支,标记A和B,A管加CD19-Percp-Cy5.5、IgG2a-FITC、IgG1-PE各10μl,加抗凝血60μl,B管加CD19-Percp-Cy5.5、CD1d-PE、CD5-FITC各10μl,加抗凝血60μl,震荡混匀,20℃避光15min;②A、B管加红细胞裂解液2ml,震荡混匀,20℃避光15min;③取A、B管1000r/min离心6min,去上清,加PBS 2ml,再离心6min,去上清,加1%多聚甲醛0.5ml,采用流式细胞仪检测。
1.4 外周血CD19+CD5+CD1d+Bregs和IL-10、TGF-β水平的检测 CD19+CD5+CD1d+Bregs检测:应用流式细胞仪DIVA分析软件。在CD19/SSC散点图上设CD19+细胞门,分析CD19+CD5+、CD19+CD5+CD1d+细胞亚群,结果以其占CD19+B淋巴细胞的百分比表示。IL-10、TGF-β水平的检测:应用ELISA法检测血清IL-10、TGF-β水平,具体操作按试剂盒说明书进行。
1.5 统计学处理 流式细胞仪所得数据采用DIVA软件进行分析。计量资料呈正态分布,以±s表示, 应用SPSS 18.0软件进行数据处理,组间比较采用单因素方差分析。相关性采用直线相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 肺癌患者的临床病理特征 72例肺癌患者中,≥60岁38例,<60岁34例;高分化20例,中低分化52例;有淋巴结转移者50例,无淋巴结转移者22例;临床分期Ⅰ、Ⅱ期30例,Ⅲ、Ⅳ期42例;肿瘤≥5cm 49例,<5cm 23例。
2.2 CD19+CD5+CD1d+Bregs细胞检测结果
2.2.1 肺癌组与对照组比较结果 72例肺癌患者外周血CD19+CD5+B淋巴细胞和CD19+CD5+CD1d+Bregs细胞占CD19+B细胞的比例分别为5.48%±0.89%、5.01%±1.20%,明显高于对照组(3.99%±0.52%和2.78%±0.56%,t=8.38、9.58,P<0.01,图1,表1)。
表1 肺癌患者与健康对照Bregs亚群及IL-10、TGF-β表达比较(±s)Tab.1 Comparison of Bregs subset ratios, IL-10 and TGF-β levels in lung cancer patients and healthy controls (±s)

表1 肺癌患者与健康对照Bregs亚群及IL-10、TGF-β表达比较(±s)Tab.1 Comparison of Bregs subset ratios, IL-10 and TGF-β levels in lung cancer patients and healthy controls (±s)
(1)P<0.01 compared with control group
?
2.2.2 肺癌组亚组分析 Ⅲ、Ⅳ期肺癌患者外周血CD19+CD5+B淋巴细胞和CD19+CD5+CD1d+Bregs细胞比例(5.85%±0.84%、5.63%±1.04%)均明显高于Ⅰ、Ⅱ期肺癌患者(4.95%±0.65%、4.13%±0.78%),差异有统计学意义(t=4.92、6.67,P<0.01,表2)。
2.3 外周血IL-10、TGF-β水平检测结果
2.3.1 肺癌组与对照组比较结果 肺癌组患者血清IL-10、TGF-β水平(2.34±0.79pg/ml、56.64±6.93ng/ml)明显高于对照组(1.29±0.51pg/ ml、22.42±4.42ng/ml),差异有统计学意义(t=6.56、24.59,P<0.01)。
2.3.2 肺癌组亚组分析 Ⅲ、Ⅳ期肺癌患者血清IL-10、TGF-β水平(2.79±0.60pg/ml、5 9.8 8±6.6 3 ng/m l)明显高于Ⅰ、Ⅱ期患者(1.71±0.59pg/ml、52.10±4.37ng/ml),差异有统计学意义(t=7.58、5.62,P<0.01)。
2.4 肺癌组患者CD19+CD5+CD1d+Bregs细胞与细胞因子的相关性分析 直线相关分析显示,肺癌患者外周血CD19+CD5+CD1d+Bregs细胞比例与血清IL-10的水平呈正相关(r=0.69,P<0.01),与TGF-β无明显相关性(r=0.22,P﹥0. 05)。
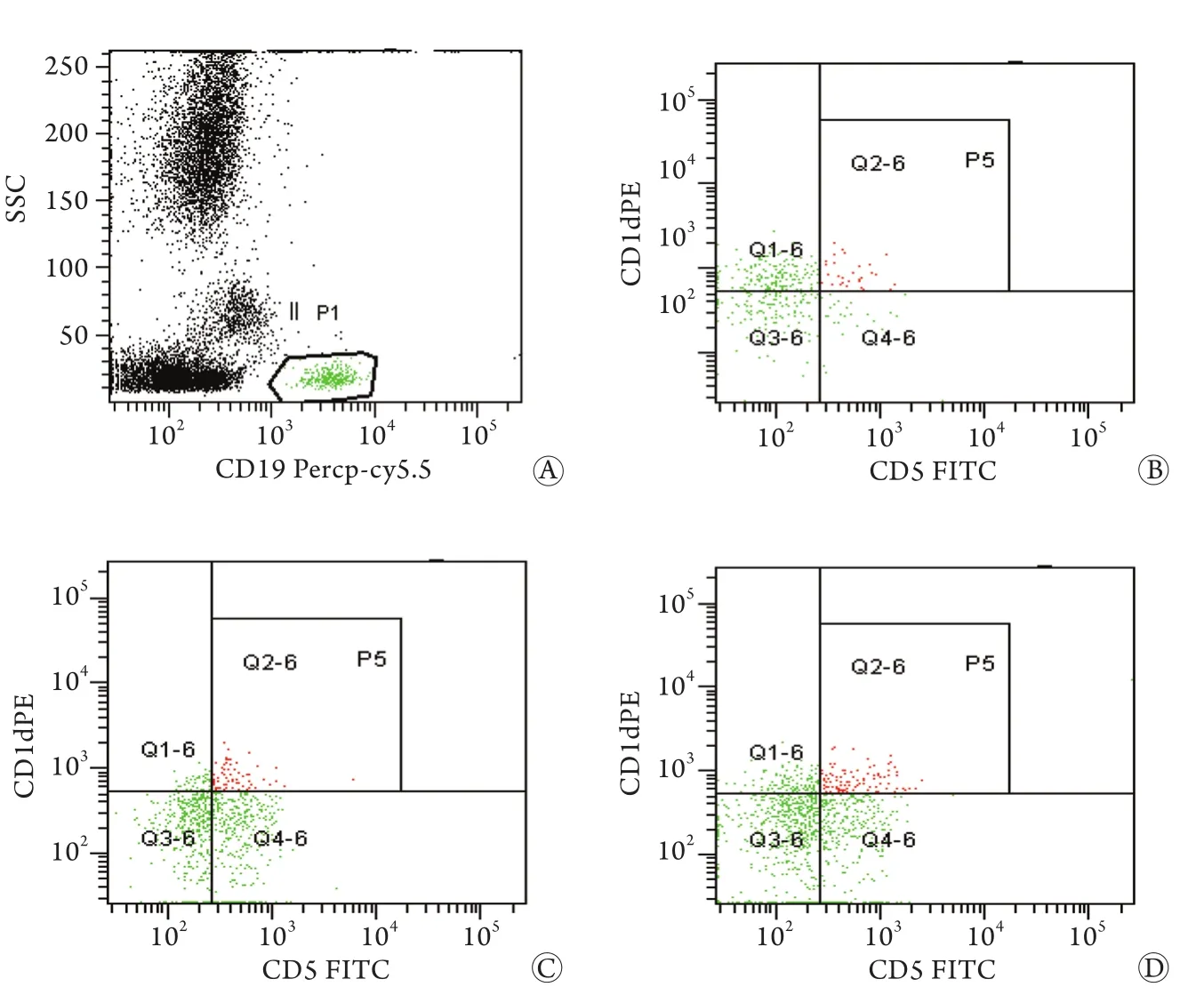
图1 肺癌患者CD19+CD5+CD1d+Bregs细胞流式分析图Fig.1 Determination of Bregs (CD19+CD5+CD1d+B cells) by flow cytometry
表2 不同分期肺癌患者Bregs亚群及IL-10、TGF-β表达比较(±s)Tab.2 Bregs subset ratios, IL-10 and TGF-β levels in lung cancer patients according to clinical staging (±s)

表2 不同分期肺癌患者Bregs亚群及IL-10、TGF-β表达比较(±s)Tab.2 Bregs subset ratios, IL-10 and TGF-β levels in lung cancer patients according to clinical staging (±s)
(1)P﹤0. 01 compared with stage Ⅰ+Ⅱ
3 讨 论
Mizoguchi等[6]首先命名了调节性B细胞,并在炎症性肠病模型中证实Bregs细胞是一种新的免疫耐受细胞亚群。在近年来的研究中Bregs的生理功能逐渐被揭示[7-8]:Bregs细胞主要通过分泌IL-10或TGF-β等抑制性细胞因子,调控效应性T细胞、细胞毒性T细胞、NK细胞、调节性T细胞(Tregs)、树突细胞等免疫活性细胞的功能,维护机体免疫平衡。在自身免疫性疾病、感染性疾病和肿瘤等疾病中该免疫平衡往往有所失调。既往文献报道,Bregs细胞免疫表型呈多样性[5],而最能代表B10细胞的免疫表型是CD19+CD5+CD1d+的Bregs亚群[9],因其表达的标记均位于细胞膜,样本处理简单、快速,适合于临床大样本研究,但目前在肿瘤患者中报道较少。
有研究显示,食管癌患者外周血CD5+CD19+Bregs细胞较健康对照组明显增多,且Ⅲ、Ⅳ期患者高于Ⅰ、Ⅱ期患者,手术切除肿瘤后Bregs细胞明显降低,提示其与肿瘤负荷有关[10]。本研究结果显示,肺癌患者外周血CD19+CD5+B细胞和CD19+CD5+CD1d+调节性B细胞亚群比例较健康对照均显著增高,且Ⅲ、Ⅳ期肺癌患者外周血中CD19+CD5+B细胞和CD19+CD5+CD1d+调节性B细胞比例明显高于Ⅰ、Ⅱ期患者,与文献报道一致。提示肺癌患者CD19+CD5+CD1d+调节性B细胞亚群比例增高,并随着疾病进展(肿瘤负荷增加)而增高。
Shi等[10]研究发现食管癌患者手术前Bregs分泌的IL-10和TGF-β较对照组增多,手术肿瘤负荷移除后TGF-β明显减少,而CD19+IL-10+细胞较术前增加;同样,在肝癌患者术后1d及7d也发现CD19+IL-10+细胞数量增加[11],因为手术解除了B10细胞的抑制功能。Olkhanud等[12]报道在乳腺癌小鼠模型(4T1)中存在肿瘤诱导的Bregs(tBregs)亚群,tBregs具有独特的生物学功能,同时分泌TGF-β和IL-10,而大量分泌TGF-β是其主要特征,TGF-β诱导Treg增殖,促进肿瘤细胞肺转移。本研究结果显示,肺癌患者外周血血清IL-10和TGF-β水平较健康对照组增高,且Ⅲ、Ⅳ期肺癌患者较Ⅰ、Ⅱ期肺癌患者更高。相关性分析显示,CD19+CD5+CD1d+Bregs细胞亚群比例与IL-10水平呈正相关,提示肺癌患者CD19+CD5+CD1d+Bregs细胞亚群主要分泌IL-10,且IL-10水平随着肿瘤负荷增加而升高,与肺癌的发病及进展密切相关。但本研究结果显示,肺癌患者CD19+CD5+CD1d+Bregs比例与TGF-β水平无明显相关性,推测可能是因为高分泌TGF-β的Bregs细胞并不包含在CD19+CD5+CD1d+Bregs亚群中,但其具体机制还有待进一步研究确认。
Bregs细胞发挥肿瘤免疫逃逸调节机制可能主要涉及以下途径:一方面,Bregs细胞上的CD40与肿瘤细胞上的CD40L相互作用,诱导Bregs细胞分泌IL-10[13-14],抑制CD8+T细胞的生物学活性,下调CD8+T细胞和NK细胞分泌IFN-γ。将肿瘤细胞与B淋巴细胞缺陷小鼠的脾细胞共同培养,CD8+T细胞和NK细胞能分泌IFN-γ,但如果在共同培养时加入纯化的正常小鼠B淋巴细胞或IL-10,则IFN-γ 的分泌就会减少,提示Bregs细胞或其产生的IL-10可抑制淋巴细胞对肿瘤细胞的杀伤作用[5]。另一方面,tBregs细胞大量分泌的TGF-β可诱导CD4+效应性T细胞转化成调节性T细胞,促进肿瘤细胞的增殖、转移。应用特异性抑制物3'4'5三羟基芪(resveratrol,RSV)能有效抑制tBregs的增殖[15-16],TGF-β表达水平随之降低,小鼠肿瘤缩小,显示出良好的潜在抗肿瘤免疫治疗前景。
综上所述,肺癌患者外周血CD19+CD5+CD1d+Bregs细胞增多,可能会抑制患者体内抗肿瘤免疫活性细胞的功能。因此,临床上检测Bregs细胞可能有助于肿瘤的诊断和预后判断。此外,若能够特异性去除Bregs,可能会有效增强机体的抗肿瘤免疫反应,将是一种有前景的肿瘤免疫治疗方法。
[1]Olkhanud PB, Damdinsuren B, Bodogai M, et al. Tumorevoked regulatory B cells promote breast cancer metastasis by converting resting CD4+T cells to T-regulatory cells[J]. Cancer Res, 2011, 71(10): 3505 -3515.
[2]Detterbeck FC, Boffa DJ, Tanoue LT. The new lung cancer staging system[J]. Chest, 2009, 136(1): 260-271.
[3]Sharma S, Yang SC, Zhu L, et al. Tumor cyclooxygenase-2/ prostaglandin E2-dependent promotion of FOXP3 expression and CD4+T regulatory cell activities in lung cancer[J]. Cancer Res, 2005, 65(12): 5211-5220.
[4]Song Y, Yang W. Medical treatment of advanced non-small cell lung cancer: progress in 2014[J]. Med J Chin PLA, 2015, 40(1): 10-15. [宋勇, 杨雯. 2014年晚期非小细胞肺癌内科治疗进展[J]. 解放军医学杂志, 2015, 40(1): 10-15.]
[5]Chou H, Wang LX. The research progress of regulatory B cells[J]. Chin J Cell Mol Immunol, 2013, 29(6): 655-657. [仇昊,王立新. 调节性B细胞的研究进展[J]. 细胞与分子免疫学杂志, 2013, 29(6): 655-657.]
[6]Mizoguchi A, Mizoguchi E, Smith RN, et al. Suppressive role of B cells in chronic colitis of T cell receptor a mutant mice[J]. J Exp Med, 1997, 186(10): 1749-1756.
[7]Den Haan JM, Kraal G, Bevan MJ. Cutting edge: Lipopolysac charideinduces IL-10-producing regulatory CD4+T cells that suppress the CD8+T cell response[J]. J Immunol, 2007, 178(9): 5429-5433.
[8]Wei YX, Zhou WQ, Xiao L, et al. Effect of regulatory dendritic cells on IL-10-producing regulatory B cells of skin allograft in mice[J]. Med J Chin PLA, 2013, 38(4): 274-278. [魏玉香, 周文强, 肖漓, 等. 调节性树突细胞对皮肤移植小鼠IL-10+调节性B细胞的影响[J]. 解放军医学杂志, 2013, 38(4): 274-278.]
[9]Noh G, Lee JH. Regulatory B cells and allergic diseases[J]. Allergy Asthma Immunol Res, 2011, 3(3): 168-177.
[10]Shi J, Li S, Zhou Y, et al. Perioperative changes in peripheral regulatory B cells of patients with esophageal cancer[J]. Mol Med Rep, 2014, 10(3): 1525-1530.
[11]Chen T, Song D, Min Z, et al. Perioperative dynamic alterations in peripheral regulatory T and B cells in patients with hepatocellular carcinoma[J]. J Transl Med, 2012, 25(10): 14.
[12]Olkhanud PB, Damdinsuren B, Bodogai M, et al. Tumorevoked regulatory B cells promote breast cancer metastasis by converting resting CD4+T cells to T-regulatory cells[J]. Cancer Res, 2011, 71(28): 3505-3515.
[13]Balkwill F, Montfort A, Capasso M. B regulatory cells in cancer[J]. Trends Immunol, 2013, 34(4): 169-173.
[14]Inoue S, Leitner WW, Golding B, et al. Inhibitory effects of B cells on antitumor immunity[J]. Cancer Res, 2006, 66(15): 7741-7747.
[15]Lee-Chang C, Bodogai M, Martin-Montalvo A, et al. Inhibition of breast cancer metastasis by resveratrol-mediated inactivation of tumor-evoked regulatory B cells[J]. J Immunol, 2013, 191(8): 4141-4151.
[16]Biragyn A, Lee-Chang C, Bodogai M. Generation and identification of tumor-evoked regulatory B cells[J]. Methods Mol Biol, 2014, 1190(5): 271-289.
Expression of the regulatory B cells in peripheral blood of patients with lung cancer and its clinical significance
CHEN Bao-guo, MEI Li-ping, ZHENG Rui*, LI Bo-li
Central Laboratory, Department of Hematology of Affiliated Taizhou Hospital, Taizhou, Zhejiang 317000, China
*
, E-mail: zhengrui80@aliyun.com
This work was supported by the New Century 151 Talent Project Fund of Zhejiang Province (Taizhou Renshe [2011]121)
ObjectiveTo investigate the expression and clinical significance of regulatory B cells (Bregs) in peripheral blood of patients with lung cancer.MethodsThe peripheral blood was collected from 72 patients with lung cancer and 29 healthy subjects (as control), and the Bregs subsets (CD19+CD5+CD1d+) were detected by flow cytometry, the levels of IL-10 and TGF-β in serum were determined by ELISA. Proportion of Bregs and peripheral blood levels of IL-10 and TGF-β were compared between lung cancer patients and healthy controls, and between the lung cancer patients in stage Ⅰ+Ⅱ and those in stage Ⅲ+Ⅳ. The correlation between Bregs proportion and peripheral blood levels of IL-10 and TGF-β were further investigated.ResultsThe percentage of Bregs was significantly higher in the peripheral blood of lung cancer patients than that of healthy controls (5.01%±1.20% vs 2.78%±0.56%, P<0.01). The proportion of Bregs was found to be increased in patients in clinical Ⅲand Ⅳ stages (5.63%±1.04%) compared with those in clinical Ⅰ and Ⅱ stages (4.13%±0.78%, P<0.01). The IL-10 and TGF-β levels were obviously higher in lung cancer patients than those in healthy controls (2.34±0.79pg/ml vs 1.29±0.51pg/ml, and 56.64±6.93ng/ml vs 22.42±4.42ng/ml, respectively, P<0.01), and in patients in Ⅲ and Ⅳ stages than those in patients in Ⅰ and Ⅱ stages (2.79±0.60pg/ml vs 1.71±0.59pg/ml, and 59.88±6.63ng/ml vs 52.10±4.37ng/ml, respectively, P<0.01). There was a positive correlation between the proportion of Bregs and the levels of IL-10 (r=0.69, P<0.01), but no significant correlation was found between the proportion of Bregs and the levels of TGF-β.ConclusionIncreased proportion of Bregs and levels of serum IL-10 and TGF-β in lung cancer patients may imply that the Bregs are probably associated with the progression of lung cancer.
lung neoplasms; B-lymphocytes, regulatory; interleukin-10; transforming growth factor beta
R734.2
A
0577-7402(2015)05-0396-04
10.11855/j.issn.0577-7402.2015.05.13
2014-11-07;
2015-03-03)
(责任编辑:沈宁)
浙江省新世纪151人才工程基金(台人社发[2011]121号)
陈葆国,主任技师。主要从事肿瘤发病机制方面的研究
317000 浙江台州 浙江省台州医院中心实验室(陈葆国、梅丽萍、郑瑞、李伯利)[通讯作者]郑瑞,E-mail:zhengrui80@aliyun.com
