EZH2及DNMT1在三阴性乳腺癌中的表达及意义
2015-06-28武萍萍陶然彭攸赵卫卫刘萃萃王璐璐胡朝晖王玉平孙振亮冯景
武萍萍,陶然,彭攸,赵卫卫,刘萃萃,王璐璐,胡朝晖,王玉平,孙振亮,冯景
EZH2及DNMT1在三阴性乳腺癌中的表达及意义
武萍萍,陶然,彭攸,赵卫卫,刘萃萃,王璐璐,胡朝晖,王玉平,孙振亮,冯景
目的探讨EZH2及DNMT1在三阴性乳腺癌中的表达特点及与主要临床病理参数的关系。方法采用免疫组化SP法,检测131例三阴性乳腺癌、78例非三阴性乳腺癌及65例癌旁组织中EZH2及DNMT1的表达情况。采用多因素logistic回归分析EZH2及DNMT1阳性表达有关的因素,Spearman等级相关分析三阴性乳腺癌中EZH2及DNMT1表达的相关关系。结果EZH2蛋白在三阴性乳腺癌组织、非三阴性乳腺癌组织和癌旁组织的阳性表达率分别为86.3%、89.7%和40.0%;DNMT1蛋白在三种组织中的阳性表达率分别为63.4%、66.6%和44.6%;两种蛋白在乳腺癌组织中的表达均高于癌旁组织(P<0.05);两种蛋白在三阴性乳腺癌与非三阴性乳腺癌组织间表达差异无统计学意义。在三阴性乳腺癌中,EZH2阳性表达与肿瘤组织学分级、肿瘤直径、淋巴结是否转移有关(P<0.05),DNMT1的表达与肿瘤组织学分级、淋巴结是否转移有关(P<0.05)。多因素logistic回归分析显示,肿瘤组织学分级为影响EZH2及DNMT1表达的最主要因素;三阴性乳腺癌中DNMT1与EZH2的表达呈正相关(r=0.34,P<0.01)。结论EZH2与DNMT1的高表达与三阴性乳腺癌的分化、生长、转移有关,且两者在三阴性乳腺癌中的表达呈正相关,其联合检测可能对三阴性乳腺癌的预后判断更有价值。
乳腺肿瘤;组蛋白甲基转移酶同源序列2增强子;DNA甲基转移酶1;免疫组织化学
三阴性乳腺癌(triple-negative breast cancer,TNBC)是指雌激素受体(ER)、孕激素受体(PR)及人表皮生长因子受体2亚型(Her-2)表达均为阴性的乳腺癌。这类乳腺癌约占所有乳腺癌的10%~17%[1-3],具有发病年轻、转移早、肿瘤体积大、诊断时分期晚、无病生存率及总生存率低等特征[4]。与非三阴性乳腺癌(non-triple-negative breast cancer,NTNBC)相比,TNBC的病理组织学分级更高[5],且内分泌治疗及靶向治疗对这类肿瘤一般无效。近年来研究表明,表观遗传学机制在三阴性乳腺癌发生发展中起重要作用。组蛋白甲基转移酶同源序列2增强子(enhancer of zeste homolog 2,EZH2)是新近认识的基因[6-7],可催化组蛋白H3的第27位氨基酸K27发生三甲基化(H3K27Me3)。EZH2不仅可以募集DNA甲基转移酶1(DNA methyltransferase 1,DNMT1)在基因甲基化过程中起调控作用[8],还可沉默抑癌基因的表达,促进多种肿瘤转移[9]。本研究通过观察影响DNA甲基化的关键酶EZH2及DNMT1在三阴性乳腺癌中的表达情况,探索其与三阴性乳腺癌的发生及临床病理特征的关系,为三阴性乳腺癌的早期诊断和治疗探索新的肿瘤标志物及治疗靶点。
1 资料与方法
1.1 标本收集 广州金域医学检验中心2008年1月至2013年5月乳腺癌病理资料较齐全的石蜡标本209例,癌旁乳腺组织65例(距离肿瘤边缘4cm以上)。所有病例均按WHO(2003年)乳腺肿瘤分类标准进行病理学分型。其中病理证实为三阴性乳腺癌的标本131例,包括浸润性导管癌101例、浸润性小叶癌12例、乳腺黏液癌5例、乳腺腺癌4例、导管原位癌4例、髓样癌1例、混合型浸润性导管癌浸润性小叶癌1例、大汗腺癌1例、浸润性微乳头状癌1例、Pagets病1例;非三阴性乳腺癌78例,包括浸润性导管癌59例、浸润性小叶癌8例、乳腺黏液癌4例、浸润性微乳头状癌2例、乳腺腺癌2例、导管原位癌2例、乳腺小管癌1例。患者均为女性,年龄24~89岁,其中,乳腺癌组49.4±12.3岁,三阴性乳腺癌组48.1±11.6岁。所有患者术前未做化疗、免疫或放射等抗肿瘤治疗。
1.2 主要试剂及方法 兔抗人单克隆抗体EZH2(稀释浓度1:400)购自cellsignal公司;DNMT1单克隆抗体(1:200)购自Abcam公司;PBS缓冲液(pH7.2)、EDTA Tris抗原修复液(pH7.4)、3%H2O2均购自Novocastra公司。
1.3 实验方法 采用免疫组化SP法染色,石蜡标本切片,脱蜡至水,3%过氧化氢室温孵育10min灭活内源性过氧化物酶,正常山羊血清室温封闭20min,加入兔抗人单克隆抗体EZH2(稀释浓度1:400)或DNMT1单克隆抗体(1:200)后4℃过夜,加入二抗37℃孵育1h,DAB显色,苏木素复染,依次脱水、透明,封固后在光镜下观察。以PBS代替一抗作为空白对照,扁桃体淋巴细胞或正常子宫肌瘤肌层作为阴性对照,使用之前确认的乳腺癌样本做阳性对照。所有切片的免疫组化染色均在同一条件下完成。染色结果由两位病理医师进行双盲阅片判断。要求显微镜下每个400倍视野至少有200个可用于评价的细胞。EZH2、DNMT1蛋白定位于细胞核,突出于背景的棕黄色大小不等颗粒判读为阳性。依据染色强度及该强度下阳性细胞比例进行计分。无染色计0分;弱染色:在40×物镜视野才能看到细胞染色,计1分;强染色:在4×或10×物镜视野能看到的细胞染色,计3分;中等染色:介于强与弱之间的染色,计2分;HSCORE=∑(I×PC),其中I代表染色强度(0、1、2、3),PC代表在每个强度被染色细胞的比例,HSCORE>30为阳性。
1.4 统计学处理 采用SPSS 13.0统计软件进行数据处理。同一指标在不同组织中的表达及与不同临床病理特征的关系采用χ2检验。采用多因素logistic回归分析EZH2和DNMT1阳性表达的影响因素,两种蛋白表达的相关性采用spearman相关分析。检验水准α=0.05。
2 结 果
2.1 EZH2、DNMT1在不同乳腺癌组织中的表达EZH2及DNMT1蛋白定位于细胞核,突出于背景的棕黄色颗粒即为阳性表达(图1)。EZH2在三阴性乳腺癌组织、非三阴性乳腺癌组织、癌旁组织中的阳性表达率分别为86.3%、89.7%、40.0%,EZH2在三阴性与非三阴性乳腺癌组织中的表达高于癌旁组织,差异有统计学意义(P<0.05);DNMT1蛋白在三阴性乳腺癌组织、非三阴性乳腺癌组织和癌旁组织中的阳性表达率分别为63.4%、66.6%、44.6%。EZH2与DNMT1在三阴性与非三阴性乳腺癌组织中的表达高于癌旁组织,差异有统计学意义(P<0.05);EZH2及DNMT1在三阴性乳腺癌与非三阴性乳腺癌的表达差异无统计学意义(P>0.05,表1)。

图1 EZH2及DNMT1在乳腺癌与癌旁组织中的表达(免疫组化 ×400)Fig.1 Expression of EZH2 and DNMT1 in breast cancer tissue (IHC ×400)
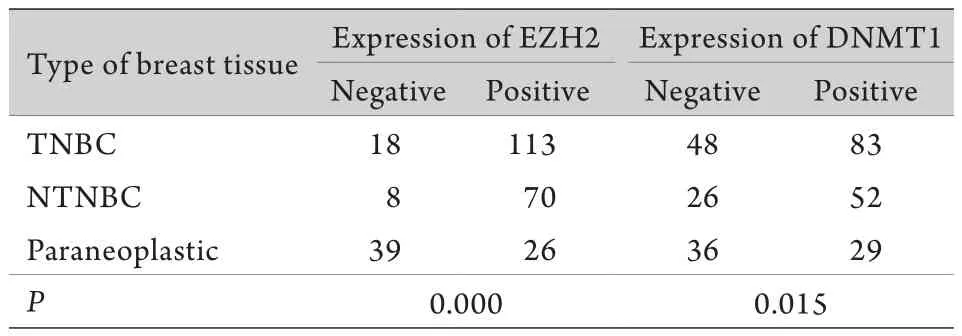
表1 EZH2、DNMT1在三种组织中的表达差异(例)Tab.1 Different expression of EZH2 and DNMT1 in the three tissues (case)
2.2 三阴性乳腺癌中EZH2的表达与患者临床病理参数的关系 三阴性乳腺癌患者中,EZH2阳性表达与患者肿瘤直径、淋巴结转移、组织学分级有关(P<0.05),与患者肿瘤组织类型、年龄、绝经状态、脉管神经浸润无关(P>0.05);DNMT1表达与肿瘤组织学分级、淋巴结转移有关(P<0.05),与患者肿瘤直径、组织类型、年龄、绝经状态、脉管神经浸润均无关(P>0.05,表2)。
2.3 三阴性乳腺癌中EZH2及DNMT1表达的多因素logistic回归分析 如表3和表4所示,将经过筛选的影响EZH2及DNMT1阳性表达的因素分别代入logistic模型进行多因素回归分析。结果显示肿瘤组织学分级、肿瘤大小与EZH2阳性表达关系密切(P<0.05),组织学分级是影响EZH2及DNMT1阳性表达最主要因素。
2.4 三阴性乳腺癌中EZH2与DNMT1表达的相关性 三阴性乳腺癌中EZH2与DNMT1表达均阳性者79例,均阴性者14例,spearman等级相关分析发现两者表达呈正相关(表5)。
3 讨 论
EZH2定位于染色体7q35上,是果蝇zeste基因增强子[E(z)]的人类同源基因,也是polycombgroup基因家族的重要成员[10]。它可以通过改变核小体、重塑染色质以及与其他转录因子相互作用影响基因的转录调控,在胚胎发育、细胞增殖及细胞周期调节中起重要作用[11]。近年来研究发现EZH2在前列腺癌、膀胱癌、肝细胞癌中呈过度表达[12-13],有学者认为它与这些肿瘤的进程、侵袭性、转移能力密切相关[14]。同其他肿瘤一样,乳腺癌的发生、演进是多基因表达调控失衡的共同结果,其中DNA甲基化与其关系最为密切。研究基因甲基化对乳腺癌的病因、诊断以及治疗具有深远意义[15]。组蛋白甲基化在DNA甲基化的建立和维护中发挥重要作用[16]。EZH2作为PRC2(polycombrepressive complex)蛋白复合体的核心组分,与EED、SUZ2等形成多梳抑制型复合物后发挥组蛋白甲基转移酶的作用,催化组蛋白的甲基化修饰。三阴性乳腺癌的病因及发病机制尚未完全明了,EZH2介导的组蛋白甲基化和DNMT1催化的DNA甲基化也许可以为研究ER、PR、Her-2的表达沉默机制提供新的线索。
文献报道,在乳腺癌的恶变过程中EZH2蛋白表达明显上调,使得转移抑制相关基因和转移促进相关基因之间的表达平衡偏向转移促进。本研究显示,209例乳腺癌中EZH2阳性表达率(82.8%)明显高于癌旁组织(40.0%),但未发现EZH2在三阴性乳腺癌与非三阴性乳腺癌中的表达存在差异,这与Gong、姚凡等[17-18]的研究结果不一致,分析原因可能在于:①乳腺癌本身存在高度异质性;②对于免疫组化结果的判读国内外尚未形成统一标准,对最终统计结果可能有影响;③本研究中非三阴性乳腺癌样本相对不足。Kleer等[19]通过细胞学研究显示,将EZH2注入裸鼠乳腺脂肪垫后,可使细胞产生致瘤性。Bachmann等[20]研究亦发现,EZH2表达量的异常升高与乳腺癌侵袭性和增殖能力密切相关。本研究发现,EZH2阳性与阴性表达组在组织学级别、肿瘤大小、淋巴结转移等方面的差异有统计学意义;进一步对影响EZH2表达的因素进行logistic回归分析,结果提示组织学分级及肿瘤大小与EZH2密切相关,其中组织学分级为最主要因素,提示EZH2阳性表达率可反映三阴性乳腺癌的细胞分化程度,EZH2表达增高者预后则差。
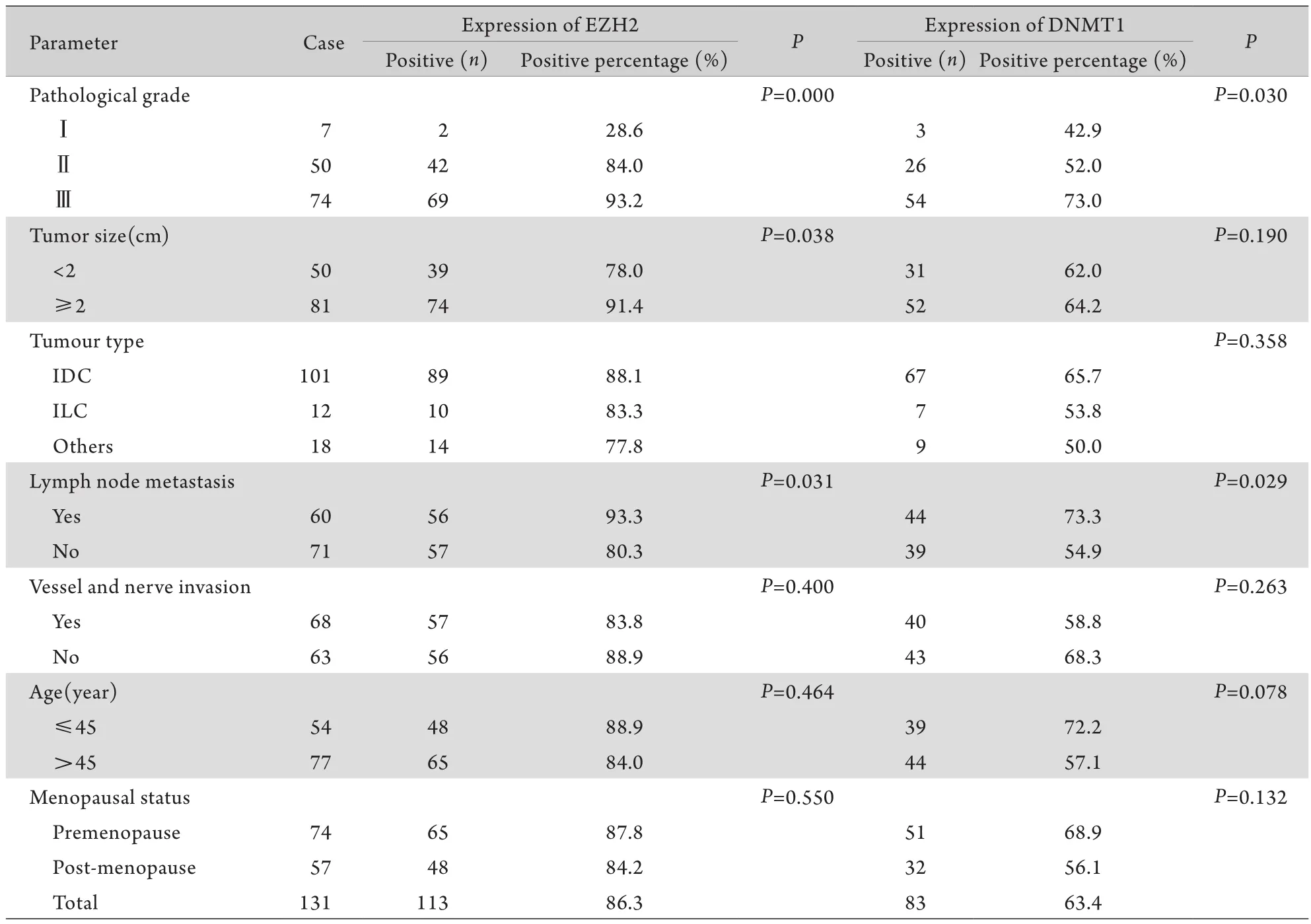
表2 三阴性乳腺癌中EZH2及DNMT1的表达与临床病理特征的关系Tab. 2 Correlation between the expression of EZH2, DNMT1 and clinical pathological significance in TNBC
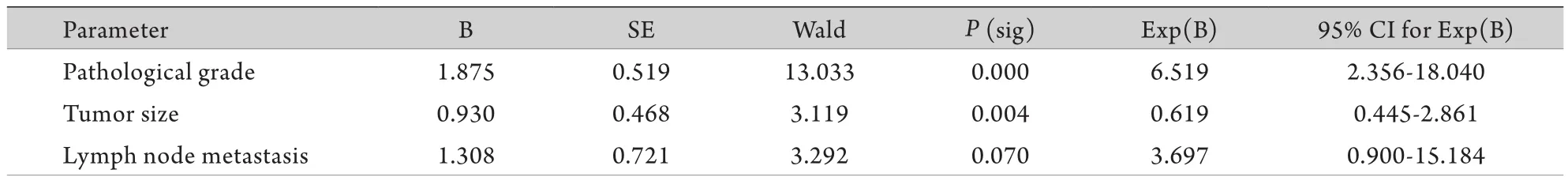
表3 三阴性乳腺癌中EZH2表达的多因素logistic回归分析Tab. 3 Multivariate logistic regression analysis for EZH2 in TNBC

表4 三阴性乳腺癌中DNMT1表达的多因素logistic回归分析Tab. 4 Multivariate logistic regression analysis for DNMT1 in TNBC
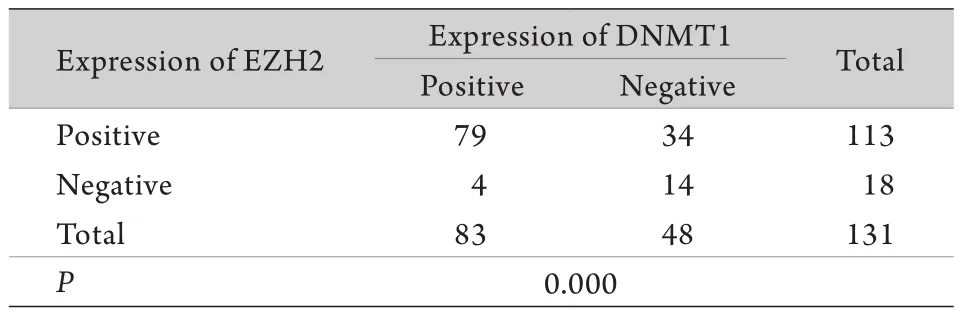
表5 三阴性乳腺癌中EZH2和DNMT1表达的相关性(例)Tab. 5 Correlation between the expression of EZH2 and DNMT1 in TNBC (case)
基因组DNA的甲基化依赖DNMT的催化[21]。DNA甲基化异常的一个潜在机制就是DNMT发生过调节,DNMT的活化和高表达是癌细胞特征性的早期分子改变[22]。哺乳动物细胞中已知有活性的DNMT有3种:DNMT1、DNMT3a和DNMT3b。Fernandez等[23]研究认为DNMT1同时具有重头甲基化和维持甲基化作用。大量研究表明,多种抑癌基因的失活和表达降低均与其启动子区域的高甲基化状态有关[24-26]。这些基因与细胞周期的调控、DNA的损伤修复、肿瘤新生血管生成、分化、凋亡、耐药性和浸润转移等密切相关。目前,尚未发现关于DNMT1在三阴性乳腺癌、非三阴性乳腺癌及癌旁组织中表达情况的研究。王文军等[27]的研究表明DNMT1在食管癌组织中的表达显著高于癌旁组织。李艳华等[28]的研究显示DNMT1在乳腺癌中的表达显著高于癌旁组织,在ERα阴性乳腺癌组织中的表达高于ERα阳性乳腺癌组织。本研究亦显示DNMT1在乳腺癌组织中的表达高于癌旁组织,但在三阴性乳腺癌与非三阴性乳腺癌组织中的表达无明显差异。本研究还发现三阴性乳腺癌中DNMT1的表达与肿瘤组织学分级及淋巴结转移相关,对影响DNMT1表达的因素进行logistic回归分析,结果提示肿瘤组织学分级与DNMT1关系最为密切,提示DNMT1阳性表达率亦可反映三阴性乳腺癌的分化程度,DNMT1过表达者恶性度可能更高。
鉴于两者均与基因甲基化修饰密切相关,本研究进一步探讨了二者在三阴性乳腺癌中表达的相关性,结果显示两者表达呈正相关,表明EZH2与DNMT1可能存在协同性。EZH2与DNMT1表达均与肿瘤分级密切相关,提示二者可能共同影响肿瘤细胞的分化。Vire等[29]的研究发现,在以EZH2为核心成员组成的PRC2蛋白参与下,EZH2可直接与DNMT1结合并影响DNMT1的活性,最终导致CpG岛甲基化。综上所述,DNMT1催化的PcG的高度甲基化和EZH2催化的H3K27组蛋白甲基化紧密相关,两者共同作用可能促使抑癌基因甲基化沉默并最终导致癌症的发生。
本研究的不足之处在于未将非三阴性乳腺癌中ER、PR、Her-2单一指标阴性和相互组合阴性样本进行再次分类。增加非三阴性乳腺癌样本量,细化非三阴性乳腺癌分组,与三阴性乳腺癌同病理类型样本进行对比分析可进一步揭示EZH2及DNMT1对沉默基因表达的作用。三阴性乳腺癌是一类高度异质性的疾病,目前仍无理想的治疗方法。了解患者EZH2及DNMT1的表达情况可能有助于早期预测三阴性乳腺癌的病情及预后,对三阴性乳腺癌患者的早期诊断和治疗有重要参考价值。
[1] Ou JH, Jiang WH, Ni D,et al. Triple negative breast cancer in Xinjiang: clinical features and prognosis[J]. Chin J Clin Oncol, 2011(18): 1159-1162. [欧江华, 蒋威华, 倪多, 等. 新疆地区三阴性乳腺癌临床特征及预后分析[J]. 中国肿瘤临床, 2011(18): 1159-1162.]
[2] Reis-Filho JS, Tutt AN. Triple negative tumours: a critical review[J]. Histopathology, 2008, 52(1): 108-118.
[3] Zhao X, Wu SK, Meng XY,et al.Effects of phenotype transformation of receptors of triple-negative breast cancer(TNBC) on clinical prognosis of patients with breast cancer[J]. Med J Chin PLA, 2012, 37(4): 322-326. [赵新,吴世凯,孟祥颖,等.三阴乳腺癌受体表型转化情况对乳腺癌患者临床预后的影响[J]. 解放军医学杂志, 2012, 37(4): 322-326.]
[4] Zhang L, Zhao XH, Tong ZS,et al. Clinical features and multivariate Cox regression prognostic analysis of ttriplenegative breast cancer: a report of 356 cases[J]. Chin J Clin Oncol, 2010, 37(18): 1045-1049. [张丽, 赵晓辉, 佟仲生, 等. 356例三阴性乳腺癌的临床特征及预后多因素分析[J]. 中国肿瘤临床, 2010, 37(18): 1045-1049.]
[5] Zhang B, Li XB, Zhang FX. Studies on the relationship of pleiotrophin and MMP2 with the clinicopathological features of invasive breast carcinoma[J]. Med J Chin PLA, 2012, 37(8): 805-810. [张博, 李晓兵, 张凤霞. 多效生长因子、基质金属蛋白酶2与浸润性乳腺癌临床病理特征的关系研究[J]. 解放军医学杂志, 2012, 37(8): 805-810.]
[6] Ma HL, Guo W, Guo YL,et al.Promoter methylation and protein expression of apoptosis protease activating factor-1 gene in esophageal squamous cell carcinoma[J]. Tianjin Med J, 2013, 41(3): 193-196, 289. [马洪亮,郭炜,郭艳丽,等.食管鳞状细胞癌中Apaf-1基因启动子区甲基化状态及其与EZH2蛋白表达的关系[J]. 天津医药, 2013, 41(3): 193-196, 289.]
[7] Zhang Y, Gong ZC, Nan XH,et al.Expression of Cox-2 and EZH2 in mucoepidermoid carcinoma of salivary glands[J]. J Logist Univ CAPF (Med Sci), 2012, 21(7): 506-508, 512, 582. [张轶,龚忠诚,南晓红,等.涎腺黏液表皮样癌中Cox-2、EZH2的表达及意义[J]. 武警后勤学院学报(医学版), 2012, 21(7): 506-508, 512, 582.]
[8] Fiskus W, Buckley K, Rao R,et al. Panobinostat treatment depletes EZH2 and DNMT1 levels and enhances decitabine mediated de-repression of Jun B and loss of survival of human acute leukemia cells[J]. Cancer Biol Ther. 2009, 8(10): 939-950.
[9] Yoo KH, Hennighausen L. EZH2 methyltransferase and H3K27 methylation in breast cancer[J]. Int J Biol Sci, 2012, 8(1): 59-65.
[10] Simon JA, Lange CA. Roles of the EZH2 histone methyltransferase in cancer epigenetics[J]. Mutat Res, 2008, 647(1-2): 21-29.
[11] Shen L, Cui J, Liang S,et al. Update of research on the role of EZH2 in cancer progression[J]. Onco Targets Ther, 2013, 6: 321-324.
[12] van Kooten C, Lombardi G, Gelderman KA,et al. Dendritic cells as a tool to induce transplantation tolerance: obstacles and opportunities[J]. Transplantation, 2011, 91(1): 2-7.
[13] Lin Y W, Chen H M, Fang J Y. Gene silencing by the polycomb group proteins and associations with cancer[J]. Cancer Invest, 2011, 29(3): 187-195.
[14] Wang H, Albadine R, Magheli A,et al. Increased EZH2 protein expression is associated with invasive urothelial carcinoma of the bladder[J]. Urol Oncol, 2012, 30(4): 428-433.
[15] Connolly R, Stearns V. Epigenetics as a therapeutic target in breast cancer[J]. J Mammary Gland Biol Neoplasia, 2012, 17(3-4): 191-204.
[16] Wang RX, Xu JH. Genomic DNA methylation and histone methylation[J]. Hereditas, 2014, 36(3): 191-199. [王瑞娴, 徐建红. 基因组DNA甲基化及组蛋白甲基化[J]. 遗传, 2014, 36(3): 191-199.]
[17] Gong Y, Huo L, Liu P,et al. Polycomb group protein EZH2 is frequently expressed in inflammatory breast cancer and is predictive of worse clinical outcome[J]. Cancer, 2011, 117(24): 5476-5484.
[18] Yao F, Liu C, Fang Y,et al. The expression and clinical significance of EZH2 in breast cancer[J]. Chin J Microbiol, 2013, 25(2): 143-146. [姚凡, 刘崇, 房月, 等. EZH2在乳腺癌中的表达及其临床意义[J]. 中国微生态学杂志, 2013, 25(2): 143-146.]
[19] Kleer CG, Cao Q, Varambally S,et al. EZH2 is a marker of aggressive breast cancer and promotes neoplastic transformation of breast epithelial cells[J]. Proc Natl Acad Sci USA, 2003, 100(20): 11606-11611.
[20] Bachmann IM, Halvorsen OJ, Collett K,et al. EZH2 expression is associated with high proliferation rate and aggressive tumor subgroups in cutaneous melanoma and cancers of the endometrium, prostate, and breast[J]. J Clin Oncol, 2006, 24(2): 268-273.
[21] Wei XL, Feng FF, He QD,et al. Change of DNA methyltransferases in the serum of patients with lung cancer[J]. J Zhengzhou Univ (Med Sci), 2014, 49(2): 172-176. [魏小玲,冯斐斐,何其栋,等.肺癌患者血清中DNA甲基化酶的表达[J]. 郑州大学学报(医学版), 2014, 49(2): 172-176.]
[22] Rhee I, Bachman KE, Park BH,et al. DNMT1 and DNMT3b cooperate to silence genes in human cancer cells[J]. Nature, 2002, 416(6880): 552-556.
[23] Fernandez AF, Huidobro C, Fraga MF. De novo DNA methyltransferases: oncogenes, tumor suppressors, or both[J]? Trends Genet, 2012, 28(10): 474-479.
[24] Takeshima H, Yamashita S, Shimazu T,et al. Effects of genome architecture and epigenetic factors on susceptibility of promoter CpG islands to aberrant DNA methylation induction[J]. Genomics, 2011, 98(3): 182-188.
[25] Cavagnari BM. Regulation of gene expression: how do epigenetic mechanisms work[J]. Arch Argent Pediatr, 2012, 110(2): 132-136.
[26] Prabhu JS, Wahi K, Korlimarla A,et al. The epigenetic silencing of the estrogen receptor (ER) by hypermethylation of the ESR1 promoter is seen predominantly in triple-negative breast cancers in Indian women[J]. Tumour Biol, 2012, 33(2): 315-323.
[27] Wang WJ, Wen JT. Study on the expression and clinical significance of DNMT1 in esophageal carcinoma[J]. Chin J Lab Diagn, 2011, 15(7): 1098-1099. [王文军, 温江涛. DNMT1在食管癌中表达及临床意义[J]. 中国实验诊断学, 2011, 15(7): 1098-1099.]
[28] Li YH, Zhang WJ, Wang LX,et al. Expression of DNMT1 and ERa in the breast cancer[J]. J basic clin oncol, 2013, 26(4): 277-281. [李艳华, 张伟杰, 王留兴, 等. 乳腺癌组织中DNMT1和ERα的表达[J]. 肿瘤基础与临床, 2013, 26(4): 277-281.]
[29] Vire E, Brenner C, Deplus R,et al. The Polycomb group protein EZH2 directly controls DNA methylation[J]. Nature, 2006, 439(7078): 871-874.
Expression and significance of EZH2 and DNMT1 in triple-negative breast cancer
WU Ping-ping1, TAO Ran3, PENG You2, ZHAO Wei-wei2, LIU Cui-cui2, WANG Lu-lu2, HU Chao-hui3, WANG Yuping2, SUN Zhen-liang2, FENG Jing2*1Third Clinical College, Southern Medical University, Guangzhou 510515, China
2Department of Clinical Laboratory, Fengxian Hospital, Southern Medical University, Shanghai 201400, China
3Guangzhou Kingmed Center for Clinical Laboratory, Guangzhou 510330, China
*Corresponding author, E-mail: fengjing8801530@163.com
This work was supported by Natural Science Foundation of Shanghai (12ZR1426300), Shanghai Medical Excellent Discipline Leader Training Program (XBR20130114)
ObjectiveTo probe into the expression features of EZH2 and DNMT1 in triple-negative breast cancer (TNBC), and the relations between the expression and the main clinical pathological parameters of TNBC.MethodsThe clinical and pathological data of 209 cases of breast cancer (including 131 cases of TNBC and 78 cases of non-TNBC) in Guangzhou Kingmed Center for Clinical Laboratory from Jan. 2008 to May 2013 were retrospectively analyzed. Immunohistochemistry SP assay was performed to determine the expressions of EZH2 and DNMT1 in 209 paraffin-embedded specimens of breast cancer and 65 specimens of normal tissue (more than 4cm away from tumor). The differences of protein expression in the specimens were compared, and correlation analysis was performed to disclose the relationship between protein expression and clinico-pathological indices. Multivariate logistic regression analysis was applied to analyze the positive expression-related factor of EZH2 and DNMT1. Spearman rank correlation analysis was used to analyse the interrelation of EZH2 and DNMT1 in TNBC.ResultsThe positive expression rates of EZH2 in TNBC, non-TNBC and adjacent breast tissue were 86.3%, 89.7% and 40.0%, respectively, while the positive expression rates of DNMT1 were 63.4%, 66.6% and 44.6%, respectively. The positive expression rates of EZH2 and DNMT1 were higher in both TNBC and non-TNBC tissues than in adjacent breast tissue (P<0.05), but no significant difference in expression rate between the TNBC tissues and non-TNBC tissues. There was no relationship between EZH2 expression and age, menstrualstatus, histologic type and vessel and nerve invasion (P>0.05), but the positive expression of EZH2 in TNBC was related to the pathological grade, tumor size and lymph node metastasis (P<0.05), and the positive expression of DNMT1 was related to the pathological grade and lymph node metastasis (P<0.05). Multivariate logistic regression analysis demonstrated that the pathological grade of tumor was the main factor affecting the expressions of EZH2 and DNMT1, and the expressions of EZH2 and DNMT1 in TNBC were positively correlated (r=0.34,P<0.01). Conclusion The high expressions of EZH2 and DNMT1 are correlated with the differentiation, growth and metastasis of TNBC. Combined detection of the expressions of EZH2 and DNMT1 may be more valuable in determination of prognosis of patients with TNBC.
breast neoplasms; enhancer of zeste homolog 2; DNA methyltransferase 1; immunohistochemistry
R737.9
A
0577-7402(2015)01-0050-06
10.11855/j.issn.0577-7402.2015.01.11
�2014-08-21;
2014-11-20)
(责任编辑:沈宁)
上海市自然基金项目(12ZR1426300);上海市卫生系统优秀学科带头人培养计划(XBR20130114)
武萍萍,硕士研究生。主要从事乳腺癌的临床与基础研究
510515 广州 南方医科大学第三临床医学院(武萍萍);201400 上海 南方医科大学附属奉贤医院检验科(彭攸、赵卫卫、刘萃萃、王璐璐、王玉平、孙振亮、冯景);510330 广州 广州金域医学检验中心有限公司(陶然、胡朝晖)
]冯景,E-mail:fengjing8801530@163.com
