尿毒症毒素对甲酚对单核细胞体外释放炎症因子的影响
2015-06-28丁瑜王健梁新韦杏雪邹仲敏袁发焕
丁瑜,王健,梁新,韦杏雪,邹仲敏,袁发焕
尿毒症毒素对甲酚对单核细胞体外释放炎症因子的影响
丁瑜,王健,梁新,韦杏雪,邹仲敏,袁发焕
目的利用体外细胞模型研究尿毒症毒素对甲酚对单核细胞释放炎症因子的影响及其可能机制。方法采用CCK-8法检测THP-1单核细胞株经20、40、80、160mg/L对甲酚分别处理6、12、24h后细胞增殖能力的变化;根据细胞增殖实验结果,选取40mg/L和80mg/L两个剂量组作为低剂量组和高剂量组,提取细胞RNA和蛋白质,用RT-PCR法、Western blotting检测对甲酚处理24h后THP-1单核细胞株炎症因子TNF-α、抗炎因子IL-10以及炎症相关Toll样受体4(TLR-4)mRNA和蛋白表达的变化。结果对甲酚可抑制THP-1细胞增殖,其抑制作用呈浓度和时间依赖性(P<0.05);RT-PCR及Western blotting检测显示,对甲酚处理的THP-1细胞炎症因子TNF-α释放增加,IL-10释放减少,TLR-4表达增加(P<0.05)。结论对甲酚可抑制THP-1细胞增殖,抑制IL-10抑炎因子表达,并可能通过上调TLR-4的表达,促进促炎因子TNF-α的释放,从而导致微炎症状态。
单核细胞;尿毒症;细胞因子类;对甲酚
慢性肾病(chronic kidney disease,CKD)是常见的肾脏疾病,患病率高达8%~10%,且晚期并发症多,病死率高。CKD患者中约70%死于心血管疾病(50%)和感染(20%),两者都与慢性肾病终末期的微炎症状态相关。微炎症状态是指机体在各种补体、免疫复合物、内毒素等非微生物因素刺激下,以单核巨噬细胞激活和促炎因子释放为中心的炎症反应,表现为全身循环中炎症标志蛋白及炎性细胞因子持续升高[1]。研究显示,肿瘤坏死因子α(TNF-α)等对微炎症状态敏感的炎症因子具有促进肾纤维化及促进动脉粥样硬化等作用[2-5]。在终末期慢性肾病患者中,肾功能减退导致体内大量尿毒症毒素蓄积。尿毒症毒素依据其生化性质以及清除方式可分水溶性物质、不与蛋白质结合的小分子物质、中分子物质以及蛋白结合毒素,其中蛋白结合毒素如硫酸吲哚酚(indoxyl sufate,IS)、硫酸对甲酚(P-cresylsuifate,PCS)可以竞争性地与血浆蛋白结合。由于蛋白结合毒素可附着于血浆蛋白,所以难以通过常规透析进行清除。研究表明,此类毒素可导致内皮细胞、肾小管上皮细胞凋亡增加,炎性细胞因子释放增多[6-7],同时还能刺激免疫系统,促进白细胞募集[8],降低T细胞Th1/Th2比率。但蛋白结合毒素对尿毒症患者微炎症状态的作用及其机制尚不清楚。本研究以体外单核细胞为模型,观察蛋白结合毒素对甲酚(p-cresol,PC)对细胞炎症因子释放的影响,并初步探究其可能的作用机制。
1 材料与方法
1.1 材料 人单核细胞株THP-1为本室保存。对甲酚购自美国Sigma公司;RPMI 1640细胞培养基及胎牛血清购自HycClone公司;Cell Counting Kit(CCK-8)试剂盒购自日本同仁化工;Trizol试剂购自美国Invitrogen公司;反转录PCR试剂盒购自日本TaKaRa公司;2×TaqMaster Mix购自Novoprotein公司,引物为自行设计,由英潍捷基合成;反转录反应和PCR扩增均在Bio-Rad公司的S1000型PCR仪上进行;兔抗人TNF-α、白介素10(IL-10)、Toll样受体4(TLR-4)抗体购自武汉博士德公司;BCA蛋白定量试剂盒、PMSF、RIPA裂解液、SDS-PAGE凝胶快速配制试剂盒、5×蛋白上样缓冲液、彩色预染蛋白分子量标准、小鼠抗人β-actin抗体、山羊抗兔二抗、山羊抗鼠二抗、ECL发光液等购自碧云天公司。
1.2 方法
1.2.1 单核细胞培养及对甲酚溶液配制 单核细胞THP-1用含10%胎牛血清的完全培养基RPMI 1640在37℃、5% CO2孵箱中培养,2d换液1次。对甲酚溶液配制:取对甲酚冻干粉,用灭菌PBS溶解稀释,参考文献[9]中CKD患者的血清对甲酚水平,先配制成1600mg/L母液,再依次稀释配制成20、40、80、160mg/L浓度对甲酚工作液处理细胞,现用现配。
1.2.2 CCK-8检测对甲酚对THP-1细胞活性的影响
收集对数期THP-1细胞,1×105个/孔接种于96孔板,100μl完全培养基培养过夜。按20、40、80、160mg/L剂量分组加入不同浓度对甲酚,另设加入等量PBS的空白对照组,每组设6个平行孔(100μl/孔)。培养6、12、24h后,加入CCK-8试剂10μl,37℃继续培养1.5h后在酶标仪上于450mm波长处检测每孔的吸光度(A)值。以空白对照组A450值均数为对照,以平行孔的平均A450值作为各实验组的A450值。细胞增殖水平=实验组A450/对照组A450×100%。根据CCK-8实验结果,选取细胞增殖在正常水平80%和60%实验组的剂量为后续实验的剂量。
1.2.3 RT-PCR法检测THP-1细胞TLR-4、IL-10、TNF-α mRNA的表达 THP-1细胞培养24h后分为40、80mg/L对甲酚处理组及空白对照组(加入同体积PBS)继续培养24h,收集细胞,PBS洗涤3次,加入500μl Trizol裂解细胞,Trizol法常规提取细胞RNA;检测各组RNA质量和浓度。所用引物序列如下:TNF-α上游5'-AGGCGGTGCTTGTTCCTCA-3',下游5'-GTTCGAGAAGATGATCTGACTGCC-3',扩增产物长度167bp;IL-10上游5'-AGGGCACCCAGTCTGAGA ACA-3',下游5'-CGGCCTTGCTCTTGTTTTCAC-3',扩增产物长度351bp;TLR-4上游5'-AGAAATGAA GGAAACTTGGAAAAGT-3',下游5'-TTGGAATGC TGGAAATCCAGATGTT-3',扩增产物长度509bp;β-actin上游5'-GGCACCACCATGTACCCTG-3',下游5'-CACGGAGTACTTGCGCTCAG-3',扩增产物长度114bp。按TaKaRa公司反转录试剂盒说明书将提取的RNA反转录为cDNA(反应体系10μl)。梯度退火温度摸索3种引物及内参最佳退火温度,IL-10、TNF-α及TLR-4最佳退火温度分别为59℃、55℃、55℃,β-actin退火温度为60℃。反应条件为:94℃5min;94℃ 1min,退火温度30s,72℃ 1min,35个循环;72℃ 10min。琼脂糖凝胶电泳分析PCR产物,电泳结果采用Image J软件进行灰度值分析。以各目的基因灰度值与内参灰度值的比值为其相对表达量。实验重复3次。
1.2.4 Western blotting检测THP-1细胞TLR-4、IL-10、TNF-α蛋白的表达 用对甲酚按前述方法处理各组细胞后,PBS洗3次,收集细胞。每组细胞中加入200μl蛋白裂解液(RIPA:PMSF按100:1配制),14 000×g离心5min,取上清。BCA蛋白定量试剂盒定量,调整蛋白电泳上样量。蛋白样品按照4:1比例加入5×Loading Buff,混匀,沸水浴变性5min。12%分离胶进行蛋白电泳,18V电压半干法转膜,5%脱脂奶粉封闭1h后,加1:1000稀释的一抗4℃孵育过夜。次日TBST洗膜3次,每次15min,二抗1:1000稀释,室温孵育1h;TBST洗膜3次,每次10min;TBS洗膜1次,5min。采用ECL发光液显色,FX成像系统曝光。Image J软件分析面积灰度值。实验重复3次。
1.3 统计学处理 采用SPSS 10.0软件进行统计学分析。计量资料数据以表示,多组间差异比较采用单因素方差分析,组间两两比较采用Scheffe检验(方差齐时)或采用TamhaneT2检验(方差不齐时)。P<0.05为差异有统计学意义。
2 结 果
2.1 对甲酚对THP-1细胞增殖的影响 CCK-8检测结果显示,对甲酚处理6h后,20、40、80、160mg/L浓度组的细胞活力分别下降至正常对照组的88.18%±7.81%、87.94%±5.66%、76.03%±4.55%、67.25%±8.48%,其中80、160mg/L组细胞抑制作用明显(P<0.05)。对甲酚处理12、24h后,各组细胞活力均较正常对照组有不同程度的下降,其中80、160mg/L组与正常对照组比较差异有统计学意义(P<0.05)。另一方面,各剂量对甲酚处理组的细胞活力随着药物处理时间的延长而不断下降,但差异无统计学意义。其余各浓度对甲酚处理组的细胞均有相似变化。最终我们选取40mg/L和80mg/L两个浓度作为低剂量处理组和高剂量处理组进行后续实验,对甲酚处理时间确定为24h(表1)。
2.2 对甲酚对THP-1细胞中TNF-α、IL-10、TLR-4 mRNA表达的影响 对甲酚处理后,细胞TNF-α、TLR-4 mRNA表达水平升高,IL-10 mRNA表达水平降低,其中高剂量组与对照组比较差异均有统计学意义(P<0.05,图1)。
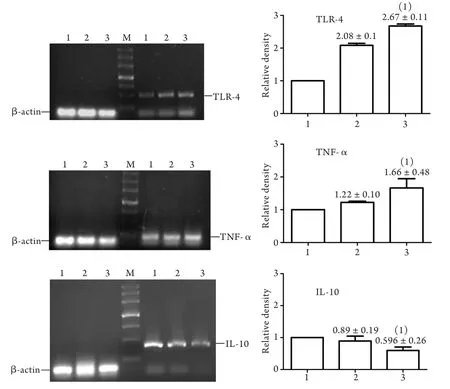
图1 对甲酚处理后TNF-α、IL-10及TLR-4 mRNA的表达Fig.1 Expressions of TNF-α, IL-10 and TLR-4 mRNA in THP-1 cell exposed to p-cresol
表1 不同浓度对甲酚处理后单核细胞活力的变化(%,±s,n=6)Tab.1 Changes of cell viability of THP-1 cell exposed to 20, 40, 80 and 160mg/L p-cresol (%,±s,n=6)

表1 不同浓度对甲酚处理后单核细胞活力的变化(%,±s,n=6)Tab.1 Changes of cell viability of THP-1 cell exposed to 20, 40, 80 and 160mg/L p-cresol (%,±s,n=6)
(1)P<0.05 compared with control group (0mg/L)
Concentration of p-cresol (mg/L)12 24 0 100 100 100 20 88.18±7.81 86.64±8.59 83.75±1.09 40 87.94±5.66 89.58±7.12 82.37±8.60 80 76.03±4.55(1)65.31±7.72(1) 55.17±6.24(1)160 67.25±8.48(1)57.65±6.14(1) 52.99±9.07(1)Time after exposure (h) 6
2.3 对甲酚对THP-1细胞中TNF-α、IL-10、TLR-4蛋白表达的影响 Western blotting 检测结果显示,对甲酚处理后,细胞TNF-α、TLR-4蛋白表达水平升高,IL-10蛋白表达水平降低,其中高剂量组与比较差异均有统计学意义(P<0.05,图2)。
3 讨 论
尿毒症相关免疫功能障碍是过度免疫激活与免疫抑制共存的复杂状态。炎症反应虽然是消灭入侵病原体的必要条件,但当不能控制时就成了一柄双刃剑[10]。心血管疾病及感染是CKD患者的主要死因,其病理过程都与免疫功能紊乱相关。尿毒症毒素能激活机体的免疫系统,导致全身炎症因子水平升高[11],并能抑制单核细胞的吞噬功能,致使机体抵抗力下降[12-13]。无论是炎症因子增高,还是机体抵抗力下降,都会对尿毒症患者的远期存活率和生活质量产生不利影响。

图2 对甲酚处理后THP-1细胞TNF-α、IL-10、TLR-4蛋白的表达Fig.2 Effects of p-cresol on the protein expressions of TNF-α, IL-10 and TLR-4 in THP-1 cell
对甲酚是一种蛋白结合毒素,CKD患者血清中对甲酚水平比健康人高10倍左右,因其与血浆蛋白的结合率为94.0%,常规血液透析及腹膜透析对其清除率仅为20.0%和17.5%。在血液中蓄积的对甲酚对单核细胞抑制作用及对炎症因子释放的影响尚缺乏直接证据。本研究通过体外实验发现,随着浓度升高,对甲酚对THP-1的增殖抑制作用逐渐增强,高浓度的对甲酚可显著抑制THP-1的增殖能力。随着作用时间延长,对甲酚对THP-1的增殖抑制程度逐渐增强,提示尿毒症患者体内的高浓度对甲酚可能抑制人单核细胞的增殖,导致单核细胞功能受损。
TNF-α是目前研究最为活跃的促炎细胞因子,它主要由单核-巨噬细胞激活释放,不但能直接导致强烈的炎症反应,还能通过诱导iNOS的表达产生大量NO,进一步加重炎症反应[14]。虽然炎症因子在防御病原体入侵及组织修复过程中十分必要,但其过度释放或长期高水平存在均会引起免疫系统紊乱,导致微炎症状态,而在CKD患者中,TNF-α水平升高与营养不良、胰岛素抵抗、血管钙化相关[15-16]。本实验证实,TNF-α的表达随对甲酚处理浓度的升高而增加,提示对甲酚在患者血液中累积可能会促进单核细胞炎症因子的释放。这一结果与Rossi等[17]发现的对甲酚可导致尿毒症终末期患者血浆中IL-6、TNF-α表达水平升高一致。IL-10是为数不多的抑制多种促炎因子释放的细胞因子[18],主要由淋巴细胞、单核细胞、巨噬细胞产生,可通过抑制IL-1、IL-6、TNF-α等炎症细胞因子的释放,下调黏附因子并抑制氧自由基的产生等方式抑制炎症的发生[16]。因此IL-10释放减少可导致机体炎症反应缺乏控制,促进炎症的发生发展。本研究证实,TNF-α的表达随着对甲酚浓度的升高而增加,而IL-10的表达却相应减少。这提示对甲酚在患者血液中的累积促进了炎症因子的表达,抑制了抑炎因子的表达,从而破坏了免疫系统中炎症调控的平衡,导致了微炎症状态的发生。
TLR-4在炎症反应中起着至关重要的作用,它能通过MyD88依赖性和非MyD88依赖性途径活化NF-κB,介导炎症因子TNF-α以及IL-6、IL-8等的释放[19-20]。临床试验证实尿毒症患者TLR-4受体表达较健康者明显增加,这与本研究中高浓度对甲酚作用于THP-1细胞导致细胞中TLR-4、TNF-α表达升高的结果相呼应,提示促炎因子表达增加可能是通过TLR-4介导的通路实现的。
综上所述,对甲酚能抑制THP-1细胞增殖,抑制抑炎因子IL-10的表达,并可能通过激活TLR-4通路,促进促炎因子TNF-α表达,导致免疫系统炎症反应平衡紊乱。免疫功能的异常以及微炎症状态会增加动脉粥样硬化及感染的风险。在未来的临床实践中,增加体内对甲酚的有效清除,有可能改善CKD患者的微炎症状态。
[1] Kaysen GA. The microinflammatory state in uremia: causes and potential consequences[J]. J Am Soc Nephrol, 2001, 12(7): 1549-1557.
[2] Memoli B, Minutolo R, Bisesti V,et al. Changes of serum albumin and C-reactive protein are related to changes of interleukin-6 release by peripheral blood mononuclear cells in hemodialysis patients treated with different membranes[J]. Am J Kidney Dis, 2002, 39(2): 266-273.
[3] Jacobs P, Glorieux G, Vanholder R. Interleukin/cytokine profiles in haemodialysis and in continuous peritoneal dialysis[J].Nephrol Dial Transplant, 2004, 19 (Suppl 5): V41-V45.
[4] Garibotto G, Sofia A, Procopio V,et al. Peripheral tissue release of interleukin-6 in patients with chronic kidney diseases: effects of end-stage renal disease and microinflammatory state[J]. Kidney Int, 2006, 70(2): 384-390.
[5] Memoli B, Salerno S, Procino A,et al. A translational approach to micro-inflammation in end-stage renal disease: molecular effects of low levels of interleukin-6[J]. Clin Sci (Lond), 2010, 119(4): 163-174.
[6] Watanabe H, Miyamoto Y, Honda D,et al. p-Cresyl sulfate causes renal tubular cell damage by inducing oxidative stress by activation of NADPH oxidase[J]. Kidney Int, 2013, 83(4): 582-592.
[7] Dou L, Bertrand E, Cerini C,et al. The uremic solutes p-cresol and indoxyl sulfate inhibit endothelial proliferation and wound repair[J]. Kidney Int, 2004, 65(2): 442-451.
[8] Pletinck A, Glorieux G, Schepers E,et al. Protein-bound uremic toxins stimulate crosstalk between leukocytes and vessel wall[J]. J Am Soc Nephrol, 2013, 24(12): 1981-194.
[9] Jourde-Chiche N, Dou L, Sabatier F,et al. Levels of circulating endothelial progenitor cells are related to uremic toxins and vascular injury in hemodialysis patients[J]. J Thromb Haemost, 2009, 7(9): 1576-1584.
[10] Hauser AB, Stinghen AE, Kato S,et al. Characteristics and causes of immune dysfunction related to uremia and dialysis[J]. Perit Dial Int, 2008, 28(Suppl 3): S183-S187.
[11] Cohen G, Glorieux G, Thornalley P,et al. Review on uraemic toxins Ⅲ: recommendations for handling uraemic retention solutesin vitro--towards a standardized approach for research on uraemia[J]. Nephrol Dial Transplant, 2007, 22(12): 3381-3390.
[12] Marzocco S, Di PR, Serraino I,et al. Effect of methylguanidine in carrageenan-induced acute inflammation in the rats[J]. Eur J Pharmacol, 2004, 484(2-3): 341-350.
[13] Marzocco S, Di PR, Genovese T,et al. Methylguanidine reduces the development of non-septic shock induced by zymosan in mice[J]. Life Sci, 2004, 75(12): 1417-1433.
[14] Thiemermann C, Wu CC, Szabo C,et al. Role of tumour necrosis factor in the induction of nitric oxide synthase in a rat model of endotoxin shock[J]. Br J Pharmacol, 1993, 110(1): 177-182.
[15] Sharma R, Agrawal S, Saxena A,et al. Association of IL-6, IL-10, and TNF-alpha gene polymorphism with malnutrition inflammation syndrome and survival among end stage renal disease patients[J]. J Interferon Cytokine Res, 2013, 33(7): 384-391.
[16] Stenvinkel P, Ketteler M, Johnson RJ,et al. IL-10, IL-6, and TNF-alpha: central factors in the altered cytokine network of uremia--the good, the bad, and the ugly[J]. Kidney Int, 2005, 67(4): 1216-1233.
[17] Rossi M, Campbell KL, Johnson DW,et al. Protein-bound uremic toxins, inflammation and oxidative stress: a cross-sectional study in stage 3-4 chronic kidney disease[J]. Arch Med Res, 2014, 45(4): 309-317.
[18] He R, Ma KH, Zuo Z,et al. Effects of hydrogen sulfide on balloon injury-induced atherosclerotic plaque and IL-10 expression in rabbit carotid arteries[J]. Med J Chin PLA, 2010, 35(2): 169-172. [贺锐, 马康华, 左中, 等. 硫化氢对球囊损伤后兔颈动脉斑块和抗炎因子IL-10表达的影响[J]. 解放军医学杂志, 2010, 35(2): 169-172.]
[19] Lin YT, Verma A, Hodgkinson CP. Toll-like receptors and human disease: lessons from single nucleotide polymorphisms[J]. Curr Genomics, 2012, 13(8): 633-645.
[20] Liu YF, Wang ZG, Tang HW,et al. Protective effect of ulinastatin on inhalation lung injury caused by black gunpowder smoke in rats and its inhibitory effect on the mRNA expression of IL-1β and TNF-α[J]. Med J Chin PLA, 2014, 39(3): 235-239. [刘一凡, 王正冠, 唐红卫, 等. 乌司他丁对黑火药烟雾所致吸入性肺损伤大鼠的保护作用以及对IL-1β、TNF-α基因表达的抑制作用[J]. 解放军医学杂志, 2014, 39(3): 235-239.]
An in vitro study of effects of the uremic toxin p-cresol on release of inflammatory cytokines from monocytes
DING Yu1, WANG Jian2, LIANG Xin1, WEI Xing-xue1, ZOU Zhong-ming2, YUAN Fa-huan1*1Kidney Disease Center of PLA, Chongqing Research Institute of Kidney Disease, Key Specialties of State Administration of Traditional Chinese Medicine, Department of Nephrology, Xinqiao Hospital, Third Military Medical University, Chongqing 400037, China
2Institute of Toxicology, School of Preventive Medicine, Third Military Medical University, Chongqing 400038, China
ObjectiveTo evaluate the effect of uremic toxin p-cresol on the release of inflammatory cytokines from monocytes and explore its potential mechanism.MethodsCCK-8 was employed to evaluate the proliferation status of monocytes cell-line THP-1 after being exposed to 20, 40, 80, 160mg/L of p-cresol for 6, 12 or 24h, while 40mg/L and 80mg/L were assigned as low-dose group and high-dose group. RNA and protein were extracted. RT-PCR and Western blotting were employed to evaluate the mRNA and protein expression of proinflammatory cytokine TNF-α, anti-inflammatory cytokine IL-10, as well as Toll-like receptor-4 (TLR-4) of THP-1 cell exposed to p-cresol for 24h.ResultsP-cresol depressed the proliferation ability of THP-1 in a dose- and time-dependent manner (P<0.05). RT-PCR and Western blotting showed that both TNF-α and TLR-4 were over-expressed in THP-1 cell exposed to p-cresol, while the expression of IL-10 was reduced (P<0.05). Conclusion P-cresol may inhibit both the proliferation of THP-1 cell and the release of IL-10. By up-regulating the expression of TLR-4, p-cresol may stimulate the release of TNF-α, resulting in microinflammation.
monocytes; uremia; cytokines; p-cresol
R692
A
0577-7402(2015)01-0035-05
10.11855/j.issn.0577-7402.2015.01.08
2014-10-12;
2014-12-04)
(责任编辑:张小利)
丁瑜,硕士研究生。主要从事慢性肾病发病机制及治疗方面的研究
400037 重庆 第三军医大学附属新桥医院肾内科、全军肾脏病中心、重庆市肾脏病研究所、国家中医药管理局重点专科(丁瑜、梁新、韦杏雪、袁发焕);400038 重庆第三军医大学预防医学系毒理学研究所(王健、邹仲敏)
]袁发焕,E-mail:yuanfh023@126.com
*Corresponding author, E-mail: yuanfh023@126.com
