CREG1蛋白对血管紧张素Ⅱ诱导的小鼠心功能损伤的影响
2015-06-28宋海旭李洋孙鸣宇彭程飞田孝祥闫承慧韩雅玲
宋海旭,李洋,孙鸣宇,彭程飞,田孝祥,闫承慧,韩雅玲
·基础研究·
CREG1蛋白对血管紧张素Ⅱ诱导的小鼠心功能损伤的影响
宋海旭,李洋,孙鸣宇,彭程飞,田孝祥,闫承慧,韩雅玲
目的探讨E1A激活基因阻遏子(CREG1)蛋白能否改善心肌纤维化小鼠的心功能。方法应用基因打靶方法建立广泛性基因敲除的CREG1杂合子小鼠和CREG1野生型小鼠模型。应用血管紧张素Ⅱ(AngⅡ)皮下埋泵方法建立小鼠心肌纤维化损伤模型,给予AngⅡ刺激14d后,采用HE和Masson染色检测小鼠心肌纤维化情况。应用Western blotting和免疫组化染色技术检测给予AngⅡ前及3、7、14d后两组小鼠心肌中CREG1蛋白的表达,并于给予AngⅡ14d后应用小动物超声仪检测心功能情况。AngⅡ给药同时,以皮下埋泵方式分别给予15、30、60、300μg/(kg·d)的外源性重组CREG1蛋白(治疗组)和生理盐水(对照组)14d,检测心功能,并应用TUNEL染色和Western blotting检测心肌凋亡情况。结果Western blotting和免疫组化检测结果显示,未给予AngⅡ刺激时杂合子小鼠心肌中CREG1蛋白表达明显低于野生型小鼠(P<0.05)。给予AngⅡ刺激3、7、14d时,野生型小鼠和杂合子小鼠心肌中CREG1蛋白表达均明显下降(P<0.05),但杂合子小鼠下降更为显著(P<0.01);HE和Masson染色显示杂合子小鼠心肌纤维化程度较野生型小鼠严重,二者心功能明显下降,且杂合子小鼠心功能下降更为明显(P<0.05)。给予外源性重组CREG1蛋白治疗后,治疗组心功能较对照组明显改善(P<0.05),心肌凋亡数量明显下降(P<0.05)。结论在AngⅡ引起的小鼠心肌纤维化模型中,CREG1蛋白减少可使小鼠心功能损伤加重,给予外源性重组CREG1蛋白可明显改善心功能。
E1A激活基因阻遏子;心肌纤维化;心功能
我国每年有300万人死于心血管疾病,占全部死亡例数的40%[1]。心肌纤维化(cardiac fibrosis,CF)是心肌损伤后成纤维细胞过度修复造成的病理改变,始发于各种诱因引起的心肌细胞损伤和死亡,继而心肌间质成纤维细胞激活、增殖并分泌大量胶原引起组织重构和CF发生。CF是多种心脏疾病终末期的共同病理改变,也是心功能由代偿期向失代偿期转换的关键环节。CF的演进最终导致恶性心律失常、心功能不全和心源性死亡[2-3]。有效预防或逆转CF的发生,遏制心血管疾病的演进已成为目前心血管疾病研究的重点方向。
E1A激活基因阻遏子(cellular repressor of E1A stimulated genes,CREG1)编码蛋白是一种在成熟组织细胞中广泛表达的小分子量分泌型糖蛋白,具有维持组织和细胞成熟分化的重要生理功能[4-5]。CREG1蛋白由220个氨基酸构成,含有3个M6P糖基化位点,能与M6P受体相互作用。免疫荧光染色显示CREG1存在于循环内吞体、溶酶体和质膜上,但其在细胞内的功能尚不清楚[6-7]。已有研究发现,CREG1在心脏组织中高表达,且过表达CREG1能够对抗高血压和主动脉缩窄引起的心功能障碍和心肌重构[8-9]。上述研究提示CREG1可能作为一种心肌细胞内稳态调控因子,参与心肌细胞的生理性适应和病理性损伤调控。本研究以血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)刺激后的CF小鼠为病理模型,尝试阐明CREG1蛋白在小鼠心功能调控中的作用。
1 材料与方法
1.1 实验动物及主要试剂 C57BL/6CREG+/+小鼠(8周龄)60只,杂合子CREG+/–小鼠(8周龄)24只,体重约25g,由沈阳军区总医院动物实验科提供。AngⅡ由美国Sigma公司提供;外源性重组CREG1蛋白由美国Abcam公司提供;Model 1004微渗透泵由美国Alzet公司提供;抗CREG1、β-actin抗体由美国Abcam公司提供;Vevo 2100小动物超声仪由加拿大维胜公司提供。
1.2 实验方法
1.2.1 动物模型及分组 AngⅡ溶于0.9% NaCl后注入微渗透泵中,以皮下埋泵的方式植入每只小鼠皮下,按1.5mg/(kg.d)剂量给药14d后检测GREG+/+和GREG+/–小鼠心肌纤维化情况。将浓度为15、30、60、300μg/(kg·d)的外源性重组CREG1蛋白和生理盐水分别注入微渗透泵中,以皮下埋泵的方式植入AngⅡ给药组CREG+/+小鼠皮下,连续给药14d。给予外源性重组CREG1蛋白的CREG+/+小鼠为治疗组(不同浓度给药治疗组各6只),注入生理盐水的为对照组(n=6)。
1.2.2 Western blotting检测 取未给予AngⅡ和给予AngⅡ3、7、14d的小鼠心脏组织,以及给予AngⅡ同时给予外源性重组CREG1蛋白的小鼠心脏组织。采用BCA比色法试剂盒测定裂解液(Sigma公司)中的蛋白质浓度,将45μg蛋白加入4×Loading Buffer,95℃煮沸5min后,经10%分离胶行SDS-PAGE电泳,判断电泳终止时间。以350mA的电流将样品转到纤维素膜上,时间为80min;在TBS-T稀释的5%脱脂奶粉中常温封闭1.5h后加入一抗(抗CREG1抗体1:1000,抗β-actin抗体1:2000)4℃孵育过夜;第2天放置摇床上摇晃半小时后TBS-T洗膜3次,每次15min;加入兔抗鼠二抗(1:1000稀释),常温孵育2h,TBS-T洗膜4次,每次20min;ECL化学发光显影。
1.2.3 免疫组化染色 对经药物处理14d小鼠的心脏标本取材后,进行石蜡包埋,切片后脱蜡,抗原修复。滴加过氧化酶阻断液,室温10min,PBS洗3次,滴加非免疫动物血清,室温20min,除去血清后滴加一抗(1:100),4℃过夜;第2天常温放置30min,PBS洗3次,滴加二抗,室温10min,PBS洗3次后滴加过氧化酶溶液,室温10min,PBS洗3次,最后DAB显色,苏木素复染、返蓝、脱水、二甲苯脱洗、封片。
1.2.4 超声检测 小鼠埋泵14d后,应用Vevo 2100小动物超声仪检测各组小鼠心功能。
1.2.5 HE染色 取埋泵14d心肌组织石蜡包埋、切片,脱蜡后染色,具体染色步骤:切片放入苏木精水溶液中染色15min,盐酸乙醇中分化数秒,氨水返蓝10min,伊红染色5min,95%乙醇数秒,100%乙醇2min,100%乙醇5min,二甲苯中透明10min,封片。
1.2.6 Masson染色 取埋泵14d后小鼠心肌组织石蜡包埋、切片,脱蜡后苏木精染色10min,过水后盐酸乙醇分化,水洗后Masson丽春红酸性复红液染色10min,2%冰醋酸水溶液浸洗,1%磷钼酸水溶液分化5min,直接用苯胺蓝染色5min,再以0.2%冰醋酸浸洗片刻,95%乙醇、100%乙醇脱蜡,二甲苯透明,封片。
1.2.7 TUNEL染色 配制染色所需试剂后,将冰冻组织切片置于4%的多聚甲醛中室温固定10min,PBS洗2次,每次10min。置3%过氧化氢甲醇溶液中20min,PBS洗3次,每次5min,置0.1%枸橼酸钠中(冰上)2min,UNEL染色配制液加入样本表面后37℃温箱孵育1h,避光;PBS浸洗,DAPI染色细胞核。
1.3 统计学处理 采用SPSS 17.0软件进行统计分析。计量资料以表示,两组间均数比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 AngⅡ刺激后小鼠心肌组织中CREG1蛋白表达情况 应用基因打靶方法构建CREG基因敲除小鼠,经鉴定只有野生型CREG小鼠(CREG+/+)和杂合子CREG小鼠(CREG+/–)存活,CREG基因敲除小鼠发生胚胎期死亡。Western blotting和免疫组化检测证实,CREG+/+小鼠心肌中CREG1蛋白表达明显高于CREG+/–小鼠(P<0.05,图1)。应用AngⅡ埋泵给药后3、7、14d,两组小鼠心肌中CREG1蛋白表达均明显降低,且杂合子CREG+/–小鼠降低更加明显(P<0.01,图2),而给药14d时,Western blotting结果显示两组小鼠心肌均未检测到CREG1蛋白表达。同时,给予AngⅡ刺激14d后超声心功能检测发现,杂合子CREG+/–小鼠心功能显著下降(P<0.05,图3)。
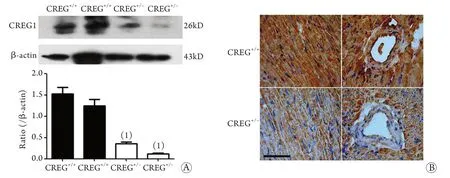
图1 未给予AngⅡ刺激时CREG+/+和CREG+/–小鼠心肌中CREG1蛋白的表达Fig.1 Expression of CREG1 protein in myocardium of CREG+/+and CREG+/–mice untreated by AngⅡ
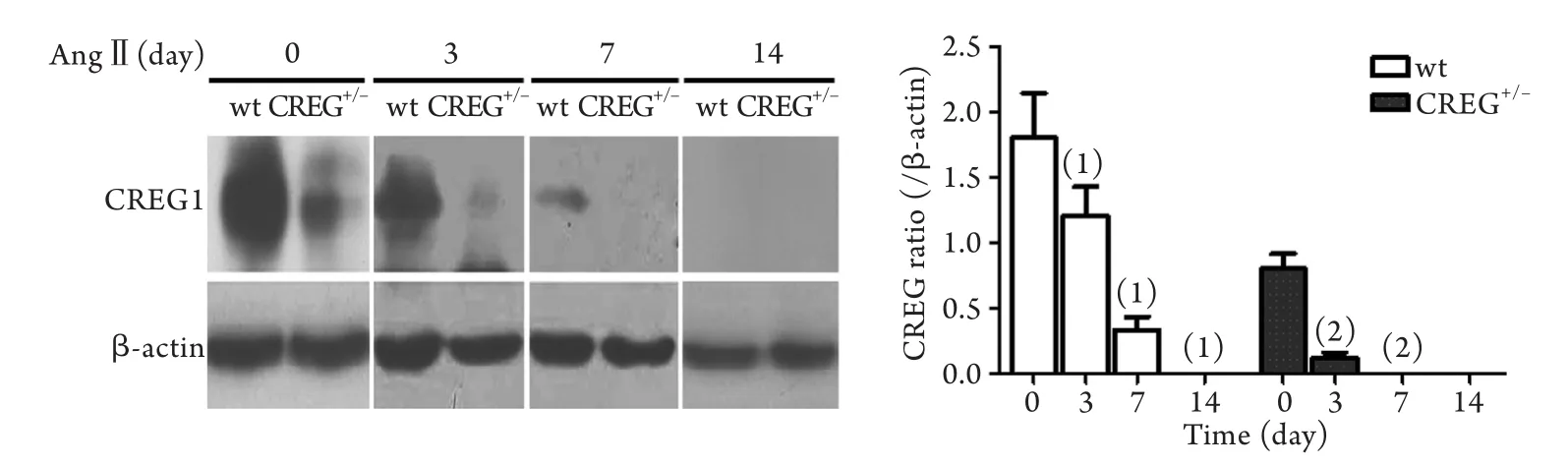
图2 应用AngⅡ埋泵给药不同时间两组小鼠心肌中CREG1蛋白的表达Fig.2 Expression of CREG1 protein in myocardium of CREG+/+and CREG+/–mice stimulated by AngⅡ for 3, 7 and 14 days
2.2 给予外源性重组CREG1蛋白后小鼠心功能的
超声检测结果显示,外源性重组CREG1蛋白治疗14d后,治疗组小鼠心功能明显改善且呈剂量依赖性。与对照组比较,0.3mg/(kg·d) CREG1蛋白治疗组心功能改善最为显著,已基本恢复至正常水平(P<0.05,图4)。
2.3 CREG1蛋白治疗前后小鼠CF情况 应用HE和Masson染色检测外源性重组CREG1蛋白治疗前后CREG+/+小鼠CF情况,结果显示:与对照组相比,治疗组小鼠CF得到明显改善(图5)。TUNEL染色结果显示,CREG+/+小鼠给予外源性重组CREG1蛋白14d后心肌凋亡细胞数量明显减少(P<0.05,图6);Western blotting检测显示,CREG+/+小鼠给予外源性重组CREG1蛋白14d后凋亡指标cleaved caspase3表达明显减少(P<0.05,图6)。
3 讨 论
原发或继发性高血压等心血管疾病发展到一定的病理阶段便会形成CF,损伤心功能,最终导致器官衰竭[10]。引起CF的机制十分复杂,涉及肾素-血管紧张素系统[11-12]、TGF-β1[4]和氧化应激反应等。AngⅡ是CF形成机制中的一个重要因素[13-16],其本身及产物可以诱导心肌成纤维细胞增殖,促进细胞外基质蛋白产生[17],最终导致心肌细胞凋亡和间质纤维化[18]。
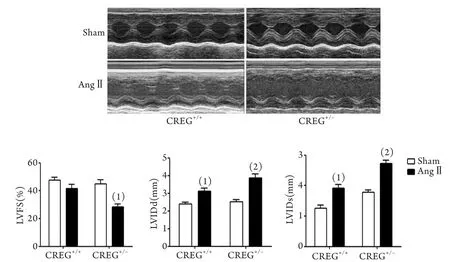
图3 给予AngⅡ刺激14d后两组小鼠心功能超声检测结果Fig.3 Echocardiographic detection of cardiac function after AngⅡ stimulation for 14 days
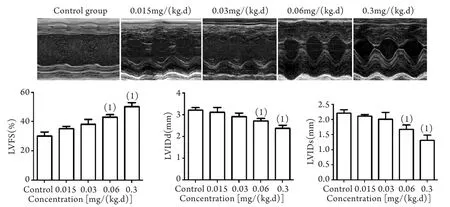
图4 给予不同浓度外源性重组CREG1蛋白治疗14d后CREG+/+小鼠心功能超声检测结果Fig.4 Cardiac function of GREG+/+mice administered with exogenous recombination CREG1 in di ff erent concentrations for 14 days
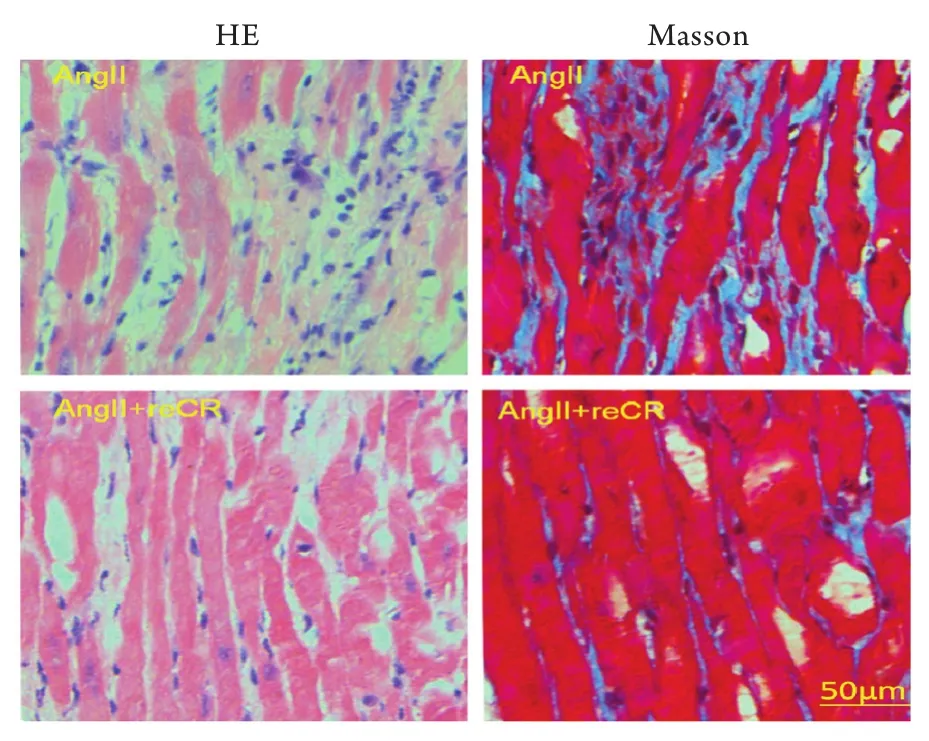
图5 给予外源性重组CREG1蛋白0.3mg/(kg·d) 14d后CREG+/+小鼠CF情况Fig.5 Myocardial fibrosis of CREG+/+mice treated with 0.3mg/(kg·d) of exogenous recombination CREG1 for 14 days
CREG1作为一种在组织中广泛分布的小分子量糖蛋白,在心脏组织中高表达。既往研究已证实,过表达的CREG1能够对抗高血压引起的心脏肥大[19-20];而本研究发现,与野生型小鼠相比,CREG1表达减少的杂合子小鼠明显不能耐受AngⅡ诱导的CF损伤,心功能在给药后14d严重恶化,提示在AngⅡ刺激条件下,心肌中CREG1蛋白的表达减少与心功能恶化密切相关。同时本研究发现,给予外源性CREG1蛋白可明显改善小鼠因AngⅡ刺激导致的心功能恶化,且呈浓度依赖性,同时心肌细胞纤维化程度也明显受到抑制。这一现象提示CREG1蛋白可能通过抑制AngⅡ引起的CF来改善心脏功能。

图6 给予外源性重组CREG1蛋白14d后CREG+/+小鼠心肌细胞凋亡情况Fig.6 Apoptosis of myocardial cells of CREG+/+mice treated with 0.3mg/(kg·d) of exogenous recombination CREG1 for14 daysA. TUNEL staining (the arrows showed the apoptosis of myocardial cells); B. Western blotting. (1)P<0.05 compared with control group
本研究显示给予外源性重组CREG1蛋白能够降低AngⅡ刺激后的心肌凋亡细胞数量,并逆转CF的发生发展。本课题组前期研究已证实,CREG1蛋白具有促进平滑肌成熟分化[21],对抗骨髓干细胞中TNF-α引起的凋亡[22],减少动脉粥样硬化内皮细胞凋亡[23],调节血管内皮细胞迁移[24]等作用。提示CREG1蛋白可能通过抑制心肌细胞凋亡进而对抗CF的进展。因此,本研究进一步检测了CREG1蛋白治疗前后心肌组织凋亡的发生情况,与预期相似,在CREG1蛋白治疗和同时AngⅡ给药刺激14d后,TUNEL染色和Western blotting检测结果均提示CREG1蛋白可能通过对抗小鼠心肌细胞凋亡而起到抑制AngⅡ诱导的CF和心功能损伤的作用。在CF时CREG1虽然改善了心功能,但其是否能够调控心肌细胞凋亡及其机制并不清楚,因此仍需进一步深入研究。
目前已有研究提示CREG1蛋白可在溶酶体上表达,可能在溶酶体的发生和成熟中起重要作用[5-6]。作为较新认识的细胞内稳态调节细胞器之一,溶酶体在抑制细胞凋亡、对抗细胞损伤中的作用机制仍有待更深入的研究。作为一种在成熟组织细胞中广泛表达的内稳态调控蛋白,CREG1蛋白在对抗心肌损伤和心功能异常中的作用为心血管疾病防治研究提供了一个新的治疗点和思路。
[1] National Center For Cardiovascular Disease. Cardiovascular disease reported in China (2011)[R]. 2012, 4. [卫生部心血管病防治研究中心. 中国心血管病报告(2011)[R]. 2012, 4.]
[2] Weber KT, Sun Y, Bhattacharya SK,et al. Myofibroblast-mediated mechanisms of pathological remodelling of the heart[J]. Nat Rev Cardiol, 2013, 10(1): 15-26.
[3] Kovacic JC, Mercader N, Torres M,et al. Epithelial-tomesenchymal and endothelial- to-mesenchymal transition: from cardiovascular development to disease[J]. Circulation, 2012, 125(14): 1795-1808.
[4] Veal E, Eisenstein M, Tseng ZH,et al. A cellular repressor of E1A-stimulated genes that inhibits activation by E2F[J]. Mol Cell Biol, 1998, 18(9): 5032-5041.
[5] Veal E, Groisman R, Eisenstein M,et al. The secreted glycoprotein CREG enhances differentiation of NTERA-2 human embryonal carcinoma cells[J]. Oncogene, 2000, 19(17): 2120-2128.
[6] Qian M, Sleat D, Zheng H,et al. Proteomics analysis of serum from mutant mice reveals lysosomal proteins selectively transported by each of the two mannose 6-phosphate receptors[J]. Mol Cell Proteomics, 2008, 7(1): 58-70.
[7] Schähs P, Weidinger P, Probst OC,et al. Cellular repressor of E1A-stimulated genes is a bona fide lysosomal protein which undergoes proteolytic maturation during its biosynthesis[J]. Exp Cell Res, 2008, 314(16): 3036-3047.
[8] Bian Z, Cai J, Shen DF,et al. Cellular repressor of E1A-stimulated genes attenuates cardiac hypertrophy and fibrosis[J]. J Cell Mol Med, 2009, 13(7): 1302-1313.
[9] Xu L, Liu JM, Chen LY. CREG, a new regulator of ERK1/2 in cardiac hypertrophy[J]. J Hypertens, 2004, 22(8): 1579-1587.
[10] Zhao W, Zhao T, Chen Y,et al. Oxidative stress mediates cardiac fibrosis by enhancing transforming growth factor-beta1 in hypertensive rats[J]. Mol Cell Biochem, 2008, 317(1-2): 43-50.
[11] Sun Y, Ratajska A, Zhou G,et al. Angiotensin-converting enzyme and myocardial fibrosis in the rat receiving angiotensin Ⅱ or aldosterone[J]. J Lab Clin Med, 1993, 122(4): 395-403.
[12] McEwan PE, Gray GA, Sherry L,et al. Differential effects of angiotensin Ⅱ on cardiac cell proliferation and intramyocardial perivascular fibrosisin vivo[J]. Circulation, 1998, 98(24): 2765-2773.
[13] Tokuda K, Kai H, Kuwahara F,et al. Pressure-independent effects of angiotensin Ⅱ on hypertensive myocardial fibrosis[J]. Hypertension, 2004, 43(2): 499-503.
[14] Sun Y, Weber KT. Tissue angiotensin Ⅱ and myocardial infarction[J]. EXS, 1996, 76: 479-488.
[15] Gonzalez A, Lopez B, Diez J. Fibrosis in hypertensive heartdisease: role of the renin-angiotensin-aldosterone system[J]. Med Clin North Am, 2004, 88(1): 83-97.
[16] Varagic J, Frohlich ED. Local cardiac renin-angiotensin system: hypertension and cardiac failure[J]. J Mol Cell Cardiol, 2002, 34(11): 1435-1442.
[17] Porter KE, Turner NA. Cardiac fibroblasts: at the heart of myocardial remodeling[J]. Pharmacol Ther, 2009, 123(2): 255-278.
[18] Weber KT, Sun Y, Katwa LC,et al. Tissue repair and angiotensinⅡ generated at sites of healing[J]. Basic Res Cardiol, 1997, 92(2): 75-78.
[19] Bian Z, Cai J, Shen DF,et al. Cellular repressor of E1A-stimulated genes attenuates cardiac hypertrophy and fibrosis[J]. J Cell Mol Med, 2009, 13(7): 1302-1313.
[20] Li HL, She ZG, Li TB,et al. Overexpression of myofibrillogenesis regulator-1 aggravates cardiac hypertrophy induced by angiotensin Ⅱ in mice[J]. Hypertension, 2007, 49(6): 1399-1408.
[21] Han Y, Deng J, Guo L,et al. CREG promotes a mature smooth muscle cell phenotype and reduces neointimal formation in balloon-injured rat carotid artery[J]. Cardiovasc Res, 2008, 78(3): 597-604.
[22] Peng CF, Han YL, Deng J,et al. Overexpression of cellular repressor of E1A-stimulated genes inhibits TNF-α-induced apoptosisviaNF-κB in mesenchymal stem cells[J]. Biochem Biophys Res Commun, 2011, 406(4): 601-607.
[23] Wang N, Han Y, Tao J,et al. Overexpression of CREG attenuates atherosclerotic endothelium apoptosisviaVEGF/PI3K/AKT pathway[J]. Atherosclerosis, 2011, 218(2): 543-551.
[24] Zhang H, Han Y, Tao J,et al. Cellular repressor of E1A-stimulated genes regulates vascular endothelial cell migration by the ILK/ AKT/mTOR/VEGF(165) signaling pathway[J]. Exp Cell Res, 2011, 317(20): 2904-2913.
Effect of cellular repressor of E1A stimulated genes (CREG1) on cardiac function injury induced by angiotensin Ⅱ in mice
SONG Hai-xu1, LI Yang2, SUN Ming-yu2, PENG Cheng-fei2, TIAN Xiao-xiang2, YAN Cheng-hui2, HAN Ya-ling2*
1Department of Cardiology, Xijing Hospital, Fourth Military Medical University, Xi’an 710032, China
2Department of Cardiology, General Hospital of Shenyang Command, Shenyang 110016, China
*Corresponding author, E-mail: hanyaling@263.net
This work was supported by the National Natural Science Foundation of China(81130072, 81370243), and the Key Project of “12th Five-Year” Research Program of China (2012ZX09303016-002)
ObjectiveTo investigate the effect of cellular repressor of E1A stimulated genes (CREG1) on cardiac function in mouse with myocardial fibrosis.MethodsCREG1 knockout mice (CREG1+/–) and CREG1 wild-type mice (CREG1+/+) were used to reproduce the model of myocardial fibrosis by subcutaneous pump burying of angiotensin Ⅱ (AngⅡ). After being stimulated with AngⅡ for 14 days, myocardial fibrosis was verified by HE staining and Masson trichrome staining. Western blotting and immunohistochemistry were used to detect the expression of CREG1 in myocardium before stimulation and 3, 7, 14 days after the AngⅡ stimulation. The cardiac function was evaluated by echocardiography after AngⅡ stimulation for 14 days. The CREG+/+mice were given AngⅡ for 14 days, and at the same time recombinant CREG1 protein [respectively 15, 30, 60 and 300μg/(kg.d), intraperitoneal (IP) injections] (treatment group) and NaCl (control group) were administered for treatment, and then cardiac function and myocardiac apoptosis were examined.ResultsWestern blotting and immunohistochemistry showed that the expression of CREG1 in heart tissue was significantly lower in CREG+/–mice than in CREG+/+mice (P<0.05). After AngⅡstimulation for 3, 7 and 14 days, the expression of CREG1 in heart tissue declined significantly in both CREG+/-and CREG+/+mice (P<0.05), especially in CREG+/-mice (P<0.01). With HE and Masson staining, it was also found that CREG1 deficiency aggravatedmyocardial fibrosis and cardiac function deterioration in response to AngⅡ stimulation (P<0.05). Conversely, exogenous infusion of recombinant CREG1 protein significantly inhibited the occurrence of myocardial apoptosis (P<0.05), thus ameliorated cardiac function (P<0.05).ConclusionsCREG1 deficiency may aggravate the deterioration of cardiac function in mouse with myocardial fibrosis induced by AngⅡ stimulation. The deterioration of cardiac function can be improved by administration of exogenous recombinant CREG1 protein.
cellular repressor of E1A stimulated genes; myocardial fibrosis; cardiac function
R542.23
A
0577-7402(2015)01-0016-06
10.11855/j.issn.0577-7402.2015.01.04
2014-09-02;
2014-11-17)
(责任编辑:张小利)
国家自然科学基金重点项目(81130072),面上项目(81370243);国家“十二五”重大新药创制研究项目(2012ZX09303016-002)
宋海旭,医学硕士。主要从事心肌缺血再灌注方面的研究
710032 西安 第四军医大学西京医院心内科(宋海旭);110016 沈阳 沈阳军区总医院心内科(李洋、孙鸣宇、彭程飞、田孝祥、闫承慧、韩雅玲)
]韩雅玲,E-mail:hanyaling@263.net
