复水对旱后不同玉米品种植株生长恢复能力及其生理响应特性的影响
2015-06-28陈道钳殷俐娜邓西平王仕稳
曹 丹,陈道钳,吴 茜,殷俐娜,邓西平,王仕稳*
(1中国科学院水利部水土保持研究所黄土高原土壤侵蚀与旱地农业国家重点实验室,陕西杨陵712100;2中国科学院大学,北京100049;3西北农林科技大学生命科学学院,陕西杨陵712100;4西北农林科技大学水土保持研究所,陕西杨陵712100)
复水对旱后不同玉米品种植株生长恢复能力及其生理响应特性的影响
曹 丹1,2,陈道钳3,吴 茜1,2,殷俐娜1,4,邓西平1,4,王仕稳1,4*
(1中国科学院水利部水土保持研究所黄土高原土壤侵蚀与旱地农业国家重点实验室,陕西杨陵712100;2中国科学院大学,北京100049;3西北农林科技大学生命科学学院,陕西杨陵712100;4西北农林科技大学水土保持研究所,陕西杨陵712100)
该研究选用2个抗旱能力相似但旱后恢复能力存在显著差异的玉米品种‘P3’和‘郑单958’为材料,采用盆栽称重控水法在苗期进行干旱及复水处理,通过测定其生长、水分状况、光合参数、叶绿素荧光参数以及叶绿素含量在干旱及复水过程中的变化规律,探讨干旱及复水过程中生理生化响应与旱后恢复能力的关系。结果发现:(1)抗旱性相同的2个玉米品种在干旱复水后的生长恢复能力表现为‘P3’显著强于‘郑单958’。(2)干旱胁迫后,‘郑单958’和‘P3’的叶片相对含水量差异不显著,但‘P3’能维持较高的叶水势、PSⅡ最大光化学效率和叶绿素含量。(3)经干旱胁迫复水后,‘P3’的净光合速率,PSⅡ最大光化学效率和气孔导度恢复速度快于‘郑单958’,说明‘P3’光合损失恢复能力高于‘郑单958’。研究表明,玉米品种‘P3’的旱后复水生长恢复能力较强,因‘P3’在干旱胁迫下能维持较高的Fv/Fm值和叶绿素含量,光系统的损伤较轻,而且复水后也能较快的恢复;在干旱过程中减轻干旱胁迫对植物光合系统的伤害是旱后复水快速恢复生长的基础,而在复水后快速修复光系统损失能够加快植物复水的恢复速度。
玉米;干旱;复水;旱后恢复能力;光合速率
干旱对农作物生长造成的损失在所有非生物胁迫中居首位,其不仅仅在干旱、半干旱区频繁发生,在非干旱地区也经常发生季节性干旱,严重影响农作物的正常生长和发育[1]。近年来由于全球气候变化,导致包括干旱在内的极端天气频繁出现,会进一步对未来的粮食生产产生威胁[2]。所以,了解植物的抗旱机制,提高植物的抗旱能力,培育抗旱品种是应对气候变化的重要手段。理想抗旱作物品种,不但要求植物在遭受干旱胁迫过程中能够尽量减少干旱胁迫对植物的伤害,而且要求一旦有降水或灌溉,又能够从干旱伤害中迅速恢复生长。后一过程,在作物抗旱中可能具有更重要的意义[3]。前人的研究结果表明,干旱后复水能够弥补干旱对植物造成的损失,对植物的生长产生补偿效应甚至是超补偿效应[4]。Acevedo[5]对玉米的研究表明,高等植物对干旱胁迫—复水的响应方式是在胁迫解除后存在短暂的快速生长,以部分补偿干旱造成的生长损失。因此,研究作物在旱后复水中的恢复机理与作物在干旱胁迫下的抗旱机制具有同样重要的意义[6]。
由于干旱和复水经常是一连续的过程,前人在研究中往往侧重于干旱过程,或者把干旱和复水当作一个整体来研究,很少有专门研究复水这一过程。而且不同植物或者同一植物的不同品种,在复水过程中的恢复能力和速度存在明显的差异[7]。了解这种差异存在的原因及其机制对了解植物的抗旱机制以及抗旱育种都有重要的意义。玉米(Zea mays)是中国广泛种植的一种粮食兼饲料作物,在农业生产和国民经济发展中占有重要地位,其生长经常遭受干旱胁迫,严重影响其产量[8-10],尤其是苗期遭受干旱胁迫可减产高达21.1%[11]。迄今对玉米抗旱性的研究多集中在抗旱性鉴定和干旱胁迫对生长及生理生化过程的影响等方面[12-14]。而前期干旱对玉米后期恢复能力影响,以及干旱和复水过程中生理生化的响应与品种间恢复能力的差异关系等尚不明确。因此,本实验从前期预实验的10个玉米品种中选取前期干旱胁迫反应相同,即在干旱胁迫下其生物量较对照降低的幅度相同,但旱后复水恢复能力存在显著差异的2个玉米品种,重点研究干旱及复水过程中其生长速率、叶片水势、光合参数变化规律及其与旱后恢复能力的关系,以期为作物的抗旱栽培和抗旱育种提供理论依据。
1 材料和方法
1.1 实验材料
选用2个抗旱性相似(干旱胁迫过程对生长抑制程度相似),而旱后恢复能力差异明显的2个玉米品种为实验材料,分别为旱后恢复能力较强的‘P3’和旱后恢复能力较弱的‘郑单958’。
1.2 实验设计
盆栽实验于2014年4~6月在中国科学院水土保持研究所塑料大棚内进行。盆栽用的塑料桶直径30cm,高28cm,每桶装入风干黄绵土16kg,土壤田间持水量为20%。三叶一心期定苗至每盆3株。
实验设置2个水分处理:对照组(充分供水,W)和处理组(旱后复水,D)。采取称重控水法每天测定土壤含水量并将同一处理补水至相同含水量。在实验过程中,充分供水组土壤相对含水量始终保持在田间持水量的80%左右;处理组土壤相对含水量先经自然干旱逐渐下降,在处理的第6、12、17天分别下降至田间持水量的57.2%、33.6%、24.9%,再于干旱处理17d后开始充分灌水,并使旱后复水后的土壤相对含水量保持在田间持水量的80%左右。复水5d后取样测定相关指标。在实验过程中对照组和干旱处理组土壤含水量变化如图1所示。
1.3 测定项目及方法
1.3.1 生物量和株高 每个处理各取10株的地上部分分别装入纸样品袋,105℃杀青30min,80℃烘至恒重后称重,作为生物量。用卷尺测量植株拉直后的最大高度作为株高,每处理重复8次。
1.3.2 叶水势和叶片相对含水量 剪取最新的完全展开叶中部,用3005型压力室(SEC公司,USA)于上午6:00~7:00测定叶水势,每处理重复6次。叶片相对含水量参考高俊凤等[15]《植物生理学实验指导》中方法测定,每处理重复6次。
1.3.3 叶绿素含量和光合参数 参考高俊凤等[15]《植物生理学实验指导》,采用80%丙酮浸提法测定叶绿素含量,每处理重复5次。采用美国LI-COR公司生产的Li-6400便携式光合系统分析仪,在晴天上午9:30~11:00测定最新完全展开叶的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)等参数,每处理重复6次。采用便携式调制荧光仪PAM-2100(德国WALZ),在植株暗适应30min后测定最新完全展开叶光系统Ⅱ最大光合效率(Fv/Fm),每处理重复6次。
1.4 数据处理
利用Excel进行整理分析及作图,利用SPSS进行数据统计分析,用最小显著差异法(LSD)进行方差分析,显著性水平为α=0.05。
2 结果与分析
2.1 干旱及复水对玉米地上部分生长的影响
如图2,A、B所示,经过17d的干旱处理,‘郑单958’和‘P3’的株高和地上部生物量均降低,二者株高分别较对照降低了13.2%和29.9%,地上部干重则分别降低了62.4%和60.9%。复水5d后(处理22d,下同)2个品种已经恢复了生长,表现为生物量累计增加,但其株高和生物量均显著低于对照。为了更直观地比较两品种抗旱和旱后复水的恢复能力,进一步计算了2个品种的相对生物量(图2,C,处理组与同时间对照组地上部分生物量之比)。其中在干旱下,‘郑单958’和‘P3’2个品种表现出相似的抗旱性,相对生物量分别为对照组的37.6%、39.1%;旱后复水5d后,2个品种相对生物量均有所增加,但‘P3’相对生物量要明显高于‘郑单958’,两者分别为各自对照的69.3%和43.3%。以上结果表明,尽管2个品种在干旱胁迫过程中表现出相似的抗旱能力,但在复水后‘P3’的恢复能力要显著高于‘郑单958’。

图1 干旱及复水过程中土壤相对含水量的变化Fig.1 The changes of soil relative water content during drought and rehydration
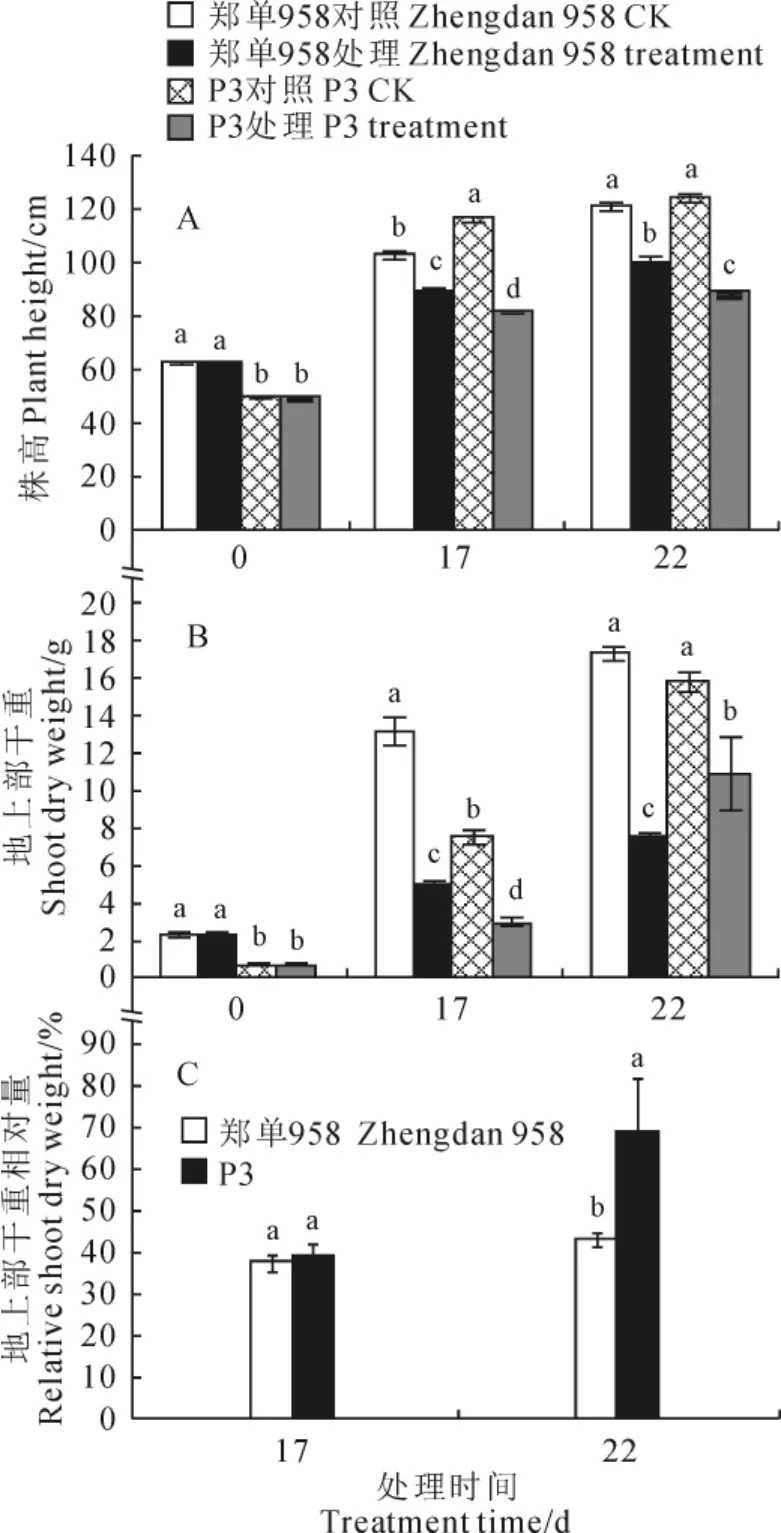
图2 干旱及复水过程中‘郑单958’和‘P3’株高(A)、地上部干重(B)和地上部干重相对量(C)的比较同期不同字母表示处理间在0.05水平存在显著性差异;下同Fig.2 The changes of plant height(A),and shoot dry weight(B)and relative shoot dry weight(C)of‘Zhengdan 958’and‘P3’during drought and rehydration The different normal letters in the same stage indicate significant difference among treatments at 0.05level;The same as below
2.2 干旱及复水过程中玉米叶片相对含水量和叶片水势的变化
如图3,A所示,经过17d的干旱处理,‘郑单9 58’和‘P3’2个玉米品种的叶片相对含水量均显著下降,分别为47.8%和50.1%,且两品种间无显著差异。复水后5d后,2个品种的叶片相对含水量均完全恢复至对照水平,但‘P3’显著高于‘郑单958’。同时,在干旱胁迫下,2个玉米品种的叶片水势均大幅显著下降到较低水平,分别为-2.17MPa和-1.98MPa,‘郑单958’的叶片水势要显著低于‘P3’。复水后,2个品种的叶片水势都恢复到正常水平,分别为-0.34MPa和-0.25MPa,但‘郑单958’仍显著低于‘P3’(图3,B)。说明不管是在干旱胁迫下还是复水后,‘郑单958’的叶片水势都显著低于‘P3’。以上结果同样也说明了‘P3’的恢复能力要高于‘郑单958’。
2.3 干旱及复水对玉米光合参数的影响
干旱胁迫降低了‘郑单958’和‘P3’的净光合速率、蒸腾速率和气孔导度(图4)。在干旱胁迫下2个品种玉米叶片净光合速率均呈下降趋势。干旱处理17d,2个品种的光合速率值都接近零;复水后2个品种的光合速率都能明显恢复,但‘P3’恢复得更快,如在复水第3d,‘P3’光合速率显著高于‘郑单9 58’,复水5d后两品种光合速率都恢复到相同水平,但均略微低于处理前(图4,A)。气孔导度和蒸腾速率的变化起初和光合速率变化一致。干旱胁迫下,2个品种叶片气孔导度和蒸腾速率随干旱程度的加重不断降低,在干旱胁迫处理17d时,2个品种的气孔导度和蒸腾速率都接近于零;复水3d后,‘P3’气孔导度和蒸腾速率显著高于‘郑单958’,复水5d后两品种气孔导度和蒸腾速率都恢复到较高水平,并接近于处理前(图4,B、C)。以上结果表明,相较于‘郑单958’,‘P3’品种光合速率、气孔导度和蒸腾速率在旱后复水能更快的恢复。
2.4 干旱及复水对PSⅡ最大光化学效率Fv/Fm的影响
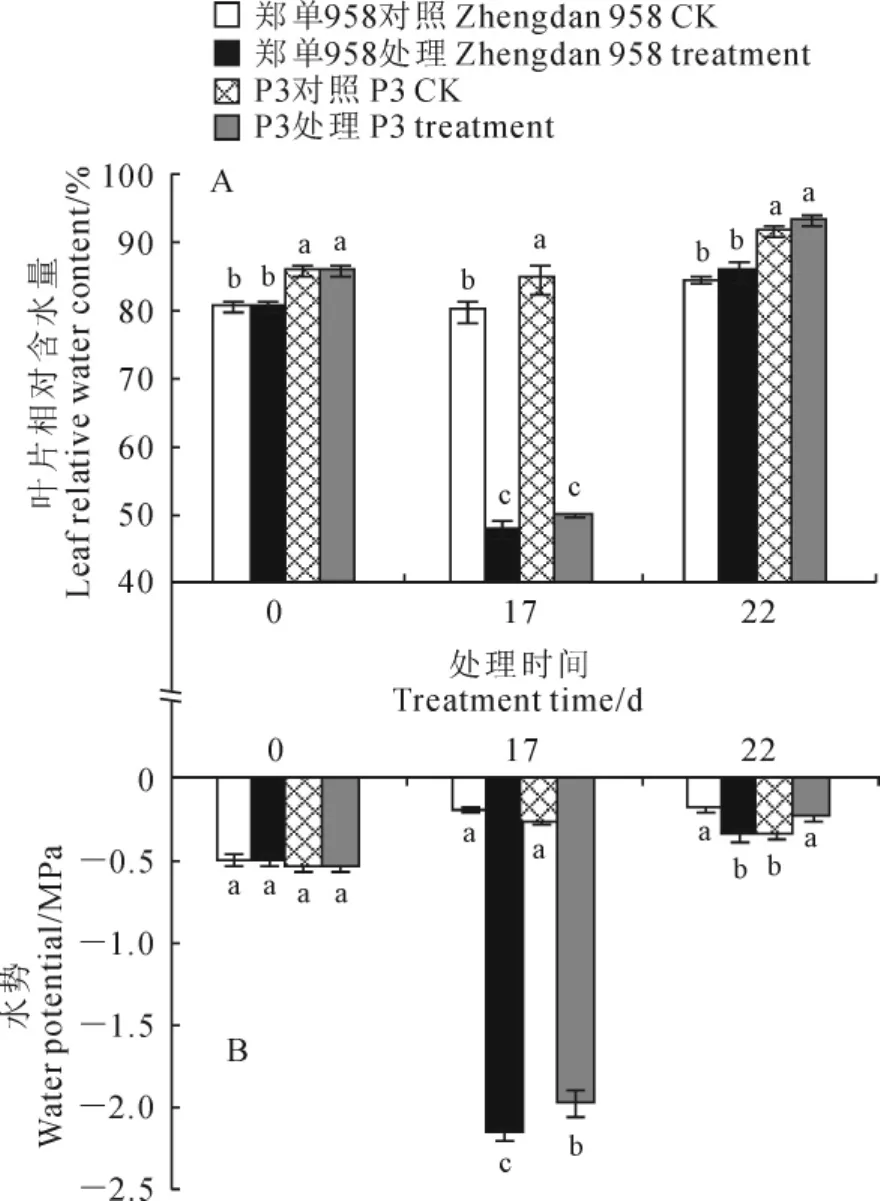
图3 干旱及复水过程中‘郑单958’和‘P3’的叶片相对含水量(A)和叶片水势(B)的变化Fig.3 The changes of leaf relative water content(A)and leaf water potential(B)of‘Zhengdan 958’and‘P3’during drought and rehydration

图4 干旱及复水过程中‘郑单958’和‘P3’光合速率(A)、气孔导度(B)和蒸腾速率(C)的变化Fig.4 The changes of Pn(A),Gs(B)and Tr(C)of‘Zhengdan 958’and‘P3’during drought and rehydration
PSⅡ最大光化学效率(Fv/Fm)是PSⅡ在光合过程中潜在的最大光能转换效率,能反映胁迫对PSⅡ复合体伤害的程度。如图5所示,两玉米品种对照组的Fv/Fm值在0.75~0.85之间;经过17d的干旱处理后,‘郑单958’和‘P3’2个品种的Fv/Fm分别为0.66和0.71;复水3d后,‘P3’最大光化学效率显著回升,而‘郑单958’未显著恢复;复水5d后,2个品种最大光化学效率都恢复到与对照相同的水平。这一结果表明,干旱胁迫条件下,‘P3’的光系统受到的损伤相较于‘郑单958’更小,其在复水过程中具有更强的修复能力,使光合结构更快地从胁迫中恢复。
2.5 干旱及复水对玉米叶片叶绿素含量的影响
叶绿素含量的高低直接影响植株光合能力[1617]。如图6所示,在干旱胁迫前,两玉米品种叶绿素含量无显著差异;经过17d的干旱处理,‘郑单958’和‘P3’2个玉米品种的叶绿素含量均显著下降,分别降低了27.9%和18.0%,但‘P3’品种叶绿素含量显著高于‘郑单958’。复水5d后,2个品种的叶绿素含量都完全恢复至对照相同的水平。

图5 干旱及复水过程中‘郑单958’和‘P3’Fv/Fm的变化Fig.5 The changes of Fv/Fmof‘Zhengdan 958’and‘P3’during drought and rehydration

图6 干旱及复水过程中‘郑单958’和‘P3’叶绿素含量的变化Fig.6 The changes of chlorophyll content of‘Zhengdan 958’and‘P3’during drought and rehydration
3 讨 论
玉米的生育期中经常会遭遇不同程度的干旱胁迫,而旱后的补偿效应是玉米自身的一种积极的调节机制,对其应对胁迫具有重要的意义。干旱胁迫显著降低了植物的生长速率,导致植株矮化,生长发育受阻,产量下降[18-19]。旱后复水植物能快速恢复生长,迅速消除干旱对植物生长的抑制,有时候甚至产生超补偿效应,弥补干旱对植物造成的损失[20-22]。所以,在干旱胁迫过程中植物的抗旱能力和复水后植物的恢复能力对于干旱环境下植物的生长同等重要。复水后植物的快速恢复能力对作物生产可能具有更重要的意义,其一方面可以快速消除前期干旱对作物生长的持续影响,同时产生的超补偿效应可以减少前期干旱对作物产量的影响,甚至增加产量。本研究中,2个玉米品种株高和地上部生物量在干旱胁迫下都显著降低,生长受到显著抑制。理论上,选择2个品种在正常生长情况下其植株形态相同,干旱胁迫后其受抑制相同,而在复水后恢复能力存在显著差异的品种开展本研究最为理想。然而在前期的实验中对10个玉米品种进行了初筛,发现很难找到1对品种可以同时满足以上3个条件。前人研究表明抗旱性评价以干旱胁迫下植株的生物量变化为依据最为可靠。抗旱系数(抗旱系数=干旱胁迫下产量或生物量/非胁迫下产量或生物量)是干旱胁迫对作物影响的最终结果,反映了品种对干旱胁迫的敏感性,是品种抗旱性鉴定的可靠依据。前人利用抗旱系数对水稻[23]、糜子[24]、玉米[25]和花生[26]等作物进行抗旱性研究中,均以此作为抗旱性评价指标。本研究中就是基于生物量计算的抗旱系数来评价品种抗旱性的。在本实验中,干旱胁迫17d后,‘郑单958’和‘P3’2个品种的相对生物量没有显著差异,分别为37.6%、39.1%;复水之后,2个品种相对生物量均有所恢复,复水5d天后‘P3’相对生物量要明显高于‘郑单958’。说明本实验选用的2个品种虽然在正常供水条件下株高、地上部干重等方面存在明显差异,但干旱胁迫后期受抑制程度相同,同时在复水后具有不同的恢复能力,即这2个品种抗旱性相同,恢复能力不同,可以满足本研究的需要。
作物产量的形成,主要通过绿色植物叶片的光合作用,光合速率是植物生长和生产力形成的决定因素[27]。在较长时间和较为严重干旱胁迫下,光合结构遭到严重的破坏,植物的光合作用受到严重抑制是作物产量降低的最重要原因[28]。本研究中干旱处理17d后,2个品种的净光合速率值都接近零;复水后两品种的净光合速率都能明显恢复,但‘P3’恢复得更快,且在复水第3天,显著高于‘郑单958’。这一结果表明,‘P3’较强的旱后恢复能力可能是由于其在复水后光合系统可以更快的恢复。在水分胁迫下光合速率的降低主要是气孔的关闭导致气孔限制和光合结构的破坏、叶绿素的降解等导致的非气孔限制引起的[29-30]。本研究中,相较于‘郑单958’,‘P3’的气孔导度和蒸腾速率在复水后能更快恢复。说明复水过程中气孔导度的迅速恢复可能和‘P3’复水的恢复能力较强有关。同时,PSⅡ最大光化学效率(Fv/Fm)是PSⅡ在光合过程中潜在的最大光能转换效率,是胁迫条件下光系统受损伤程度的判定标准之一[31]。本研究中,旱后恢复能力较强的‘P3’在干旱17d后能够保持较高的PSⅡ最大光化学效率,并在复水过程中更快的恢复,说明前期的干旱对‘P3’的光系统损害程度较轻,复水后恢复较快。另外,叶绿素在植物进行光合作用时对光能的吸收和利用起着重要的作用,是植物进行光合作用的必要条件,叶绿素含量的高低直接影响光合能力。本研究中,在干旱胁迫后‘P3’能够保持较高的叶绿素含量,旱后复水过程中恢复能力更强。说明维持较高的叶绿素含量有利于作物光合作用的快速恢复。本实验中如果复水后保留一部分植株继续予以干旱处理,则能更好地说明复水对植株生长的补偿效应。但是由于胁迫程度已经相当严重,若继续干旱处理可能会导致植株死亡。
综上所述,2个玉米品种在干旱复水5d后各个光合参数都能恢复到与对照接近的水平,说明玉米旱后复水的恢复是一个相对较迅速的过程。虽然这一恢复过程较为迅速,但是不同的品种仍能表现出恢复能力的差异,并最终在复水后的生物量累积上表现出显著的差异,说明旱后复水的恢复能力对玉米应对干旱胁迫的影响也极为重要。‘P3’品种旱后恢复能力更强,对应的其在干旱胁迫后能维持较高的叶水势、Fv/Fm和叶绿素含量,说明在干旱过程中减轻干旱胁迫对玉米光系统的伤害仍然是旱后复水快速恢复的基础。而在复水后玉米能够快速修复前期干旱对光系统的损伤(表现在PSⅡ最大光化学效率迅速恢复)和恢复气孔导度,均有利于玉米光合速率的快速恢复,从而使玉米具有更强的旱后恢复能力。
[1] BOYER J S.Plant productivity and environment[J].Science,1982,218:443-448.
[2] WU P T(吴普特),ZHAO X N(赵西宁).Impact of climate change on agricultural water use and grain production in China[J].Transactions of the Chinese Society of Agricultural Engineering(农业工程学报),2010,26(2):1-6(in Chinese).
[3] CHAVES M M,OLIVEIRA M M.Mechanisms underlying plant resilience to water deficits:prospects for water-saving agriculture[J].Journal of Experimental Botany,2004,55(407):2 365-2 384.
[4] ZHAO L Y(赵丽英),DENG X P(邓西平),SHAN L(山 仑).A review on types and mechanisms of compensation effect of crops under water deficit[J].Chinese Journal of Applied Ecology(应用生态学报),2004,15(3):523-526(in Chinese).
[5] ACEVEDO E,HSIAO T C,HENDERSON D W.Immediate and subsequent growth responses of maize leaves to changes in water status[J].Plant Physiology,1971,48:631-636.
[6] ZHOU X Y(周雪英),DENG X P(邓西平).Effect of post-drought rewatering on leaf photosynthetic characteristics and antioxidation in different wheat genotypes[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2007,27(2):278-285(in Chinese).
[7] CORREIA B,et al.Water stress and recovery in the performance of two Eucalyptus globulus clones:physiological and biochemical profiles[J].Physiologia Plantarum,2014,150(4):580-592.
[8] ZAHO T H(赵天宏),SHEN X Y(沈琇英),YANG D G(杨德光).Effects on chlorophyll content and photosynthetic rate of maize leaves under water stress and rewatering[J].Horticulture &Seed(杂粮作物),2003,23(1):33-35(in Chinese).
[9] CHAVES M M,J S PEREIRA,J MAROCO,et al.How plants cope with water stress in the field?Photosynthesis and growth[J].Annals of Botany,2002,89(7):907-916.
[10] PASSIOURA J.The drought environment:physical,biological and agricultural perspectives[J].Journal of Experimental Botany,2007,58(2):113-117.
[11] DU CH Y(杜长玉),PANG Q G(庞全国),LI D M(李东明).The effect of drought in different growth stages of maize on yield and physi-ological indexes[J].Journal of Maize Sciences(玉米科学),2002,10:64-65(in Chinese).
[12] RIBAUT J M,JAVIER BETRAIV,PHILIPPE MONNEVEUX.Drought Tolerance in Maize,in Handbook of Maize:its Biology[M].Berlin:Springer,2009:311-344.
[13] BRUCE W B,EDMEADES G O,BARKER T C.Molecular and physiological approaches to maize improvement for drought tolerance[J].Journal of Experimental Botany,2002,53(366):13-25.
[14] ANJUM S A,et al.Morphological,physiological and biochemical responses of plants to drought stress[J].African Journal of Agricultural Research,2011,6(9):2 026-2 032.
[15] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[16] ZHANG L CH(张林春),HAO Y(郝 扬),ZHANG R H(张仁和).Response of drought and rewatering to leaf photosynthetic characteristics in different maize varieties[J].Acta Agriculturae Boreali-Occidentalis Sinica(西北农业学报),2010,19(5):76-80(in Chinese).
[17] SIDDIQUE M,HAMID A,ISLAM M.Drought stress effects on photosynthetic rate and leaf gas exchange of wheat[J].Botanical Bulletin of Academia Sinica,1999,40(2):141-145.
[18] KAMARA A,MENKIR A,BADU-APRAKU B,et al.The influence of drought stress on growth,yield and yield components of selected maize genotypes[J].The Journal of Agricultural Science,2003,141(1):43-50.
[19] DICKIN E,WRIGHT D.The effects of winter waterlogging and summer drought on the growth and yield of winter wheat(Triticum aestivumL.)[J].European Journal of Agronomy,2008,28(3):234-244.
[20] CHEN X Y(陈晓远),LUO Y P(罗远培).Compensatory efeets of water-recovery during different growth durations on winter wheat under water stress[J].Chinese Journal of Eco-Agriculture(中国生态农业学报),2002,10(1):35-37(in Chinese).
[21] BU L D(卜令铎),et al.The physiological mechanism of compensation effect in maize leaf by re-watering after draught stress[J].Acta Agriculturae Boreali-Occidentalia Sinica(西北农业学报),2009,18(2):88-92(in Chinese).
[22] HAO SH R(郝树荣),GUO X P(郭相平),ZHANG ZH Y(张展羽).Research progress on compensatory effects of crops in drought stress and rehydration[J].Advances in Science and Technology of Water Resources(水利水电科技进展),2009,29(1):81-84(in Chinese).
[23] HU B L(胡标林),YU SH W(余守武),WAN Y(万 勇),et al.Drought resistance identification of dongxiang common wild rice(Oryza rufipogon Griff.)in whole growth period[J].Acta Agronomica Sinica(作物学报),2007,33(3):425-432(in Chinese).
[24] LU G H(路贵和),DAI J R(戴景瑞),ZHANG SH K(张书奎),et al.Drought resistance of elite maize inbred lines in different water stress conditions[J].Acta Agronomica Sinica(作物学报),2005,31(10):1 284-1 288(in Chinese).
[25] LIU T P(刘天鹏),DONG K J(董孔军),HE J H(何继红),et al.Identification and evaluation on the drought resistance of broomcorn millet bred cultivars at germinating stage[J].Journal of Plant Genetic Resources(植物遗传资源学报),2014,15(4):746-752(in Chinese).
[26] LI G H(历广辉),ZHANG K(张 昆),LIU F ZH(刘风珍),et al.Morphological and physiological traits of leaf in different drought resistant peanut cultivars[J].Scientia Agricultura Sinica(中国农业科学),2014,47(4):644-654(in Chinese).
[27] ZHAO CH H(赵春华),MA G Q(马光泉).The correlation analysis of crop yield and photosynthesis[J].Agriculture &Technology(农业与技术),1997,(1):18-19(in Chinese).
[28] CHAVES M,FLEXAS J,PINHEIRO C.Photosynthesis under drought and salt stress:regulation mechanisms from whole plant to cell[J].Annals of Botany,2009,103(4):551-560.
[29] CORNIC G.Drought stress inhibits photosynthesis by decreasing stomatal aperture-not by affecting ATP synthesis[J].Trends in Plant Science,2000,5:187-188.
[30] HU L X,WANG Z L,HUANG B R.Diffusion limitations and metabolic factors associated with inhibition and recovery of photosynthesis from drought stress in a C-3perennial grass species[J].Physiologia Plantarum,2010,139:93-106.
[31] WOO N S,BADGER M R,POGSON B J.A rapid,non-invasive procedure for quantitative assessment of drought survival using chlorophyll fluorescence[J].Plant Methods,2008,4(1):27.
(编辑:裴阿卫)
Research on Rewatering Post-Drought Growth Recovery Capacity and Physiological Characteristics of Different Maize Varieties
CAO Dan1,2,CHEN Daoqian3,WU Xi1,2,YIN Lina1,4,DENG Xiping1,4,WANG Shiwen1,4*
(1State Key Laboratory of Soil Erosion and Dryland Farming on the Loess Plateau,Institute of Soil and Water Conservation,Chinese Academy of Sciences,and Ministry of Water Resources,Yangling,Shaanxi 712100,China;2University of Chinese Academy of Science,Beijing 100049,China;3College of Life Sciences,Northwest A&F University,Yangling,Shaanxi 712100,China;4Institute of Soil and Water Conservation,Northwest A&F University,Yangling,Shaanxi 712100,China)
In this study,to explore the relationship of post-drought recovery capacity and physiological and biochemical response during drought and rewatering,we selected two maize varieties,‘Zhengdan 958’and‘P3’with similar drought resistance but different resilience as experiment materials.The changes of growth,water status,photosynthetic parameters,chlorophyll fluorescence parameters and chlorophyll content were studied with potted experiment during drought and rewatering at seedling stage.The results indicated that:(1)the two maize varieties showed similar drought resistance,but significantly different growth recovery capacity.(2)The leaf water content of‘Zhengdan 958’and‘P3’demonstrated no significance during the drought period,but‘P3’maintained higher water potential,maximal efficiency of PSⅡphoto-chemistry and chlorophyll content under drought conditions.(3)The recovery rate of photosynthetic rate,maximal efficiency of PSⅡphotochemistry and stomatal conductance of‘P3’was quicker than that of‘Zhengdan 958’after drought and rehydration.Research showed that the photosynthetic loss recovery capacity of‘P3’was higher than that of‘Zhengdan 958’.The reason why the recovery capability of‘P3’was stronger is because it can maintain higher Fv/Fmand chlorophyll content under drought,and the damage of photosynthetic systems was lighter,and also because the recovery was faster than‘Zhengdan 958’after rehydration.These results revealed that reducing damage of drought stress on plant photosynthetic systems is the basis of rapid recovery after rewatering,and the rapid of damaged photosynthetic systems to accelerate the recovery of plant after rewatering.
maize;drought;rewatering;post-drought recovery capacity;photosynthetic rate
Q945.79
A
10.7606/j.issn.1000-4025.2015.06.1222
1000-4025(2015)06-1222-07
2014-12-07;修改稿收到日期:2015-06-03
国家自然科学基金(31101597);中国科学院西部之光项目
曹 丹(1990-),女,在读硕士研究生,主要从事旱地作物生理生态的研究。E-mail:nadoaixoac@163.com
*通信作者:王仕稳,副研究员,主要从事植物生理生态以及分子生物学研究。E-mail:shiwenwang@nwsuaf.edu.cn
