乳腺癌保乳术后调强放疗的疗效及可行性分析
2015-06-27王留洋陈泽慧
王留洋, 陈泽慧
(周口市中医院 肿瘤科,河南 周口 466002)
乳腺癌保乳术后调强放疗的疗效及可行性分析
王留洋, 陈泽慧
(周口市中医院 肿瘤科,河南 周口 466002)
目的 探讨乳腺癌保乳术后调强放疗(IMRT)的疗效及可行性。方法 回顾性分析81例左侧乳腺癌保乳术后患者的临床资料及随访记录,将采用三维适形放疗(3D-CRT)的43例设为3D-CRT组,采用IMRT放疗的38例设为IMRT组,对比两组癌肿控制疗效及不良反应。结果 IMRT组局部控制率、存活率均略高于3D-CRT组,复发率、远处转移率均略低于3D-CRT组,差异无统计学意义(P>0.05),IMRT组不良反应发生率低于3D-CRT组,差异有统计学意义(P<0.05)。结论 IMRT与3D-CRT控制乳腺癌肿效果无明显差异,但IMRT不良反应低,临床可行性优于3D-CRT。
乳腺癌;保乳手术;调强放疗;适形放疗
保乳术联合放疗是早期乳腺癌患者最易接受的治疗方式,术后患者生存状态与术后放疗技术密切相关。笔者回顾性分析2008年6月-2013年6月收治的81例左侧乳腺癌保乳术后患者的临床资料及随访记录,探讨乳腺癌保乳术后调强放疗(intensity modulated radiation therapy,IMRT)的疗效及可行性,现总结报道如下。
1 资料与方法
1.1 一般资料 周口市中医院肿瘤科2008年6月-2013年6月收治的81例乳腺癌保乳术后患者的临床资料及随访记录,所有患者参考《中国抗癌协会乳腺癌诊治指南与规范(2007版)》[1]确诊并分期,排除胸部既往有手术、外伤、放疗史及伴严重肝、肾、肺疾病及心脏疾病者,将采用三维适形放疗(three dimensional conformal RT,3D-CRT)放疗的43例设为3D-CRT组,采用IMRT放疗的38例设为IMRT组。3D-CRT组:年龄34~57(41.7±5.1)岁;TNM分期:Ⅰ期32例,Ⅱ期11例。IMRT组:年龄37~59(42.3±4.9)岁;TNM分期:Ⅰ期28例,Ⅱ期10例。两组患者年龄、TNM分期等一般资料差异无统计学意义,具有可比性(P>0.05)。
1.2 治疗方法 两组患者均于仰卧、平静自由呼吸情况下进行CT定位扫描后传送至三维放射治疗系统,应用Precise软件勾画临床靶区并设计全乳放疗计划,乳腺实质外放5mm作为计划靶区,皮肤方向不外放,采用6MV-X射线照射,靶区剂量50 Gy/25次,瘤床加量10 Gy,1次/d,5次/周。3D-CRT组采用切线对穿野,在主野方向加2~4个子野分布照射,IMRT组采用切线野方向适行视野,以剂量体积直方图对靶区和危及器官剂量权重进行优化。
1.3 观察指标 参考CTCAEv3.0分级标准[2]观察两组患者放疗期间出现放射性肺损伤、皮肤损伤、心脏病、乳房疼痛、骨髓抑制等不良反应,仅统计Ⅱ级及以上需对症治疗者;观察随访结束时癌肿控制疗效[1](局部控制:癌肿无复发无转移;复发:癌肿原病灶或左侧胸壁、腋窝淋巴结等再次出现癌肿;远处转移:原癌肿病灶外转移;存活:未因癌肿及相关不良反应死亡)。

2 结果
2.1 两组癌肿控制疗效对比 IMRT组局部控制率、存活率均略高于3D-CRT组,复发率、远处转移率均略低于3D-CRT组,差异无统计学意义(P>0.05)。见表1。
2.2 两组不良反应对比 两组均未因不良反应而中止放疗,IMRT组心脏病、乳房疼痛、皮肤损伤等发生率均明显低于3D-CRT组,差异有统计学意义(P<0.05)。见表2。
表1 两组癌肿控制疗效对比
注:与3D-CRT组对比,1)P>0.05。
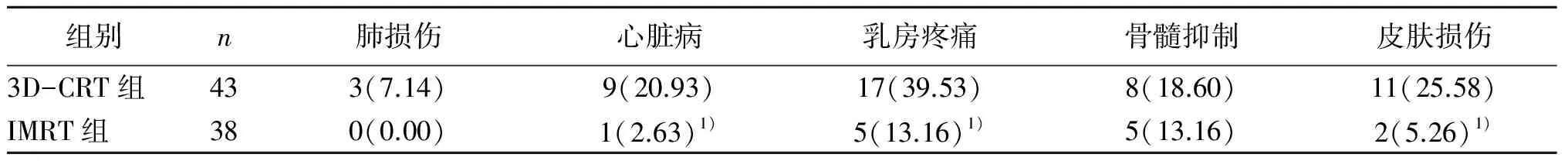
表2 两组不良反应对比[n(%)]
注:与3D-CRT组对比,1)P>0.05。
3 讨论
育龄妇女是乳腺癌的高发人群,多数患者有乳房生理功能及美容方面的需求,保乳术联合放疗治疗早期乳腺癌患者的无瘤生存率及存活率与根治术相近[3],因此已经成为早期乳腺癌的首选治疗措施。放疗是乳腺癌患者行保乳术后必须进行的后续治疗,是控制癌肿复方的关键步骤之一,但由于乳腺外形及分布不规则,常规两野放疗技术难以均匀分布靶区剂量,易出现不良反应而影响患者生活质量,因此近年来3D-CRT和IMRT成为主流放疗技术。
3D-CRT可根据CT扫描结果勾画的靶区均匀、无缝分布各视野剂量,减少对心、肺及对侧乳腺等器官、组织的照射剂量,降低相关不良反应。张烨等[4]2010年对国内396家综合医院进行统计分析发现,约51.8%已经开展了3D-CRT,说明2010年3D-CRT已经成为我国保乳术后主要的化疗技术。随着3D-CRT广泛应用,临床发现其相关不良反应虽然较常规放疗明显减少,但邻近危及器官的不良反应仍然较高,尤其左侧乳腺癌患者,心脏损伤尤为突出。放疗诱发的心脏病与心脏受照射的体积及剂量关系最为密切,3D-CRT为优化乳腺靶区的剂量分布而难以顾及心脏受照射的面积及剂量[5],因此其出现心脏损伤的风险更大,尤其大乳房患者更为严重。
IMRT与3D-CRT一样基于三维放射治疗平台,采用逆向算法,射野与靶区基本一致,且可调节强度及剂量分布,确定更为恰当的治疗弧或治疗野数,其靶区适形度、剂量均匀度较3D-CRT更为优良[6],因此不良反应更少,故近年来逐渐有取代3D-CRT的趋势。IMRT顺利实施的关键是保证临床靶区不脱靶,虽然自由呼吸对临床靶区的影响基本可以忽略,但对于呼吸不规则、运动度较大的患者其仍有一定影响[7],因此在临床靶区外小量外放5 mm以修正误差。
本研究显示,IMRT组癌肿控制疗效仅略高于3D-CRT组,但心脏病、乳房疼痛、皮肤损伤等不良反应发生率均明显低于3D-CRT组,提示IMRT与3D-CRT控制乳腺癌肿效果基本相当,但IMRT不良反应更低,具有更好的可行性。
[1] 中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2007版)[J].中国癌症杂志,2007,17(5):410-428.
[2] Trotti A,Colevas AD,Setser A,et a1.CTCAE v3.0:development of a comprehensive grading system for the adverse effects of cancer treatment[J].Semin Radiat Oncol,2003,13(3):176-181.
[3] 彭明尧,周雪宇,何兴平,等.早期乳腺癌保乳术后三维适型放疗疗效及美乳效果分析[J].四川医学,2012,33(5):869-870.
[4] 张 烨,惠周光,张江鹄,等.中国大陆地区乳腺癌保乳术后放疗现状调查分析[J].中华放射肿瘤学杂志,2012,21(3):241-246.
[5] 丁 喆,夏新舍,叶红强,等.左侧乳腺癌保乳术后三维适形放疗与常规放疗的剂量学比较[J].宁夏医科大学学报,2012,34(12):1 297-1 299.
[6] 艾秀清,木克代斯·拜克提亚尔,韩有溪,等.乳腺癌根治术后三维调强放疗与三维适形放疗剂量学比较及不良反应观察[J].临床和实验医学杂志,2014,13(5):365-368.
[7] 王 玮,李建彬,胡宏光,等.自由呼吸状态下三维CT和四维CT极限时相全乳正向调强放疗治疗计划的比较[J].中华肿瘤杂志,2012,34(10):759-763.
[责任编校:张亚光]
2014-10-27
王留洋(1981-),男,河南省周口市人,本科,放射医学技师,从事肿瘤放射治疗工作。
R 730.5;R737.9
B
1008-9276(2015)04-0459-02
