NF-κB和TGF-β1在大鼠IgAN纤维化进展中的作用及机制研究
2015-06-27黄燕萍赵文静马丹萍
黄燕萍,高 娜,王 祥,赵文静,孙 艳,马丹萍,刘 丽
(1.西安交通大学第一附属医院儿科,陕西 西安 710061;2.陕西省人民医院儿科,陕西 西安710068;3.莱州市人民医院,山东 莱州261400;4.西安市中心医院,陕西 西安710003)
NF-κB和TGF-β1在大鼠IgAN纤维化进展中的作用及机制研究
黄燕萍1,高 娜2,王 祥3,赵文静4,孙 艳4,马丹萍1,刘 丽1
(1.西安交通大学第一附属医院儿科,陕西 西安 710061;2.陕西省人民医院儿科,陕西 西安710068;
3.莱州市人民医院,山东 莱州261400;4.西安市中心医院,陕西 西安710003)
目的 探讨核转录因子-κB(NF-κB)和转化生长因子-β1(TGF-β1)在IgA肾病(IgAN)纤维化进展中的作用及意义;观察大蒜素对IgAN的治疗作用,并探究其可能的治疗机制。方法 选择健康雌性SD大鼠32只,随机抽取8只作为正常对照组,其余24只建立IgAN纤维化模型。干预前,再将24只IgAN纤维化模型组大鼠随机分为模型对照组、高剂量大蒜素治疗组和低剂量大蒜素治疗组,每组8只。分别于不同时间点收集大鼠尿液、血液以检测尿蛋白定量、血清肌酐含量;用ELISA法检测血清中NF-κB和TGF-β1的浓度;取肾组织分别做普通光镜染色及免疫荧光检查。结果 ①成功建立了IgAN纤维化大鼠模型;②NF-κB和TGF-β1在IgAN纤维化进展中血清浓度进行性增高,二者呈线性正相关(干预14天:r=0.983,P<0.01;干预28天:r=0.849,P<0.01),且分别与临床检测指标24小时尿蛋白定量、血肌酐均具有正相关性(NF-κB与24小时尿蛋白定量:干预14天r=0.524,干预28天r=0.871;NF-κB与血肌酐:干预14天r=0.622,干预28天r=0.776,均P<0.05。TGF-β1与24小时尿蛋白定量:干预14天r=0.521,干预28天r=0.815;TGF-β1与血肌酐:干预14天r=0.643,干预28天r=0.869,均P<0.05);③大蒜素可以降低IgAN纤维化大鼠尿蛋白定量和血肌酐水平,减少、减轻肾脏病理损伤,降低血清中NF-κB和TGF-β1的浓度水平。结论 该课题在国内首次成功建立了IgAN纤维化大鼠模型;血清NF-κB和TGF-β1的水平变化可以作为动态评价IgAN纤维化进展的指标;大蒜素能降低尿蛋白定量、血肌酐水平,减轻病理损伤,降低血清中NF-κB和TGF-β1的浓度水平,可能是通过抑制NF-κB活化、下调TGF-β1浓度水平的机制而达到延缓IgAN纤维化进展的目的。
IgA肾病;纤维化;核转录因子-κB;转化生长因子-β1;大蒜素
IgA肾病(IgA nephropathy,IgAN)是全世界范围内最常见的原发性肾小球疾病,也是儿童时期最常见的原发性肾小球疾病之一,约20%~40%的患者最终进展为终末期肾病(end-stage renal disease,ESRD)[1]。IgAN可发生在任何年龄阶段,但高发病率在儿童和青年是一种终生性疾病,需要对病情进行动态评估。肾活检作为有创性检测不易反复进行,寻找到可以预测IgAN进展的无创便捷的检测方法,并及时有效地给予靶向性的治疗措施势在必行。NF-κB是一种多功能的转录因子,其异常激活可导致异常炎症反应和自身免疫反应;转化生长因子-β1(TGF-β1)是全球公认的致纤维化因子,广泛存在于各种细胞中,二者均具有广泛生物学效应。大蒜素是一种较好的免疫调节剂,具有抗炎、抗纤维化、抗肿瘤、抗氧化应激、提高机体免疫功能等多种功效。
本实验通过建立IgAN纤维化大鼠模型,探讨NF-κB和TGF-β1在IgAN纤维化进展中的作用及意义;另一方面,采用大蒜素干预,观察大蒜素对于IgAN纤维化大鼠的治疗效果,同时探究其对IgAN纤维化可能的治疗机制,为临床对于IgAN进展的机制研究及治疗提供新思路。
1 材料与方法
1.1 实验动物与分组
健康、雌性、清洁级SD大鼠32只,鼠龄6周龄,体重在160~180g,由西安交通大学医学院实验动物中心提供。随机抽取8只作为正常对照组,其余24只建立IgAN纤维化模型。干预前,再将24只IgAN纤维化模型组大鼠随机分为模型对照组、高剂量大蒜素(山东鲁抗辰欣制药)治疗组和低剂量大蒜素治疗组,每组8只。正常对照组、模型对照组、高剂量及低剂量大蒜素治疗组,分别给予生理盐水、大蒜素(60mg/kg)、大蒜素(40mg/kg)灌胃,每日1次,持续4周。
1.2 方法
1.2.1 IgA肾病纤维化大鼠模型的建立
参考汤颖等[2]报告的IgAN改良方法加以改进,运用牛血清白蛋白(BSA,美国Amresco公司)、四氯化碳(CCl4,西安化学试剂厂)及脂多糖(LPS,美国Sigma公司)的方法建立实验性IgAN大鼠模型。具体方案为:将BSA以蒸馏水配成100g/L浓度(400mg/kg),自实验第1天起,隔日灌胃,持续9周;CCl4皮下注射(CCl4 0.1mL+蓖麻油0.1mL),自实验第1周末起,每周1次,持续9周;联合LPS(0.05mg/只),分别于实验第6、8周末,尾静脉注射1次。正常对照组给予与纤维化模型组等量蒸馏水隔天灌胃,持续9周;皮下注射氯化钠溶液0.2mL,每周1次,持续9周;分别于第6、8周末尾静脉注射1次氯化钠溶液0.2mL。
第10周起实施单侧输尿管梗阻(UUO)术:用10%水合氯醛溶液腹腔注射麻醉,沿左侧腹直肌外缘依次切开进入,暴露腹腔,在左侧输尿管近肾盂段,取4-0号手术缝线于输尿管中上段结扎两道,并从中间离断。肠管复位后逐层缝合。术后肌注青霉素抗感染3天,并置于术前相同饲养条件下饲养。正常对照组:第10周实施假手术,仅分离,不结扎和剪断左侧输尿管。术后给予肌注青霉素抗感染3天,并在与术前相同的饲养条件下饲养。
1.2.2 临床指标检测
①采用代谢笼收集干预前、干预14天、干预28天的尿液,并记录24小时尿量,予24小时尿蛋白定量检测;②采用毛细采血管內眦取血法于干预前、干预14天、干预28天收集血液,予肾功能检查(血清肌酐)。
1.2.3 血清核转录因子-κB和转化生长因子-β1检测
收集的血液取上清血清分装,-80℃保存,采用ELISA法分别检测大鼠血清NF-κB和TGF-β1水平,ELISA试剂盒购自北京博奥森生物技术有限公司。
1.2.4 肾组织病理学检查
①光镜检查:在实验干预28天时处死大鼠,切取部分肾组织甲醛固定,石蜡包埋,常规切片,行苏木精-伊红染色法(hematoxylin-eosin staining,HE染色法)、三色胶原染色(Masson trichrome,Masson染色);②免疫荧光观察:新鲜大鼠肾组织取出液氮速冻,以组织包埋剂OCT包埋置于-70℃冰箱保存,采用直接免疫荧光法检测肾小球IgA沉积强度(羊抗大鼠IgA抗体,北京博奥森生物技术有限公司)。IgA沉积免疫荧光强度的判定参照目前国内外通用的5级半定量法(-~++++):低倍镜下不显示、高倍镜下似乎可见为-;低倍镜下似乎可见、高倍镜下可见为+;低倍镜下可见、高倍镜下清晰可见为++;低倍镜下清晰可见、高倍镜下耀眼为+++;高倍镜下刺眼为++++。
1.3 统计学方法

2 结果
2.1 各组大鼠肾脏大体观比较
干预28天时,除正常对照组外,其余各组大鼠肾脏外观呈现出不同变化,模型对照组肾脏体积较前明显增大,皮质变薄,肾积水明显;高剂量大蒜素治疗组与模型对照组相比较,肾脏体积相当,但切开后高剂量组皮质稍厚于模型对照组,明显薄于低剂量组,有中等量积水;而低剂量组的肾脏外观较正常对照组稍大,切开后皮质较薄,仍有少至中量积水,见图1。

注:1为异常肾组织;2为正常肾组织。
图1 各组肾脏大体观比较
Fig.1 Comparison of the general view of kidneys among each group
2.2 干预28天光镜下肾组织形态学改变
2.2.1 苏木精-伊红染色情况
光镜下正常对照组肾小球体积正常,系膜基质未见增生,系膜细胞无明显增加,肾小管结构正常;模型对照组肾小球肿胀,系膜基质中至重度增生,系膜细胞增多,偶见球囊壁粘连,部分肾小管周围水肿、空泡样变,肾皮质变薄,肾小管上皮细胞萎缩、管腔扩张,大部分视野中肾间质增宽明显,间质可见炎症细胞浸润;高、低剂量大蒜素治疗组与模型对照组病理形态改变相似,只是病变较模型对照组均有不同程度减轻,以低剂量组减轻为著,见图2。
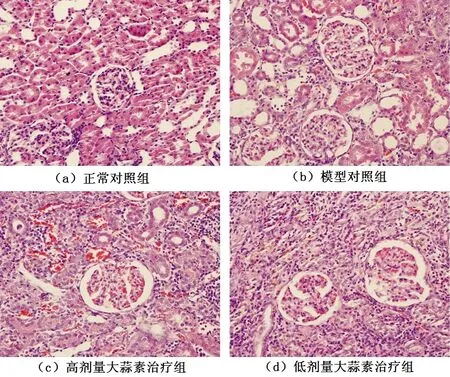
图2 各组大鼠HE染色结果(×400)
Fig.2 HE staining results of each group(×400)
2.2.2 三色胶原染色结果
正常对照组未见明显蓝色胶原纤维沉积;模型对照组间质纤维化表现突出,蓝色胶原纤维沉积明显;高、低剂量大蒜素治疗组:蓝色胶原纤维沉积明显,与模型对照组病理改变类似,但肾间质和肾小管病变较模型对照组均有不同程度减轻,以低剂量组减轻为著,见图3。

图3 各组大鼠Masson染色结果(×400)
Fig. 3 Masson staining results of each group(×400)
2.3 免疫荧光强度对比
干预28天荧光显微镜下观察,正常对照组大鼠肾小球系膜区未见IgA沉积;各IgAN纤维化模型组大鼠系膜区有颗粒状或黄绿色团块IgA沉积,其荧光强度大多为+++~++++。
与模型对照组相比,高、低剂量大蒜素治疗组IgA沉积的荧光强度有不同程度减弱;而高、低剂量大蒜素治疗组间比较荧光强度程度相当,见表1、图4。
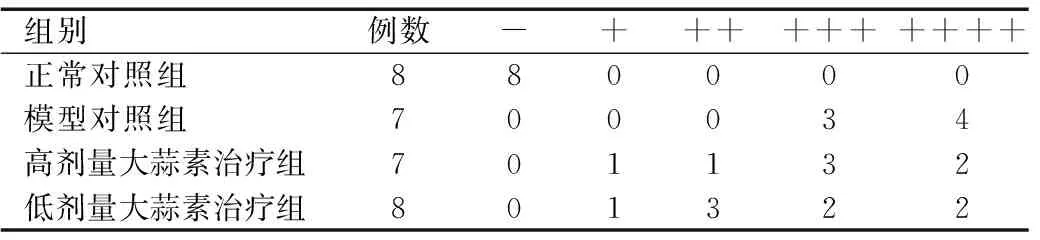
表1 干预28天各组大鼠IgA免疫荧光定量(n)

图4 各组大鼠肾小球IgA沉积强度(免疫荧光×400)
Fig. 4 Glomerular IgA deposition strength of each group (Immunofluorescence×400)
2.4 各组大鼠蛋白尿、肾功能变化情况
干预前,与正常对照组相比,各IgAN纤维化模型组大鼠24小时尿蛋白定量明显增高,差异均有统计学意义(正常对照组与模型对照组:t=4.633,P=0.000;正常对照组与高剂量组:t=6.941,P=0.000;正常对照组与低剂量组:t=4.587,P=0.000),模型建立成功。
干预14天,各IgAN纤维化模型组24小时尿蛋白定量均升高,三者之间两两比较差异均无统计学意义(模型对照组与高剂量组:t=1.385,P=0.177;模型对照组与低剂量组:t=0.258,P=0.799;高剂量组与低剂量组:t=1.563,P=0.129)。
干预28天,与模型对照组相比,高、低剂量大蒜素治疗组的24小时尿蛋白定量升高水平有所降低,差异均有统计学意义(模型对照组与高剂量组:t=4.364,P=0.000;模型对照组与低剂量组:t=6.341,P=0.000),但高、低剂量组之间比较差异无统计学差异(t=1.987,P=0.058),见表2。
表2 各组大鼠24小时尿蛋白定量比较
注:★表示与正常对照组比较P<0.05,■表示与模型对照组比较P<0.05。
干预前,与正常对照组相比,各IgAN纤维化模型组大鼠血肌酐水平进行性升高,差异均有统计学意义(正常对照组与模型对照组:t=10.412,P=0.000;正常对照组与高剂量组:t=9.241,P=0.000;正常对照组与低剂量组:t=9.315,P=0.000),模型建立成功。
干预14天,各IgAN纤维化模型组大鼠血肌酐水平进行性升高,但3组之间两两比较差异均无统计学意义(模型对照组与高剂量组:t=1.988,P=0.057;模型对照组与低剂量组:t=1.990,P=0.058;高剂量组与低剂量组:t=0.526,P=0.063)。
干预28天,各IgAN纤维化模型组大鼠血肌酐水平开始略有下降,以低剂量大蒜素治疗组下降较为突出,3组之间两两比较差异仍无统计学意义(模型对照组与高剂量组:t=2.533,P=0.017;模型对照组与低剂量组:t=2.504,P=0.015;高剂量组与低剂量组:t=0.955,P=0.348),见表3。

表3 各组大鼠血肌酐含量比较
注:★表示与正常对照组比较P<0.05。
2.5 血清核转录因子-κB和转化生长因子-β1水平的变化
干预前,与正常对照组比较,各IgAN纤维化模型组大鼠血清中NF-κB、TGF-β1的浓度均明显升高,差异均有统计学意义(NF-κB:正常对照组与模型对照组t=3.569,P=0.002;正常对照组与高剂量组t=2.359,P=0.027;正常对照组与低剂量组t=3.595,P=0.001。TGF-β1:正常对照组与模型对照组t=6.750,P=0.000;正常对照组与高剂量组t=11.910,P=0.000;正常对照组与低剂量组:t=11.529,P=0.000)。
干预14天时,高、低剂量大蒜素治疗组的血清NF-κB、TGF-β1浓度升高水平较模型对照组相比有所降低,差异均有统计学意义(NF-κB:模型对照组与高剂量组t=6.917,P=0.000;模型对照组与低剂量组:t=7.022,P=0.000。TGF-β1:模型对照组与高剂量组t=7.651,P=0.000;模型对照组与低剂量组t=7.411,P=0.000);而高、低剂量组之间比较差异均无统计学意义(NF-κB:高剂量组与低剂量组:t=0.500,P=0.621;TGF-β1:高剂量组与低剂量组:t=0.197,P=0.846)。
干预28天时,高、低剂量大蒜素治疗组的血清NF-κB和TGF-β1浓度升高水平仍低于模型对照组,差异均有统计学意义(NF-κB:模型对照组与高剂量组t=9.176,P=0.000;模型对照组与低剂量组t=11.818,P=0.000。TGF-β1:模型对照组与高剂量组t=2.557,P=0.016;模型对照组与低剂量组:t=6.762,P=0.000);且高、低剂量组之间比较差异也均有统计学意义(NF-κB:高剂量组与低剂量组t=2.642,P=0.013。TGF-β1:高剂量组与低剂量组:t=4.204,P=0.000)。见表4、表5。
2.6 血清中核转录因子-κB和转化生长因子-β1浓度水平的相关性分析
大蒜素干预14、28天时,IgAN纤维化大鼠血清中NF-κB的浓度水平与TGF-β1的浓度水平趋势相一致。经Spearman相关性分析显示,NF-κB与TGF-β1之间呈正线性相关。干预14天的相关系数r=0.983,P<0.01;干预28天的相关系数r=0.849,P<0.01。
2.7 血清中核转录因子-κB和转化生长因子-β1浓度水平与临床指标的相关性分析
经Spearman相关性分析显示,IgAN纤维化大鼠血清中NF-κB和TGF-β1的浓度水平分别与临床检测指标(尿蛋白定量、血肌酐)的水平呈正相关性(均P<0.05),见表6和表7。
表4 各组大鼠血清NF-κB浓度的比较
注:★表示与正常对照组比较P<0.05,■表示与模型对照组比较P<0.05,◆表示与高剂量大蒜素治疗组比较P<0.05。

表5 各组大鼠血清TGF-β1水平比较
注:★表示与正常对照组比较P<0.05,■表示与模型对照组比较P<0.05,◆表示与高剂量大蒜素治疗组比较P<0.05。
表6 大鼠血清NF-κB的表达与临床检测指标的相关性分析
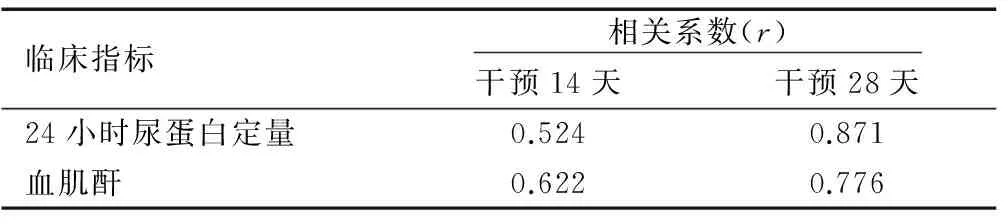
Table 6 Correlation analysis of serum NF-κB expression and clinical detection indexes
表7 大鼠血清TGF-β1的表达与临床检测指标的相关性分析

Table 7 Correlation analysis of serum TGF-β1 expression and clinical detection indexes
3 讨论
3.1 IgA肾病纤维化动物模型的建立
由于人体肾活检所取标本仅限于诊断,探索理想的动物模型对于IgAN纤维化进展的研究显得颇为重要。IgAN是逐渐进展至ESRD的,而实际进行动物研究达不到如此长的时间,因此,本实验在IgAN动物模型建立的基础上,再实施UUO,以期加快IgAN的进展速度,最终建立成一个在IgAN基础上进展至ESRD的大鼠模型——IgAN纤维化模型。本实验采用的第1部分IgAN动物模型是一个目前研究较为成熟的免疫诱导[2]动物模型,而UUO动物模型[3]是一个以进行性肾间质纤维化为病理特点的肾病模型,鉴于该动物模型并不直接产生蛋白尿,也不出现急性肾功能衰竭,所以排除了蛋白尿和尿毒症毒素对实验结果的影响。与IgAN动物模型也不会出现相互干扰。
本研究中IgAN纤维化模型将IgAN模型与UUO模型巧妙结合,通过前期预实验经肾组织病理证实,该模型既有IgAN的病理特征,又较快的出现了纤维化的改变。不仅不妨碍原有模型的建立,而且对于研究IgAN的进展机制提供了良好的思路,以便及早采取靶向性干预措施,延缓IgAN的纤维化进展。
3.2 血清中核转录因子-κB和转化生长因子-β1在IgA肾病进展中的作用及机制
NF-κB是一种多功能转录因子,广泛存在于各种细胞中,在各种因子之间的作用网络中起中心调控作用。NF-κB[4]参与免疫反应、生长控制、信号转导、细胞分化、调控多种基因的表达,其异常激活与抑制势必将启动不正常的炎症反应和自身免疫反应,引起疾病的发生与变化。NF-κB可以被多种细胞外信号刺激[5],使得胞质内的NF-κB活化,比如:生长因子、细胞因子(TNF-α等)、免疫刺激剂、脂多糖(LPS)活性氧自由基及紫外线等。NF-κB激活后可以引起各种炎性细胞因子、生长因子,如TGF-β1、单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)等的释放和表达增加,而且TGF-β1等作为其调控产物通过正反馈途径又能够激活NF-κB,其意味着病理损伤下存在一个放大的延续环路调节通路。另外,NF-κB还参与调节诱导性一氧化氮合酶(iNOS)的基因表达,iNOS分布于肾小球系膜细胞、内皮细胞及小管上皮细胞的胞浆中,在内毒素等刺激下合成过量的NO,从而扩张小动脉,引起肾小球高滤过及高压,造成肾小球硬化。
研究证实,在IgAN患者的肾组织中发现细胞内的信号激活可以引起全身氧化应激反应,目前已较为明确,氧化应激可以激活NF-κB,进一步导致系膜细胞的异常增殖和分泌大量炎症因子、纤维化因子等,如:TGF-β1等,激活单核巨噬系统产生炎症。另外,在IgAN发生及进展过程中,肾素血管紧张素系统(renin-angiotensin system,RAS)引起肾脏局部血流动力学的改变,并可见激活NF-κB,进一步增强分泌大量炎症因子,如:TGF-β1等。
血管紧张素原Ⅱ(AngⅡ)基因是NF-κB作用的靶位之一,TGF-β1基因可以被AngⅡ激活。TGF-β1在体内刺激分泌多种细胞因子,是国内外研究最多的致纤维化生长因子,它介导了上皮细胞分化、成纤维细胞增殖及细胞外基质(extracellular matrix,ECM)合成等多个环节。它通过以下4种途径促进ECM的沉积[6-7]:增加ECM的蛋白合成;减少ECM降解;促使ECM受体整合素增加,使细胞与基质之间粘附增强;而且,TGF-β1具有自我诱生作用,即在所损伤部位再释放TGF-β1可诱导细胞产生更多的TGF-β1,从而放大其生物学效应。在肾纤维化的过程中,TGF-β1主要通过调节诱导肾小管上皮细胞向肌成纤维细胞转化,调控αalpha-smooth muscle actin,α-SMA)的表达,参与ECM的生成和沉积,促进炎性细胞的浸润及诱导细胞凋亡,参与肾间质纤维化过程。
本实验研究发现,随着IgAN纤维化的进展,各IgAN纤维化模型组大鼠血清NF-κB和TGF-β1的浓度水平进行性增高,且二者分别与临床检测指标(尿蛋白定量、血肌酐之间呈正相关(均P<0.05);而TGF-β1和NF-κB二者之间也呈正线性相关。由此可以推测:NF-κB和TGF-β1可以作为评价IgAN纤维化进展情况的动态观察指标;而且,在IgAN纤维化进展中,NF-κB起着中心调控作用,TGF-β1起着推动纤维化进展的作用,二者相互协同、相互作用,可能共同参与IgAN的纤维化进展机制。
3.3 大蒜素对IgA肾病的治疗作用及其可能的治疗机制
大蒜素具有结构简单、易得易合成、生物活性明显、治疗范围广泛、不良副反应小的特点。从本实验结果中可以看出,大蒜素可以降低IgAN纤维化大鼠的尿蛋白定量、血肌酐水平,减少IgA或以IgA为主的免疫复合物的沉积,减轻肾脏病理损伤改变,延缓IgAN纤维化进展。大蒜素还可以降低血清中NF-κB和TGF-β1的浓度水平,以低剂量效果为佳,从而对IgAN肾脏起治疗保护作用。鉴于大蒜素具有多种生物学功效[8-9],如:抗炎症、抗氧化及抗纤维化等,且原料易得易合成,结合本实验的研究结果,推测可能的作用机制为:大蒜素的抗炎、抗纤维化及抗氧化应激等作用,使得刺激NF-κB活化的细胞外信号减少,抑制了NF-κB的活化,从而引起各种炎性细胞因子,如TGF-β1、白介素(IL)-1、MCP-1等的释放和表达减少,肾组织损伤减轻。TGF-β1是目前全球公认的致纤维化因子,在IgAN的发生及进展中起着绝对的推动作用,它参与IgAN肾间质纤维化过程的多个环节。大蒜素在抗纤维化等方面效果显著,可以通过下调TGF-β1的浓度水平,以达到抗纤维化的目的,但具体机制仍不是非常明确。因此推测其中的机制,一方面可能与大蒜素抑制TGF-β1的信号通路转导[10]有关;另一方面,可能与TGF-β1和其他炎症及纤维化因子的相互作用相关。
综上所述,大蒜素在治疗IgAN纤维化进展中,可以明显改善IgAN纤维化大鼠的临床症状、减少肾小球免疫复合物的沉积,减轻病理损伤;而且,大蒜素可能通过抑制NF-κB的活化、下调TGF-β1的浓度水平以延缓IgAN纤维化进展。IgAN为慢性进展性疾病,其中涉及多种机制共同作用,NF-κB和TGF-β之间相互因果关系及在IgAN中更深层次的机制研究以及大蒜素的治疗机制,还有待进一步深入研究。
[1]Barbour S J, Reich H N.Risk stratification of patients with IgA nephropathy[J].Am J Kidney Dis,2012,59(6):865-873.
[2]汤颖,娄探奇,成彩联,等.实验性IgA肾病模型的改进[J].中山大学学报(医学科学版),2006,27(2):184-187.
[3]Chevalier R L, Forbes M S, Thornhill B A.Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy[J].Kidney Int,2009,75(11):1145-1152.
[4]Silva G E, Costa R S, Ravinal R C,etal.NF-κB expression in IgA nephropathy outcome[J].Dis Markers,2011,31(1):9-15.
[5]赵辉.核因子-κB在眼科疾病中的研究进展[J].首都医药,2013,(6):19-21.
[6]Pardali E, Goumans M J, ten Dijke P.Signaling by members of the TGF-beta family in vascular morphogenesis and disease[J].Trends Cell Biol,2010,20(9):556-567.
[7]余学清.TGF-β/smads与腹膜纤维化及调节机制系列研究[J].中山大学学报(医学科学版),2010,31(2):161-165.
[8]李贵玲,刘根焰,陈寅,等.大蒜素联合不同药物对多重耐药鲍曼不动杆菌的体外抗菌作用[J].中国临床药理学杂志,2011,27(10):752-754.
[9]田寅,李壮,周昱,等.大蒜素对肝纤维化大鼠肝脏中TIMP-1、Smad4表达的影响[J].黑龙江医药科学,2013,36(5):85-86.
[10]曾玉兰,冷凡.大蒜素对肺纤维化大鼠肺组织α-SMA和TGF-β1表达的影响[J].中国现代医学杂志,2011,21(15):1814-1818.
[专业责任编辑:潘凯丽]
Role and mechanism of NF-κB and TGF-β1 in the progression of IgA nephropathy fibrosis
HUANG Yan-ping1, GAO Na2, WANG Xiang3, ZHAO Wen-jing4, SUN Yan4, MA Dan-ping1, LIU Li1
(1.DepartmentofPediatrics,FirstAffiliatedHospitalofXi’anJiaotongUniversity,ShaanxiXi’an710061,China;
2.DepartmentofPediatrics,ShaanxiProvincialPeople’sHospital,ShaanxiXi’an710068,China;
3.LaizhouCityPeople’sHospital,ShandongLaizhou261400,China; 4.CentralHospitalofXi’an,ShaanxiXi’an710003,China)
Objective To investigate the role and significance of nuclear factor kappa B (NF-κB) and transforming growth factor-β1(TGF-β1) in IgA nephropathy (IgAN) fibrosis progression, and to observe therapeutic effect of allicin for IgAN as well as its possible therapeutic mechanism. Methods Of 32 healthy female SD rats, 8 were randomly selected in normal control group and the other 24 were recruited to establish IgAN fibrosis models. Before intervention, 24 SD rats of IgAN fibrosis model were randomly divided into model control group, high-dose allicin treatment group and low-dose allicin treatment group with 8 rats in each group. Urine and blood at different time points were collected for the test of urine protein and serum creatinine. The blood levels of NF-κB and TGF-β1 were assayed by ELISA. Kidney tissues were sampled for HE, Masson staining and immunofluorescence examination. Results Rats models of IgA nephropathy fibrosis progression were successfully established. The serum concentration of NF-κB and TGF-β1 in IgAN fibrosis progression increased progressively and there was a positive linear correlation between them (intervention for 14 days:r=0.983,P<0.01. intervention for 28 days:r=0.849,P<0.01). They were positively correlated with 24-hour urinary protein excretion and serum creatinine (NF-κB and 24 hour urinary protein quantitative test: intervention for 14 days,r=0.524. intervention for 28 days,r=0.871. NF-κB and serum creatinine: intervention for 14 days,r=0.622. intervention for 28 days,r=0.776. TGF-β1 and 24 hour urinary protein quantitative test: intervention for 14 days,r=0.521. intervention for 28 days,r=0.815. TGF-β1 and serum creatinine: intervention for 14 days,r=0.643; intervention for 28 days,r=0.869, allP<0.05). Allicin could reduce the levels of urinary protein and serum creatinine, pathological damage, and serum levels of NF-κB and TGF-β1. Conclusion The rat fibrosis progression models of IgAN are successfully established with the modified method in this study for the first time in our country. The levels of NF-κB and TGF-β1 in serum can be used as indicators of dynamic evaluation of fibrosis progression of IgAN. Allicin can reduce levels of urinary protein and serum creatinine, pathological damage and serum levels of NF-κB and TGF-β1 with the possible mechanism of inhibiting NF-κB activation and reducing serum concentration of TGF-β1 to achieve the purpose of delaying IgAN fibrosis progression.
IgA nephropathy(IgAN);fibrosis;nuclear factor kappa B(NF-κB);transforming growth factor-β1(TGF-β1);allicin
2014-07-11
黄燕萍(1963-),女,教授,博士,主要从事小儿肾病的临床与基础研究。
10.3969/j.issn.1673-5293.2015.02.016
R817-33;R392
A
1673-5293(2015)02-0214-06
