迷迭香酸抗恶性肿瘤作用研究进展*
2015-06-26冯茹黄雯雯蒙宁赵真艺王雨昕张媛媛
冯茹黄雯雯蒙宁赵真艺王雨昕张媛媛
(1.四川大学华西基础医学与法医学院2012级基础医学基地班,四川成都 610041; 2.四川大学华西基础医学与法医学院药理教研室,四川成都 610041)
迷迭香酸抗恶性肿瘤作用研究进展*
冯茹1黄雯雯1蒙宁1赵真艺1王雨昕1张媛媛2△
(1.四川大学华西基础医学与法医学院2012级基础医学基地班,四川成都 610041; 2.四川大学华西基础医学与法医学院药理教研室,四川成都 610041)
迷迭香酸是一种在自然界广泛分布的多酚羟基化合物,是多种中草药的活性成分,具有抗炎、镇痛、免疫调节等多种药理作用。近年来许多报道表明,迷迭香酸有显著的抗肿瘤活性,是一种非常有前景的抗肿瘤药物。此文通过对近年来国内外文献的调研,分析和总结了迷迭香酸的抗肿瘤作用和机制,综述了迷迭香酸在该领域的最新研究进展。
迷迭香酸;恶性肿瘤;药理作用
1 抗肿瘤治疗
肿瘤(Tumor)的发病率位于全球第二,仅次于心脑血管疾病,严重危害人类生命和健康。肿瘤分良性肿瘤和恶性肿瘤,良性肿瘤在通过手术治疗后一般能够恢复健康,但恶性肿瘤因为其顽固性不容易被治愈。恶性肿瘤具有十大特征:自给自足的生长信号(Self-sufficiency in growth signals);抗生长信号的不敏感(Insensitivity to antigrowth signals);抵抗细胞死亡(Resisting cell death);潜力无限的复制能力(Limitless replicative potential)持续的血管生成(Sustained angiogenesis);组织浸润和转移(Tissue invasion and metastasis);避免免疫摧毁(Avoiding immune destruction);促进肿瘤的炎症(Tumor promotion inflammation);细胞能量异常(Deregulating cellular energetics);基因组不稳定和突变(Genome instability and mutation)[1]。
通过GLOBOCAN的数据统计,2012年全球约有1410万新发恶性肿瘤病例,同年有820万患者死于恶性肿瘤[2]。中国国立中央癌症登记处(National central cancer registry,NCCR)提供数据显示,中国2011年恶性肿瘤发病率为250.28/10万,死亡率为156.83/10万[3]。
目前,恶性肿瘤的治疗方法为综合治疗法,主要涉及手段有手术治疗、化学药物治疗、放射疗法、介入治疗、免疫细胞疗法、生物疗法等。
化疗是一种全身性治疗手段,对恶性肿瘤的原发灶、转移灶和亚临床转移灶均有治疗作用。但是化疗药物的选择性差,在产生治疗效果的同时,常出现不同程度的毒副作用,如骨髓抑制、消化道、肺、肝、肾、膀胱、神经毒性、皮肤反应、过敏反应、脱发以及一些局部反应[4]。面对现有化疗药物的特异性不足、疗效不强、毒副作用较大的缺点,中药给恶性肿瘤的临床治疗带来新的希望。中药一般毒副作用较少,有些重要还具有增强免疫功能、改善血相等有益于机体健康的辅助作用,这正是多数化疗药物的不足之处。并且中药价格相对低廉。利用现代生化方法深入研究中药的抗肿瘤作用机制,对于发现抗肿瘤治疗的新靶点,发现新的抗肿瘤药物是很有意义的[5]。实践证明中医药与化疗药物联合应用时大大提高了化疗药物疗效,而且显著改善肿瘤患者的生活质量,但是大部分中药的作用物质基础不清,作用机理不明,这些因素都严重限制了中药在治疗恶性肿瘤中的应用。
2 迷迭香酸的性质
迷迭香酸(Rosrarinic acid,RA)是一种天然水溶性的多酚羟基化合物,在植物中分布广泛,主要存在于唇形科、紫草科、葫芦科、伞形科等植物中[6]。除了可从植物中提取外,还可以通过生物合成和化学合成得到RA。前者是利用L-苯丙氨酸和L-酪氨酸两种原料在8种酶的作用下完成,后者则是利用咖啡酸和3,4-二羟基苯基乳酸酯化合成[7]。
1958年意大利科学家Scarpati和Oriente首次从唇形科植物中分离出RA,一种易溶于水及乙醇水溶液,难溶于氯仿,不溶于油脂、无水乙醇的淡黄色粉末,并得知其为一分子咖啡酸和一分子3,4-二羟基苯基乳酸缩合而成的酯。其化学名为R (t)2-[[3-(3,4-二羟基苯基)-1-氧代-2-丙烯基]氧基]-3,4-二羟基苯丙酸,化学结构如图1所示。
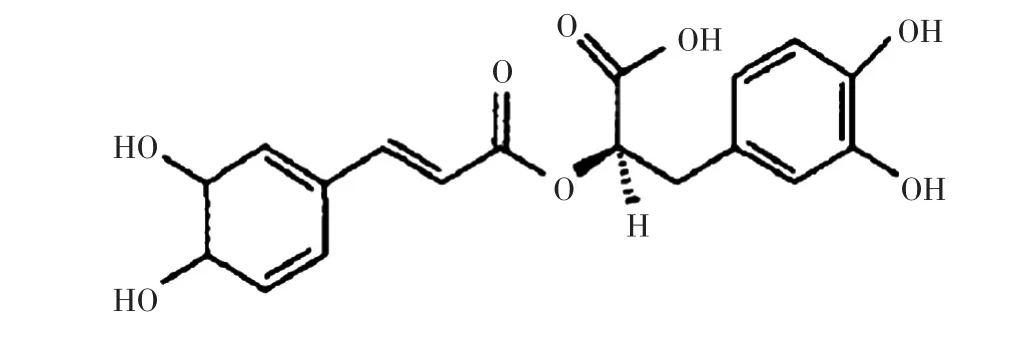
图1 迷迭香酸的化学结构
近年来不少文献报道RA为一种天然抗氧化剂[8],并且具有抗炎[9]、免疫抑制[10]等多种活性。Zenk等将RA与吲哚美辛作比较,发现迷迭香酸的抗炎效果与之相当。为此,德国Nattermann公司于1991年把它作为抗炎、镇痛、解毒药物投放市场[11]。
3 迷迭香酸抗恶性肿瘤药理学研究进展
3.1 结肠癌
对环氧酶-2(Cyclo-oxygen-ase-2,COX-2)的选择性抑制能明显减少由于环氧酶-1(Cyclo-oxygen-ase-1,COX-1)阻断引起的胃肠道不适,目前Kristen等人对RA药理作用研究显示, RA可以通过对抗转录激活因子AP-1依赖的COX-2启动子激活,而降低COX-2的表达水平,从而减少结肠癌的发生[12]。Venkatachalam等人[13]报道,RA处理组的结肠癌模型小鼠硫代巴比妥酸反应产物(Thiobarbituric acid reactive substances, TBARS)显著增高,提示氧化应激反应显著增强了,而抗氧化酶SOD和CAT在接受RA处理的癌症小鼠模型中更接近正常水平。Xu等人[14]发现RA可抗人结肠癌细胞Ls174-T细胞的转移。RA抑制了上皮生长因子受体(Epidermal growth factor receptor,EGFR)和血管内皮生长因子受体(Vascular endothelial growth factor receptor,VEGFR)的活性,通过p-Akt和p-ERK的去磷酸化减少了核转录因子NF-k B的表达。与此同时,谷胱甘肽(Glutathione,GSH)的上调减少了活性氧簇(Reactive oxygen species,ROS)。这两种效果使基质金属蛋白酶MMP-2和MMP-9的表达和活性均降低,同时伴随血管内皮生长因子(Vascular endothelial growth factor,VEGF)的下调,这些事件的结果就是肿瘤细胞的转移性显著降低。Kaithikkumar等人[15]发现RA在1,2-二甲肼诱导的鼠结肠癌癌前病变过程中具有重要作用,RA可有效抑制异常隐窝病灶(Aberrant crypt foci,ACF)的形成,并且服用了RA的结肠癌小鼠的TBARS、酶类及非酶类抗氧化物质活性显著降低。此外该实验组小鼠粪便及结肠粘膜的细菌性酶类数量也显著性的降低。Xavier等人[16]则发现RA在人结直肠癌细胞株HCT15及CO115中能显著的诱导细胞凋亡,且具有明显剂量依赖性。
3.2 乳腺癌
COX-2在乳腺组织中高度表达,Kristen等人发现RA可以有效的抑制COX-2表达,从而抑制肿瘤血管增生及诱导细胞凋亡[12]。另外Elansary等人[17]对埃及的草药汤茶研究中发现,RA是其中主要有效的成分,其可以阻滞乳腺癌MCF-7细胞的细胞周期,并诱导凋亡,并且发现凋亡相关基因p21的表达显著上调。Berdowska等人[18]的实验发现,RA因含有较多的羟基和羧基,因此表现出对人乳腺癌细胞株MCF-7/Adr有强细胞毒性。
3.3 白血病
核糖核苷酸还原酶是一种细胞内产生d NTP的关键酶,该酶的活性随肿瘤细胞的增殖而增加。Saiko等人[19]的研究结果显示,从RA处理的人类HL-60白血病细胞中提取出的核糖核苷酸还原酶活性显著降低,因此认为RA可通过抑制核苷酸还原酶活性而减少d NTP的产生,显著抑制肿瘤增殖,并且还发现其抗氧化作用可诱导细胞周期阻滞及细胞凋亡,被认为有很好的预防肿瘤的作用。
3.4 宫颈癌
Elansary等人[17]对埃及的草药汤茶研究中发现,其中主要成分RA可明显的抑制宫颈癌HeLa细胞的细胞周期,并诱导凋亡,且凋亡相关基因p21的表达显著上调。Tomohieo等人[20]以宫颈癌KB-C2细胞为研究对象发现,迷迭香植物素可以显著抑制KB-C2细胞的主动外排系统,显著升高细胞内化疗药物浓度,降低KB-C2细胞对化疗药物的耐药性。而迷迭香植物素中含有多个成分,该研究分离提纯其成分分别实验,发现其中鼠尾草酸的抑制外排系统作用最强,RA也是其主要成分,但作用效果不明显,但这也很可能提示了RA还具有其他的抗肿瘤机制。Miyako等人[21]的研究也证实RA对HeLa细胞增殖有明显抑制效果。
3.5 黑色素瘤
Miyako等人[21]以胃腺癌MK-1细胞,肝癌HeLa细胞,黑色素癌B16F10细胞为材料研究RA的抗肿瘤效果,仅发现RA对HeLa和B16F10细胞增殖有明显抑制效果。

表1 迷迭香酸抗肿瘤机制
4 结语
当今恶性肿瘤的治疗成为我们急需攻克的一个重大难关,迷迭香酸植物来源丰富,可通过多种途径发挥抗肿瘤作用(如表1),作为抗肿瘤药物具有良好的应用前景。继续对其抗恶性肿瘤分子机制进行深入研究,将有利于发现抗恶性肿瘤的新的治疗靶点,为开发抗恶性肿瘤创新药物打下坚实的基础。
1 Hanahan D,and Weinberg RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
2 Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012 [J].CA Cancer J Clin,2015,65(2):87-108.
3 陈万青,郑荣寿,曾红梅,等.2011年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2015,(01):1-10.
4 段庚仙.恶性肿瘤化疗的毒副作用及其防治[J].肿瘤研究与临床, 2004,15(6):353-354.
5 吴国利,聂剑初,颜卉君,等.几种中药抗癌作用的生化研究[J].北京师范大学学报(自然科学版),1982,57(02):57-67.
6 吴建章,郁建平,艾长春,等.迷迭香中微量元素与黄酮类化合物的含量分析[J].光谱实验室,2008,25(04):627-629.
7 Kim GD,Yong SP,Jin YH,et al.Production and applications of rosmarinic acid and structurally related compounds[J].AM Biotechnol,2015,99(5):2083-2092.
8 Bakota EL,Winkler-Moser JK,Berhow MA,et al.Antioxidant activity and sensory evaluation of a rosmarinic acid-enriched extract of Salvia officinalis[J].J Food Sci,2015,80(4):C711-C717.
9 Rocha J,Eduardo-Figueira M,Barateiro A,et al.Anti-inflammatory effect of rosmarinic acid and an extract of Rosmarinus officinalis in rat models of local and systemic inflammation[J].Basic Clin Pharmacol Toxicol,2015,116(5):398-413.
10 Hur YG,Suh CH,Kim S,et al.Rosmarinic acid induces apoptosis of activated T cells from rheumatoid arthritis patients via mitochondrial pathway[J].J Clin Immunol,2007,27(1):36-45.
11李伟光,粱敬钰.迷迭香酸的研究进展[J].海峡药学,2004,16 (1):1-4.
12 Scheckel KA,Degner SC,Romagnolo DF.Rosmarinic acid antagonizes activator protein-1-dependent activation of cyclooxygenase-2 expression in human cancer and nonmalignant cell lines[J].J Nutr, 2008,138(11):2098-2105.
13 Venkatachalam K,Gunasekaran S,Jesudoss VAS,et al.The effect of rosmarinic acid on 1,2-dimethylhydrazine induced colon carcinogenesis[J].Exp Toxicol Pathol,2013,65(4):409-418.
14 Xu Y,Xu G,Liu L,et al.Anti-invasion effect of rosmarinic acid via the extracellular signal-regulated kinase and oxidation-reduction pathway in Ls174-T cells[J].J Cell Biochem,2010,111(2):370-379.
15 Karthikkumar V,Sivagami G,Vinothkumar R,et al.Modulatory efficacy of rosmarinic acid on premalignant lesions and antioxidant status in 1,2-dimethylhydrazine induced rat colon carcinogenesis[J]. Environ Toxicol Pharmacol,2012,34(3):949-958.
16 Xavier CP,Lima CF,Fernandes-Ferreira M,et al.Salvia fruticosa, Salvia officinalis,and rosmarinic acid induce apoptosis and inhibit proliferation of human colorectal cell lines:the role in MAPK/ERK pathway[J].Nutr Cancer,2009,61(4):564-571.
17 Elansary HO,Mahmoud EA.Egyptian herbal tea infusions'antioxidants and their antiproliferative and cytotoxic activities against cancer cells[J].Nat Prod Res,2014,21(5):474-479.
18 Berdowska I,Zieliński B,Fecka I,et al.Cytotoxic impact of phenolics from Lamiaceae species on human breast cancer cells[J].Food Chem,2013,141(2):1313-1321.
19 Saiko P,Steinmann MT,Schuster H,et al.Epigallocatechin gallate,ellagic acid,and rosmarinic acid perturb d NTP pools and inhibit de novo DNA synthesis and proliferation of human HL-60 promyelocytic leukemia cells:Synergism with arabinofuranosylcytosine [J].Phytomedicine,2015,22(1):213-222.
20 Nabekura T,Yamaki T,Hiroi T,et al.Inhibition of anticancer drug efflux transporter P-glycoprotein by rosemary phytochemicals [J].Pharmacol Res,2010,61(3):259-263.
21 Yoshida M,Fuchigami M,Nagao T,et al.Antiproliferative constituents from Umbelliferae plants VII.Active triterpenes and rosmarinic acid from centella asiatica[J].Biol Pharm Bull,2005,28(1): 173-175.
22 Huang SS,and Zheng RL.Rosmarinic acid inhibits angiogenesis and its mechanism of action in vitro[J].Cancer Lett,2006,239(2):271 -280.
23 Baldasquin-Caceres B,Gomez-Garcia FJ,López-Jornet P,et al. Chemopreventive potential of phenolic compounds in oral carcinogenesis[J].Arch Oral Biol,2014,59(10):1101-1107.
24 Ramos AA,Azqueta A,Pereira-Wilson C,et al.Polyphenolic compounds from Salvia species protect cellular DNA from oxidation and stimulate DNA repair in cultured human cells[J].J Agric Food Chem,2010,58(12):7465-7471.
Advances in anti-cancer effects and mechanisms of rosmarinic acid*
Feng Ru1,Huang Wen-wen1,Meng Ning1,Zhao Zhen-yi1,Wang Yu-xin1,Zhang Yuan-yuan2△
(1.Basic Medical Base Class 2012,West China School of Preclinical and Forensic Medicine, Sichuan Chengdu 610041;2.Department of Pharmacology,West China School of Preclinical and Forensic Medicine, Sichuan University,Sichuan Chengdu 610041)
2015-6-30)
国家基础科学人才培养基金能力提高项目(编号: J1103604)
冯茹,女,四川大学华西基础医学与法医学院2012级本科生, Email:452520769@qq.com。
△通讯作者:张媛媛,女,副教授,主要从事抗肿瘤药理研究方向,Email: sarahyyzhang@hotmail.com。
