口服百草枯建立帕金森病模型及其评价研究
2015-06-25罗烘权徐名衬郑春华王玉珏吴丽红顾为望
罗烘权,袁 进,徐名衬,郑春华,王玉珏,吴丽红,顾为望*
(1.南方医科大学实验动物中心,广东广州510515;2.广州医科大学附属口腔医院,广东广州510140)
帕金森病(Parkinson’s disease,PD)又称震颤麻痹(Paralysis agitans,Shaking palsy),是中老年人常见的中枢神经系统椎体外系退行性疾病。主要的病理特征是黑质致密部大量多巴胺能神经元的坏死,纹状体内多巴胺(dopamine,DA)含量减少。临床上以静止性震颤、肌强直、姿势异常和运动迟缓以及平衡功能障碍为主要表现,可伴有记忆力减退、抑郁等精神障碍。PD与年龄、遗传、环境等因素相关,发病率有逐年增加并有年轻化的趋势。近年来,农药(如百草枯)在饮水、食品中的残留被认为是PD的重要诱发因素[1-2]。有研究报道,国内外农民以及除草剂(如百草枯)暴露人群中帕金森病的发病率会相对增加[3]。
百草枯(paraquat,PQ),也叫克芜踪、对草快等,被广泛应用于农业生产。其结构与经典PD造模剂1-甲基-4苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrehydropyridine,MPTP)及其活性代谢产物MPP+极为相似,具有与MPTP相似的神经毒性作用。百草枯可通过皮肤接触或吸入、经服食沾有该除草剂的食物、饮用水进入人体内。
国外已经报道百草枯的暴露是帕金森病的一个重要致病因素[4]。国内外常通过腹腔注射或脑内注射或皮下注射百草枯建立小鼠、大鼠PD模型[5-7],这与人类的主要经口暴露方式相差甚远。通过大鼠口服百草枯建立PD模型的研究尚未见报道。因此,本研究通过口服途径使大鼠较长时间暴露于百草枯,模拟人类长期、慢性暴露于该除草剂建立大鼠的PD模型,为PD的发病机制及其防治研究提供理想的模型动物。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级SD大鼠(♂,220g~250 g)64只,由南方医科大学实验动物中心提供(许可证号:SCXK[粤]2011-0015)。
1.1.2 主要试剂 200g/L百草枯,南京杜邦生物化工有限公司产品;DA、HVA、5-HT标准品,Sigma公司产品。
1.1.3 主要仪器 RC5C高速低温离心机,美国杜邦公司产品;PHS-2C精密酸度计,上海理达仪器厂产品;Waters HPLC系统(510输液泵,420荧光检测器,Baseline810色谱工作站);RD1112-OF-R-1鼠博士旷场实验视频分析系统、RD1101-MWM-G鼠博士MORRIS水迷宫视频分析系统,上海移数信息科技有限公司产品;HF-240全自动生化分析仪,海力孚公司产品。
1.2 方法
1.2.1 试验分组 将大鼠随机分为4组,分别为对照组、低剂量组、中剂量组和高剂量组,每组16只,每天分别按生理盐水、5、10、20mg/kg百草枯给药,连续灌胃4个月,监测大鼠试验前后体重变化情况。
1.2.2 行为学检测
1.2.2.1 日常行为观察 主要观察动物精神状况,行为动作,给药前后有无异常表现等。
1.2.2.2 旷场试验 4个月后,每组随机抽取8只大鼠进行试验,把大鼠分别放入100cm×100cm×45cm的旷场箱内,通过动物旷场实验视频分析系统采集分析大鼠在5min内的运动总路程和中央活动时间。
1.2.2.3 水迷宫试验 定位航行试验:试验共历时4d,4次/d,每次分别从4个不同象限将大鼠面向池壁放入水中,记录大鼠从入水到找到并爬上平台的时间,即为其逃避潜伏期。若大鼠在90s内未找到平台则由试验者将其引向平台,潜伏期记为90s。大鼠爬上平台后,让其在上休息15s,之后再进行下1次训练。将4次/d的算术平均值记为当天的成绩。空间探索试验:于第5天撤除平台,在第1象限将大鼠面壁投入水池,视频分析系统记录其2min内水中游泳路径及穿过原平台的次数。
1.2.3 各组大鼠肝肾功能的检测 试验结束时,3组大鼠中每组随机抽取8只,用30g/L戊巴比妥钠腹腔注射麻醉后通过眼眶静脉丛采集血液1.5mL,分离血清,测定 ATL、BUN、Cr。
1.2.4 病理学观察 将每组随机抽取6只大鼠,采集肺、中脑组织并用100g/L甲醛固定后制作石蜡切片,进行HE染色。观察各组大鼠肺、中脑黑质部组织病理学变化。
1.2.5 HPLC-FD法检测多巴胺及其代谢产物含量
1.2.5.1 色谱条件 采用 Waters-510泵;Nucleosil-C18(4mm×250mm)色谱柱;流动相:5.89g/L柠檬酸三钠缓冲液(用盐酸调节pH为3.5)∶甲醇∶乙腈=85∶10∶5,经0.45μm的滤膜真空抽滤;脱气,流速1.0mL/min;柱温:室温。荧光检测器波长设置为:激发波长280nm,发射波长315nm;以峰面积定量。
1.2.5.2 标准品和样品的制备与测定 标准品制备:DA、HVA、5-HT分别溶解于10.05g/L HClO4中,浓度为0.5g/L,贮存于-20℃冰箱中;分析时将上述溶液稀释成20μg/L作为标准溶液。样品制备:每组大鼠用30g/L戊巴比妥钠腹腔注射麻醉后快速断头取脑,在预冷的PBS缓冲液中剥离出纹状体,经干冰固化称重后迅速置-80℃冰冻保存。测定时取出标本置于匀浆器中,加入1mL预冷的HClO4,制成匀浆。于台式冷冻离心机中15 000 r/min离心20min,取上清液0.22μm滤器过滤进样检测。根据外标法进行定量,计算出样本中各项指标的浓度,并表示为ng/mg组织(湿重)。
1.2.6 统计学分析 试验数据采用SPSS13.0进行分析,组间比较为Independent sample t检验,试验数据均用±SD表示,P<0.05则具有统计学差异。
2 结果
2.1 日常行为观察
给药1周后,与对照组相比,发现给药的两组部分大鼠出现拉稀和鼻孔出血;2周后中剂量组大鼠会出现呼吸急促,甚至出现嚎叫的现象、喂药后竖毛、翘尾和异常活泼,随时间推移,以上症状逐渐减轻;4周后,中剂量组大鼠呆滞、反应迟钝;10周后,中剂量组部分大鼠动作僵硬和四肢震颤,且维持到试验结束;而低剂量组大鼠整个过程没有明显上述变化。另外,高剂量组大鼠在试验过程出现大量死亡(图1),4个月后所剩大鼠数量无统计意义,因此,在进行检测时把高剂量组剔除。
2.2 大鼠体重的变化
由表1可知,造模前各组大鼠体重比较,差异不显著(P>0.05),造模后各组大鼠体重都有明显的增加,但组间差异不显著(P>0.05)。

表1 造模前后各组大鼠的体重比较Table 1 Comparison of body weights of rats among groups before and after modeling g
2.3 旷场试验
由图2结果显示,对照组大鼠5min内中央活动时间是中剂量组的13.69倍,差异显著(P<0.05),低剂量组的中央活动时间与对照组相比,差异不显著(P>0.05)。各组大鼠5min内运动总路程分别为2 610.41cm±633.55cm、2 556.90cm±837.97cm、2 507.69cm±780.07cm,虽然对照组>低剂量组>中剂量组,但经统计学检验,各组间差异不显著(P>0.05)。
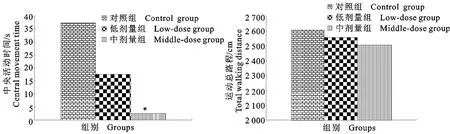
图2 各组大鼠5min中央活动时间和运动总路程Fig.2 The time in the center of open field and the total walking distance in 5min among groups of rats
2.4 水迷宫试验
定位航行试验:在连续的4d的训练中,中剂量组和低剂量组与对照组相比,每天平均逃避潜伏期均增加,但是只有中剂量组与对照组比较,差异显著(P<0.05);而低剂量组与对照组比较,差异不显著(P>0.05)(图3)。
空间探索试验统计结果表明,中剂量组大鼠穿越平台次数(2.14±0.69)与对照组(3.86±0.69)相比明显减少,差异极显著(P<0.01),但是低剂量组(3.14±1.57)与对照组相比差异不显著(P>0.05)。

图3 各组大鼠日均寻台潜伏期Fig.3 Daily average escape latency time in each groups of rats
2.5 肝肾功能检测
采血后测定BUN、Cr以及ALT指标,结果见表2。各组之间的肾功能(BUN、Cr)差异不显著(P>0.05),而中剂量组的ALT虽然比低剂量组和对照组有所增高,但均差异不显著(P>0.05)。

表2 不同处理组的大鼠肝肾功能指标变化Table 2 Changes of hepatic and renal function indexes in different treatment groups of rats
2.6 病理学观察
2.6.1 中脑病理观察 由图4中A、B、C可以看出,对照组大鼠大致正常,中剂量组大鼠黑质神经元细胞大量萎缩,色素大量减少,胶质细胞增生,低剂量组大鼠有轻度上述变化。
2.6.2 肺组织病理观察 由图4中D、E、F结果显示,中剂量组大鼠肺泡腔严重淤血,肺泡上皮坏死脱落,肺泡间质中炎细胞浸润,低剂量组大鼠肺组织损伤程度较轻,而对照组大鼠正常。
2.7 纹状体中神经递质含量
通过HPLC检测测定结果显示,中剂量组大鼠4个月后纹状体中的DA及HVA含量较对照组均明显下降,分别下降20.0%(P<0.01)和11.3%(P<0.01)。而低剂量组大鼠纹状体中的DA和HVA含量较对照组也有下降,但差异不显著(P>0.05)。5-HT检测结果显示,两个试验组与对照组相比,差异不显著(P>0.05)(表3。)

图4 中脑和肺组织HE染色结果(400×)Fig.4 The HE results of midbrain and lung tissue(400×)

表3 各组大鼠暴露4个月后纹状体中神经递质的含量Table 3 The concentration of DA and its metabolites in the striatum of each groups of rats after 4moth exposure
3 讨论
PD是常见于中老年人群的第二大神经系统变性疾病,在我国大于65岁以上人群中的PD患病率为1.7%,且有逐年递增的趋势[8]。近年一项研究表明,到2030年50岁以上的中老年人患PD的人数会增加1倍,估计相当于全世界900万的人口[9]。PD作为严重危害老年人身体健康的神经退行性疾病,对其进行研究具有重要的国民保健和社会经济意义。
近年来,虽然农药种类和使用方法不断更新改进,用药水平和残留水平也在下降,但农产品和加工食品中种类繁多的农药残留,给食品安全问题带来了隐患。流行病学研究发现,经常接触农药、除草剂(如百草枯)的农民,饮用被污染的河水、井水的居民,其PD发病率明显增高[10]。
通过试验研究不断证实了百草枯具有致PD的神经毒性作用。本试验通过灌胃给予大鼠百草枯稀释液,模拟人类经消化道暴露该除草剂的方式,大鼠出现了PD的临床症状和中脑病变。与大量报道的其他研究方法一样,大鼠出现自发活动减少、运动迟缓、四肢震颤、脑内神经细胞明显萎缩、黑质神经元受损、胶质细胞增生、DA及其代谢物含量降低等一系列变化。有报道称帕金森患者焦虑障碍的发生率为3.6%~40%[11],旷场试验表明,口服中剂量百草枯的大鼠在进入一个广阔的空间后会产生一定程度的焦虑,Morris水迷宫试验结果说明了其学习记忆能力也相对减退,这与对照组形成了鲜明的对比;从该研究各结果显示,本试验采用的方法可以建立具典型PD样行为学表现的疾病模型。
人们常用腹腔或脑内注射或皮下注射百草枯的方法进行建立帕金森模型[5-7],采用单次或短期较高剂量多次给药诱导出神经元坏死的模型,这与生活中人类暴露于百草枯的方式完全不一致;且所用药物大多为试剂级,价格昂贵;制备技术上,脑内注射需立体定位特殊设备,有一定技术难度。虽丁正同等[12]已经采用该方法在小鼠进行研究,同为啮齿类动物,来源容易,观察方便,但小鼠个体小,在取脑组织研究等方面相对较难。本研究方法模拟了人类暴露该除草剂的方式,采用商用百草枯水剂,价格低廉,操作简便,试验周期较长,符合了PD患者自然病程较长,病情进展缓慢的特点,较经济有效的进行模型制备。
近年来百草枯其神经毒性作用被广泛研究,但肺是百草枯毒性作用的靶器官。有研究表明,长期给予低剂量的百草枯,其慢性毒性作用主要对基底节造成损害而不产生肺毒性作用[3]。但本研究结果显示,大鼠肺泡腔严重淤血,肺泡上皮坏死脱落,肺泡间质中炎细胞浸润,这表明该研究方法会对肺组织产生毒副作用,该毒副作用可能也是高剂量组的高死亡率原因。另外,虽然肝脏和肾脏是百草枯的主要代谢器官,但检测结果显示,本研究方法尚未损伤动物肝肾功能,这与相关报道[12]是一致的。
综上所述,百草枯可能是导致PD的环境因素之一。SD大鼠通过口服方式暴露于百草枯可以发生典型的PD样改变,行为学方面出现日常活动减少,震颤,学习记忆能力下降等;形态学方面大鼠中脑黑质致密部DA能神经细胞减少明显;生化方面大鼠纹状体中DA及其代谢物HVA降低明显等等。这些结果提示,通过亚慢性暴露于百草枯可导致大脑黑质DA能神经系统产生明显的变化,说明该方法建立PD模型是有效可行的,这为PD的机制和治疗研究奠定基础。
[1]Hisahara S,Shimohama S.Toxin-induced and genetic animal models of Parkinson's disease[J].Parkinson's Dis,2011,doi:10.4061/2011/951709.
[2]Liou H H,Tsai M C,Chen C J,et al.Environmental risk factors and Parkinson's disease:a case-control study in Taiwan[J].Neurology,1997(48):1583-1588.
[3]Gorell J M,Johnson C C,Rybicki B A,et al.The risk of Parkinson's disease with exposure to pesticides,farming,well water,and rural living[J].Neurology,1998(50):1346-1350.
[4]Dinis-Oliveira R J,Remião F,Carmo H,et al.Paraquat exposure as an etiological factor of Parkinson's disease[J].Neuro Toxicol,2006,27(6):1110-1122.
[5]Ren J P,Zhao Y W,Sun X J.Toxic influence of chronic oral administration of paraquat on nigrostriatal dopaminergic neurons in C57BL/6mice[J].Chin Med J,2009,122(19):2366-2371.
[6]Kuter K,Smialowska M,Wierońska J,et al.Toxic influence of subchronic paraquat administration on dopaminergic neurons in rats[J].Brain Res,2007,1155:196-207.
[7]孟姗姗,贾 非,刘洪文.百草枯诱导的慢性帕金森病模型大鼠血脑屏障和P-gp变化的研究[J].临床急诊杂志,2013,14(6):273-276.
[8]Zhang Z X,Roman G C,Hong Z,et al.Parkinson's disease in China:Prevalence in Beijing,Xi'an and Shanghai[J].Lancet,2005(365):595-597
[9]Pahwa R,Lyons K E.Early diagnosis of Parkinson's disease:Recommendations from diagnostic clinical guidelines[J].Am J Manag Care,2010:16(4):94-99.
[10]Vanacore N,Nappo A,Gentile M,et al.Evaluation of risk of Parkinson's disease in a cohort of licensed pesticide users[J].Neurol Sci,2002(23):S119-120.
[11]Weintraub D,Comella C L,Horn S.Parkinson's disease-Part 3:Neuropsychiatric symptoms[J].Am J Manag Care,2008,14(2):S59-69.
[12]丁正同,任惠民,蒋雨平,等.百草枯对小鼠黑质纹状体多巴胺能系统的影响[J].复旦学报:医学版,2001,28(1):28-31.
