滩羊体内盐酸四环素的消除规律研究
2015-06-25何生虎刘维华余永涛雷元元罗瑞明
吴 强,何生虎*,刘维华,余永涛,雷元元,罗瑞明
(1.宁夏大学农学院,宁夏银川750021;2.宁夏回族自治区兽药饲料监察所,宁夏银川750021)
四环素类抗生素是发现于20世纪40年代的一类广谱抗生素,50年代开始应用于幼儿和孕妇以外的临床[1-2];兽医临床上常用的有四环素、土霉素和金霉素等,它们对革兰阳性菌、阴性菌、螺旋体、支原体、衣原体、原虫等均可产生抑制作用,故又称为广谱抗生素[3-4]。在养殖业上,四环素类药物在促进畜禽生长、提高饲料报酬、疾病防治等方面发挥着重要作用[5-6]。由于该类药物的不合理使用、滥用,对人类健康造成影响[7-9]。首先,四环素超标可对人体肾脏、肝脏造成损伤。其次,由于四环素为广谱抗生素,可对多种细菌有效,因此,四环素残留可以杀死人体肠胃内正常的菌群,造成肠胃功能失调,引起腹泻等症状。最后,四环素会导致骨骼生长停滞。因此,对于四环素的使用必须非常谨慎与严格,对使用四环素的家畜必须要严格遵循国家兽药典中规定的休药期,在现行的兽药典中牛、羊四环素的休药期为8d。
由于盐酸四环素高度的抑菌作用,在牛羊养殖中被广泛使用。本文就盐酸四环素注射液在滩羊体内的消除规律进行研究,并预测其在滩羊体内的休药期。
1 材料与方法
1.1 材料
1.1.1 试剂与材料 盐酸四环素标准品,纯度大于96%,为Dr.Ehrenstorfer GmbH公司产品;盐酸四环素注射液为成都新亨药业公司产品;甲醇、乙腈为美国Fisher公司产品;柠檬酸、乙二铵四乙酸二钠、磷酸氢二钠为分析纯;HLB固相萃取柱(3mL/60mg)为美国 Waters公司产品。
1.1.2 仪器设备 Agilent 1100高效液相色谱仪、AE-205电子天平为 Mettler Toledo公司产品;CT15RT高速冷冻离心机为日立公司产品;Organomation Associates氮吹仪为美国Organomation公司产品;MS1旋涡合器为IKA公司产品;PL-202L电子天平为美国Mettler Toledo公司产品;FE20酸度计为美国Mettler Toledo公司产品;固相萃取装置为上海安普科学仪器公司产品。
1.1.3 试验用动物 健康宁夏滩羊42只,体重25 kg~30kg,雌雄各半,喂饲不添加任何抗菌药物的全价饲料。试验前后各组词养条件相同,自由饮水[10]。
1.2 方法
1.2.1 试验动物分组 42只试验羊随机分组,每组7只,空白1只,试验6只,对所有羊称重、记录[11]。
1.2.2 试验动物给药及样品采集 试验组受试羊与空白对照羊均采用一次性注射器按照10mg/kg体重分别颈静脉注射盐酸四环素与生理盐水,每天早晚各1次,自由饮水,连续给药3d;分别在羊停药后的0、3、6、9、12、5d,随机于每个检测点选择6头试验羊进行屠宰。宰杀之前称重,试验羊死亡后对其进行解剖,快速取其肌肉(300g~500g)、肝脏(400g~500g)、双肾各取一半(纵切)。采集的样本不作任何洗涤或处理,立即做好标记、包装,保存于-20℃冰箱,待测。
1.2.3 样品的处理与检测 对所采集的所有组织进行匀浆处理[12],称取匀浆后的样品5g置于50mL聚丙烯离心管中,分别用 20、20、10mL 0.1mol/L EDTA-Mcllvainc缓冲溶液水域超声提取3次,每次漩涡混合1min,超声提取10min,3 000r/min离心5min(温度低于15℃),合并上清液(体积不能超过50mL),并定容至50mL,混匀,5 000r/min离心10min(温度低于15℃),用快速滤纸过滤,然后待净化。准确吸取10mL提取液(相当于1g样品),以1滴/s的速度过HLB固相萃取柱,待样液完全流出后,依次用5mL水和5mL甲醇+水淋洗,弃去全部流出液。2.0ku以下减压抽干5min,最后用10mL甲醇+乙酸乙酯洗脱。将洗脱液氮吹浓缩至干(温度低于40℃),0.5mL甲醇+三氟乙酸水溶液溶解残渣,过0.45μm滤膜,供高效液相色谱仪测定。
1.2.4 色谱条件 色谱柱:ZOR BAX Eclipse XDB-C18,4.6mm×250mm,粒径5μm;流动相:乙腈-甲醇-10mmol/L三氟乙酸水溶液,采用梯度洗脱,流动相比例见表1。流速:1.5mL/min;检测波长:270nm;柱温:30℃,进样量:100μL,自动进样器进样。
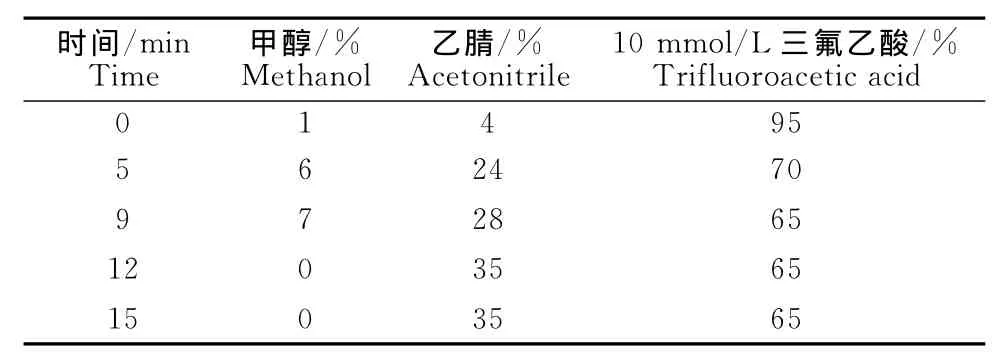
表1 液相色谱流动相洗脱梯度Table 1 The mobile phase elution gradient of high performance liquid chromatography
2 结果
2.1 样品检测结果
本试验采用国家标准GB/T21317—2007(动物源性食品中四环素类兽药残留检测方法 液相色谱-质谱/质谱法与高效液相色谱法)[12]中高效液相色谱法对样品进行检测,四环素的出峰时间在8.2min左右,峰形良好,样品检测色谱图见图1。
由检测结果得知,在羊组织中肾脏药物浓度最高,肝脏次之,肌肉最少;0d时药物在滩羊体内药物浓度最高,随着时间的推移,药物浓度逐渐降低,0d~3d时,3种组织中药物浓度降低幅度较大,3d~6 d时,肾脏与肝脏中的药物浓度下降幅度趋较小,而肌肉中的浓度下降幅度基本不变,6d~9d时,肝脏与肾脏浓度下降幅度再次变大,停药9d后肌肉组织中四环素的平均含量为0.078 43mg/kg已低于限量标准(0.1mg/kg),肝脏组织中四环素的平均含量为 0.199 85mg/kg,已低于限量标准(0.3 mg/kg),肾脏组织中四环素的平均含量为0.560 47 mg/kg,已低于限量标准(0.6mg/kg);在12d后,肝脏及肾脏组织中药物浓度均低于250μg/kg,肌肉药物浓度降低至50μg/kg。以时间为横坐标药,样品中药物物浓度为纵坐标绘制药物浓度变化曲线(图2)。
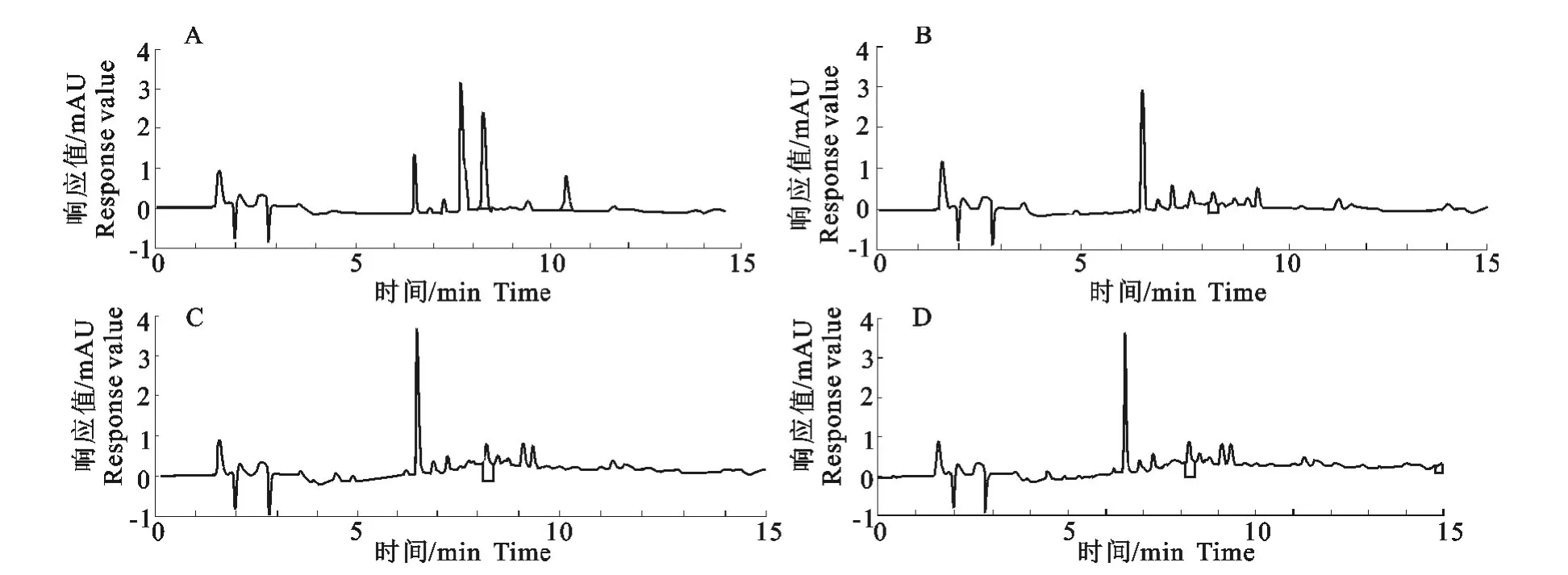
图1 样品检测色谱图Fig.1 The chromatogram of tested samples
2.2 休药期的测定
将所检测的结果输入WT1.4休药期软件(由中国饲料工业协会信息中心与北京瑞先农科技发展有限公司联合研发)对四环素在肌肉、肝脏、肾脏各组织中的休药期进行预测,结果表明,以95%耐受限为指标对四环素在滩羊肌肉组织中休药期的预测,确定其休药期为9.7d(图3)。以95%耐受限为指标对四环素在肝脏组织中休药期的预测,确定其休药期为10.6d。以95%耐受限为指标对四环素在肾脏组织中休药期的预测,确定其休药期12d(图4)。综上所述,为了避免四环素在羊体内的残留对人类健康造成危害,以本试验为基础,静脉注射盐酸四环素给药后推荐的休药期应为12d(图5)。

图3 以95%耐受限为指标滩羊肌肉中休药期预测Fig.3 Plot of withdrawal time calculation for muscle of Tan-sheep at the time when the one-sided 95%upper tolerance limit was blow the MRL
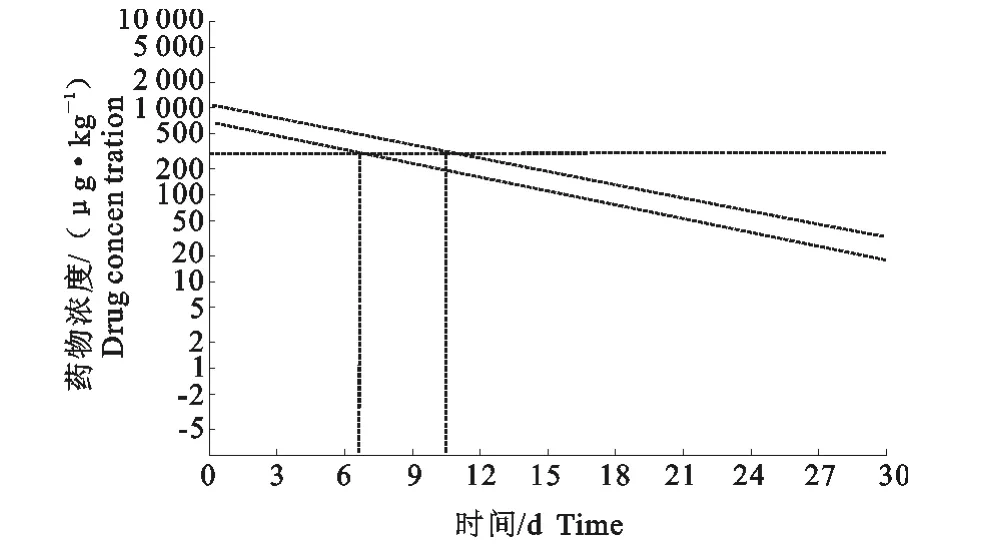
图4 以95%耐受限为指标滩羊肝脏组织中休药期的评估Fig.4 Plot of withdrawal time calculation for liver of Tan-sheep at the time when the one-sided 95%upper tolerance limit was blow the MRL
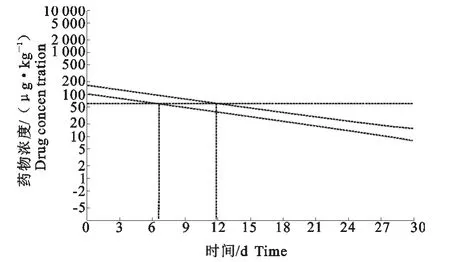
图5 以95%耐受限为指标滩羊肾脏组织中休药期的评估Fig.5 Plot of withdrawal time calculation for kidney of Tan-sheep at the time when the one-sided 95%upper tolerance limit was blow the MRL
3 讨论
最高残留限量(maximum residue limit,MRL)是指对食品动物用药后产生的允许存在于食品表面或内部的该兽药残留的最高量,对于四环素在动物体内的残留限量,我国有严格的规定,农业部颁布的235号公告《动物性食品中兽药最高残留限量》中对四环素在食品动物中的最高限量为肌肉100μg/kg,肝脏300μg/kg,肾脏600μg/kg,这一标准与欧盟对四环素残留最高限量一致。
四环素类药物中,以土霉素与多西环素在动物体内消除规律研究较多,并且主要以水生动物[5-6]和猪[10,13]为研究对象,在牛、羊方面很少查阅到有关于盐酸四环素消除规律研究的文献,因此本试验以滩羊为试验动物,研究盐酸四环素在滩羊机体内的消除规律并预测休药期。
目前,对四环素类抗生素残留的检测方法有多种,即薄层色谱法、高效液相色谱法、毛细管电泳法[14]、液相色谱-串联质谱法[15]等,由于本试验所测样品量较大,因此本文选择精确度较高且性价比最合理的高效液相色谱法,参照国家标准GB/T 21317-2007对样品进行处理与检测。结合检测结果,以滩羊肌肉、肝脏、肾脏中药物浓度为标准,通过WT1.4软件对盐酸四环素的休药期进行评估,在95%耐受限为指标,肌肉、肝脏、肾脏的 WT分别为9.7、10.6、12d。我国兽药典中明确规定盐酸四环素在所有羊体内的休药期为8d。但由于物种的不同,动物个体差异,药剂剂型不同,药物在动物体内的代谢快慢存在差异,另外,由于不同品种羊在不同的生长环境中对药物的代谢也有影响。因此,为了防止四环素残留而对人体造成危害,以本试验以滩羊为试验动物,建议盐酸四环素在滩羊的休药期为12d。
[1]Petra V,Marcela F,Helena J,et al.Chicken faecal microbiota and disturbances induced by single or repeated therapy with tetracycline and streptomycin[J].BMC Vet Res,2013,9(1):30.
[2]贺德春,许振成,吴根义,等.四环素类抗生素的环境行为研究进展[J].动物医学进展,2011,32(4):98-102.
[3]陈敏艳,王香敏,朱 弘,等.畜禽产品兽药残留危害现状与分析[J].动物医学进展,2012,33(9):109-112.
[4]房 可.中国兽药代谢动力学数据库建立及土霉素在猪可食性组织中残留消除研究[D].湖北武汉:华中农业大学,2011.
[5]袁 娟,李汝琴,彭小云,等.土霉素在黄颡鱼肌肉组织中残留消除规律的研究[J].中国农学通报,2013,23(29):27-31.
[6]封 琦,王 权,顾 伟,等.土霉素在中华绒螯蟹肝胰腺中的药代动力学及残留消除规律[J].江苏农业科学,2013,41(3):260-263.
[7]郭 杰,张朝飞,高庚渠,等.高效液相色谱―串联质谱联用在牛奶抗生素残留检测中的研究进展[J].中国畜牧兽医,2014,41(1):236-239.
[8]高旭东,陈士恩,叶永丽,等.高效液相色谱法测定畜禽肉及三文鱼中土霉素、四环素和金霉素残留[J].食品安全质量检测学报,2014,5(2):369-376.
[9]de Albuquerque Fernandes S A,Magnavita A P,Ferrao S P,et al.Daily ingestion of tetracycline residue present in pasteurized milk:apublic health problem[J].Environ Sci Pollu Res,2013,21(5):3427-3434.
[10]蔡金华,顾 欣,刘雅妮.长效土霉素注射液在猪体内的药代动力学研究[J].中国兽药杂志,2006,40(7):17-21.
[11]Cetinkaya F,Yibar A,Soyutemiz G E,et al.Determination of tetracycline residues in chicken meat by liquid chromatography-tandem mass spectrometry[J].Food Addit Contam B,2012,5(1):45-49.
[12]GB/T21317—2007.动物源性食品中四环素类兽药残留检测方法 液相色谱-质谱/质谱法与高效液相色谱法[S].
[13]杨秋实.猪可食用组织中盐酸多西环素长效注射液残留检测方法及消除规律的研究[D].江苏南京:南京农业大学,2012.
[14]Miranda J M,Rodríguez J A,Galán-Vidal C A.Simultaneous determination of tetracyclines in poultry muscle by capillary zone electrophoresis[J].J Chromatogra A,2009,1216(15):3366-3371.
[15]曹艺耀.动物性食品中兽药残留检测方法研究及济南市售动物性食品中兽药残留市场调查[D].山东济南:山东大学,2013.
