液相芯片鉴别检测7种出血性大肠埃希菌血清型
2015-06-25唐金明林庆燕曹琛福吕建强杨俊兴花群义秦智锋
陶 虹,陈 兵,孙 洁,唐金明,林庆燕,曹琛福,吕建强,杨俊兴,花群义,秦智锋*
(1.深圳出入境检验检疫局,广东深圳518045;2.深圳市检验检疫科学研究院,广东深圳518001)
食源性疾病是指通过摄食而进入人体的有毒有害物质等致病因子所造成的疾病,其中尤以细菌性疾病为主要病因。在细菌性食源性疾病中,以肠出血性大肠埃希菌(Shiga toxin-producingEscherichiacoli,STEC)引发的食品安全事件最为常见。STEC主要寄居在动物肠道中,致病性强,约70%的STEC感染是由6种主要的血清型(O26、O45、O103、O111、O121和 O145)引发[1]。目前,许多保守序列已被应用到STEC的分子生物学检测中,如uidA、fliC、rfb、ehxA、wzx、wbdI、ihpl和 wzy等[2]。液相芯片技术是20世纪90年代后期发展起来的高通量检测技术,具有高通量、样本用量少、操作简单快速、灵敏度高、检测范围广、特异性强、准确性高、重复性好、费用低及灵活的优点,是近年来最受关注的临床高通量检测技术。目前液相芯片系统在食源性致病菌的快速检测方面的应用研究已经展开,初步研究显示该系统能够在短时间内(6h~8 h)对多种常见食源性致病菌进行准确、快速和定量检测。
本研究以 O157、O26、O45、O103、O111、O121和O145等7种血清型的出血性大肠埃希菌为检测对象,建立了基于多重扩增和液相芯片的7种血清型大肠埃希菌的快速高通量检测技术。通过对所建方法的灵敏度、特异性进行评估,以确定所建方法在食源性致病菌快速高通量检测的适用性和可行性。
1 材料与方法
1.1 材料
1.1.1 细菌 大肠埃希菌 O121(菌种编号:CVCC2071)、大肠埃希菌 O111(菌种编号:CVCC1450)、大肠埃希菌 O103(菌种编号:CVCC1442)、大肠埃希菌O45(菌种编号:CVCC1514),均购自中国兽医微生物菌种保藏管理中心;大肠埃希菌O157,由深圳检验检疫局实验室分离保存;大肠埃希菌O145及O26,由深圳疾病预防控制中心馈赠。
1.1.2 试剂 HotStarTaqPlus Master Mix Kit、Strep tavidin-PE,Qiagen公司产品;编号为34、36、37、38、42、43、45液相芯片微球、5mol/L TMAC、200g/L Sarkosyl、1mol/L Tris-HCl、0.15mol/L EDTA,Luminex公司产品。
1.1.3 仪器设备 Veriti PCR仪,Applied Biosystems公司产品;Liquichip 200液相芯片检测工作站,Qiagen公司产品;GAS7001X凝胶成像分析仪,UVItech公司产品。
1.2 方法
1.2.1 引物探针的设计与合成 参考GenBank数据库中 O26 型(GenBank:AB903790.1)、O45型(GenBank:AY771223.1)、O103 型(GenBank:AJVQ01000264.1)、 O111 型(GenBank:AB903203.1)、O121型(GenBank:AB903874.1)、O145型(GenBank:AY863412.1)、O157型(Gen-Bank:AB903734.1)等STEC的核苷酸序列,利用DNA Star生物软件进行同源性分析比较,筛选出特异性针对各个血清型的STEC基因中相对保守且高度特异的核苷酸片段,设计出针对O26型、O45型、O103型、O111型、O121型、O145型和O157型的特异性引物和探针,并在上下游引物的5′端分别加入通用引物,探针的5′端偶联NH2。通用引物的下游引物5′端标记生物素。7种菌株的引物及探针由上海生工生物工程技术服务有限公司合成,各个血清型的引物见表1。
1.2.2 细菌复苏与DNA抽提 用接种环蘸取各个菌种,于麦康凯琼脂(MacConkey Agar)平板上划线,37℃过夜。挑选大肠埃希菌特征性的单菌落,于营养肉汤中过夜培养。将各个血清型的细菌培养液取3mL~5mL,10 000r/min离心5min,收集菌体沉淀。菌体沉淀重悬于100μL无菌ddH2O中,煮沸15min。10 000r/min离心5min,取上清液作为核酸模板,进行PCR反应。
1.2.3 7种血清型STEC单重PCR扩增 分别以O26型、O45型、O103型、O111型、O121型、O145型和O157型菌株核酸为模板,按照Qiagen PCR Kit Handbook推荐的方法配置PCR反应液:每个50μL的反应体系中包含10× Qiagen PCR buffer 5μL,dNTP mix(10mmol/L)2μL,上、下游超级引物混合液(80μmol/L)1.5μL,特异性引物1.5μL,TaqDNA聚合酶2μL,模板5μL。于PCR仪上进行如下反应程序扩增:95℃5min;94℃30s,52℃1min,72℃1min,15个循环;94℃30s,70℃1min 30s,6个循环;94℃20s,55℃30s,72℃20s,35个循环;72℃10min。

表1 O血清型的引物与预期扩增片段Table 1 Primers of O serogroup of STEC and amplification fragment
1.2.4 7种血清型STEC多重PCR扩增 将7种菌株全部混合后抽提核酸,按照1.2.3PCR反应体系和反应程序进行PCR扩增。在反应体系中,同时加入7种血清型的特异性引物后进行多重PCR扩增,同时设定阴性对照。
1.2.5 STEC液相芯片检测
1.2.5.1 荧光编码微球与探针偶联 将编号为34、36、37、38、42、43和45的液相芯片荧光微球,分别与O26、O45、O103、O111、O121、O145和 O157的特异性探针进行共价键偶联,探针与微球对应关系见表2。偶联程序参照Luminex推荐操作步骤进行。将所有试剂恢复至室温,用0.1mol/L MES(pH 4.5)将寡核苷酸探针稀释至0.2mmol/L。先将荧光编码微球贮存液用旋涡振荡重悬,后取200μL荧光编码微球贮存液(5×106)至1.5mL的聚丙烯微量离心管中,10 000r/min离心5min。弃上清,加入50μL的0.1mol/L MES后振荡混匀,再加入0.2 nmol寡核苷酸探针,吹打混匀。加入10μL新鲜配制的10mg/mL EDC溶液,混匀后室温避光孵育30 min,再次加入相同量的EDC继续孵育30min。加入1.0mL的吐温-20(0.2g/L W/V)混匀洗涤,10 000r/min离心10min沉淀微球[3-4]。弃上清后加入1.0mL的SDS(1g/L W/V)混匀洗涤后再次10 000r/min离心10min沉淀微球。加入适量0.1mol/L MES,采用血球计数法对制备的荧光编码微球偶联物进行计数,计算出荧光编码微球的浓度,用MES将荧光编码微球稀释成5 000个/μL,于2℃~8℃避光保存。

表2 O血清型探针与不同荧光编码微球对应表Table 2 Correspond table of different code microspheres to probes of O serogroup
1.2.5.2 液相芯片检测 将各个偶联好探针的荧光编码微球振荡混匀,分别取各种微球10μL混合,用1.5×TMAC杂交液将每个编码微球进一步稀释成200个/μL。在每个样品孔和背景孔,加入33μL混合荧光编码微球工作液;对每个背景孔,加入17μL TE(pH 8.0)作为空白对照;对每个样品孔,加入12μL TE、5μL PCR反应液。将各孔反复吹打混匀,于PCR仪中进行如下反应:95℃5min,46℃ 15min。杂交结束后,10 000r/min离心3min。同时用1×TMAC杂交液将SA-PE稀释至2μg/mL,制成报告混合液。离心结束后,弃上清加入75μL的报告混合液,吹打几次混匀,于PCR仪上40℃孵育5min[5-6]。按照Luminex公司推荐的仪器检测步骤,设置仪器每次只检测相应编码的荧光编码微球,将上样加热陶瓷底板预先加热至40℃后取样品上机进行检测。
根据Luminex公司推荐的判定标准,当每种荧光编码微球个数不少于20个且背景空白荧光强度不高于3 000,试验成立,进行结果判定。液相芯片定性比值结果(Luminex qualitative ratio result,LQRR)等于样品的校正后的荧光强度中位值(median florescence intensity,MFIs)与空白对照 MFI的平均值(MFIb)的比值,即LQRR=MFIs/mMFIb。如果LQRR≥3,判定为阳性样本;如果2≤LQRR≤3,则判定为可疑;如果LQRR<2,则判定为阴性。
1.2.6 7种血清型STEC液相芯片检测方法的评价
1.2.6.1 灵敏性试验 将7种血清型的大肠埃希菌细菌培养液混合,从原液开始10倍系列稀释至1010,抽提每个稀释度的混合核酸。采用所建立的7种血清型STEC液相芯片检测方法进行灵敏度试验。鉴于7种血清型肠出血性大肠埃希菌均产生产志贺毒素,因此采用市售的“肠出血性大肠埃希菌STX荧光PCR检测试剂盒”进行灵敏度检测,对比两者的灵敏度。
1.2.6.2 特异性试验 取营养肉汤、沙门菌、单增李斯特菌、金黄色葡萄球菌等细菌样品经核酸抽提仪抽提核酸,进行7种血清型STEC液相芯片检测,评价该法的特异性。
1.2.6.3 小样试验 从美国、法国等国家进口的冻肉中采集样品,采用经典的细菌分离鉴定方法分离鉴定细菌。同时对细菌的预培养液采用所建立的液相芯片检测方法进行平等检测,共检测样品20份。探讨该法的田间实用性及可靠性。
2 结果
2.1 7种血清型STEC PCR扩增结果
在50μL 反应体系中,O157、O145、O121、O111、O103、O45和O26血清型大肠埃希菌的单项PCR可特异性分别扩增出相应血清型的目的片段,片段大小分别为 115、292、234、219、149、255、248bp。将7种血清型出血性大肠埃希菌菌株引物混合,同时检测7个血清型菌株混合样品,经多重PCR扩增,可特异性扩增出多重目的片段(图1)。
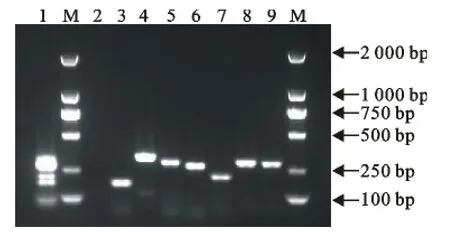
图1 7种血清型大肠埃希菌PCR扩增结果图Fig.1 Amplification results of PCR for seven O serotypes of STEC
2.2 7种血清型STEC液相芯片检测结果
2.2.1 液相芯片检测单个血清型STEC的结果 将各个血清型的探针与相应荧光编码的荧光编码微球偶联,分别只与各个血清型相应的PCR反应扩增产物直接杂交后,进行单血清型液相芯片检测。结果各个参与计数的荧光编码微球均≥20个,表明用于计数的荧光编码微球数量有效,所产生的MFI值可信。各个荧光编码微球的空白对照MFIB介于108~308之间,均<3 000,表明结果有效,试验可以进行结果判定。PCR反应扩增产物的MFIS介于5 321~8 978。探针与相应的PCR扩增的阳性产物之间均有特异性的杂交,LQRR值介于17~63之间,表明均为阳性。各个单血清型检测的MFI值和相应的LQRR结果见表3。
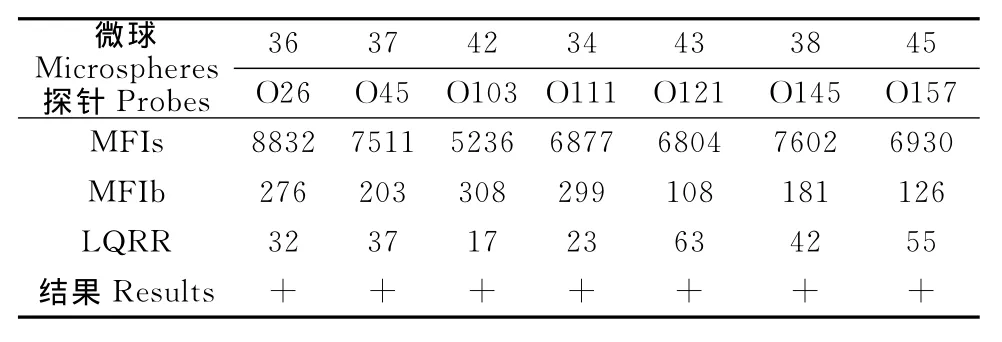
表3 单血清型液相芯片检测MFI值Table 3 MFI value of Luminex for single serotype
2.2.2 液相芯片同时检测七个血清型STEC的结果 将7种血清型菌株多重PCR扩增产物纯化后,直接与混合探针进行杂交,结果各个编码的荧光微球均≥20个,空白对照 MFIb<3 000,表明试验成立,可以进行判定。混合微球与多重PCR扩增产物的 MFI介于9 312~15 321,LQRR值介于11~23之间,表明均为阳性。检测7种血清型菌株的MFI值和相应的LQRR结果见表4。

表4 7种血清型菌株液相芯片同时检测的MFI值Table 4 MFI value of Luminex for seven serogroups mixture
2.2.3 7种血清型STEC液相芯片检测方法的评介
2.2.3.1 灵敏性试验结果 采用所建立的7种血清型STEC液相芯片检测方法检测10倍系列稀释的大肠埃希菌培养混合液,可检测到104稀释度。肠出血性大肠埃希菌STX荧光PCR检测试剂盒检测10倍系列稀释的大肠埃希菌细菌培养混合液,可检测到106稀释度(图2)。所建立的液相芯片检测方法的灵敏度比市售荧光PCR检测试剂盒灵敏度低100倍。
2.2.3.2 特异性试验结果 采用所建立的7种血清型STEC液相芯片检测方法检测营养肉汤、沙门菌、单增李斯特菌、金黄色葡萄球菌等样品抽提的核酸,其的LQRR值介于1~1.6之间,均小于临界值2,表明所建立方法比较特异。

图2 肠出血性大肠埃希菌STX荧光PCR检测试剂盒的灵敏度测定结果Fig.2 Sensitivity test of STX real-time PCR kit for seven serogroup mixture
2.2.3.3 小样试验 通过对美国、法国等国家进口的冻肉90份样品进行检测,共检测出O157阳性样品3份,与细菌的常规检测方法(荧光PCR筛选检测—细菌分离鉴定方确证)结果一致。表明所建立方法具有一定的实用性。
3 讨论
目前,STEC细菌的常规检测方法为先进行预培养,然后用肠出血性大肠埃希菌荧光定量PCR进行筛选,然后用经典的细菌分离培养方法进行确证。整个检测流程比较繁琐,包括细菌预培养、划线培养、生化鉴定、血清分型等步骤,耗时较长,检测通量较低,不能满足快速通关的需求[7]。而近年来液相芯片技术等现代分子生物学方法的出现很大程度上弥补了传统方法的不足,可实现对生物样品快速、并行、高效的检测,是细菌微生物快速高通量检测的趋势之一。在细菌的快速分子生物学检测中,基于PCR和荧光定量PCR的检测逐步占据大规模筛选检测市场,尽管PCR检测具有快速、灵敏的特点,但由于肠出血性大肠埃希菌有较多的O型,在分型鉴定时就比较繁琐。我们所建立的7种血清型的出血性大肠埃希菌液相芯片经过预培养后,即可从分子的角度对觉的7种血清型进行分型鉴定,具有高通量、操作简单快速、特异性强的特点[8]。当然,由于同时对7种血清型进行分型鉴定,其的灵敏度与常规荧光定量PCR相比低了100倍。由于采用液相芯片进行检测时,检测样品是经过预培养的菌液,从一定程度上解决了液相芯片检测灵敏度较低的缺点。本研究以真正实现快速、集成、高通量的检测目的,进行菌株的分型,建立的一种高度敏感、特异及简便的检测平台,并将建立的方法应用于日常的监测具有重要的意义。
目前国内没有同时检测7种出血性大肠埃希菌的报道,国外也没有这种商品化的检测试剂盒。本研究设计了针对出血性大肠埃希菌O103、O111、O121、O145、O26、O45和O157等7种血清型的分型引物和探针,建立了出血性大肠埃希菌PCR检测方法,并将出血性大肠埃希菌分型PCR检测方法与液相芯片检测方法结合,形成了一次多重扩增,结合液相芯片同时检测区分7种血清型的高能量检测方法。所建出血性大肠埃希菌快速高通量分型检测方法检测通量高,可一次对出血性大肠埃希菌O103、O111、O121、O145、O26、O45和O157等7种血清型进行分型鉴定。液相芯片技术具有显而易见的高通量特征,理论上可以同时检测100个目标菌,但是要真正实现这一目标还有必要进一步探索研究。因为高达100种微球混在一起时,微球之间颜色差别变小,存在一定的干扰,检测仪无法完全区分开来,而且微球种类多带来较高的背景信号,影响低浓度样本的判断。
综上所述,本研究所建立的方法快速,出血性大肠埃希菌分型检测可在6h内完成。所建方法特异性强,通过两个引物和一个探针来确保各个血清型的特异性,搭建了出血性大肠埃希菌全新快速高通量检测平台,为其他病原体的快速高通量检测提供了借鉴和经验。
[1]Fratamico P M,Bagi L K.Detection of Shiga toxin-producingEscherichiacoliin ground beef using the Gene Disc real-time PCR system[J].Front Cell Infect Microbiol,2012,2(152):1-6.
[2]Lin A,Kase J A,Moore M M,et al.Multilaboratory validation of a luminex microbead-based suspension array for the identification of the 11most clinically relevant Shiga toxin-producingEscherichia coliO serogroups[J].J Food Prot,2013,76(5):867-870.
[3]Qin Z F,Sun J,Lu T K,et al.Subtyping animal influenza virus with general multiplex RT-PCR and Liquichip high throughput(GMPLex)[J].Virol Sin,2012,27(2):120-131.
[4]Fonseca B P,Marques C F,Nascimento L D,et al.Development of a multiplex bead-based assay for detection of hepatitis C virus[J].Clin Vac Immunol,2011(18):802-806.
[5]Zhao J,Kang L,Hu R,et al.Rapid oligonucleotide suspension array-based multiplex detection of bacterial pathogens[J].Foodborne Pathog Dis,2013,10(10):896-903.
[6]吕东月,石晓路,陈妙龄,等.常见7种食源性致病菌xMAP液相芯片快速筛查方法的建立及应用[J].卫生研究,2012,41(1):96-101.
[7]陈爱平,陈建辉,杨劲松.分子生物学技术在肠出血性大肠杆菌诊断中的应用[J].中国人兽共患病学报,2011,27(9):808-811.
[8]温来欣.Luminex液相芯片在微生物多重检测中的应用[J].职业与健康,2014,30(16):2355-2358.