鸡传染性支气管炎病毒弱毒株ZZ-V35在鸡胚中的增殖规律
2015-06-25闫艺婷潘耀谦勾肖晶静1黄亚明杨激辉刘兴友
闫艺婷,潘耀谦,王 青,勾肖晶,刘 静1,,黄亚明,杨激辉,刘兴友*
(1.河南科技学院动物科学学院,河南新乡453003;2.畜禽智能化清洁生产河南省工程实验室;河南新乡453003;3.动物病毒病防控与药残分析河南省重点学科开放实验室,河南新乡453003)
鸡传染性支气管炎(Infectious bronchitis,IB)是由传染性支气管炎病毒(Infectious bronchitis virus,IBV)引起的一种急性、高度接触性传染病。病鸡主要的临床表现为咳嗽、打喷嚏、生长发育迟缓、产蛋量减少和蛋的品质下降等。另外,患鸡的免疫机能下降,从而易继发感染多种疾病。IBV可通过呼吸道和粪便快速传播,一周内可使整个鸡群感染,具有较高的发病率和病死率,严重阻碍了养禽业的健康发展[1]。
近年来不断有新发现的IBV毒株的报道,如2012年埃及报道了一株可引起严重的呼吸道和肾病变的新型IBV[2];2013年意大利北部报道了可导致病鸡死亡率突增,并伴发肾组织坏死和腺胃炎的Q1株IBV[3]。临床研究发现广西新分离的8个IB毒株,与常规的Mass型疫苗株亲缘关系较远,起不到很好的免疫保护作用[4],因此,传统的活疫苗已不能很好的控制该病的发生。目前,深入研究新的毒株和新型疫苗成为控制该病的重点。2004年,刘兴友等[5]发现一株对鸡和鸭均易感的IBV新型毒株(IBV ZZ2004),用 PK15细胞、Vero细胞和鸡胚成纤维细胞培养均未成功,目前仅能通过鸡胚接毒传代。通过用SPF鸡胚对该毒株低温诱导使其毒力减弱,获得弱毒株IBV ZZ-V35。经鉴定,IBV ZZV35具有良好的免疫原性和生物安全性,具有作为一种新疫苗毒的潜力。本研究旨在通过探针实时定量PCR方法检测IBV ZZ-V35在鸡胚尿囊液中的增殖规律,找出IBV弱毒在鸡胚中增殖量最高的时间点,为研究弱毒苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验材料 IBV ZZ-V35由河南科技学院实验室保存。SPF鸡胚,北京梅里亚维通实验动物技术有限公司产品。
1.1.2 主要试剂 MiniBEST Viral RNA/DNA Extraction Kit 5.0、PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)、Prime-STAR HS DNA 聚合酶、pMD19-T 载体、DH5α化学感 受 态 细 胞、Premix EXTaq(Probe qPCR),TaKaRa公司产品;凝胶DNA快速纯化回收试剂盒、质粒提取试剂盒,OMEGA公司产品;西班牙琼脂糖。
1.2 方法
1.2.1 IBV ZZ-V35实时荧光定量PCR的建立 根据文献[6]IBV ZZ2004全基因序列(JF705860.1)设计一对特异性引物和一条TaqMan探针。引物序列为F1(上游引物):5′-AGGTAGTGGTGTTCCTGATAATGAG-3′,F2(下 游 引 物 ):5′-ACGCATCTGGGACTGGTTTTC-3′,P(探针引物):5′(FAM)-CCTGGCTTATACCTGGCTTGGCGTCT(Eclipse)3′,扩增为N基因的一部分,其产物大小为117bp,由TaKaRa公司合成并标记,用TE缓冲液稀释到10nmoL/mL,置-20℃保存,备用。
1.2.2 RNA的提取及其反转录 将含IBV ZZV35弱毒的尿囊液反复冻融3次后,取含病毒的尿囊液200μL,按提病毒RNA试剂盒的步骤提取病毒RNA。用反转录试剂盒将病毒RNA合成cDNA。
1.2.3 阳性模板的制备 PCR反应体系总量为50μL:5× PrimeSTAR buffer 10 μL,dNTPs(2.5mmol/L)4μL,上、下游引物F1、F2各1μL,PrimeSTAR HS DNA 聚 合酶1μL,cDNA 模板2μL,高压的去离子水31μL。反应条件为:95℃3min;94 ℃ 10s,68 ℃ 2min,35个循 环;68 ℃10min。PCR产物用15g/L的琼脂糖凝胶电泳后,将目的片段回收;16℃过夜,连接pMD19-T载体;转化到DH5α感受态细胞内,涂板氨苄固体培养基37℃12h~14h;挑取单个菌落,于氨苄液体培养基37℃、170r/min摇床过夜,按照质粒提取说明书提取质粒,经PCR鉴定为阳性重组质粒,用蛋白核酸检测仪,测定浓度后,作为阳性模板。样品拷贝数(copies)=(测得样品浓度×阿氏常数)/样品总分子量长度×660)。
1.2.4 实时定量RT-PCR标准曲线的建立 将已知浓度的标准阳性质粒经101~10710倍梯度稀释,每个稀释度设3个重复,Ct值为纵坐标,稀释倍数的对数为横坐标,建立标准曲线。荧光定量的反应体系为20μL,ExTaq(2x)10μL,上、下游引物各0.4μL,TaqMan探针0.8μL,Rox Reference DyeⅡ0.2μL,cDNA 模板2.0μL,高压去离子水6.2μL。荧光定量反应条件为:95℃20s;95℃3s,60℃32s,40个循环。
1.2.5 IBV ZZ-V35感染SPF鸡胚 孵化箱熏蒸消毒1h~2h,通风24h~48h,SPF鸡胚用1g/L的KMnO4表面消毒后,置于预热的孵化箱中。孵化条件为:37.8℃,湿度50%~60%,间隔2h自动翻蛋。弱毒尿囊腔原液经0.22μm滤膜过滤后,接种于11日龄SPF鸡胚0.2mL/枚,弃去24h死亡的鸡胚。孵化至36、48、52、56、60、64、68、72、76、80、88、96、120、144h分别取样。
1.2.6 感染样品的采集及cDNA的制备 每个时间点取接种IBV ZZ-V35弱毒株的SPF鸡胚3枚,无菌收集鸡胚尿囊液,反复冻融3次后,取病毒液200μL,按照提取病毒 RNA/DNA 试剂盒提取RNA,并按照反转录试剂盒说明书合成cDNA,用已建立的实时定量PCR方法对每个时间点的样品检测,然后计算IBV ZZ-V35在不同时间按的拷贝数,以及3重复样品之间的变异系数。
2 结果
2.1 阳性模板的制备
用设计的IBV ZZ-V35特异性引物,进行RTPCR扩增,结果显示扩增出一条约117bp的特异性条带,与预期结果一致(图1)。将PCR产物回收,连接pMD18-T载体,并转化到DH5α感受态细胞,挑取阳性重组质粒。经核酸蛋白测定仪,测得阳性重组质粒的浓度为206×10-6g/mL。
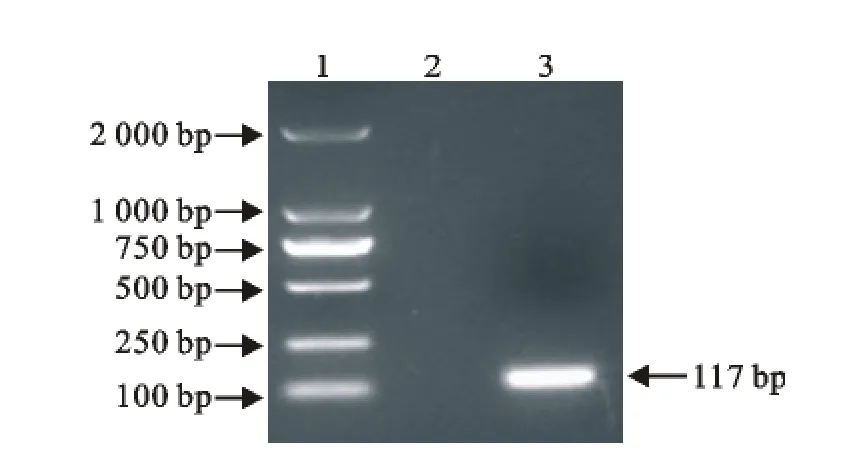
图1 RT-PCR产物电泳Fig.1 Electrophoresis of RT-PCR products
2.2 实时定量RT-PCR标准曲线的建立
IBV ZZ-V35的阳性质粒经实时定量PCR扩增,其扩增曲线和标准曲线见图2和图3。结果显示,所建立的IBV ZZ-V35实时定量PCR方法在10-2~10-7倍稀释范围呈良好的线性关系,Ct值范围是7.99~24.84,标准曲线的线性关系R2=1,斜率为-3.277。log(copies/μL)=(Ct-28.191)/-3.277。扩增效率(E%)为101.888。
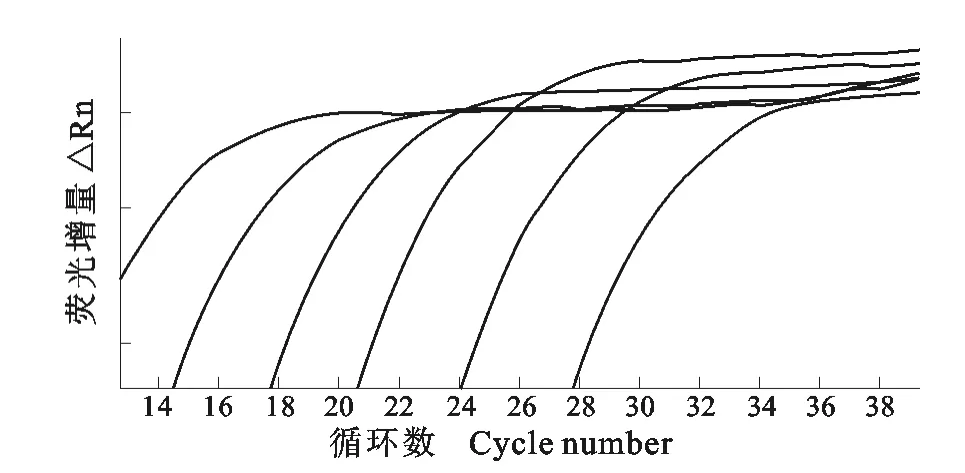
图2 IBVZZ-V35TaqMan探针荧光定量PCR扩增曲线Fig.2 Amplification curve of IBVZZ-V35TaqMan quantitative real-time PCR
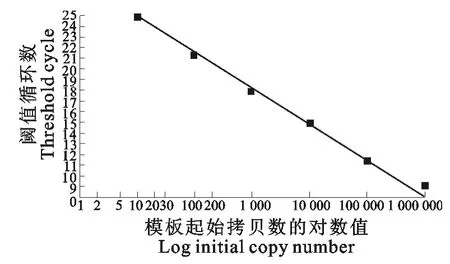
图3 IBV ZZ-V35TaqMan探针荧光定量PCR标准曲线Fig.3 Standard curve of IBV ZZ-V35TaqMan quantitative real-time PCR
2.3 IBV ZZ-V35在SPF鸡胚中的增殖规律
用建立的IBV ZZ-V35探针实时定量PCR方法检测感染该弱毒株不同时间的SPF鸡胚尿囊液中IBVZZ-V35的含量。检测结果显示,SPF鸡胚感染IBV ZZ-V3536、48、52、56、60、64、68、72、76、80、88、96、120、144h,尿囊液中病毒的平均拷贝数为1.416×106、1.791×106、2.056×106、3.027×106、3.664×106、1.854×106、1.380×106、1.109×106、7.976×105、5.408×105、2.958×105、2.512×105、4.365×104、1.130×104。变异系数为0.8%~2.1%。根据该弱毒株在SPF鸡胚尿囊液中的病毒拷贝数绘制曲线(图4)。
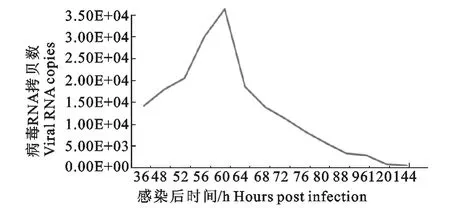
图4 IBVZZ-V35感染SPF鸡胚不同时间病毒的增殖曲线Fig.4 Proliferation curve of IBVZZ-V35in SPF chicken embryoes at different time post-infection
3 讨论
实时定量PCR技术不仅在基础研究和医学领域中广泛应用,在畜牧兽医学领域中也发挥了巨大的作用[7]。实时定量PCR技术分为相对定量和绝对定量。前者应用较多的是SYBR Green染料法,后者是TaqMan探针法。SYBR Green染料能够与所有的双链DNA结合,故易出现非特异性扩增而影响检测结果的可靠性和重复性。TaqMan探针是根据合成片段设计的特异性探针引物,具有高度的特异性和敏感性。申伟霞等[8]研究表明双重TaqMan探针实时定量PCR方法对H3、H9亚型流感病毒进行检测,敏感度分别提高了100倍和1 000倍。Meir R等[9]研究表明TaqMan探针荧光定量可高效快速的检测出临床样本中IBV。张鹳晓等[10]采用TaqMan探针方法可快速、敏感、特异的检测到活禽中新城疫病毒中强毒株。梁耀峰等[11]TaqMan探针方法建立了IBV H52株的定量的检测方法,比常规PCR敏感性高10倍。上述均表明了TaqMan探针方法具有明显的特异性和敏感性,可作为病毒定性和定量的有效手段。
本研究主要通过TaqMan探针实时定量RTPCR方法绘制了IBV ZZ-V35在SPF鸡胚中的增殖曲线,证明在52h~64h病毒的拷贝数较高,60h达到峰值,以后逐渐下降。这可能是由于通过鸡胚传代致弱的毒株,在鸡胚中的适应性逐渐上升,48h后鸡胚死亡率有所上升,但此时弱毒株的增殖也趋于上升阶段,但是随着鸡胚的生长,抵抗力增强,病毒的复制也出现下降趋势,表现在64h后病毒增殖明显下降。该毒株在细胞上培养还未获得突破性的进展,通过鸡胚尿囊液扩增病毒是其主要手段。通过TaqMan探针实时定量PCR能够精确的检测到鸡胚尿囊液中病毒的含量,为传染性支气管炎病毒ZZ-V35弱毒株的研究提供了依据,更为今后IBV弱毒疫苗的研究奠定了基础。
[1]孙长春.鸡传染性支气管炎的诊断与防制[J].畜牧与饲料科学,2009,30(11-12):105-107.
[2]Abdel-Moneim A S,Afifi M A,El-Kady M F.Emergence of a novel genotype of avian infectious bronchitis virus in Egypt[J].Arch Virol,2012,157(12):2453-2457.
[3]Toffan A,Bonci M,Bano L,et al.Diagnostic and clinical observation on the infectious bronchitis virus strain Q1in Italy[J].Vet Ital,2013,49(4):347-355.
[4]陈 丽,薛 瑜,李光伟,等.传染性支气管炎病毒广西分离株S1基因克隆与序列分析[J].动物医学进展,2014,35(3):68-72.
[5]于 娟.鸭源性IBVZZ2004株S1和M基因在sf9昆虫细胞中的表达及表达蛋白的抗原性研究[J].河南郑州:河南农业大学,2012.
[6]周晓丽.鸡生长与免疫抑制综合症病毒RT-PCR及荧光定量RT-PCR检测方法的建立[D].河南郑州:河南农业大学,2010.
[7]徐 波,张建超.实时荧光定量PCR技术及在畜牧兽医中的应用[J].畜禽业,2009(12):10-12.
[8]申伟霞,田巧珍,陈 圆,等.H3、H9压性禽流感病毒双重荧光定量PCR方法的建立及初步应用[J].中国动物传染病学报,2014,22(1):16-24.
[9]Meir R,Maharat O,Farnushi Y,et al.Development of a realtimeTaqMan RT-PCR assay for the detection of infectious bronchitis virus in chickens,and comparison of RT-PCR and virus isolation[J].J Virol Meth,2010,163:190-194.
[10]张鹤晓,赖平安,高志强,等.荧光RT-PCR检测活禽和禽产品中新城疫病毒中强毒株的研究[J].中国兽医杂志,2006,42(3):3-6.
[11]梁耀峰,郭霄峰,宋 立,等.鸡传染性支气管炎病毒 H52株TaqMan-MGB荧光定量RT-PCR检测方法的建立[J].中国畜牧兽医,2012,39(4):169-173.