蓝舌病、口蹄疫、小反刍兽疫和水泡性口炎多重PCR检测方法的建立
2015-06-25邹丰才杨云庆聂福平叶玲玲周晓黎
秦 敏,邹丰才,杨云庆,祝 贺,聂福平,王 煜,杨 俊,叶玲玲,周晓黎,艾 军*
(1.云南农业大学,云南昆明650201;2.云南出入境检验检疫局,云南昆明650228;3.重庆出入境检验检疫局,四川重庆400020)
蓝舌病、口蹄疫、小反刍兽疫和水泡性口炎分别是由蓝舌病病毒(Blue tongue virus,BTV)、口蹄疫病毒(Foot-and-mouth disease virus,FMDV)、小反刍兽疫病毒(Peste des petits ruminants virus,PPRV)和水泡性口炎病毒(Vesicular stomatitis virus,VSV)引起的动物急性传染病,这4种病毒都可以引起反刍动物发病,发病率极高,并能够形成大范围的流行,均被世界动物卫生组织(OIE)列为法定报告的动物疫病。
BTV存在25个血清型,每个血清型均为一种新的病毒。1994年-1997年间对我国云南、山西、四川、湖北、内蒙古、新疆、西藏7个省区采集的7 158份4种反刍动物(山羊、绵羊、黄牛、水牛)血清样品进行血清学分析,鉴定出BTV-1、2、3、4、12、15、16等7个血清型,其中BTV-1型和BTV-16型是主要的致病血清型。FMDV包括7个血清型:O、A、C、SAT1、SAT2、SAT3、Asia1型,每个型又可以进一步分为不同的亚型。PPRV只有1个血清型,但根据基因进化树将该病毒分为4个系,分别为Ⅰ、Ⅱ、Ⅲ、Ⅳ。VSV包括NJ型和IND型,在引起家畜发病的血清型中,NJ型占多数。
4种病毒在临床上存在混合感染,同时均表现出精神沉郁,体温升高,口腔黏膜、乳头和蹄部冠状带等处发生水泡及溃疡,在临床诊断上不易区分,必须通过病原学进行鉴别诊断。但传统的病原分离耗时耗力,普通PCR检测需要不同的反应体系,耗时费力。本研究通过分析比对,针对4种病毒的相对保守基因设计特异性引物,建立了BTV、FMDV、VSV、PPRV 4种病毒多重PCR快速检测方法。
1 材料与方法
1.1 材料
1.1.1 病毒与质粒 BTV 4型、BTV 8型、BTV 9型、BTV 15型、BTV 17型、BTV 18型灭活病毒、FMDV O型、FMDV A型、FMDV AsiaⅠ型灭活病毒、PPRV疫苗株和 VSV NJ型、VSV IND型灭活病毒、正常BHK-21细胞由云南出入境检验检疫局动检实验室保存;山羊痘病毒、绵羊痘病毒、牛结节性皮肤病病毒由重庆出入境检验检疫局动检实验室保存。
1.1.2 主要试剂 Prime Script RT reagent Kit、Premix rTaqDNA 聚合酶、pMD18-T克隆载体、DH5α感受态细胞,宝生物工程(大连)有限公司产品;Trizol Reagent为Invitrogen公司产品;小量凝胶回收试剂盒及小量质粒提取试剂盒,AxyGEN公司产品;乙醇、氯仿、异丙醇等,国产分析纯试剂。
1.2 方法
1.2.1 引物设计与合成 根据NCBI上公布的4种病毒的不同型的基因序列,利用MEGA5.2软件找到针对BTV的NS3基因、FMDV的3D基因、PPRV的N基因和VSV的N基因序列的相对保守区,应用Primer5.0软件设计4对特异性引物(BTV登录号:JX680466、FMDV 登录号:X85493、PRRV登录号:EU340363和VSV登录号:AY383716)(表1)。引物设计好后,通过NCBI Blast对引物的特异性进行比对,4对引物均具有良好的特异性。引物由宝生物工程(大连)有限公司合成。
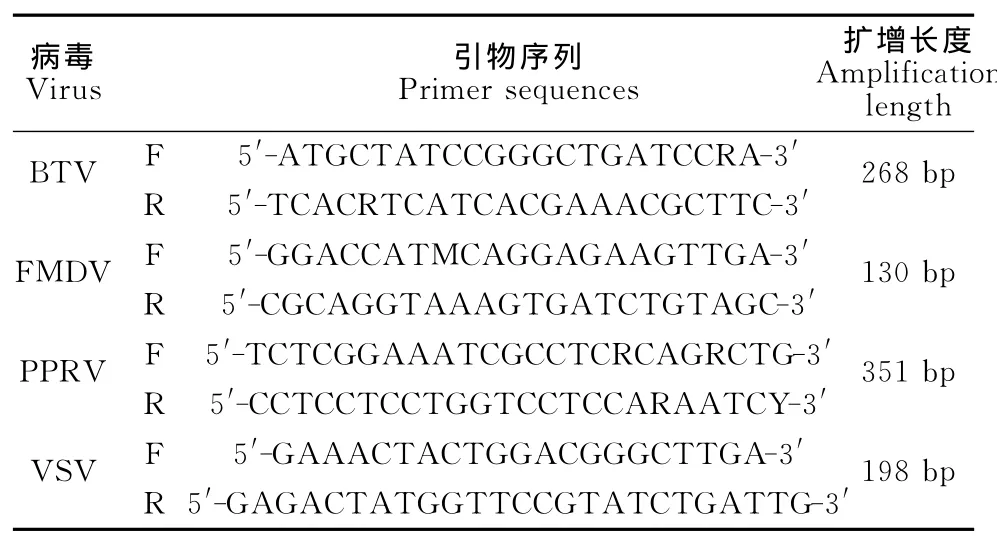
表1 多重PCR引物信息Table 1 The information of primers for multiplex PCR
1.2.2 单重PCR引物验证 取BTV 4型、BTV 8型、BTV 9型、BTV 15型、BTV 17型、BTV 18型灭活病毒、FMDV O 型、FMDV A 型、FMDV AsiaⅠ型灭活病毒、VSV NJ型、VSV IND型灭活病毒和PPRV疫苗株按照Trizol Reagent说明书方法提取RNA,并按照Prime Script RT reagent kit试剂盒说明书将病毒RNA反转录为cDNA,以cDNA为模板进行单引物单模板PCR扩增。PCR扩增体系为25μL,分别为Premix rTaqDNA 聚合酶12.5μL、上下游引物各1μL(20μmol/L)、模板cDNA 2μL,其余用去离子水补足。PCR扩增条件:预变性95℃5min;95℃30s,57℃45s,72℃30s,35个循环;72℃10min;4℃保存。PCR扩增产物于20g/L琼脂糖凝胶中,100V电泳40min后,观察扩增条带。
1.2.3 阳性克隆质粒的构建 针对4种病毒的靶基因序列扩增得到PCR产物,连接到pMD18-T载体上,构建4种病毒的克隆质粒。
1.2.4 多重PCR反应体系的优化 对4种病毒的阳性克隆质粒用紫外分光光度计测定浓度,计算其拷贝数,以108copies/μL作为模板,构建多重PCR体系。以病毒的阳性克隆质粒为模板进行PCR扩增(反应体系为25μL),分别为 Premix rTaqDNA聚合酶12.5μL、引物4μL(2种引物各0.5μL)、模板2μL(4种质粒各0.5μL),其余用去离子水补足。PCR扩增条件:预变性95℃5min;95℃30s,57℃45s,72℃30s,35个循环;72℃10min;4℃保存。PCR扩增产物于20g/L琼脂糖凝胶中,100V电泳40min后,观察结果。
然后对多重PCR反应的各引物浓度、反应温度、扩增时间等进行优化,优化条件变化如下:各引物浓度为0.15、0.3、0.45、0.5、0.55、0.6、0.65、0.7 μmol/L;反应温度梯度为55、56、57、58、59、60℃;退火时间梯度为30、45、60s,筛选出多重PCR扩增的最佳反应条件。
1.2.5 多重PCR特异性试验 采用两种方法评估建立的多重PCR检测方法的特异性。①将试验毒株(BTV、PPRV、VSV、FMDV)进行人为的混合,利用多重PCR方法进行检测,分析所建立的方法对4种病毒检测的特异性;②利用多重PCR方法对反刍动物易感的山羊痘病毒(GPV)、绵羊痘病毒(SPV)、牛结节性皮肤病病毒(LSDV)进行检测,分析建立方法的特异性。
1.2.6 多重PCR敏感性试验 将携带PPRV N基因、BTV NS3基因、VSV N 基因、FMDV 3D基因的克隆质粒进行10倍递减稀释,使质粒浓度为108copies/μL~101copies/μL。取各相同浓度质粒人为混合后作为模板,按已优化的多重PCR反应条件进行扩增,分析多重PCR的敏感性。
1.2.7 样品检测 应用多重PCR检测方法对PPRV细胞培养物、BTV4型、15型、17型细胞培养物,15份BTV临床送检样品以及正常BHK-21细胞等20份样品进行检测。
2 结果
2.1 单重PCR验证引物特异性
利用设计的不同引物对,分别检测相应的病毒。通过对PPRV、BTV、VSV、FMDV不同型毒株进行单重PCR检测,以验证引物的特异性。结果显示引物特异性良好,以同一病毒不同型别毒株的cDNA为模板,均能以对应的引物扩增到相应的目的片段(图1~图4)。
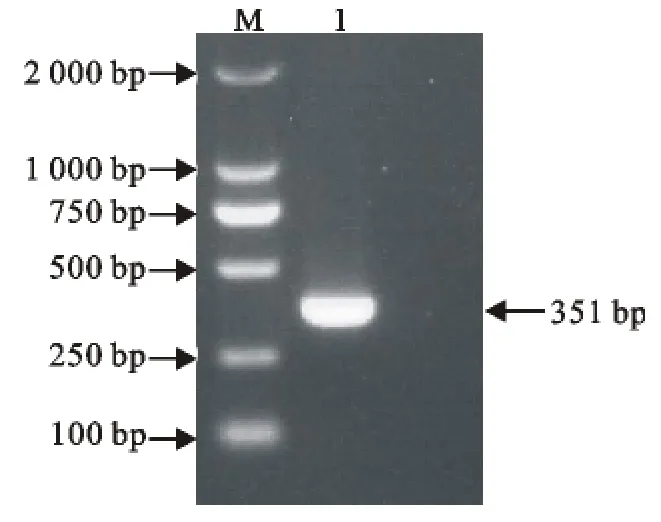
图1 PPRV扩增结果图Fig.1 PCR results of PPRV
2.2 多重PCR扩增条件的优化
对PPRV、BTV、VSV和FMDV 4对引物浓度、多重PCR扩增温度、时间等条件进行了优化。当质粒浓度为108copies/μL时,多重PCR反应体系中以引物终浓度分别为 PPRV 0.65μmol/L、BTV 0.15 μmol/L、VSV 0.5 μmol/L、FMDV 0.7 μmol/L为佳;退火温度为57℃(图5)。在此条件下,多重PCR扩增以如下反应模式为佳:95℃5 min;95℃30s,57℃45s,72℃30s,共进行35个循环;72℃10min,4℃保存。
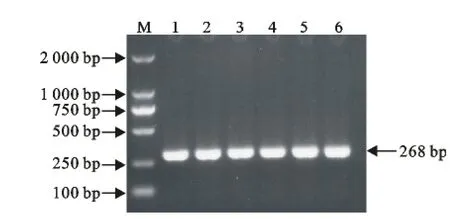
图2 BTV PCR扩增结果Fig.2 PCR results of BTV
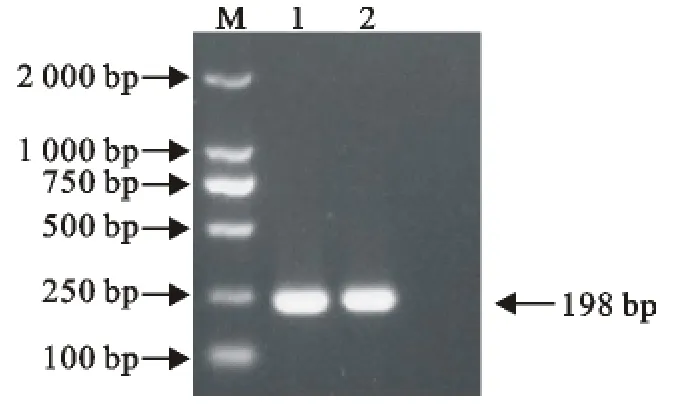
图3 VSV PCR扩增结果Fig.3 PCR results of VSV
2.3 多重PCR特异性试验结果
利用优化好的多重PCR反应条件,对PPRV疫苗株、BTV 8型、VSV NJ型和FMDV AsiaⅠ型的cDNA模板人为混合后进行多重PCR扩增,结果含有PPRV、BTV、VSV和FMDV的核酸样品均扩增出与试验设计相符的目的条带(图6),分别为351、268、198、130bp,且无其他非特异性扩增条带。选取GPV、SPV、LSDV核酸样品进行多重PCR检测,结果均为阴性(图7)。
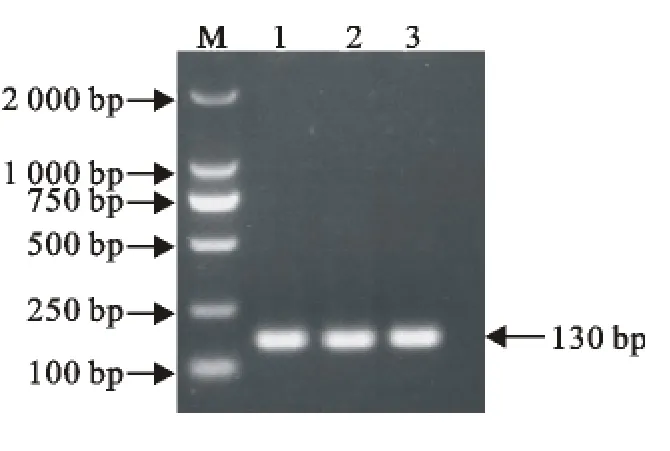
图4 FMDV PCR扩增结果Fig.4 PCR results of FMDV
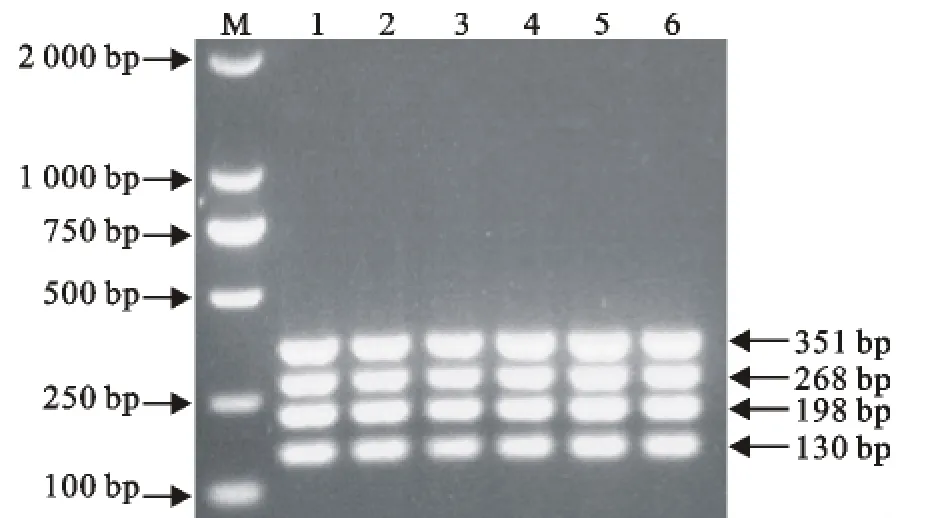
图5 PPRV、BTV、VSV、FMDV多重温度梯度PCRFig.5 The multiple temperature gradient PCR of PPRV,BTV,VSV,FMDV
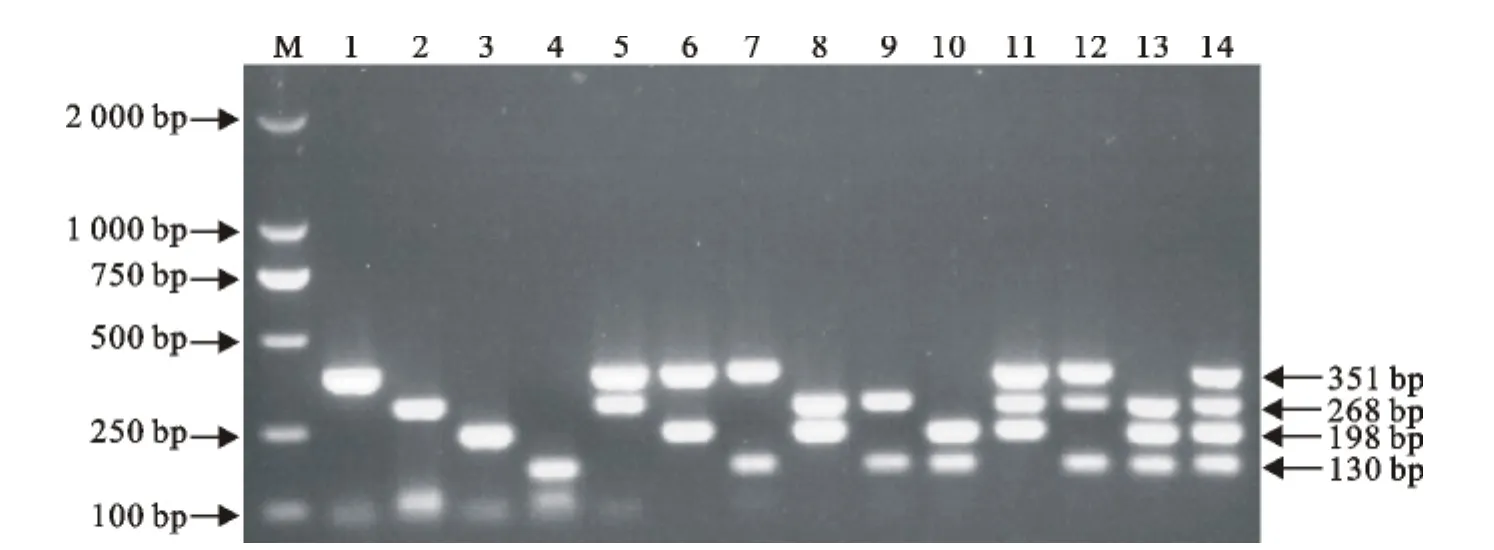
图6 多重PCR特异性扩增结果Fig.6 The specificity results of multiplex PCR

图7 多重PCR特异性扩增结果Fig.7 The specificity results of multiplex PCR
2.4 多重PCR敏感性结果分析
在引物终浓度分别为 PPRV 0.65μmol/L、BTV 0.15 μmol/L、VSV 0.5 μmol/L、FMDV 0.7μmol/L时,该多重PCR能检测出的最低拷贝数分别为 PPRV 103copies/μL、BTV 103copies/μL、VSV 103copies/μL、FMDV 102copies/μL(图8)。
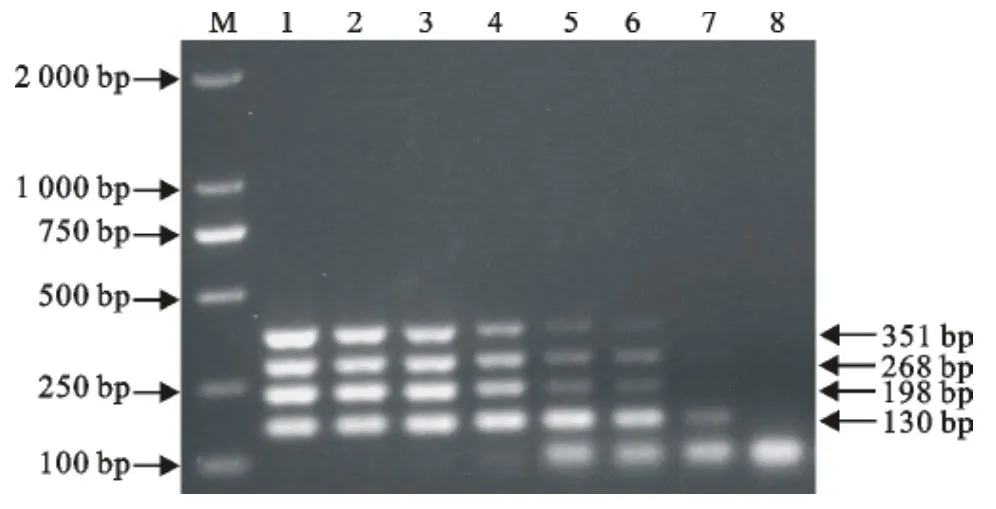
图8 多重PCR敏感性扩增结果Fig.8 The sensitivity results of multiplex PCR
2.5 样品检测结果
应用多重PCR体系对PPRV和BTV细胞培养物,BTV临床送检样品以及正常BHK-21细胞等20份样品进行检测,结果表明,病毒细胞培养物检测为阳性,正常BHK-21细胞和BTV临床送检样品检测均为阴性。利用现行国标(BTV国家标准号:GB/T 18089—2008;PPRV 国家标准号:GB/T 27982—2011)检测方法验证,与多重PCR检测结果相同。
3 讨论
多重PCR(multiplex PCR)是在同一个PCR反应体系中加入两对或两对以上的引物,并能同时扩增出对应的多个核酸片段的PCR方法。该技术主要用于多种病原微生物的同时检测或鉴定某些遗传病及癌基因的分型鉴定等。多重PCR具有高效性、系统性、经济简便等优点,在同一PCR反应管内可以同时检出多种病原微生物,或对有多个型别的目的基因进行分型,另外,多种病原体在同一反应管内可以同时被检出,将大大节省时间、试剂、经费开支。
本研究所建立的多重PCR方法能在一次的反应中检测出由PPRV、BTV、VSV和FMDV 4种病毒的核酸,通过对检测方法的特异性、敏感性和临床样品检测,初步表明该检测方法可作为上述4种病原快速筛查的候选方法,具有一定的临床应用意义。
多重PCR的扩增效率受到多种因素的影响,特异性引物的设计是多重PCR的关键,设计特异性引物首要考虑选择的目的基因,在本研究中,主要是基于以下几方面的原因选择了多重PCR扩增的目的基因:①BTV的保守基因,报道主要有编码病毒非结构蛋白的NS1和NS3基因,编码病毒核衣壳蛋白的VP7基因。在现行的蓝舌病病毒检测的国家标准和OIE手册推荐的PCR方法中,检测的目的片段为BTV NS1基因;OIE手册推荐的BTV荧光PCR检测中,检测的目的片段为NS3基因;部分论文报道的蓝舌病病毒PCR检测,检测引物扩增的目的片段为VP7基因。本研究中,利用 MEGA5.2软件,分析了NCBI中蓝舌病病毒1~24个血清型的VP7NS3 NS1基因片段的保守区,结合引物设计的原则,选择了NS3基因作为本研究扩增的目的片段。②PPRV的保守基因,报道主要是编码核蛋白的N基因,核蛋白在病毒蛋白中含量最高,是病毒颗粒的主要组成部分。PPRV的国家检测标准中规定的RT-PCR检测方法选用N基因作为目的基因,在对N基因的序列比对时,其保守性相对较好,因此,本研究针对PPRV N基因序列设计引物。③VSV的保守基因,报道主要是编码核衣壳蛋白的N基因,N基因由422个氨基酸组成,呈现群特异性,为不同型的VSV所共有,且与其他弹状病毒无任何的交叉反应。VSV的行业检测标准中规定的半套式RTPCR方法选用L蛋白基因较保守的序列作为PCR扩增区,本研究中,我们利用 MEGA5.2软件,分析了NCBI中报道的VSV不同型的L/N基因片段的保守区,结合引物设计的原则,选择了N基因作为本研究扩增的目的片段。④FMDV的保守基因,报道主要是5′UTR基因和3D基因。在现行的口蹄疫行业检测标准中,PCR检测方法中检测的目的基因为5′UTR基因,荧光PCR中检测的目的基因为5′UTR基因和3D基因,同时在引物设计前期通过对FMDV的不同基因序列的保守性比对,选择3D基因作为本研究中检测口蹄疫病毒的特异性引物序列。本研究设计的4对特异性引物的G+C%含量相近,Tm值相近,这就保证了在相同的退火温度下,PPRV、BTV、VSV和FMDV的目的基因都能得到很好地扩增。在进行多重PCR扩增条件的优化时,4对引物的工作浓度对扩增效率有很大的影响,然而,退火温度对扩增效率的影响不大,通过对引物的退火温度的优化结果图可知55℃~60℃均可,因此选择一个中间温度进行多重PCR反应。但是在多重PCR扩增过程中,仍有不同程度的引物二聚体形成,需进一步克服研究。
本研究应用建立的方法对BTV、PPRV感染的细胞培养物进行了检测,均能检出相应病毒核酸。对15份临床抗凝血、组织样本的检测中,检测结果均为阴性。同时用国标推荐的检测方法进行了验证,均为阴性。本研究中,由于PPR、VS、FMD临床样品收集较困难,未能对本方法进行进一步验证,在今后的试验中,将进一步增加所建立方法对临床样品检测的应用研究,使本研究建立的多重PCR方法更适合临床检测应用。
[1]殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社,1998.
[2]Khalafalla A I,Saeed I K,Ali Y H,et al.An outbreak of peste des petits ruminants(PPR)in camels in the Sudan[J].Acta Trop,2010,116(2):161-165.
[3]Sen A,Saravanan P,Balamurugan V,et al.Vaccines against peste des petits ruminants virus[J].Expert Rev Vac,2010,9(7):785-796.
[4]Hayama Y,Muroga N,Nishida T,et al.Risk factors for local spread of foot-and-mouth disease,2010epidemic in Japan[J].Res Vet Sci2012932631-635.
[5]Chen Q R,Vansant G,Oades K,et al.Diagnosis of the small round blue cell tumors using multiplex polymerase chain reaction[J].J Mol Diagnost,2007,9(1):80-88.
[6]Giridharan P,Hemadri D,Tosh C,et al.Development and evaluation of a multiplex PCR for differentiation of foot-and-mouth disease virus strains native to India[J].J Virol Meth,2005,126(1):1-11.
[7]Bao H F,Li D,Guo J H,et al.A highly sensitive and specific multiplex RT-PCR to detect foot-and-mouth disease virus in tissue and food samples[J].Arch Virol,2008,153(1):205-209.
[8]陈明洁,方 倜,柯 涛,等.多重PCR-一种高效快速的分子生物学技术[J].武汉理工大学学报,2005,27(10):33-36.
[9]祁会彩,龚振华,杨增岐,等.多重RT-PCR检测猪口蹄疫病毒,猪水泡病病毒和猪水疱性口炎病毒的研究[J].中国动物检疫,2006,23(3):24-26.
[10]刘晓丹,孟祥莉,徐 凝,等.多重PCR方法快速检测3种消化道病原菌[J].中国预防兽医学报,2013,35(4):308-310.
[11]刘建柱,崔玉东,李 鹏,等.多重PCR检测猪瘟病毒、猪细小病毒、猪伪狂犬病病毒[J].中国兽医学报,2003,23(6):535-537.
[12]黄银花,胡晓湘,徐慰倬,等.影响多重PCR扩增效果的因素[J].遗传,2003,25(1):65-68.
[13]GB/T 18089—2008.蓝舌病病毒分离、鉴别及血清中和抗体检测技术[S].
[14]Anthony S,Jones H,Darpel K E.A duplex RT-PCR assay for detection of genome segment 7(VP7gene)from 24BTV serotypes[J].J Virol Meth,2007,141(2):188-197.
[15]GB/T 27982—2011.小反刍兽疫诊断技术[S].
[16]SN/T 1166—2010.水泡性口炎检疫技术规范[S].
[17]SN/T 1181—2010.口蹄疫检疫技术规范[S].