表达猪圆环病毒2型Cap蛋白重组腺病毒的构建
2015-06-25李海敏王爱玲李春燕李河林吕其壮张彦明郭抗抗
许 晗,李海敏,王爱玲,李春燕,李河林,吕其壮,张彦明,郭抗抗
(西北农林科技大学动物医学院,陕西杨凌712100)
猪圆环病毒2型(Porcine circovirus type 2,PCV-2)属圆环病毒科圆环病毒属,是目前发现的最小的动物病毒[1]。PCV-2是断奶仔猪多系统衰竭综合征(Post weaning multisystemic wasting syndrome,PMWS)、猪皮炎肾病综合征(Porcine dermatitis and nephropaphy syndrome,PDNS)、仔猪先天性震颤(Congenital tremors,CT)及猪呼吸道疾病(Porcine respiratory disease complex,PRDC)等的主要致病因素[2-3],其感染呈全球性分布,是危害养猪业的重要病原。国内猪场PCV-2的感染情况比较严重,往往与其他病原混合感染,最常见的是与猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪瘟病毒(Classical swine fever virus,CSFV)、猪细小病毒(Porcine parvovirus,PPV)等混合感染。为了预防PCV-2相关疾病的发生,减少养猪业的损失,对繁殖母猪和仔猪进行PCV-2疫苗免疫是目前生产中采用的主要措施。近10年来,多种PCV-2商品疫苗推向市场,如法国梅里亚公司研制的全病毒灭活苗“Circovac”,德国勃林格公司研制的亚单位疫苗“Ingelvac CircoFLEX”,均对繁殖母猪和仔猪具有良好的保护效果[4]。国内也有多家兽用生物制品相关企业都有PCV-2灭活疫苗上市销售。这些PCV-2疫苗都能够激发动物的免疫反应,有效地降低PCV-2对猪的感染,保护动物的免疫系统。虽然如此,但目前PCV-2依然在猪场存在,甚至流行[5]。因此,研究一种抗原浓度高、安全性好的新型猪圆环病毒疫苗成为现实需要。
基因工程疫苗较之灭活疫苗和弱毒疫苗,具有安全性好,稳定性强,可区分免疫动物和自然感染动物,易制成多价联苗等优点。本研究采用重组腺病毒表达系统,构建了表达PCV-2Cap基因和具有免疫增强作用的耶尔森菌侵袭素C端(InvC)基因的重组腺病毒,为新型猪圆环病毒疫苗的研发提供了基础材料。
1 材料与方法
1.1 材料
1.1.1 质粒和细胞 腺病毒穿梭质粒载体pAd-Shttle-CMV,带有绿色荧光蛋白标记的骨架载体pAdEasy-1、插入PCV-2全基因序列的重组质粒TPCV-2、HEK293AD细胞、E.coli菌株 DH5α均由西北农林科技大学动物医学院兽医公共卫生学实验室提供;pAd-(Gly4Ser)3-InvC由西北农林科技大学动物医学院杜恩歧副教授馈赠。
1.1.2 主要试剂 高保真 Prime STAR HSTaq、BglⅡ、SalⅠ和HindⅢ限制性内切酶,T4DNA连接酶,Trizol试剂,TaKaRa公司产品;PacⅠ,NEB公司产品;PmeⅠ内切酶,TurboFect转染试剂,Thermo公司产品;质粒提取试剂盒,核酸胶回收试剂盒,百泰克公司产品;胎牛血清,BioWest公司产品;DMEM培养基,Hyclone公司产品;Dylight594山羊抗兔抗体,晶彩生物公司产品。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中发表的PCV-2Cap基因序列(KM924367.1)以及(Gly4Ser)3-InvC序列(HE805230.1)(InvC)设计引物,由北京华大基因公司合成。引物序列为:Cap上游引物P1:5′-GAAGATCTATGACGTATCCAAGGAGGCG-3′,划线部分为BglⅡ酶切位点;Cap下游引物P2:5′-ACGCGTCGACTTAAGGGTTAAGTGG-3′,划线部分为SalⅠ酶切位点;PCR产物大小为702bp。InvC(664bp)上游引物 P3:5′-ACGCGTCGACGGATCCGGATCAGGTTCAG-3′,划线部分为SalⅠ酶切位点;InvC下游引物P4:5′-CCCAAGCTTCTATATTGCCAGCGCACAG-3′,划线部分为HindⅢ酶切位点;PCR产物大小为664bp。图1示例2个目的基因与酶切位点之间的关系。

图1 目的基因与酶切位点位置关系Fig.1 The position relation between two target genes and three restriction sites
1.2.2 目的基因扩增 以插入PCV-2全基因序列的重组质粒 T-PCV-2,pAd-(Gly4Ser)3-InvC 为模板,分别用P1、P2,P3、P4引物,扩增获得Cap基因和InvC基因。PCR反应体系为50μL,包括5×Primes TAR buffer 10 μL,上、下 游 引 物(10μmol/L)各2.5μL,模板10μL,prime STAR HS DNA Polymerase 0.5μL,灭菌水 20.5μL。PCR反应条件:98℃ 5min;98℃ 30s,60℃15s,72℃50s,共35个循环;72℃10min。Cap和InvC基因PCR产物均经10g/L琼脂糖凝胶电泳鉴定后回收。
1.2.3 重组腺病毒穿梭载体的构建 将Cap基因先连接于载体pAdShuttle-CMV,连接成功后再将InvC基因连接于pAdShuttle-CMV-Cap,获得穿梭质粒pAdShuttle-CMV-Cap-InvC。步骤为:首先将Cap基因和腺病毒穿梭载体pAdShuttle分别用BglⅡ和SalⅠ进行双酶切,回收产物,按说明书用T4连接酶将双酶切产物4℃过夜连接,转化入DH5α感受态细胞,LB培养液37℃、190r/min摇菌60min,4 000r/min、离心5min,弃去大部分培养液,剩余100μL LB培养液吹悬菌泥,涂布于含有50μg/mL卡那霉素的LB培养板上,37℃16h,挑出15个~20个单个菌落培养,PCR、BglⅡ和SalⅠ双酶切鉴定含有Cap基因的重组质粒。取阳性质粒与InvC基因用SalⅠ和HindⅢ双酶切,按前述操作,将InvC连入载体,获得经SalⅠ和HindⅢ双酶切鉴定有InvC基因的重组质粒。阳性质粒送至华大基因公司测序。
1.2.4 同源重组腺病毒载体的构建及鉴定 用PmeI酶对pAdShuttle-CMV-Cap-InvC线性化酶切,CaCl2法转化入BJ5183感受态细胞(含pAdEasy骨架质粒),冰浴30min,LB培养液37℃、170r/min摇菌90min,离心后取菌泥涂布于含有50μg/mL卡那霉素的LB培养板上,37℃20h,挑取单个菌落LB培养液37℃、170r/min摇菌14h,提取质粒,8g/L琼脂糖凝胶电泳鉴定质粒大小,挑选约30kb大小的阳性质粒再通过PacⅠ酶切鉴定,鉴定正确后命名pAd-Cap-InvC。将重组质粒转化入DH5α感受态细胞培养,提取质粒,菌液和质粒均保存于-20℃备用。同时构建仅插入目的基因片段Cap的pAd-Cap,未插入任何目的基因的pAd作为试验对照,同步进行后续试验。
1.2.5 重组腺病毒的包装 将PacⅠ酶切线性化的重组质粒用TubofectTM转染试剂按说明书转染HEK293细胞,待转染后7d~10d细胞明显病变,收集培养液和细胞,反复冻融3次,4℃、11 000r/min离心12min,收集上清液作为病毒液,继续感染HEK293细胞24h~48h至出现细胞病变,同时能在荧光显微镜下观察到pAd-Easy-1载体绿色荧光蛋白基因表达的绿色荧光,收集培养液和细胞,按上述方法收集保存上清液,获得的重组腺病毒命名为rAd-Cap-InvC。
1.2.6 重组腺病毒的鉴定
1.2.6.1 重组腺病毒基因组鉴定 取适量第1代的重组腺病毒,按照病毒DNA基因提取试剂盒说明书,提取重组腺病毒DNA基因组,以此为模板,用P1/P2,P3/P4两对引物扩增检测目的基因Cap和InvC。
1.2.6.2 重组腺病毒目的稳定性检测 取适量第3、7、12代的重组腺病毒(rAd-Cap-InvC),依照 Trizol试剂说明书提取总RNA,进行反转录,反应体系:模板 RNA 4.0μL,Oligo(dT)(50mol/L)1.0μL,RNase free dH2O 1.0μL,充分混匀,70 ℃10min,冰浴3min,加入5×M-mLV buffer 2.0 μL;dNTP(10mmol/L)0.5μL;Rnase inhibitor 0.25μL;反转录酶(200U/μL)0.25μL,RNase free dH2O定容至10μL。42℃1h,70℃15min,冰上冷却10min。分别以P1/P2,P3/P4,按照前述条件进行PCR反应。
1.2.6.3 重组腺病毒目的蛋白表达的鉴定 将重组腺病毒反复冻融3次,4℃、11 000r/min离心10 min,收集上清。取30μL病毒液,加入2×SDSPAGE上样缓冲液,充分混匀后冰浴30min,煮沸10min,离心后吸取上清,以1∶1 000稀释的兔抗PCV-2血清为一抗,以1∶500稀释的辣根过氧化物酶标记鼠抗兔血清为二抗,以DAB为显色剂,Western blot鉴定目的蛋白。
1.2.6.4 重组腺病毒间接免疫荧光鉴定 将重组腺病毒稀释至合适浓度,接种于96孔板里的单层HEK293细胞,体积分数为5%的CO2、37℃培养36h~42h,弃上清,PBS清洗3次,加入甲醇和丙酮1∶1混合液,-20℃固定20min,PBS洗3次,50 g/L脱脂奶粉37℃封闭2h,以1∶50稀释的兔抗PCV-2血清作为一抗、以1∶100稀释的Dylight594山羊抗兔抗体为二抗孵育,清洗晾干,加维持液,荧光显微镜下观察。
1.2.7 重组腺病毒的纯化和TCID50的测定 将第一代rAd-Cap-InvC用DMEM培养基做8个梯度稀释(10-1至10-8),各取1mL稀释好的病毒液添加到生长良好的HEK293细胞,置于体积分数为5%的CO2培养箱、37℃孵育2h,弃去上清,每孔覆盖2 mL含有10g/L低熔点琼脂糖的无酚红培养基,封口,倒置于体积分数为5%的CO2培养箱、37℃恒温静置培养3d~8d,每天统计噬斑的数量直至数量不再变化。挑取单个噬斑琼脂糖块,置于1.5mL离心管中并加入500μL无菌PBS,琼脂捣碎反复冻融3次,12 000r/min离心10min,收获上清病毒液接种于HEK293细胞,如此反复纯化3次。将纯化好的病毒连续接入HEK293细胞进行传代,待传至第12代,将重组病毒10倍梯度稀释,由10-3至10-13依次接种于96孔板的HEK293细胞,并设立阴性对照,每个稀释度做8个复孔,每孔100μL体积分数为5%的CO2培养箱中、37℃培养5d,按照Reed-Muench法,计算病毒TCID50。
2 结果
2.1 目的基因的克隆
用引物P1,P2经PCR扩增得到702bp的Cap基因片段(图2);用引物P3、P4经PCR扩增得到664bp的InvC基因片段(图3)。
2.2 重组腺病毒穿梭载体的构建
将构建的pAdShuttle-CMV-Cap-InvC分别用BglⅡ和SalⅠ,SalⅠ和HindⅢ,BglⅡ和HindⅢ做3三组双酶切鉴定,分别得到约702、664、1 370bp的条带(图4)。证明Cap和InvC均成功克隆至穿梭载体。

图2 Cap基因的PCR扩增Fig.2 PCR amplification of Cap gene
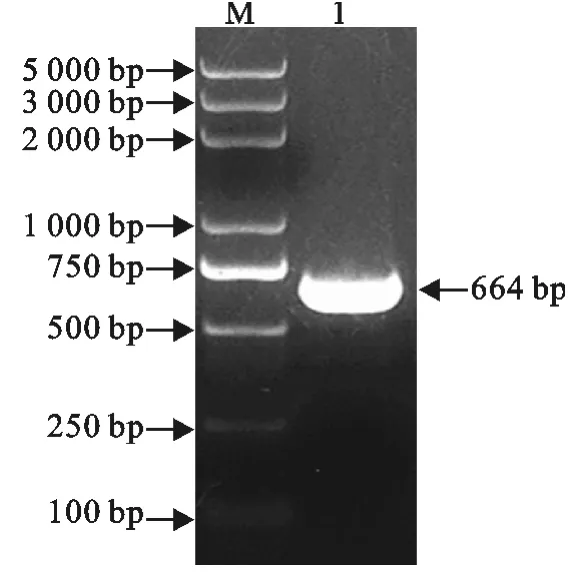
图3 InvC基因的PCR扩增Fig.3 PCR amplification of InvC gene
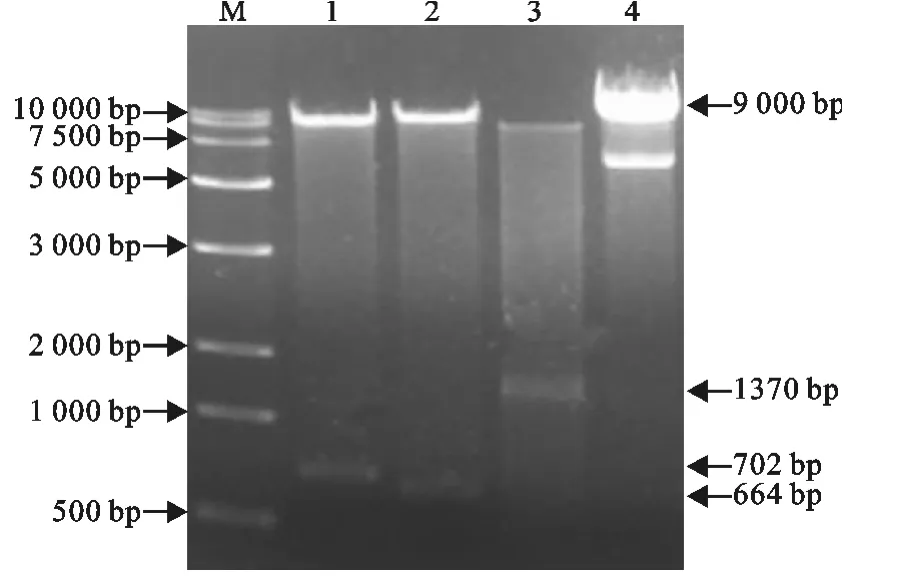
图4 穿梭载体pAdShuttle-CMV-Cap-InvC酶切鉴定Fig.4 Identification of pAdShuttle-CMV-Cap-InvC with enzyme digestion
2.3 重组腺病毒骨架载体的构建
将同源重组获得的pAd-Cap-InvC,获得的pAd-Cap和pAd用PacⅠ酶切鉴定,3个同源重组质粒约30kb,酶切得到大小约4 800bp条带(图5),鉴定结果显示,获得了重组腺病毒载体。
2.4 重组腺病毒的获得
用构建的重组腺病毒骨架转染HEK293细胞,8d~10d后显微镜下见到明显的细胞变形、聚缩、脱落等变化,荧光显微镜下观察到绿色荧光细胞。收集病变细胞和培养液,反复冻融接入新的HEK293细胞,24h后细胞可观察到绿色荧光,细胞变形、聚缩、脱落等变化(图6)。
2.5 重组腺病毒中目的基因检测
提取第2代重组腺病毒DNA作为模板PCR,从rAd-Cap-InvC扩增出目的基因Cap(图7)和InvC(图8),rAd-Cap中仅扩增出目的基因Cap条带(图7),rAd没有扩增出任何目的基因。
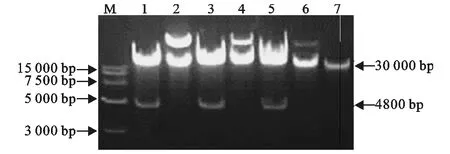
图5 pAd-Cap-InvC,pAd-Cap和pAd的PacⅠ酶切鉴定Fig.5 Identification of pAd-Cap-InvC,pAd-Cap and pAd by enzyme digestion with PacⅠ

图6 重组腺病毒感染HEK293细胞后的变化Fig.6 The changes of HEK293cells infected with rAd-Cap-InvC
2.6 重组腺病毒rAd-Cap-InvC目的基因稳定性检测
提取第3、7、12代重组腺病毒rAd-Cap-InvC的RNA,RT-PCR检测发现,3个代次的rAd-Cap-InvC均扩增得到702bp的Cap(图9)和664bp的InvC基因(图10)。结果表明,该重组腺病毒的基因稳定性良好,经过多次传代,Cap与InvC基因都没有出现缺失。
2.7 Western blot检测目的蛋白的表达
从分别接入重组腺病毒细胞rAd-Cap-InvC,rAd-Cap和rAd的细胞中提取的蛋白进行Western blot,可见rAd-Cap-InvC在约50ku处有一条印迹条带,说明Cap-InvC融合蛋白得到表达,rAd-Cap在约26ku处有一条印迹条带,说明Cap蛋白得到表达(图11)。

图7 重组病毒rAd-Cap-InvC和rAd-Cap中Cap基因的PCR扩增Fig.7 PCR amplification of Cap in rAd-Cap-InvC and rAd-Cap

图8 重组病毒rAd-Cap-InvC中InvC基因的PCR扩增Fig.8 PCR amplification of InvC gene in rAd-Cap-InvC

图9 不同代次的rAd-Cap-InvC Cap基因的PCR扩增Fig.9 PCR amplification of Cap gene from different generations of rAd-Cap-InvC
2.8 间接免疫荧光鉴定
接种rAd-Cap-InvC和rAd-Cap 2种重组腺病毒的HEK293细胞均能观察到Cap蛋白特异红色荧光,而接种rAd细胞的以及正常细胞则观察不到红色荧光(图12)。

图10 不同代次的rAd-Cap-InvC中InvC基因的PCR扩增Fig.10 PCR amplification of InvC gene from different generations of rAd-Cap-InvC
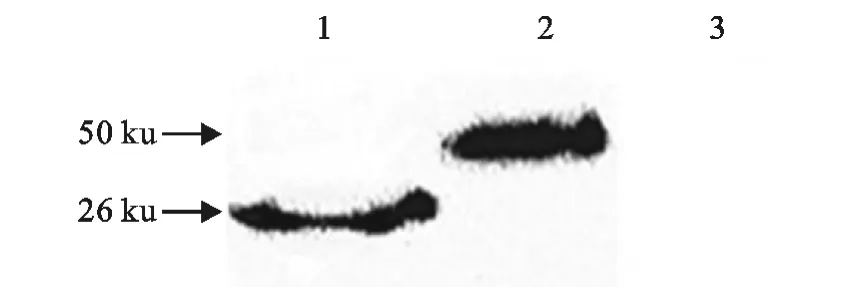
图11 蛋白质表达的Western blot检测Fig.11 Detection of protein expression by Western blot

图12 重组腺病毒中Cap蛋白的免疫荧光检测Fig.12 Detection of Cap with IFA in HEK293cells infected with recombinant adenovirus
2.9 重组腺病毒的纯化和滴度检测
经琼脂糖噬斑纯化获得纯化后的病毒传至12代,测得重组腺病毒rAd-Cap-InvC的TCID50为10-9.32/mL。
3 讨论
近年来国际国内有多种PCV-2商品疫苗上市,市售PCV-2商品疫苗对控制PCV-2的感染具有较好的效果,但PCV-2的流行依然存在。上市的疫苗大多为灭活苗,其灭活病毒难以纯化,制备成本较高,使用时需要多次注射,并且易导致疫苗受体动物的过敏反应。DNA疫苗正处在研制阶段,虽然已取得一定进展[6],但其遗传安全性也受到争议。这些问题的存在,提示PCV-2疫苗的研究工作还有待深入。通过基因工程手段获得病毒活载体疫苗,不失为一种崭新的方向。Cap蛋白作为PCV-2的免疫原性蛋白是基因工程疫苗重组抗原蛋白的首选。2001年,Liu Q等[7]就利用大肠埃希菌表达出具有特异性的重组Cap蛋白,表达量占大肠埃希菌表达蛋白总量的1%。Wang K等[8]使用乳酸菌表达重组Cap蛋白,经口免疫小鼠,ELISA检测到血清中PCV-2特异性抗体。Bucarey Sergio A 等[9]利用大肠埃希菌/酵母菌表达Cap蛋白,对小鼠具有良好的免疫原性。
腺病毒宿主范围广,能够感染多数哺乳动物细胞,表达病毒自身基因,但并不整合到染色体,不会导致插入性突变。腺病毒增殖能力强,其滴度能达到1011VP/mL。腺病毒载体能够携带多种抗原,并刺激机体产生很强的体液免疫或细胞免疫。由于腺病毒载体能感染呼吸道和肠道细胞,可以方便地通过黏膜进行免疫并诱导机体产生黏膜和系统免疫应答,腺病毒载体还可以同其他载体联合免疫[10]。因此腺病毒载体疫苗广泛应用于细菌、病毒、寄生虫及肿瘤疫苗方面的研究[11]。Wang X W 等[12]构建了表达重组Cap蛋白的腺病毒,经过2次免疫,小鼠的特异性抗体和中和抗体均能达到较高的水平。Liu G M等[13]构建了表达Cap-INFγ融合蛋白的重组腺病毒,免疫效果明显好于单纯表达Cap蛋白的重组腺病毒。虽然PCV-2活载体疫苗具有优越的前景,但相关的研究工作依旧任重而道远。
假结核耶尔森菌侵袭素(Inv)蛋白是一种外膜蛋白,由耶尔森菌侵袭素基因编码986个氨基酸[14]。该蛋白普遍存在于革兰阴性菌外膜,通过结合细胞的β-1整合素介导细菌对靶细胞的识别,并诱导细胞促炎性细胞因子的表达[15]。Inv蛋白在结合β-1整合素后诱导细胞产生活性氧并释放到胞外环境,同时活化磷酸肌醇3-激酶信号通路,吸引中性粒细胞聚集[16]。Inv蛋白还能激活黏着斑复合体,Rac1,丝裂原活化蛋白激酶,以及NFκB等信号通路级联反应,诱导CD4和CD8T细胞应答,表明Inv蛋白能够有效地增强宿主细胞对抗原的摄取能力,进一步提高动物机体的细胞免疫和体液免疫,具备成为一种崭新的疫苗佐剂的巨大潜力[17]。有人利用这一特性,将无致病性志贺氏菌和大肠埃希菌通过Inv蛋白与肠道中的M细胞β-1整合素结合,靶向递送抗原给肠淋巴组织进行免疫[18]。
构建表达Cap-InvC融合蛋白的重组腺病毒,作为疫苗的免疫原,既具有腺病毒滴度高,稳定表达大量特异抗原蛋白,对宿主机体安全性高等腺病毒载体优点,又具备通过多种途径诱导机体产生高效的体液免疫和细胞免疫等侵袭素蛋白的优势,是在PCV-2活载体疫苗上的一次尝试。
本研究以PCV-2Cap和InvC基因作为目的基因,利用重组腺病毒表达系统,成功构建表达Cap-InvC融合蛋白的重组腺病毒(rAd-Cap-InvC)。通过PCR、RT-PCR、Western blot、IFA 验证该重组腺病毒有效表达了目的蛋白。为了评价rAd-Cap-InvC对动物的免疫性和保护性水平,我们将继续进行动物免疫试验,为PCV-2基因工程活载体疫苗的研究提供基础材料。
[1]Yu S,Opriessnig T,Kitikoon P,et al.Porcine circovirus type 2(PCV-2)distribution and replication in tissues and immune cells in early infected pigs[J].Vet Immunol Immunopathol,2007,115(3-4):261-272.
[2]周继勇,陈庆新,叶菊秀,等.猪圆环病毒2型感染的血清学分析[J].中国兽医学报,2004,24(1):1-7.
[3]Shibahara T,Sato K,Ishikawa Y,et al.Porcine circovirus induces B lymphocyte depletion in pigs with wasting disease syndrome[J].J Vet Med Sci,2000,62(11):1125-1131.
[4]Kurmann J,Sydler T,Brugnera E,et al.Vaccination of dams increases antibody titer and improves growth parameters in finisher pigs subclinically infected with porcine circobirus type2[J].Clin Vac Immunol,2011,18(10):1644-1649.
[5]李 玲,李国新,周艳君,等.2008~2011年中国部分地区猪圆环病毒2型的分子流行病学调查[J].中国动物传染病学报,2012,20(2):1-10.
[6]Chen G L,Fu P F,Wang L Q,et al.Immune responses of piglets immunized by a recombinant plasmid containing porcine circovirus type 2and porcine interleukin-18genes[J].Viral Immunol,2014,27(10):521-528.
[7]Liu Q,Willson P,Attoh-Poku S,et al.Bacterial expression of an immunologically reactive PCV-2ORF2fusion protein[J].Protein Express Purificat,2001,21(1):115-120.
[8]Wang K,Huang L,Kong J,et al.Expression of the capsid protein of porcine circovirus type 2inLactococcuslactisfor oral vaccinationJ .J Virol Meth200815020081-6.
[9]Bucarey S A,Noriega J,Reyes P,et al.The optimized capsid gene of porcine circovirus type 2expressed in yeast forms virus-like particles and elicits antibody responses in mice fed with recombinant yeast extracts[J].Vaccine,2009,27(42):5781-5790.
[10]Majhen D,Calderon H,Chandra N,et al.Adenovirus-based vaccines for fighting infectious diseases and cancer:progress in the field[J].Human Gene Ther,2014,25(4):301-317.
[11]Dong D,Gao J,Sun Y,et al.Adenovirus-mediated co-expression of the TRAIL and HN genes inhibits growth and induces apoptosis in Marek's disease tumor cell line MSB-1[J].Cancer Cell Int,2015,15:20.
[12]Wang X W,Jiang W M,Jiang P,et al.Construction and immunogenicity of recombinant adenovirus expressing the capsid protein of porcine circovirus 2(PCV-2)in mice[J].Vaccine,2006,24(16):3374-3380.
[13]Liu G M,Luo M L,Chen R A,et al.Construction and immunogenicity of recombinant adenovirus expressing ORF2of PCV-2and porcine IFN gammaJ .Vaccine20112947 8677-8682.
[14]Anderson J C,Clarke E J,Arkin A P,et al.Environmentally controlled invasion of cancer cells by engineered bacteria[J].J Mol Biol,2006,355(4):619-627.
[15]Wong K W,Isberg R R.Emerging views on integrin signaling via Rac1during invasin-promoted bacterial uptake[J].Curr Opin Microbiol,2005,8(1):4-9.
[16]Schaake J,Drees A,Grüning P,et al.Essential role of invasin for colonization and persistence ofYersiniaenterocoliticain its natural reservoir host,the pig[J].Infect Immun,2014,82(3):960-969.
[17]Autenrieth S E,Autenrieth I B.Yersiniaenterocolitica:Subversion of adaptive immunity and implications for vaccine development[J].Int J Med Microbiol,2008,298(1-2):69-77.
[18]Critchley-Thorne R J,Stagg A J,Vassaux G.RecombinantEscherichiacoliexpressing invasin targets the Peyer's patches:the basis for a bacterial formulation for oral vaccination[J].Mol Ther,2006,14(2):183-191.
