线粒体电子传递呼吸链及其生物学意义的研究进展
2015-06-24综述鲁姗姗张红旗葛均波审校
徐 婷(综述) 李 华 鲁姗姗 张红旗,4 葛均波(审校)
(1复旦大学上海医学院人体解剖学与组织胚胎学系 上海 200032;2中国科学院上海生命科学院生物化学与细胞生物学研究所 上海 200031;3复旦大学附属中山医院心血管病研究所 上海 200032;4上海市医学图像处理与计算机辅助手术重点实验室 上海 200032;5复旦大学生物医学研究院 上海 200032)
线粒体电子传递呼吸链及其生物学意义的研究进展
徐 婷1(综述) 李 华2,3鲁姗姗1张红旗1,4葛均波3,5△(审校)
(1复旦大学上海医学院人体解剖学与组织胚胎学系 上海 200032;2中国科学院上海生命科学院生物化学与细胞生物学研究所 上海 200031;3复旦大学附属中山医院心血管病研究所 上海 200032;4上海市医学图像处理与计算机辅助手术重点实验室 上海 200032;5复旦大学生物医学研究院 上海 200032)
线粒体为细胞的生命活动提供基本能量。其内膜上的呼吸链酶传递氢和电子到ATP酶复合体,用于合成能量及维持跨内膜氢离子梯度循环。细胞生存所需能量的95%由线粒体呼吸链提供,主要由位于线粒体内膜上的5个复合体(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ)组成的线粒体呼吸链酶完成,即NADPH-泛醌、琥珀酸-泛醌还原酶、泛醌-Cytc还原酶、细胞色素c氧化酶及ATP合成酶。本文对线粒体呼吸链Ⅰ/Ⅱ/Ⅲ/Ⅳ/Ⅴ的分子结构、功能及生物学意义等进行了综述。
烟酰胺腺嘌呤二核苷酸磷酸(NADPH)-泛醌还原酶; 琥珀酸-泛醌还原酶(SQR); 泛醌-细胞色素c还原酶(QCR); 细胞色素c氧化酶(COX); ATP合成酶
细胞是生物体基本的结构和功能单位。线粒体是细胞内由两层膜包被的半自主细胞器,除了参与细胞生长、分化、信息传递和凋亡等过程,还是细胞内氧化磷酸化和合成三磷酸腺苷(triphosadenine,ATP)的主要场所。细胞生存所需能的95%由线粒体呼吸链提供,主要由位于线粒体内膜上的5个复合物组成的线粒体呼吸链酶完成:烟酰胺腺嘌呤二核苷酸磷酸(nicotinawide adenine dinucleotide phosphate,NADPH)-泛醌还原酶(复合体Ⅰ)、琥珀酸-泛醌还原酶(复合体Ⅱ)、泛醌-细胞色素c还原酶(复合体Ⅲ)、细胞色素c氧化酶(复合体Ⅳ)、ATP合成酶(复合体Ⅴ)。
线粒体复合体Ⅰ(NADPH-泛醌还原酶) 线粒体复合体Ⅰ是线粒体呼吸链中首个,也是最大的膜蛋白复合体,由44个不同的亚基组成,其相对分子质量约为980 000[1-2];包含1个黄素单核苷酸(flavin mononucleotide,FMN)和8个铁硫中心(Fe-S)[3]。其中,14个核心亚基组成的最简单形式复合体Ⅰ(相对分子质量约550 000),从细菌到人类均高度保守[4-8]。
线粒体复合体Ⅰ含有氧化还原组件和经典的L型结构,并由疏水性结构和亲水性结构两部分组成:疏水一臂嵌在内膜中,而亲水一臂凸出于细胞器基质中[2,5-6,9]。7个疏水亚基(ND1~ND6和ND4L)由线粒体DNA编码,并在线粒体核糖体中合成[3];其余亚基为核基因编码的产物,并从细胞质中导入线粒体[10]。这7个亚基构成膜的催化核心,而核基因编码的7个亚基形成外围臂的催化核心,从而组成原核最简单形式复合体Ⅰ,即外围壁上存在NADH、FMN、Fe-S的结合位点,以FMN为主要的电子受体,借助铁硫蛋白(iron-sulfur protein,ISP)将FMN和终端电子受体泛醌绑定,从而接受各种黄素酶类脱下的氢到可在膜中迅速移动的泛醌(呼吸链中唯一的非蛋白氧化还原载体),进而将膜的催化核心联系到外围臂[11]。哺乳动物的线粒体复合体Ⅰ中还有30个亚基未直接参与催化,可能涉及复合体的组装、稳定或监管等功能[3];并且发现14个核心亚基外围附有额外亚基,其确切的分子结构与空间位置尚待进一步研究。
线粒体复合体Ⅰ在线粒体呼吸链以及许多细菌中扮演着重要的角色,为氧化磷酸化-电子呼吸链入口点,2个电子从NADH进入电子传递链至泛醌,并伴有4个质子由线粒体基质释放到膜间隙(图1),继而再通过复合体Ⅲ和Ⅳ的协作,完成10个质子的跨膜易位,形成跨内膜氢质子梯度,最终为复合体Ⅴ合成ATP提供动力[11-13](图2)。
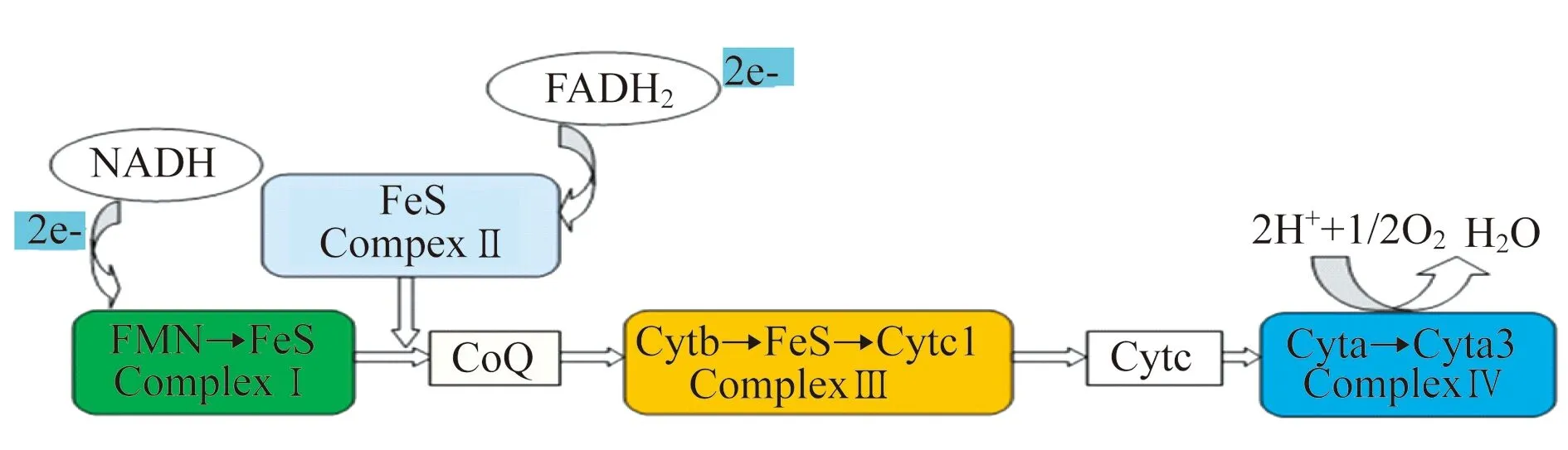
图1 线粒体电子传递呼吸链Fig 1 Mitochondrial electron transport chain, ETC
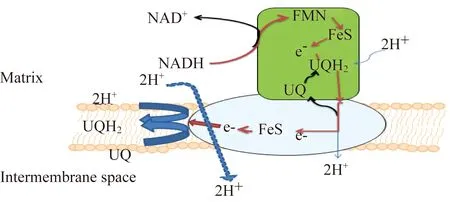
图2 线粒体复合体ⅠFig 2 Mitochondrial complexⅠ
线粒体复合体Ⅱ(琥珀酸-泛醌还原酶,SQR) 线粒体复合体Ⅱ是三羧酸循环和有氧呼吸中一个完整的膜蛋白质复合体,存在于各种需氧生物体中。通常,认定其由可溶性催化性异二聚体和1个完整的跨膜区域组成:可溶性催化性异二聚体由A亚基和B亚基组成,即黄素蛋白(flavin protein,FP)和ISP,A亚基内含有1个共价键结合的FAD辅助因子,B亚基内含有3个铁硫中心,分别为(2Fe-2S)、(4Fe-4S)和(3Fe-4S)[14-15];跨膜区域由1~2个含/不含血红素的疏水性多肽链组成[16],并将整个复合物锚定在线粒体内膜上[15]。
根据其疏水亚基和血红素的数量,线粒体复合体Ⅱ归为C类[16],具有1个血红素分子和2个跨膜蛋白,即大细胞色素b结合蛋白(CybL或C单元),小细胞色素b结合蛋白(CybS或d单元)。研究发现原核内琥珀酸的结构中,泛醌氧化还原酶(B、C、D型)共享一个相似复合体Ⅱ的酶功能[17-19],然而,关于线粒体复合体Ⅱ使泛醌(辅酶Q)还原的机制以及泛醌在复合体Ⅱ与Ⅲ之间传递转移的具体过程等重要问题依然未明,阐明在线粒体复合体Ⅱ中泛醌的位置和数量将有助于这些问题的解决。在缺少线粒体复合体Ⅱ的具体三维结构数据时,研究者通常使用原核生物线粒体复合体Ⅱ模型来研究泛醌的结合方式[17-19]。
三羧酸循环中,线粒体复合体Ⅱ催化琥珀酸到延胡索酸,同时与泛醌耦合传递2个电子到FAD,然后单独穿过Fe-S集群,再通过b血红素,从而完成电子由琥珀酸传递给泛醌[14](图3)。
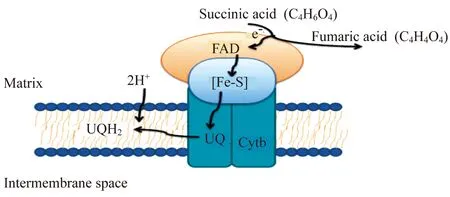
图3 线粒体复合体ⅡFig 3 Mitochondrial complexⅡ
线粒体复合体Ⅲ(泛醌-细胞色素c还原酶,QCR) 线粒体复合体Ⅲ是一个多亚基的膜蛋白质复合体,它是参与光合作用和呼吸电子传递链的一个基本组分。这种酶催化电子从泛醌转移到细胞色素c和伴随跨膜电位形成导致质子易位的过程[20-21]。不同物种内的复合体Ⅲ均含有3种核心亚基,这些亚基具有3个氧化还原辅基组分,分别为细胞色素b、c1和具有高电势的ISP。其中,细胞色素b有2种类型,即含有血红素bL的b566和含有血红素bH的b562。除了3个核心亚基,还存在许多无氧化还原性的额外亚基,且在不同物种内数目不均等。例如荚膜红细菌的线粒体复合体Ⅲ无额外亚基,类球红细菌的线粒体复合体Ⅲ中有1个亚基,而牛的线粒体复合体Ⅲ中有多达8个亚基。虽然额外亚基的确切作用尚不明确,但缺失额外亚基的复合体Ⅲ生物活性较低且不稳定[22-23]。
线粒体复合体Ⅲ最简单的一种转移方式是线性路径,即辅基的氧化还原电位决定电子的转移方向,但这无法合理解释复合体Ⅲ催化时出现的2H+/e-转移(理论上应为1H+/e-)[24]。由此,Peter Mitchell提出Q循环机制[25]:首先,有2个独立的泛醌结合位点,分别为Qp和Qn;其次,Qp电子转移会分路径进行,其氧化泛醌存在较高的活化阻力[26],即产生1个电子传递给由ISP、细胞色素c1、c组成的高电势链,同时释放2个氢到膜间隙,而另一个电子传递给由血红素bL、bH组成的低电势链;最终电子均在Qn中将泛醌还原为比较稳定的Q-。在第2次循环时,第2个泛醌在Qp中被氧化,和来自血红素bH的电子还原第1次循环时在Qn中生成的Q-,结合Qn的2个氢从而形成QH2(图4)。
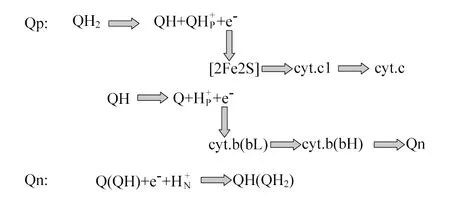
图4 线粒体复合体ⅢFig 4 Mitochondrial complexⅢ
线粒体复合体Ⅳ(细胞色素c氧化酶,COX) 线粒体复合体Ⅳ是血红素铜氧化酶家族(HCO)的成员[27],其将由复合体Ⅰ、Ⅱ、Ⅲ传递的电子给氧分子,同时耦合膜内外质子的易位,最终被氧化,并伴随一分子水生成[27-29]。线粒体复合体Ⅳ是由多亚基组成的膜蛋白复合体,相对分子质量约210 000,含13条多肽链,有2个血红素(heme a和heme a3)、1个铜离子(CuB)和1个双核铜离子(CuA)中心[27-29]。
线粒体复合体Ⅳ中SU1、SU2、SU3亚基由线粒体DNA编码。其中,亚基SU1中包含heme a、heme a3和CuB,并且heme a3和CuB形成双核Fe-Cu中心(a3-CuB),与[2Fe-2S]结构类似;亚基SU2中具有双核铜离子中心;亚基SU3无电子传递体,与亚基SU1和SU2相互作用,起到维持电子传递中心稳定的作用。利用化学分析方法对酶的晶体结构深入研究发现,在氧化还原中心外,存在一些不具有氧化还原作用的金属离子,例如在CuA附近发现了1个Mg离子,在线粒体基质端发现了1个距CuB较远的Zn离子[11],在牛的心肌细胞COX中还发现了锌指结构[31-32],但其具体功能仍不清楚。
在线粒体复合体Ⅳ中存在2条质子通道:基质中的质子利用一条通道到达Fe-Cu中心,并还原氧分子生成水;借助另一条通道进入膜间隙,传递一个电子到Fe-Cu中心,同时伴随着一个基质中的质子传递到膜间隙[27-29](图5)。
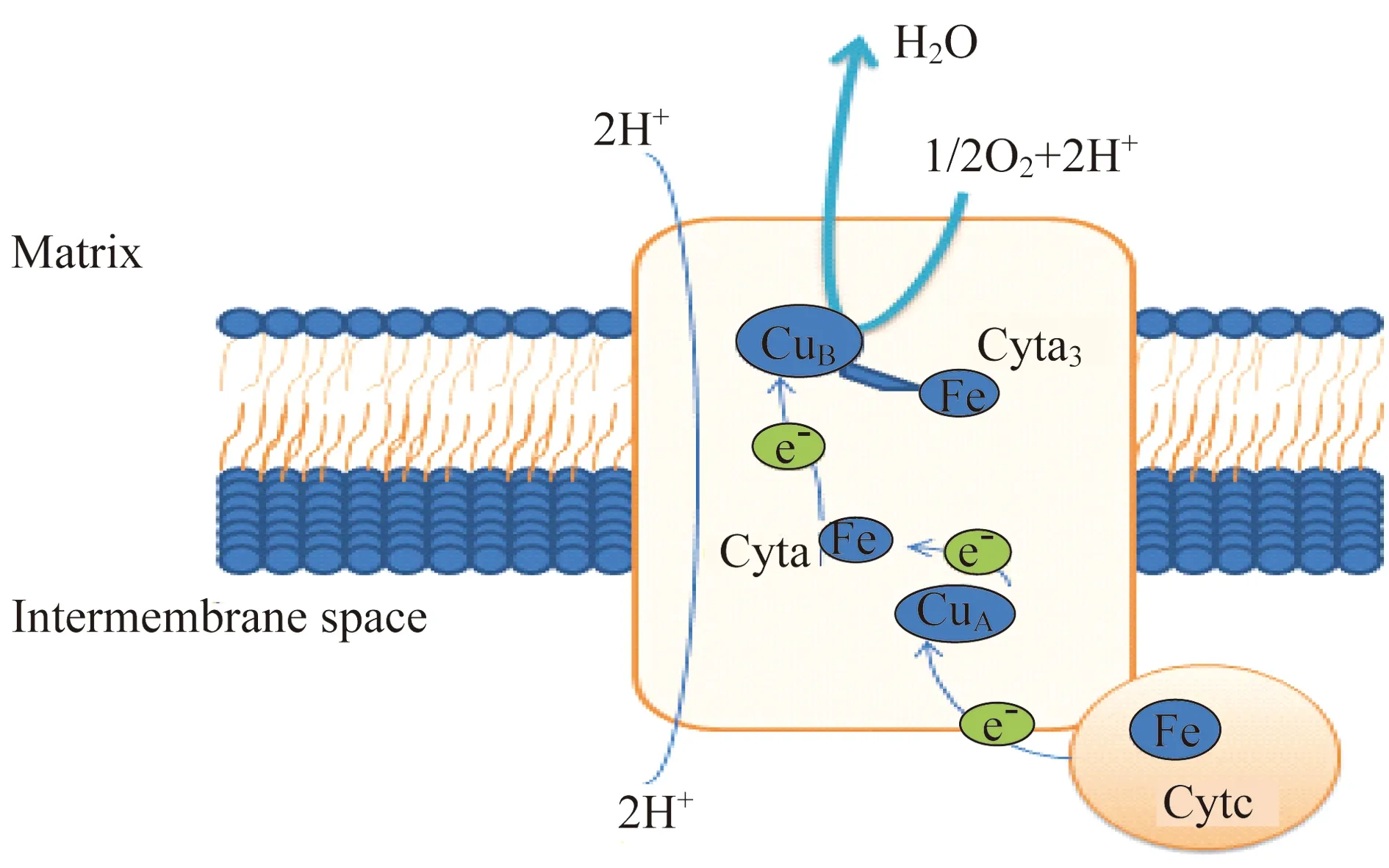
图5 线粒体复合体ⅣFig 5 Mitochondrial complexⅣ
线粒体复合体Ⅴ(ATP合成酶) 线粒体复合体Ⅴ是一个具有多个亚基的蛋白质复合体,由凸出于线粒体膜外的可溶性部分F1和嵌在线粒体内膜的F0组成主要功能区域,且不同来源的线粒体复合体Ⅴ的组成结构基本相同。
F1由3个α、3个β、1个γ、1个δ和1个ε组成。其中,3 个α亚基和 3 个β亚基交替排列组成一个对称的六聚体。在β亚基上存在ATP的结合位点,起到催化ATP合成和分解的作用。F0是一种疏水蛋白复合体,嵌合在内膜上,形成一个跨膜质子通道;其由1个a、2个b、10~14个c等3种亚基组成,a亚基和b亚基二聚体排列在由c亚基形成环的外侧,c亚基数目在不同物种中不等。γ、ε、δ和b亚基组成的结构连接膜内F1和膜外F0,γ与ε亚基形成转子结构,δ和b亚基形成定子结构。γ和ε亚基借助通过F0的质子流推动旋转,并依次与3个β亚基相互作用,进而调节β亚基上催化位点的构象变化,完成β亚基催化位点的开放或关闭。而定子结构则是将α3β3与F0连接绑定[33-35]。
ATP合酶的功能是利用从膜间隙穿过线粒体内膜形成的梯度质子流通过F0产生能量,进而在F1区域结合ADP和无机磷酸Pi合成ATP。这种由质子梯度带动质子移动的动力包含pH值差和电子膜电位差(Δψm)两部分[36],其释放的能量推动转子及定子两个结构的旋转(图6)。
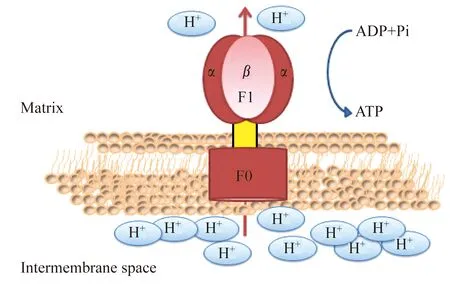
图6 线粒体复合体ⅤFig 6 Mitochondrial complexⅤ
线粒体呼吸链复合体的生物学意义 线粒体呼吸链提供细胞生存所需约95%的能量,主要由线粒体呼吸链酶Ⅰ/Ⅱ/Ⅲ/Ⅳ/Ⅴ完成。据统计,约有30%~40%线粒体病是由于线粒体呼吸链酶复合体缺陷所致,通常采用线粒体基因组分析与线粒体呼吸链酶活性检测相结合的方式予以确诊。
帕金森病(Parkinson′s disease,PD)、亨廷顿舞蹈病(Humtington′s disease,HD)等神经退行性疾病的线粒体功能障碍和能量代谢异常已成为当今共识的早期病理现象。PD的症状特点是震颤、动作迟缓、运动功能减退和姿势不稳定,其病理特征为黑质多巴胺能神经元损伤[37]。1993年,Cardellach等[37]进一步提供了PD患者线粒体复合体Ⅰ、Ⅳ酶活性功能受损的依据,他们在对该类患者骨骼肌组织中线粒体功能进行研究时发现,线粒体复合体Ⅰ和Ⅳ的酶活性降低,伴有部分线粒体复合体Ⅴ的酶活性下降,但线粒体复合体Ⅱ和Ⅲ的酶活性均正常。运用1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)能产生与PD相似的症状[38]。研究表明,在大脑中单胺氧化酶B促进MPTP转变成活跃的神经毒性代谢物1-甲基4-吡啶,后者通过多巴胺转运体转运至多巴胺神经元[39],进而抑制线粒体呼吸链复合体Ⅰ的NADH,导致电子传递障碍并产生大量O2,最终抑制线粒体呼吸[40]。Betarbet等[41]研究发现,复合体Ⅰ抑制剂鱼藤酮单一对线粒体呼吸链复合体Ⅰ的活性具有抑制作用,并可诱发PD,小鼠模型中通过多次给予小剂量的鱼藤酮,产生黑质多巴胺神经元选择性退化,可出现实验小鼠类似PD患者的行动迟缓和肌强直等症状。HD是发病年龄较早的一类家族显性遗传性疾病,其主要症状为舞蹈样动作、扭动扭体动作、抽搐、摇摆不稳、不连贯的步态,严重者甚至出现死亡。HD是第4对染色体内DNA基质之CAG三核苷酸重复序列过度扩张,作用于纹状体质[42],造成脑部神经细胞持续退化,这种基因突变引起亨廷顿蛋白(Htt)N-端的多聚谷氨酰胺延长[43]。近年,研究证明线粒体机能障碍在HD发病机制中扮演着重要角色,其线粒体复合体Ⅱ酶活性丢失,铁硫中心和FAD两个亚基表达降低;继而在体外模型中过表达铁硫中心和FAD两个亚基,出现Htt毒性的抑制[44]。运用线粒体复合体Ⅱ抑制剂3-NP或丙二酸诱导产生HD的动物模型,发现线粒体复合体Ⅰ、Ⅱ、Ⅲ和Ⅳ酶活性均降低。
线粒体占心肌细胞总容积的1/2,可直接利用葡萄糖、游离脂肪酸和酮体,经过电子呼吸链生成ATP,供给心肌细胞。当线粒体呼吸链功能障碍和/或氧化磷酸化解偶联,影响心肌细胞的ATP生成,导致细胞收缩、舒张功能失调。研究证实,扩张型心肌病患者的心肌线粒体复合体Ⅰ/Ⅲ/Ⅳ酶活性下降,且与心衰程度呈正相关[45]。Mauter等[46]发现冠心病患者的心肌细胞线粒体复合体Ⅰ、Ⅱ、Ⅱ和Ⅲ 酶活性均明显下降,且早于扩张型的心肌病。在阿霉素诱导心肌病小鼠模型中,发现阿霉素损伤心肌细胞线粒体呼吸链,导致COXⅡ基因表达减少及心肌COX活性下降。在快速起搏心室致心衰犬模型中也发现心肌细胞线粒体复合体Ⅰ活性有所降低。Arbustini等[47]的研究结果显示,肌球蛋白重链基因突变所引发的呼吸链异常是肥厚性心肌病发病的决定因素,并对发生心衰有着重要的影响。由此可见,线粒体氧化体系中呼吸链的基因表达、功能异常与心血管疾病的发生、发展密切相关。
线粒体呼吸链酶异常还会导致多系统线粒体病,如母系遗传Leigh综合征、Leer遗传性视神经病、婴儿猝死综合征、MERRF-线粒体肌病、线粒体脑肌病、进行性眼外肌麻痹、共济失调并发色素性视网膜炎、细胞外基质慢性游走性红斑、铁粒幼细胞贫血、癫痫、耳聋、家族性双侧纹状体坏死等疾病。
结语 线粒体呼吸链复合体Ⅰ/Ⅱ/Ⅲ/Ⅳ/Ⅴ的结构和功能已被广泛研究。目前临床上以营养支持对症治疗复合体缺陷或酶活性异常,从而改善患者症状及延缓病情发展,然而其确切的发病机制和特异性治疗方法仍亟待解决。我们采用酶联免疫吸附试验方法发现,心衰模型小鼠心肌线粒体复合体酶活性呈早期升高后下降的抛物线趋势,这为临床上诊断与治疗早期心衰患者提供了崭新的思路。随着细胞分子生物学研究的不断深入,外源性替代或者干预有望成为完善线粒体电子呼吸链的传递和能量生成的特效治疗手段,从而完成各脏器细胞的基础能量代谢。
[1] Carroll J,Fearnley IM,Skehel JM,etal.Bovine complex I is a complex of 45 different subunits[J].JBiolChem,2006,281(43):32724-32727.
[2] Balsa E,Marco R,Perales-Clemente E,etal.NDUFA4 is a subunit of complex Ⅳ of the mammalian electron transport chain[J].CellMetab,2012,16(3):378-386.
[3] Chomyn A,Mariottini P,Cleeter MW,etal.Six unidentified reading frames of human mitochondrial DNA encode components of the respiratory-chain NADH dehydrogenase[J].Nature,1985,314(6012):592-597.
[4] Walker JE.The NADH:ubiquinone oxidoreductase (complex I) of respiratory chains[J].QRevBiophys,1992,25(3):253-324.
[5] Yagi T,Matsuno-Yagi A.The proton-translocating NADH-quinone oxidoreductase in the respiratory chain:the secret unlocked[J].Biochemistry,2003,42(8):2266-2274.
[6] Sazanov LA.Respiratory complex I:mechanistic and structural insights provided by the crystal structure of the hydrophilic domain[J].Biochemistry,2007,46(9):2275-2288.
[7] Yip CY,Harbour ME,Jayawardena K,et al.Evolution of respiratory complex I:"supernumerary" subunits are present in the alpha-proteobacterial enzyme[J].JBiolChem,2011,286(7):5023-5033.
[8] Efremov RG,Sazanov LA.The coupling mechanism of respiratory complex I-a structural and evolutionary perspective[J].BiochimBiophysActa,2012,1817(10):1785-1795.
[9] Hirst J,Carroll J,Fearnley IM,etal.The nuclear encoded subunits of complex I from bovine heart mitochondria[J].BiochimBiophysActa,2003,1604(3):135-150.
[10] Carroll J,Fearnley IM,Shannon RJ,etal.Analysis of the subunit composition of complex I from bovine heart mitochondria[J].MolCellProteomics,2003,2(2):117-126.
[11] Sharpe MA,Qin L,Ferguson-Miller S.Proton entry,exit and pathways in cytochrome oxidase:insight from conserved water[M]//WikstromM.Biophysicalandstructuralaspectsofbioenergetics.Norfolk:RSCPublishing,2005:26-52.
[12] Moser CC,Farid TA,Chobot SE,etal.Electron tunneling chains of mitochondria[J].BiochimBiophysActa,2006,1757(9-10):1096-1109.
[13] Watt IN,Montgomery MG,Runswick MJ,etal.Bioenergetic cost of making an adenosine triphosphate molecule in animal mitochondria[J].ProcNatlAcadSciUSA,2010,107(39):16823-16827.
[14] Sun F,Huo X,Zhai Y,etal.Crystal structure of mitochondrial respiratory membrane protein complex Ⅱ[J].Cell,2005,121(7):1043-1057.
[15] Hagerhall C.Succinate:quinone oxidoreductases.Variations on a conserved theme[J].BiochimBiophysActa,1997,1320(2):107-141.
[16] Lemos RS,Fernandes AS,Pereira MM,etal.Quinol:fumarate oxidoreductases and succinate:quinone oxidoreductases:phylogenetic relationships,metal centres and membrane attachment[J].BiochimBiophysActa,2002,1553(1-2):158-170.
[17] Iverson TM,Luna-Chavez C,Cecchini G,etal.Structure of the Escherichia coli fumarate reductase respiratory complex[J].Science,1999,284(5422):1961-1966.
[18] Lancaster CR,Kroger A,Auer M,etal.Structure of fumarate reductase from Wolinella succinogenes at 2.2 A resolution[J].Nature,1999,402(6760):377-385.
[19] Yankovskaya V,Horsefield R,Tornroth S,etal.Architecture of succinate dehydrogenase and reactive oxygen species generation[J].Science,2003,299(5607):700-704.
[20] Berry EA,Zhang Z,Huang LS,etal.Structures of quinone-binding sites in bc complexes:functional implications[J].BiochemSocTrans,1999,27(4):565-572.
[21] Berry EA,Guergova-Kuras M,Huang LS,etal.Structure and function of cytochrome bc complexes[J].AnnuRevBiochem,2000,69:1005-1075.
[22] Stroebel D,Choquet Y,Popot JL,etal.An atypical haem in the cytochrome b(6)f complex[J].Nature,2003,426(6965):413-418.
[23] Gao X,Wen X,Esser L,etal.Structural basis for the quinone reduction in the bc1 complex:a comparative analysis of crystal structures of mitochondrial cytochrome bc1 with bound substrate and inhibitors at the Qi site[J].Biochemistry,2003,42(30):9067-9080.
[24] Esser L,Quinn B,Li YF,etal.Crystallographic studies of quinol oxidation site inhibitors:a modified classification of inhibitors for the cytochrome bc(1) complex[J].JMolBiol,2004,341(1):281-302.
[25] Tian H,White S,Yu L,etal.Evidence for the head domain movement of the rieske iron-sulfur protein in electron transfer reaction of the cytochrome bc1 complex[J].JBiolChem,1999,274(11):7146-7152.
[26] Darrouzet E,Valkova-Valchanova M,Moser CC,etal.Uncovering the [2Fe2S] domain movement in cytochrome bc1 and its implications for energy conversion[J].ProcNatlAcadSciUSA,2000,97(9):4567-4572.
[27] Ferguson-Miller S,Babcock GT.Heme/Copper terminal oxidases[J].ChemRev,1996,96(7):2889-2908.
[28] Brzezinski P,Gennis RB.Cytochrome c oxidase:exciting progress and remaining mysteries[J].JBioenergBiomembr,2008,40(5):521-531.
[29] Belevich I,Verkhovsky MI.Molecular mechanism of proton translocation by cytochrome c oxidase[J].AntioxidRedoxSignal,2008,10(1):1-29.
[30] Tsukihara T,Aoyama H,Yamashita E,etal.Structures of metal sites of oxidized bovine heart cytochrome c oxidase at 2.8 A[J].Science,1995,269(5227):1069-1074.
[31] Iwata S,Ostermeier C,Ludwig B,etal.Structure at 2.8 A resolution of cytochrome c oxidase from Paracoccus denitrificans[J].Nature,1995,376(6542):660-669.
[32] Devenish RJ,Prescott M,Rodgers AJ.The structure and function of mitochondrial F1F0-ATP synthases[J].IntRevCellMolBiol,2008,267:1-58.
[33] Walker JE,Dickson VK.The peripheral stalk of the mitochondrial ATP synthase[J].BiochimBiophysActa,2006,1757(5-6):286-296.
[34] Boyer PD,Kohlbrenner WE.The present status of the bindingchange mechanism and its relation to ATP formation by chloroplasts[Z]// Selman BR,Selman-Peimer S (eds).Energy coupling in photosynthesis.Elsevier:Amsterdam.1981:231-240.
[35] Campanella M,Parker N,Tan CH,etal.IF(1):setting the pace of the F(1)F(o)-ATP synthase[J].TrendsBiochemSci,2009,34(7):343-350.
[36] Savitt JM,Dawson VL,Dawson TM.Diagnosis and treatment of Parkinson disease:molecules to medicine[J].JClinInvest,2006,116(7):1744-1754.
[37] Cardellach F,Marti MJ,Fernandez-Sola J,etal.Mitochondrial respiratory chain activity in skeletal muscle from patients with Parkinson′s disease[J].Neurology,1993,43(11):2258-2262.
[38] Langston JW,Ballard P,Tetrud JW,etal.Chronic Parkinsonism in humans due to a product of meperidine-analog synthesis[J].Science,1983,219(4587):979-980.
[39] Nicklas WJ,Vyas I,Heikkila RE.Inhibition of NADH-linked oxidation in brain mitochondria by 1-methyl-4-phenyl-pyridine,a metabolite of the neurotoxin,1-methyl-4-phenyl-1,2,5,6-tetrahydropyridine[J].LifeSci,1985,36(26):2503-2508.
[40] Bender A,Krishnan KJ,Morris CM,etal.High levels of mitochondrial DNA deletions in substantia nigra neurons in aging and Parkinson disease[J].NatGenet,2006,38(5):515-517.
[41] Betarbet R,Sherer TB,MacKenzie G,etal.Chronic systemic pesticide exposure reproduces features of Parkinson′s disease[J].NatNeurosci,2000,3(12):1301-1306.
[42] Myers RH,Vonsattel JP,Stevens TJ,etal.Clinical and neuropathologic assessment of severity in Huntington′s disease[J].Neurology,1988,38(3):341-347.
[43] Borrell-Pages M,Zala D,Humbert S,etal.Huntington′s disease:from huntingtin function and dysfunction to therapeutic strategies[J].CellMolLifeSci,2006,63(22):2642-2660.
[44] Benchoua A,Trioulier Y,Zala D,etal.Involvement of mitochondrial complex Ⅱ defects in neuronal death produced by N-terminus fragment of mutated huntingtin[J].MolBiolCell,2006,17(4):1652-1663.
[45] Arbustini E,Diegoli M,Fasani R,etal.Mitochondrial DNA mutations and mitochondrial abnormalities in dilated cardiomyopathy[J].AmJPathol,1998,153(5):1501-1510.
[46] Maurer I,Zierz S.Myocardial respiratory chain enzyme activities in idiopathic dilated cardiomyopathy,and comparison with those in atherosclerotic coronary artery disease and valvular aortic stenosis[J].AmJCardiol,1993,72(5):428-433.
[47] Arbustini E,Fasani R,Morbini P,etal.Coexistence of mitochondrial DNA and beta myosin heavy chain mutations in hypertrophic cardiomyopathy with late congestive heart failure[J].Heart,1998,80(6):548-558.
Research progress of mitochondrial electron transport chain and its biological significance
XU Ting1, LI Hua2,3, LU Shan-shan1, ZHANG Hong-qi1,4, GE Jun-bo3,5△
(1DepartmentofAnatomy,Histology&Embryology,ShanghaiMedicalCollege,FudanUniversity,Shanghai200032,China;2InstituteofBiochemistryandCellBiology,CollegeofLifeScience,ChineseAcademyofSciences,Shanghai200032,China;3InstituteofCardiovascularDiseases,ZhongshanHospital,FudanUniversity,Shanghai200032,China;4KeyLaboratoryofMedicalImagingComputing&ComputerAssistedInterventionofShanghai,Shanghai200032,China;5InstitutesofBiomedicalSciences,FudanUniversity,Shanghai200032,China)
Mitochondria provide basic energy for the cell life activities.Electron transfer complexes in the inner mitochondrial membrane carry hydrogen and electronics to ATP enzyme complexes.This process is responsible for the energy and hydrogen ions across the membrane gradient cycle.The mitochondrial respiratort chain provides 95% of the energy to cell survival,which is mainly composed of 5 complex:NADPH-ubiquinone oxidoreductase,succinate-ubiquinone oxidoreductase,ubiquinone-cytochrome c reductase,cytochrome c oxidase and ATP synthase located on the mitochondrial membrane.We explicated in detail molecular structure,function and biological significance of mitochondrial complexes in present article.
NADH-ubiquinone oxidoreductase (SQR); succinate-ubiquinone oxidoreductase (QCR); ubiquinone-cytochrome c reductase (COX); cytochrome c oxidase; ATP synthase
国家自然科学基金青年项目(81300232)
R 34
B
10.3969/j.issn.1672-8467.2015.02.019
2014-10-27;编辑:段佳)
△Corresponding author E-mail:ge.junbo@zs-hospital.sh.cn
*This study was supported by the Youth Project of the National Natural Science Foundation of China (81300232).
