普拉克索片在健康人体的药动学研究及安全性评价
2015-06-24张云轩陈笑艳施孝金卢家红钟大放钟明康
张云轩 陈笑艳 施孝金 卢家红 钟大放 钟明康
(1复旦大学附属华山医院药剂科 上海 200040;2复旦大学附属华东医院药剂科 上海 200040;3上海药物代谢研究中心 上海 201203;4复旦大学附属华山医院神经内科 上海 200040)
普拉克索片在健康人体的药动学研究及安全性评价
张云轩1,2陈笑艳3施孝金1△卢家红4钟大放3钟明康1
(1复旦大学附属华山医院药剂科 上海 200040;2复旦大学附属华东医院药剂科 上海 200040;3上海药物代谢研究中心 上海 201203;4复旦大学附属华山医院神经内科 上海 200040)
目的 研究健康受试者口服0.125 mg和0.25 mg普拉克索片的药动学过程,并评价该制剂的安全性,为注册治疗不宁腿综合征(restless leg syndrome,RLS)提供药动学依据。方法 采用随机、开放、双向交叉试验设计,12名健康受试者(男女各半)分两个阶段分别进行单次口服普拉克索片0.125 mg和0.25 mg的药动学试验,两次给药间隔13天,每次给药前及给药后采集血样,采用液相色谱-串联质谱联用法(LC-MS/MS)测定健康受试者给药后血浆中普拉克索的浓度。采用WinNonlin (R) 6.0版软件计算普拉克索片的药动学参数(AUC0-t、AUC0-∞﹑ρmax﹑tmax﹑t1/2﹑CL/F等)。整个试验过程进行全面安全性评估。结果 单次口服普拉克索片0.125 mg和0.25 mg后,ρmax分别为(237±83) μg/L和(493±155) μg/L,tmax分别为(1.71±1.64) h和(1.21±1.01) h,t1/2分别为(6.12±2.21) h和(7.27±2.17) h,AUC0-∞分别为(1 791±765) μg·h·L-1和(4 419±1 932) μg·h·L-1,不同性别的药动学参数差异无统计学意义(P>0.05).试验过程无严重不良事件发生。结论 单次口服0.125 mg或 0.25 mg普拉克索吸收很快,吸收程度随剂量增加而增加,药动学过程不受性别影响.本研究制剂安全性较好,可按试验剂量给药治疗RLS。
普拉克索; 药动学; 安全性; 液相色谱-串联质谱联用法(LC-MS/MS); 不宁腿综合征(RLS)
普拉克索是一种非麦角类多巴胺激动剂[1],最初的适应证是治疗特发性帕金森病的体征和症状,现在研究发现还可有效治疗不宁腿综合征(restless leg syndrome,RLS),欧洲、北美已注册用于RLS的治疗[2],但有报道低血压,嗜睡,性欲亢进和病态赌博等不良事件[3]。日本在健康男性中做了普拉克索单次给药0.1、0.2和0.3 mg的药动学和安全性研究[4],发现0.3 mg以内剂量单次给药时安全耐受性好。芬兰进行的一项为期3周的随机、双盲、安慰剂对照试验则证实0.125 mg和0.25 mg为临床治疗RLS症状的有效剂量[5]。因此本试验选择0.125 mg和0.25 mg作为研究剂量组,并以液相色谱-串联质谱联用法(LC-MS/MS)方法测定12名健康中国受试者(男女各半)口服普拉克索片的血药浓度[6],研究药动学过程,并进行安全性评价,为本药物在中国注册和临床治疗RLS提供药动学依据,并提高普拉克索在中国人群中药动学的认识。
资 料 和 方 法
受试者选择 选择12名健康志愿者,男女各半,平均年龄(25±5)岁,身高(1.675±0.062) m,体重(60.8±6.1) kg,经体检证明肝、肾功能正常,心电图正常,均符合受试者入选要求。试验前12人均签署知情同意书,试验方案经复旦大学附属华山医院伦理委员会批准。
试验药物与试剂 普拉克索片(批号:806807,规格:0.125 mg,);普拉克索片(批号:807017,规格:0.25 mg,)。普拉克索对照品(批号:1018351/0006,纯度:93.6%),以上药物均为上海勃林格殷格翰药业有限公司产品。内标石杉碱甲对照品(批号:100243-200401,纯度:100%,中国药品生物制品检定所)。乙醚、二氯甲烷和氢氧化钠(AR纯),甲醇、乙腈、醋酸铵和甲酸(HPLC级),水( 法国 Millipore 纯水器制备),人空白血浆 (复旦大学附属华山医院血库提供)。
仪器 Agilent 1100高效液相色谱(美国Agilent 公司),TSQ Quantum Ultra 型三重四极杆串联质谱仪(美国Thermo Finnigan 公司),配备电喷雾离子源,Xcalibur 2.0.7 软件(美国Thermo Finnigan 公司),色谱柱为Venusil ASB-C18柱( 4.6 mm×150 mm,5 μm,天津艾杰尔公司),预柱为C18柱( 4.0 mm×3.0 mm,5 μm,美国Phenomenex公司)。
分组及血浆样品采集 12名中国健康受试者以1∶1随机分为2组,采用开放、双向交叉设计,试验分2个阶段进行。受试者入组后,于次日清晨空腹口服试验药物0.125 mg 或 0.25 mg,于给药前1h及给药后0.25、0.5、1.0、1.5、2.0、3.0、4.0、6.0、8.0、12.0、16.0、24.0、36.0、48.0 h分别抽取静脉血5 mL,置于肝素化离心管中,离心(12 000×g,10 min)分离血浆,于-20 ℃保存待测。受试者经13天清洗期,于清晨再次空腹口服试验药物0.25 mg或0.125 mg,血浆样本的获取时间和方法同第1阶段。
普拉克索的LC-MS/MS测定方法 精密吸取500 μL血浆样品,加入25 μL 内标工作液(20 μg/L)、50 μL甲醇-水溶液( 50∶50,v/v)和0.1 mol/L的NaOH溶液100 μL,混匀。加3.5 mL萃取剂(乙醚:二氯甲烷( 3∶2,v/v),涡流混合1.5 min,往复振荡15 min (240次/min),12 000×g高速离心5 min,移取全部上层有机相,40 ℃空气吹干,流动相:乙腈-10 mmoL/L醋酸铵-甲酸(60∶40∶0.1,v/v/v)复溶,取20 μL进行LC-MS/MS分析。流速0.5 mL/min;柱温25 ℃。
采用电喷雾离子源正离子模式,质谱扫描方式为选择反应监测,分别测定普拉克索正离子m/z212-,m/z111+,126+,153+,石杉碱甲正离子m/z243-,m/z210+,前者为准分子离子峰,后者为峰度较强的碎片离子,作为定量监测的产物离子。
本法测定血浆中普拉克索的线性范围为5.92~740 μg/L,定量下限(LLOQ)为5.92 μg/L。高、中、低浓度的普拉克索和内标的提取回收率均>90%,绝对基质效应在90%~110%。用6个不同人空白血浆考察方法的基质效应,相对标准偏差(RSD)<12%。方法测定准确度为98%~103%,日内、日间RSD均<10%。另用来自同一受试者的生物样品在同一批中测定,每次测定时建立新的标准曲线,并随时测定高、中、低3个浓度的质控样品,考察普拉克索血浆样品室温放置2 h 的稳定性、经液-液萃取后在室温放置 24 h 的稳定性、血浆样品经历3次冷冻-解冻循环的稳定性和血浆样品-20 ℃ 放置58 天的稳定性等。结果显示方法的特异性、准确性、灵敏度、稳定性等技术指标均满足SFDA颁布的《化学药物临床药动学研究技术指导原则》中关于临床药物代谢药动学研究体内药物分析的方法学的技术要求和本试验研究药物的测定需求。
药动学研究 本试验采用WinNonlin (R) 6.0版软件计算普拉克索片的药动学参数。
安全性评价 整个试验过程由神经内科医师进行临床监护,并进行全面的安全性评估,包括生命体征,心电图检查,实验室检查和不良事件等。

结 果
药动学研究 12名健康受试者单次口服普拉克索0.125 mg和0.25 mg后的平均血浆浓度-时间曲线见图1,计算所得药代动力学参数见表1。

表1 单剂量双向交叉试验中口服普拉克索片0.125 mg和0.25 mg后普拉克索片的药动学参数Tab 1 Pharmacokinetic parameters in a 2-period single dose crossover study of tablets containing 0.125 mg and 0.25 mg pramipexole
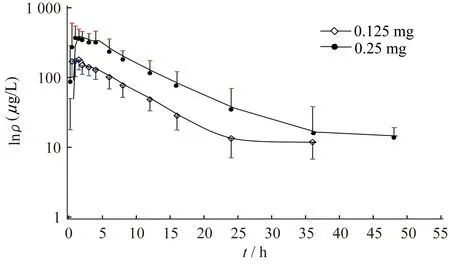
图1 单剂量双向交叉试验中12名健康受试者口服0.125 mg或0.25 mg普拉克索片后的平均血药浓度-时间曲线Fig 1 Mean plasma concentration-time curves of a 2-period single dose crossover study of tablets containing 0.125 mg and 0.25 mg pramipexole to 12 healthy volunteers
药代动力学分析结果显示,单次口服普拉克索可以很快达到一定的血药浓度,且ρmax和AUC随剂量增加而增加,显示进入体循环的药量随着给药剂量的增加而增加。男女受试者的各主要药动学参数之间的差异均无统计学意义(P>0.05)。
安全性分析 本试验过程无严重不良事件发生,0.125 mg组内1例出现血压下降、头晕及冷汗、1例女性受试者出现双侧乳房胀痛、1例出现I度房室传导阻滞。0.25 mg组内1例发生血压下降、头晕及冷汗。其中与普拉克索有关的不良事件的程度均为轻度。所有不良事件均可自行缓解,并在研究结束之前消失。试验期间监测受试者的生命体征,均未发现有临床意义的异常变化。实验室检查心电图、肝肾功能等均未见明显异常。
讨 论
RLS是一种独特的感觉运动异常症,其特征为四肢深处的不适感,迫使人不断运动以减轻休息时加剧的感觉异常,主要发生在傍晚和夜间,受累人群的生活和睡眠质量都会受到影响,是影响中年和老年人常见的疾病。考虑到RLS同时累及感觉和运动,包括脊髓运动的调节,很可能与大脑皮质层下的多巴胺系统相关。加拿大的一项对10个RLS患者的随机、双盲、安慰剂对照交叉试验[7]发现,左旋多巴和溴隐亭只能控制部分症状,而普拉克索作为一种非麦角类多巴胺激动剂,能选择性激动多巴胺D2受体,对D3受体亲和力高,使患者感觉运动异常有所减轻,比同类型的罗匹尼罗更有效[8]。但既往研究显示,可能发生以下不良作用:低血压、嗜睡、性欲亢进和病态赌博等[3]。
本试验选择0.125 mg和0.25 mg作为研究剂量组,与临床实践中常用的治疗RLS症状的有效剂量相一致。药动学参数分析显示,空腹给药后受试者的普拉克索的AUC0-t均达到AUC0-∞的90%以上,说明本试验测得的血药浓度-时间曲线能较好描述所研究制剂的药动学特征。试验中单次给药0.125 mg和0.25 mg普拉克索片在口服以后吸收迅速而完全,且进入体内的药量随剂量增加而递增,0.25 mg组AUC和ρmax较0.125 mg剂量组分别升高了147%和108%,与国外研究结果一致[9]。另对男性和女性受试者药动学参数的分析显示,不同性别的普拉克索药动学参数的差异无统计学意义(P>0.05),说明普拉克索的代谢不受性别影响。
试验期间受试者的生命体征均未发现有临床意义的异常变化,实验室检查心电图、肝肾功能等均未见明显异常,给药后部分受试者出现血压下降、头晕及冷汗等预期不良事件,均为一过性并可自行缓解。0.125 mg组的1例房室传导阻滞和1例乳房胀痛事件经研究者判断为与试验药物相关,发生房室传导阻滞的受试者在试验过程中心电图显示PQ间期在0.21~0.24 s,为轻度异常值,且该名受试者在整个试验过程中未出现任何不适;而在既往应用普拉克索时,极少有自发报告乳房胀痛事件。所有不良事件均在研究结束之前消失,试验过程无严重不良事件发生,0.125 mg和0.25 mg普拉克索片剂的安全性较好,可用于临床RLS的治疗。
[1] Antonini A,Calandrella D.Pharmacokinetic evaluation of pramipexole [J].ExpertOpinDrugMetabToxicol,2011,7(10):1307-1314.
[2] Mccormack PL,Siddiqui MA.Pramipexole:in restless legs syndrome [J].CNSDrugs,2007,21(5):429-437.
[3] Stiasny K,Möller JC,Oertel WH.Safety of pramipexole in patients with restless legs syndrome [J].Neurology,2000,55(10):1589-1590.
[4] Inoue Y,Hirata K,Kuroda K,etal.Efficacy and safety of pramipexole in Japanese patients with primary restless legs syndrome:A polysomnographic randomized,double-blind,placebo-controlled study [J].SleepMed,2010,11(1):11-16.
[5] Jama L,Hirvonen K,Partinen M,etal.A dose-ranging study of pramipexole for the symptomatic treatment of restless legs syndrome:polysomnographic evaluation of periodic leg movements and sleep disturbance [J].SleepMed,2009,10(6):630-636.
[6] Li H,Chen XY,Shi XJ,etal.LC-MS/MS determination of pramipexole in human plasma [J].ChinJPharmAnal,2011,31(2):330-334.
[7] Montplaisir J,Nicolas A,Denesle R,etal.Restless legs syndrome improved by pramipexole:a double-blind randomized trial [J].Neurology,1999,52(5):938-943.
[8] Quilici S,Abrams KR,Nicolas A,etal.Meta-analysis of the efficacy and tolerability of pramipexole versus ropinirole in the treatment of restless legs syndrome [J].SleepMed,2008,9(7):715-726.
[9] Wright CE,Sisson TL,Ichhpurani AK,etal.Steady-state pharmacokinetic properties of pramipexole in healthy volunteers [J].JClinPharmacol,1997,37(6):520-525.
Pharmacokinetics study and safety assessment of pramipexole tablets in healthy Chinese subjects
ZHANG Yun-xuan1,2, CHEN Xiao-yan3, SHI Xiao-jin1△, LU Jia-hong4, ZHONG Da-fang3, ZHONG Ming-kang1
(1DepartmentofPharmacy,HuashanHospital,FudanUniversity,Shanghai200040,China;2DepartmentofPharmacy,HuadongHospital,FudanUniversity,Shanghai200040,China;3CenterforDrugMetabolismandPharmacokineticsResearch,Shanghai201203,China;4DepartmentofNeurology,HuashanHospital,FudanUniversity,Shanghai200040,China)
Objective To investigate the pharmacokinetic properties and safety of a single dose of 0.125 mg and 0.25 mg of pramipexole tablets in healthy Chinese subjects for the registration of treating restless leg syndrome (RLS). Methods One single-dose,open-label,randomized and crossover study of oral pramipexole tablets was conducted in 12 healthy subjects (6 males,6 females) aged from 20 to 30 years,who were orally administrated pramipexole tablet 0.125 mg in fasted state.After a washout period of 13 days,the subjects were orally administrated another dose of 0.25 mg.Plasma samples were collected before and after each of 12 healthy subjects was given a tablet.Concentrations of pramipexole were determined by LC-MS/MS.Pharmacokinetic parameters (AUC0-t,AUC0-∞,ρmax,tmax,t1/2,CL/F,etal) of 0.125 mg and 0.25 mg dose groups were calculated with WinNonlin (R) Version 6.0.Safety assessment was performed throughout the experiment. Results The main pharmacokinetic parameters of 0.125 mg and 0.25 mg dose groups were as follows respectively:ρmax,(237±83) μg/L and (493±155) μg/L;tmax,(1.71±1.64) h and (1.21±1.01) h;t1/2,(6.12±2.21) h and (7.27±2.17) h;AUC0-∞,(1 791±765) μg·h·L-1and (4 419±1 932) μg·h·L-1.There was no significant difference in pharmacokinetic parameters between different gender (P>0.05). Conclusions Tablets containing 0.125 mg and 0.25 mg pramipexole are absorbed quickly,and the extent of absorption increases with the dose.The pharmacokinetic properties are not influenced by gender.It is safe to use the agent.The experiment doses for treating RLS can be recommended.
pramipexole; pharmacokinetics; safety; LC-MS/MS; restless leg syndrome (RLS)
R 969.1
A
10.3969/j.issn.1672-8467.2015.02.016
2014-09-01;编辑:王蔚)
△Corresponding author E-mail:xiaojin_shi@hotmail.com
