STAT3在新型肠道病毒71型(EV71)感染和复制中的作用初步研究
2015-06-24刘晴晴李泽阳龙健儿
王 艳 卞 良 刘晴晴 熊 鹰 李泽阳 龙健儿
(复旦大学基础医学院病原生物学系 上海 200032)
STAT3在新型肠道病毒71型(EV71)感染和复制中的作用初步研究
王 艳 卞 良 刘晴晴 熊 鹰 李泽阳 龙健儿△
(复旦大学基础医学院病原生物学系 上海 200032)
目的 研究STAT3(signal transducer and activator of transcription 3)对新型肠道病毒71型(enterovirus 71,EV71)感染及复制的影响。方法 观察EV71感染横纹肌肉瘤细胞后STAT3的动态表达;利用慢病毒载体下调或过表达STAT3技术,观察细胞在改变STAT3表达后,对EV71感染细胞后病毒VP1表达、形成蚀斑和病毒滴度的影响,研究STAT3对EV71感染和复制的影响。结果 EV71感染可明显下调细胞STAT3-Tyr705磷酸化(p-STAT3)水平。在STAT3表达稳定下调的细胞中,p-STAT3水平也下调,这有利于EV71病毒感染和复制。而过表达STAT3的细胞内,p-STAT3水平也上调,对EV71感染和复制的效应与上述STAT3下调的结果相反。免疫共聚焦和蚀斑分析发现高表达p-STAT3的细胞不易被EV71感染。结论EV71感染可明显下调p-STAT3水平,并促进病毒的复制。STAT3影响EV71的感染和复制,可能主要通过STAT3的磷酸化水平影响细胞对病毒的易感性。
EV71; STAT3; 横纹肌肉瘤细胞
肠道病毒71型(enterovirus 71,EV71)是导致婴幼儿手足口病及神经系统并发症的主要病原体,目前尚无有效的疫苗和特异性抗病毒药物[1-5]。因此,加强EV71与宿主相互作用的基础研究显得非常重要。研究表明,EV71感染诱导宿主细胞因子风暴(cytokine storm)和细胞凋亡可能与其导致神经性重症相关[1-2,6]。EV71诱生一些致炎症因子,如COX2、VCAM-1、TNF-α等通过激活C-Src(sarcoma kinase)、PDGFR (platelet-derived growth factor)、EGFR、PI3K/AKT、MAPK和NF-κB等信号通路[7-10]来表达;而PDGFR,EGFR,PI3K/AKT,NF-κB等分子可能与STAT3 (signal transducer and activator of transcription 3)分子在信号传递的多个层次上相互作用,形成正向或反向、直接或反馈的调控[11-14]。STAT3还能拮抗STAT1、STAT4等介导的Th1型细胞因子(如IL-12,IFN-γ)的释放,调节Treg、Th1、Th17等辅助T细胞的发育和分化等[13,15-16]。此外,STAT3可通过Fas、BCL-XL及BCL-2等基因参与细胞凋亡过程[11]。因此,作为中轴性信号转导分子,STAT3在病毒感染、细胞免疫应答、细胞生长发育和凋亡等多个环节起着重要的调节作用。
然而,STAT3在病毒感染和复制中的作用尚不明确,有研究表明STAT3影响多种病毒的感染和复制,如SARS-CoV、VZV、HCV和HBV等[17-20]。研究发现,pY705-STAT3 (p-STAT3)在VZV、HCV和HBV等病毒感染后上调,并促进上述病毒的复制。而在Vero E6细胞中,p-STAT3在SARS-CoV感染后下调;在B细胞中,低水平的p-STAT3有利于激活EBV裂解细胞[21]。显然STAT3对病毒感染和复制的影响是一个病毒特异性生物学过程。至于STAT3是否在EV71的感染和复制中发挥重要作用目前并不清楚。因此,本研究拟通过观察EV71感染细胞后STAT3的动态变化,构建过表达STAT3细胞株及STAT3稳定沉默细胞株,以研究STAT3对EV71感染和复制的影响。
材 料 和 方 法
材料和试剂 EV71病毒株(Genbank Access No.HQ891927,064-Shanghai)由本实验室分离并保存[22]。横纹肌肉瘤(rhabdomysarcoma,RD)细胞购自中科院细胞库。慢病毒过表达载体pCDH-puro和基因沉默载体pLKO.1-puro系统分别为美国SBI和Addgene公司产品。
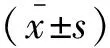
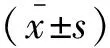
构建稳定下调或过表达STAT3的RD细胞 为构建稳定下调STAT3表达细胞,通过设计与人类STAT3 mRNA (NM_139276.2) 1 578~1 598位点靶向结合的短发卡RNA(short hairpin,shRNA)。将shRNA克隆入慢病毒载体pLKO.1,与病毒包装质粒pspAX2,pMD2.G共转染RD细胞,包装有感染性的病毒。用包装好的慢病毒感染RD细胞,通过嘌呤霉素(2 μg/mL)筛选稳定整合慢病毒的细胞株RD-pLKO.1-shSTAT3。提取细胞基因组DNA经PCR进一步确认病毒整合情况。为构建过表达STAT3细胞,将STAT3 cDNA (位于133~2 396,NM_213662)克隆入慢病毒载体pCDH-puro中,按照上述类似方法包装有感染性的慢病毒,然后用嘌呤霉素筛选稳定细胞株(RD-pCDH-STAT3-puro)。同时分别构建和筛选整合阴性对照慢病毒载体pLKO.1-SCR及pCDH-puro的RD细胞作为对照。
免疫荧光染色 为确定STAT3对病毒感染的作用,将上述整合不同慢病毒的RD细胞接种于6孔板(6×105/孔),孵育24 h后感染EV71 (MOI=1.0 PFU/细胞)。2 h后弃去病毒上清,重新加入2 mL新鲜培养基。感染后6 h,细胞经4%甲醛固定、甲醇穿透之后与VP1单抗(1∶1 000稀释)和山羊抗鼠IgG-DyLight 594(1∶500稀释)反应。最后用DAPI染色,在EVOS F1荧光显微镜下观察;或同时以p-STAT3单抗(1∶100稀释)和山羊抗兔IgG-Alexa FluorTM488染色。最后经DAPI着染,细胞免疫荧光经共聚焦显微镜观察。
MTT法检测细胞存活力 为确定STAT3表达改变后EV71感染如何影响细胞存活力,将整合不同慢病毒的RD细胞接种在96孔板(2×104/孔)中,孵育24h后,EV71以不同的MOI感染细胞(从MOI=10 PFU/细胞开始2倍连续稀释)。细胞孵育24~72 h后,随后加入MTT(10 μL/孔)反应4 h,再加入DMSO (200 μL/孔)于37 ℃裂解15 min,并测定细胞570 nm处的吸光度(D)值。病毒感染后细胞的存活力百分数以DEV71-infected/Dcell control×100%表示。
EV71蚀斑形成分析 将RD细胞接种于6孔板(1×106/孔),孵育24 h。之后EV71按梯度稀释感染RD细胞2 h,弃去病毒上清后用PBS洗3遍,然后用2 mL含2% FBS及0.5%低熔点琼脂糖的新鲜培养基覆盖并孵育72 h。用0.1%的中性红染色4~6 h后观察蚀斑形成情况。为确定STAT3对EV71形成蚀斑能力的影响,将整合不同慢病毒的RD细胞分别接种于6孔板,然后用相同病毒储存液(经正常RD细胞测定后病毒滴度为4.8×107PFU/mL)经指定倍数稀释,分别用0.5 mL病毒稀释液感染不同细胞2 h,按上述方法检测EV71在不同细胞上形成蚀斑的数量和大小。
数据统计分析 不同组间的数据使用Student′st检验进行数据分析,所有数据均使用SPSS 11.0软件进行处理。P<0.05为差异有统计学意义。
结 果
EV71对STAT3表达的影响 EV71感染细胞后30和45 min,STAT3磷酸化(p-STAT3)水平分别下调1.86和3.14倍,并长时间持续下降(图1A)。而总STAT3的表达在EV71感染后无显著变化(图1B)。结果表明EV71感染可迅速下调p-STAT3的水平,而对总STAT3的表达无显著影响。
p-STAT3与EV71感染的关系 为研究p-STAT3与EV71感染的关系,我们利用免疫荧光染色和共聚焦显微镜观察,发现在EV71感染早期(6 h,MOI=1 PFU/细胞),高水平p-STAT3表达的细胞(强绿色荧光)通常不易被EV71感染、几乎看不到VP1染色信号(红色荧光);而被EV71感染,VP1染色信号强的细胞,其p-STAT3的水平通常较低(图2)。提示细胞高表达p-STAT3可能抑制了EV71的感染。
下调STAT3可促进EV71的感染和复制 为确定STAT3及p-STAT3在EV71感染和复制中的作用,我们采用shRNA下调STAT3和p-STAT3的方法,通过构建相应的慢病毒载体、筛选稳定下调STAT3的细胞株RD-pLKO.1-shSTAT3(图3A)。在稳定细胞株中,STAT3 mRNA、总STAT3及p-STAT3与对照细胞株RD-pLKO.1-SCR相比均明显下调(图3B)。在EV71感染后的8 h,免疫荧光染色显示RD-pLKO.1-shSTAT3细胞中VP1信号高于对照组RD-pLKO.1-SCR细胞(图3C)。EV71在不同MOI条件下感染细胞,细胞存活力随MOI的增加而下降,RD-pLKO.1-shSTAT3细胞存活力较对照RD-pLKO.1-SCR细胞下降更快,并且下降的幅度随着病毒感染时间延长至42~72 h而更为明显(图3D)。比较两种细胞EV71蚀斑形成情况,结果显示RD-pLKO.1-shSTAT3细胞形成的蚀斑大于对照组RD-pLKO.1-SCR细胞,且边缘较清晰;形成的蚀斑数量在等量病毒、相同感染时段较对照组增加2.92倍(图3E)。提示下调STAT3和p-STAT3水平使细胞对EV71更敏感,显著恢复了RD细胞由于整合pLKO.1慢病毒载体后而丧失的部分对EV71的敏感性(病毒储存液在RD-pLKO.1-SCR上形成的蚀斑数明显少于正常RD细胞,结果未统计)。观察EV71感染RD-pLKO.1-shSTAT3细胞后病毒的复制情况,结果显示在感染后8~24 h,EV71 VP1在RD-pLKO.1-shSTAT3细胞中的表达与对照相比,可更早地检测到,且表达量明显更高(图3F),同时上清液中病毒滴度在感染后4~24 h均明显高于对照组(P<0.05,图3G)。上述结果提示下调STAT3和p-STAT3水平可增加细胞对EV71的易感性,进而促进病毒的感染和复制。

图1 EV71感染RD细胞后p-STAT3和STAT3的表达Fig 1 Expressions of p-STAT3 and STAT3 after EV71 infected RD cells
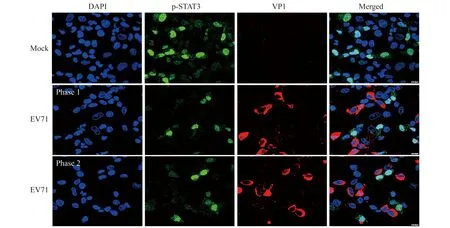
图2 免疫荧光染色观察EV71感染细胞后VP1和p-STAT3的表达(×200)Fig 2 Immunofluorescence staining of VP1 and p-STAT3 in cells after EV71 infection (×200)
过表达STAT3抑制EV71的感染和复制 为进一步确认STAT3对病毒感染的作用,将STAT3基因克隆并包装进入慢病毒载体pCDH-STAT3-puro,进而筛选稳定表达的细胞株RD-pCDH-STAT3-puro(图4A)。在稳定细胞株中,STAT3 mRNA上调了3.68倍,总STAT3和p-STAT3较对照组RD-pCDH-puro分别上调了2.41倍和1.97倍(图4B)。利用此RD-pCDH-STAT3-puro细胞检测过表达STAT3对EV71感染和复制的影响:在EV71感染细胞后8h,免疫荧光染色初步显示RD-pCDH-STAT3-puro细胞中VP1信号弱于对照组RD-pCDH-puro细胞(图4C);病毒以不同的MOI复数感染细胞之后,随着MOI的增加,RD-pCDH-STAT3-puro和对照组RD-pCDH-puro细胞的存活力均明显下降,但RD-pCDH-STAT3-puro较对照组下降更慢。当病毒感染至48 h时,RD-pCDH-STAT3-puro细胞存活力比对照组下降的幅度也更小(图4D)。比较EV71感染两种细胞株的蚀斑形成情况,发现等量病毒在相同的感染时间内,RD-pCDH-STAT3-puro细胞形成的蚀斑数量约为对照组RD-pCDH-puro细胞的81%(图4E)。观察EV71的复制情况,发现RD-pCDH-STAT3-puro细胞中EV71 VP1的表达在感染后8~24 h低于对照组(图4F),且上清中病毒滴度在感染后8~24 h也明显低于对照组(P<0.05,图4G)。上述结果说明,过表达STAT3和高水平的p-STAT3降低了细胞对EV71的易感性,并不利于EV71的感染和复制。
讨 论
STAT3可影响多种病毒的复制过程,有研究显示HCV核心蛋白可直接与STAT3相互作用并激活STAT3。研究发现在HCV复制时STAT3被持续地磷酸化,且STAT3的活化可显著促进HCV的复制。由于STAT3是转录因子,研究发现STAT3可能通过正向调控微管动力蛋白而影响HCV的复制过程[19]。HBV的X蛋白(HBx)在病毒复制及诱导肝细胞肿瘤过程中发挥重要作用。Waris等[20]发现,HBx可与线粒体结合并诱导一些转录因子(如STAT3和NF-κB活化)。另有研究发现,带状疱疹病毒感染可导致细胞STAT3的磷酸化,而磷酸化抑制剂可抑制体外VZV的复制,显著减小由VZV感染导致的皮肤损伤[18]。

图3 STAT-3表达下调促进EV71的感染和复制Fig 3 STAT-3 knock-down stimulated EV71 infection

图4 STAT-3过表达抑制EV71的感染和复制Fig 4 STAT-3 overexpression inhibited EV71 infection
STAT3在病毒复制中的作用十分复杂,如p-STAT3在上述病毒如HCV、HBV和VZV感染后上调,并促进病毒的复制,而在Vero E6细胞中p-STAT3在SARS-CoV感染后下调[17],这与本研究EV71感染后使细胞p-STAT3下调类似。此外,在B细胞中低水平的p-STAT3有利于激活EBV裂解细胞[21],而IL-6诱导的STAT-3磷酸化和入核过程也被人偏肺病毒(human metapneumovirus)感染所抑制[23]。显然,宿主细胞STAT3影响病毒复制是一个对病毒特异的应答过程。
在本研究中,我们发现了STAT3与EV71的感染和复制有关。EV71感染可以明显抑制STAT3的磷酸化,而高水平p-STAT3抑制了EV71的感染。下调STAT3可以促进病毒增殖,而过表达STAT3则抑制病毒复制。结合共聚焦显微镜观察EV71感染细胞早期p-STAT3和VP1的分布及等量病毒在相同感染时间内形成的蚀斑,提示细胞STAT3影响EV71感染和复制可能主要通过p-STAT3水平来影响细胞对EV71的敏感性,进而影响EV71的复制。至于STAT-3影响EV71感染和复制的分子机制,以及EV71又如何下调宿主细胞p-STAT3水平而拮抗细胞的抗病毒能力,尚需进一步研究。明确STAT3和EV71感染和复制的关系有利于加深对EV71致病机制的理解,并为研究抗EV71感染药物提供线索。
[1] Solomon T,Lewthwaite P,Perera D,etal.Virology,epidemiology,pathogenesis,and control of enterovirus 71 [J].LancetInfectDis,2010,10(11):778-790.
[2] Ooi MH,Wong SC,Lewthwaite P,etal.Clinical features,diagnosis,and management of enterovirus 71[J].LancetNeurol,2010,9(11):1097-1105.
[3] Yi L,Lu J,Kung HF,etal.The virology and developments toward control of human enterovirus 71 [J].CritRevMicrobiol,2011,37(4):313-327.
[4] Lee MS,Chang LY.Development of enterovirus 71 vaccines [J].ExpertRevVaccines,2010,9(2):149-156.
[5] Wu KX,Ng MM,Chu JJ.Developments towards antiviral therapies against enterovirus 71 [J].DrugDiscovToday,2010,15(23-24):1041-1051.
[6] Weng KF,Chen LL,Huang PN,etal.Neural pathogenesis of enterovirus 71 infection [J].MicrobesInfect,2010,12(7):505-510.
[7] Tung WH,Sun CC,Hsieh HL,etal.EV71 induces VCAM-1 expression via PDGF receptor,PI3-K/Akt,p38 MAPK,JNK and NF-kappa B in vascular smooth muscle cells [J].CellSignal,2007,19(10):2127-2137.
[8] Tung WH,Lee IT,Hsieh HL,etal.EV71 induces COX-2 expression via c-Src/PDGFR/PI3K/Akt/p42/p44 MAPK/AP-1 and NF-kappa B in rat brain astrocytes [J].JCellPhysiol,2010,224(2):376-386.
[9] Tung WH,Hsieh HL,Yang CM.Enterovirus 71 induces COX-2 expression via MAPKs,NF-kappaB,and AP-1 in SK-N-SH cells:Role of PGE(2) in viral replication [J].CellSignal,2010,22(2):234-246.
[10] Tung WH,Hsieh HL,Lee IT,etal.Enterovirus 71 modulates a COX-2/PGE(2)/cAMP-dependent viral replication in human neuroblastoma cells:role of the c-Src/EGFR/p42/p44 MAPK/CREB signaling pathway [J].JCellBiochem,2011,112(2):559-570.
[11] Aggarwal BB,Kunnumakkara AB,Harikumar KB,etal.Signal transducer and activator of transcription-3,inflammation,and cancer:how intimate is the relationship? [J].AnnNYAcadSci,2009,1171:59-76.
[12] Bode JG,Ehlting C,Haussinger D.The macrophage response towards LPS and its control through the p38(MAPK)-STAT3 axis [J].CellSignal,2012,24(6):1185-1194.
[13] Yu H,Pardoll D,Jove R.STATs in cancer inflammation and immunity:a leading role for STAT3 [J].NatRevCancer,2009,9(11):798-809.
[14] Lee H,Herrmann A,Deng JH,etal.Persistently activated stat3 maintains constitutive NF-kappa B activity in tumors [J].CancerCell,2009,15(4):283-293.
[15] Gerosa F,Baldani-Guerra B,Lyakh LA,etal.Differential regulation of interleukin 12 and interleukin 23 production in human dendritic cells [J].JExpMed,2008,205(6):1447-1461.
[16] Kortylewski M,Xin H,Kujawski M,etal.Regulation of the IL-23 and IL-12 balance by stat3 signaling in the tumor microenvironment [J].CancerCell,2010,18(5):536-536.
[17] Mizutani T,Fukushi S,Murakami M,etal.Tyrosine dephosphorylation of STAT3 in SARS coronavirus-infected Vero E6 cells [J].FEBSLetters,2004,577(1-2):187-192.
[18] Sen N,Che X,Rajamani J,etal.Signal transducer and activator of transcription 3 (STAT3) and survivin induction by varicella-zoster virus promote replication and skin pathogenesis [J].ProcNatlAcadSciUSA,2012,109(2):600-605.
[19] McCartney EM,Helbig KJ,Narayana SK,etal.Signal transducer and activator of transcription 3 is a proviral host factor for hepatitis C virus [J].Hepatology,2013,58(5):1558-1568.
[20] Waris G,Huh KW,Siddiqui A.Mitochondrially associated hepatitis B virus X protein constitutively activates transcription factors STAT-3 and NF-kappa B via oxidative stress [J].MolCellBiol,2001,21(22):7721-7730.
[21] Hill ER,Koganti S,Zhi J,etal.Signal transducer and activator of transcription 3 limits Epstein-Barr virus lytic activation in B lymphocytes [J].JVirol,2013,87(21):11438-11446.
[22] Yan XF,Gao S,Xia JF,etal.Epidemic characteristics of hand,foot,and mouth disease in Shanghai from 2009 to 2010:Enterovirus 71 subgenotype C4 as the primary causative agent and a high incidence of mixed infections with coxsackievirus A16 [J].ScandJInfectDis,2012,44(4):297-305.
[23] Mitzel DN,Jaramillo RJ,Stout-Delgado H,etal.Human metapneumovirus inhibits the IL-6-induced JAK/STAT3 signalling cascade in airway epithelium [J].JGenVirol,2014,95(Pt 1):26-37.
Effects of STAT3 on enterovirus 71 (EV71) infection and replication
WANG Yan, BIAN Liang, LIU Qing-qing, XIONG Ying, LI Ze-yang, LONG Jian-er△
(LaboratoryofMedicalMicrobiology,DepartmentofMedicalMicrobiologyandParasitology,SchoolofBasicMedicalSciences,FudanUniversity,Shanghai,200032,China)
Objective To identify the roles of signal transducer and activator of transcription 3 (STAT3) in enterovirus 71 (EV71) infection and replication. Methods According to the observations of the kinetics of STAT3 in rhabdomysarcoma (RD) cells after EV71 infection,and the detection of the effects of loss-and gain-of-function of STAT3 (by knocked-in a short-hairpin RNA or a STAT3 gene into the cellular genome with a lentivirus vector,respectively) on the expression of EV71 VP1,virus plaque-forming,and virus titer after EV71 infection,we evaluated host STAT3 roles in EV71 infection and replication. Results The level of phosphorylated STAT3-Tyr705(pY705-STAT3) was down-regulated significantly after EV71 infection.In the RD cells knocked-down STAT3,p-STAT3 was also down-regulated.The knock-down of STAT3 promoted EV71 infection and replication.By contrast,over-expression of STAT3 showed the opposite effects on EV71 infection.Confocal microscopy analysis and plaque-forming assay indicated that high level of p-STAT3 decreased the cellular susceptibility to EV71 infection. Conclusions Our data indicated that host STAT3 has an important role in EV71 infection and replication,which may be induced by the doen-regulation of phosphorylated p-STAT3 level.Therefore,EV71 infection increased the cellular susceptibility to the virus and promoted the viral replication.
EV71; STAT3; rhabdomysarcoma cell
国家传染病重大专项 (2012ZX10004503-003); 国家自然科学基金基础科学人才培养项目(J1210041); 上海市自然科学基金(09411964500)
R 738.7
A
10.3969/j.issn.1672-8467.2015.02.004
2014-08-17;编辑:张秀峰)
△Corresponding author E-mail:longjianer@fudan.edu.cn
*This work was supported by the National Science and Technology Major Project on Infectious Diseases (2012ZX10004503-003),Basic Science Youth Training Program of National Science Foundation of China (J1210041),and the Shanghai Science and Technology Fund (09411964500).
