富血小板血浆(PRP)对兔早期椎间盘退变(IDD)的干预作用
2015-06-24桂柯科俞永林任伟民董加纯尹望平
桂柯科 俞永林 任伟民 李 新 董加纯 尹望平
(1复旦大学附属金山医院骨科,3病理科,4放射科 上海 201508; 2复旦大学附属华山医院骨科 上海 200040)
富血小板血浆(PRP)对兔早期椎间盘退变(IDD)的干预作用
桂柯科1俞永林2△任伟民3李 新4董加纯1尹望平1
(1复旦大学附属金山医院骨科,3病理科,4放射科 上海 201508;2复旦大学附属华山医院骨科 上海 200040)
目的 采用纤维环穿刺法建立兔椎间盘退变(intervertebral disc degeneration,IDD)模型,进行椎间盘内注射自体富血小板血浆(platelet-rich plasma,PRP)干预,评价影像学及组织学干预效果。方法 健康成年新西兰大白兔16只,随机分为PRP干预组(A组)、磷酸盐缓冲液(phosphate buffered saline,PBS)注射组(B组)、造模对照组(C组)和单纯对照组(D组),每组4只。A、B和C组采用纤维环穿刺法建立L4/5、L5/6 IDD模型。在造模后2周,对各组实验动物进行二次干预。A组取耳中央动脉血,采用Landesberg法制备PRP,于L4/5、L5/6椎间隙分别注入0.1 mL PRP;B组于L4/5、L5/6椎间隙分别注入0.1 mL PBS;C组暴露椎间隙后不作特殊处理。干预后2周,进行X线及MRI检查。处死实验动物,取椎间盘组织进行HE染色、Masson染色、番红O染色以及Ⅱ型胶原免疫组织化学染色,观察组织学改变。结果 所有实验动物均存活至实验结束。PRP血小板计数约为外周血的3.69倍。随着时间推移,B组和C组的椎间隙高度逐渐下降、椎间盘信号逐渐降低,各时间点组内椎间盘高度指数百分数(disc height index percentage,%DHI)和MRI分级差异有统计学意义(P<0.05);A组和D组的椎间隙高度、椎间盘信号无明显变化,在初次手术后4周的时间点与B组和C组相比,差异均有统计学意义(P<0.05)。B组和C组的椎间盘组织病理学表现为髓核软骨细胞退行性变、坏死,形态不规则,分布不均匀,软骨基质逐步被纤维束取代,可见蛋白聚糖及Ⅱ型胶原减少;A组和D组的椎间盘组织形态变化不明显,在初次手术后4周的时间点与B组和C组相比,差异均有统计学意义(P<0.05)。结论 自体PRP注射治疗兔早期IDD模型的影像学及组织学评价满意,PRP早期干预可以有效抑制IDD进程。
富血小板血浆(PRP); 椎间盘退变(IDD); 生物学治疗; 兔
下腰痛是现代社会的常见病和多发病,椎间盘退变(intervertebral disc degeneration,IDD)是引起下腰痛的主要原因之一[1],目前在临床上尚无公认的有效治疗方法。近年来,IDD的分子生物学机制和治疗方法开始成为研究热点[2-3]。富血小板血浆(platelet-rich plasma,PRP)作为一种含有超生理浓度血小板的自体全血衍生物,富含多种生长因子和其他细胞因子,能促进多种类型细胞的迁移和增殖,为骨、软骨以及肌腱、肌肉等软组织的修复再生提供良好的微环境,近年来在骨科和整形外科领域得到了广泛关注[4]。目前国内外有关PRP对IDD的修复作用的研究仍处于起步阶段。本研究采用纤维环穿刺法建立兔IDD模型,抽取兔外周血通过高速离心制备PRP,对兔退变椎间盘进行盘内注射自体PRP干预,通过观察影像学及组织学表现对干预效果进行评价,以期为进一步临床应用提供实验基础。
材 料 和 方 法
实验动物 健康成年新西兰大白兔16只,雌雄不限,体质量(2.5±0.5) kg,由复旦大学实验动物科学部提供。经X线及MRI检查排除脊柱的先天性畸形和椎间盘病变。所有实验动物随机分为PRP干预组(A组)、磷酸盐缓冲液(phosphate buffered saline,PBS)注射组(B组)、造模对照组(C组)和单纯对照组(D组),每组各4只。其中A、B和C组分别按下述方法进行手术干预,D组实验动物不加干预,只在标准条件下饲养,用于对照。
IDD模型制备 对A组、B组和C组实验动物,采用氯胺酮0.2 g:地西泮10 mg混合后肌注麻醉,左侧卧位,固定妥四肢,腰背部电动剃毛器备皮,常规消毒铺巾。由第12肋缘至髂嵴作平行于脊柱长轴的纵切口长约8 cm,剪开腹外斜肌与背肌间隙,钝性分离至脊柱横突处,注意避免损伤腹膜,由于髂嵴与L6椎体大致在同一水平,可据此定位,找到相应的椎间隙,暴露L4/5、L5/6椎间盘。采用16 G穿刺针进行单次纤维环穿刺,穿刺方向为椎间盘侧前方平行终板,蚊式钳夹持穿刺针前端,控制刺入椎间盘中央深度为5 mm,维持5 s,然后拔出穿刺针。注意操作轻柔,避免将髓核带出。生理盐水冲洗创口后逐层缝合。所有动物分别于术前和手术结束时肌肉注射青霉素80万U。术后佩戴伊丽莎白项圈以防止动物舔咬手术切口,置于标准条件下自由喂养。
PRP制备 A组实验动物取耳中心动脉血约11 mL,其中0.5 mL用于镜下血小板计数,剩余10.5 mL加入含枸橼酸钠的试管中摇匀用于制备PRP。根据Landesberg等[5]推荐的二次离心条件,先以200×g离心10 min,留取上层及交界面以下约1 mm处共约4.5 mL,再以200×g离心10 min,留取下层1/4约1.1 mL液体摇匀,即为PRP。取0.5 mL PRP用于镜下血小板计数,剩余约0.6 mL PRP中加入0.06 mL凝血酶(浓度1 000 U/mL),形成凝胶状物备用。
二次手术干预 在初次手术后2周,分别对A、B、C组实验动物进行二次手术干预,具体方法如下。A组:暴露L4/5、L5/6椎间盘,分别注入0.1 mL自体PRP,然后逐层缝合。B组:暴露L4/5、L5/6椎间盘,分别注入0.1 mL PBS缓冲液(pH 7.4),然后逐层缝合。C组:暴露L4/5、L5/6椎间盘,不作特殊处理,然后逐层缝合。
X线检查 在初次手术前和二次手术干预后2周,所有实验动物摄腰椎正侧位DR片。应用PACS系统分别测量相应侧位片的椎间盘高度(DH)、上位椎体高度(UB)、下位椎体高度(LB),计算椎间盘高度指数(DHI)以及手术前后椎间盘高度指数百分数(disc height index percentage,%DHI,图1)。
MRI检查 在初次手术前和二次手术干预后2周,所有实验动物取仰卧位,采用Siemens 1.5T超导MRI扫描仪进行矢状位T2WI扫描,用SE序列,扫描参数为TR/TE 3500/100 ms,层厚1.5 mm,间隔0 mm。以Pfirrmann改良分级法[6]作为评估标准,根据T2WI像兔椎间盘信号强度将退变分为5级:I级,髓核结构均一、亮白,髓核纤维环界限清楚,髓核信号强度高,椎间盘高度正常;Ⅱ级,髓核结构不均,可有水平带,髓核纤维环界限清楚,髓核信号强度高,椎间盘高度正常;Ⅲ级,髓核结构不均、灰,髓核纤维环界限不清,髓核信号强度中,椎间盘高度轻度降低;Ⅳ级,髓核结构不均、灰到黑,髓核纤维环界限丢失,髓核信号强度中到低,椎间盘高度中度降低;V级,髓核结构不均、黑,髓核纤维环界限丢失,髓核信号强度低,椎间盘高度重度降低。
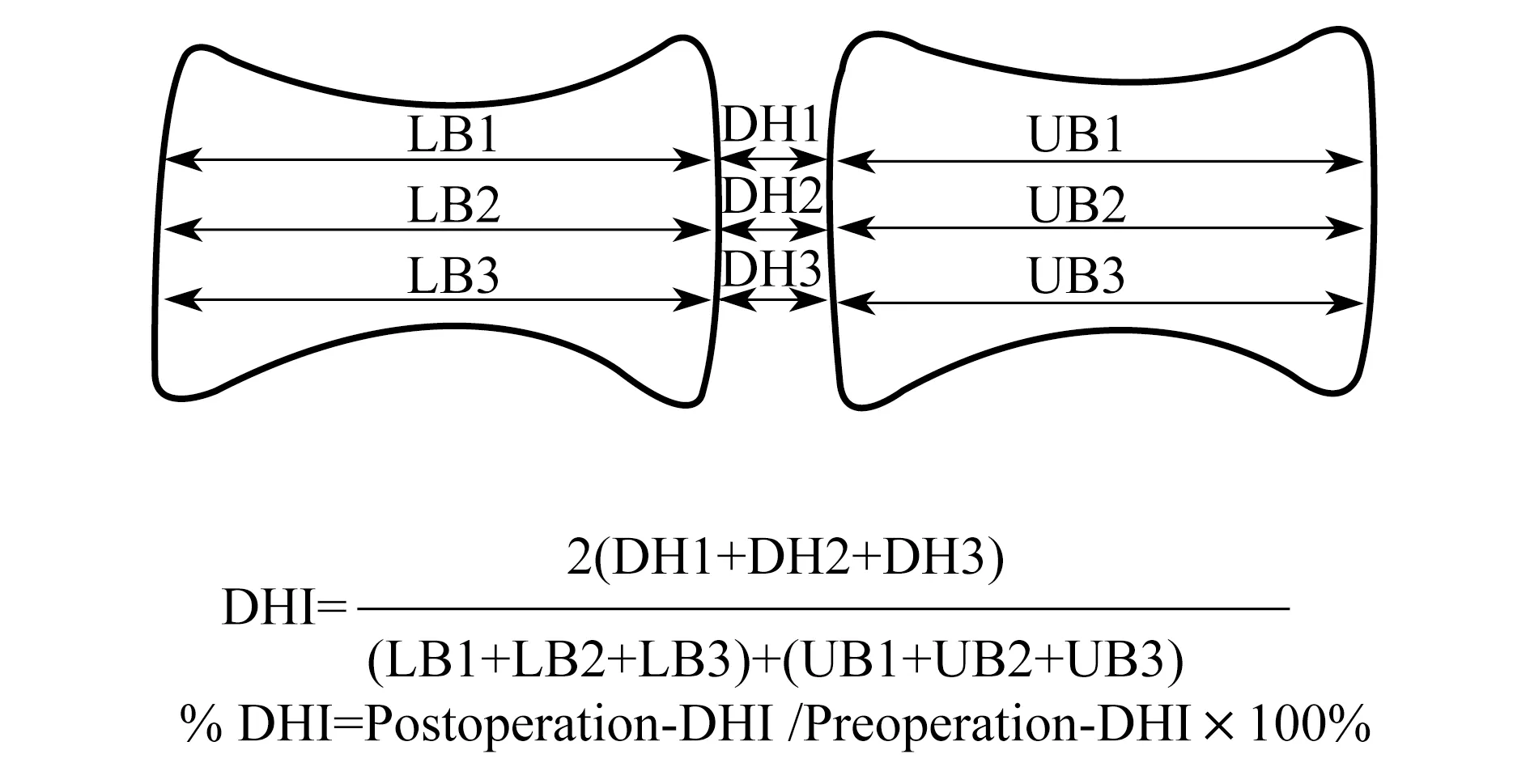
图1 X线测量和计算方法Fig 1 Measurement and calculation of X-rays
组织学检查 在二次手术干预后2周,结束X线及MRI检查后,经耳缘静脉注入10 mL空气处死实验动物,获取手术节段椎间盘髓核组织。常规切片,进行HE染色,观察髓核组织形态学变化;进行Masson染色,观察胶原纤维的变化;进行番红O染色,观察蛋白聚糖的变化;进行免疫组化染色,观察Ⅱ型胶原表达情况。在HE染色和番红O染色的基础上,参考文献[7]的半定量标准对髓核的病理变化进行分级:0级,正常结构;1级,细胞外基质蜂窝状改变,无结缔组织增生;2级,<24%的髓核组织被增生的结缔组织替代;3级,25%~50%的髓核组织被增生的结缔组织替代;4级,>50%的髓核组织被增生的结缔组织替代;5级,原有正常的髓核组织全部被增生的结缔组织替代。
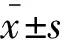
结 果
一般情况 所有动物均顺利存活至本实验结束。未发生切口感染、积液、裂开等情况,术后2周切口愈合良好。所有动物术后双下肢活动正常,未发生因穿刺过深导致瘫痪的情况。
PRP制备 A组所有实验动物外周血经二次离心后可得血小板富集层,吸弃大部分上清液后即可制得PRP(图2)。所得PRP中血小板计数P2约为外周血血小板计数P1的3.69倍(表1)。
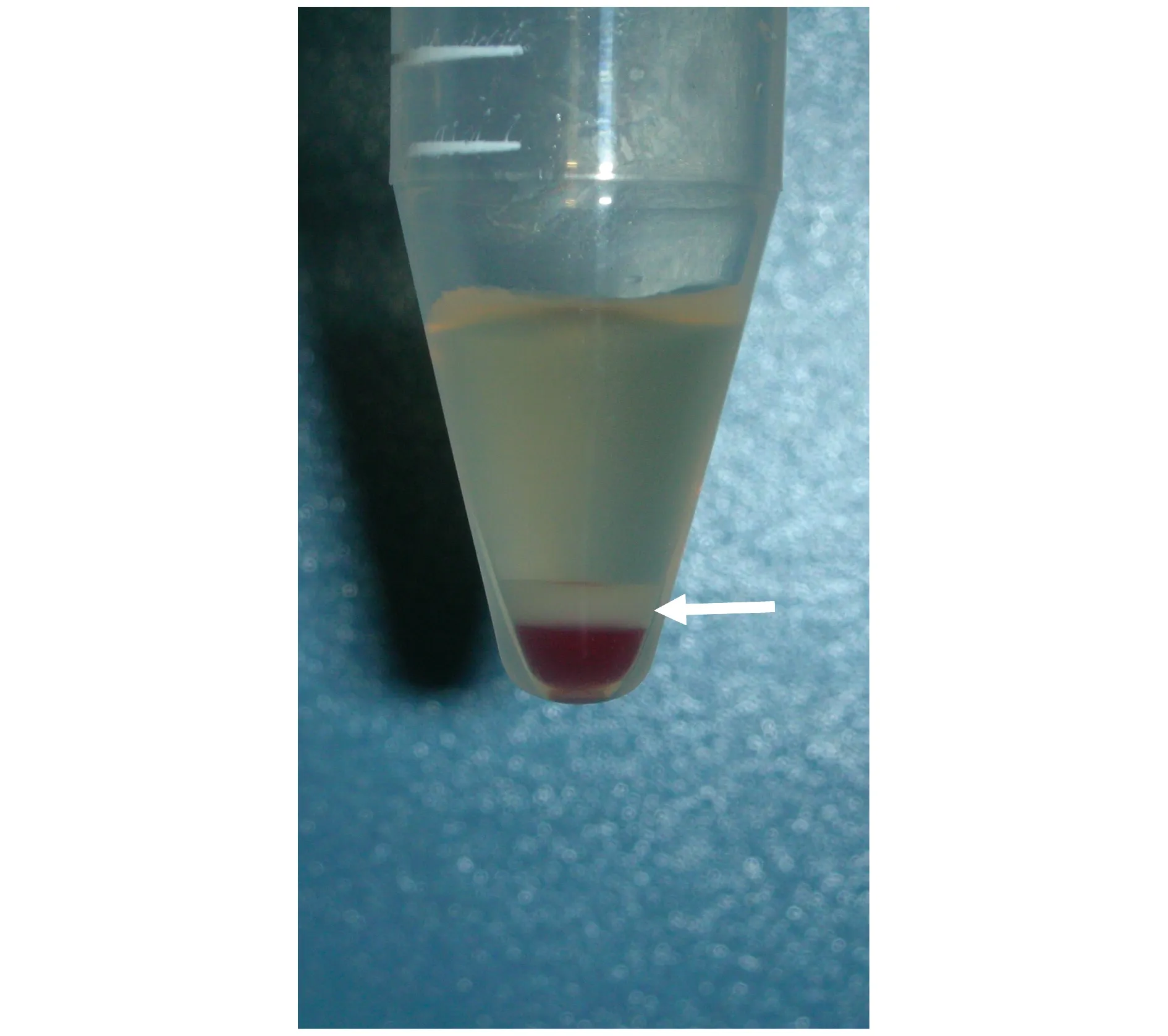
图2 血小板富集层(中间层)Fig 2 Platelet rich layer (the center layer)

表1 A组血小板计数Tab 1 Platelet counts in group A
1~4:Animal No.
X线检查 通过对不同时间点兔侧位X线的测量和计算发现,A组和D组相应节段椎间隙高度无明显下降,组内各时间点%DHI差异无统计学意义(P>0.05)。B组和C组相应节段椎间隙高度随时间推移均逐渐下降,组内各时间点%DHI差异有统计学意义(P<0.05)。在初次手术后4周(二次手术后2周)时间点,A组与B组或C组相比,%DHI差异均有统计学意义(P<0.05)。A组与D组相比,%DHI差异无统计学意义(P>0.05)。B组与C组相比,%DHI差异无统计学意义(P>0.05)。B组或C组与D组相比,%DHI差异均有统计学意义(P<0.05,表2)。

表2 不同时间点X线检查所示的%DHITab 2 %DHI indicated by X-rays at different time points
T1:Before the 1stoperation; T2:4 weeks after the 1stoperation.Data were compared between the same colum respectively.(1)vs.T1,P<0.05;(2)vs.group A,P<0.05;(3)vs.group D,P<0.05.
MRI检查 通过对不同时间点兔矢状位T2WI MRI影像的观察发现,B组和C组相应节段椎间盘髓核信号强度在术后呈现逐渐降低趋势,髓核面积逐渐缩小,椎间隙高度也逐步下降。A组和D组相应节段椎间盘髓核信号强度、髓核面积以及椎间隙高度的变化不明显(图3)。
根据Pfirrmann改良分级法进行IDD分级。A组和D组内各时间点差异无统计学意义(P>0.05);B组和C组组内各时间点差异有统计学意义(P<0.05)。在初次手术后4周(即二次手术后2周),A组与B组或C组相比,差异均有统计学意义(P<0.05);A组与D组相比,差异无统计学意义(P>0.05);B组与C组相比,差异无统计学意义(P>0.05);B组或C组与D组相比,差异均有统计学意义(P<0.05,表3)。
组织学检查 通过对兔椎间盘的HE染色检查发现,随着时间的推移,B组和C组的椎间盘组织表现为髓核软骨细胞退行性变、坏死,形态不规则,分布不均匀;Masson染色显示软骨基质逐步被纤维束取代;番红O染色可见蛋白聚糖减少;而Ⅱ型胶原免疫组化染色则提示Ⅱ型胶原减少。A组的椎间盘组织形态与D组相比变化不明显(图4~7)。

图3 不同时间点兔腰椎MRI图像Fig 3 MR images of rabbit lumbar at different time points
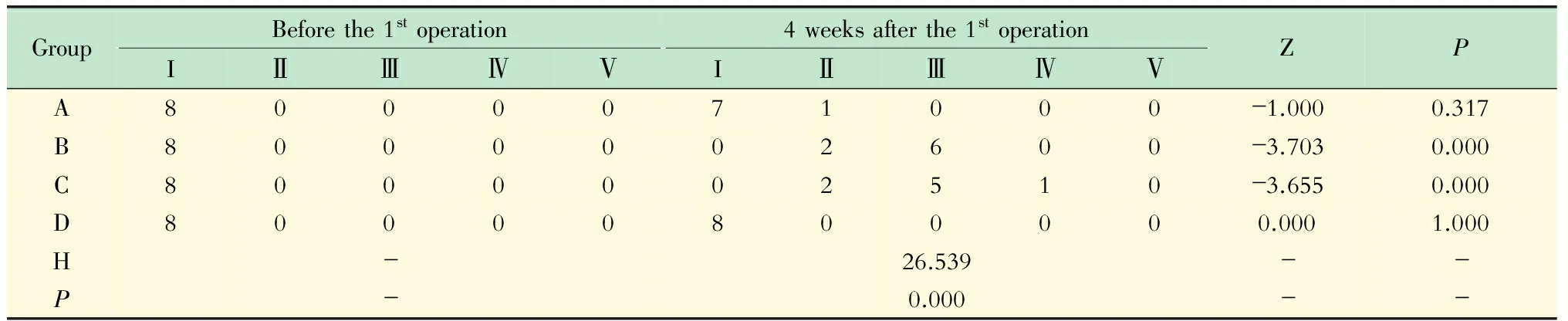
表3 不同时间点MRI的IDD分级Tab 3 IDD grades of MR images at different time points (n)

图4 初次手术后4周兔椎间盘组织的HE染色(×100)Fig 4 HE staining of rabbit intervertebral discs 4 weeks after the 1st operation (×100)

图5 初次手术后4周兔椎间盘组织的Masson染色(×100)Fig 5 Masson staining of rabbit intervertebral discs 4 weeks after the 1st operation (×100)

图6 初次手术后4周兔椎间盘组织的safranin O染色(×100)Fig 6 Safranin O staining of rabbit intervertebral discs 4 weeks after the 1st operation (×100)

图7 初次手术后4周兔椎间盘组织的IHC染色(×100)Fig 7 IHC staining of rabbit intervertebral discs 4 weeks after the 1st operation (×100)
根据半定量评估标准进行IDD分级,在初次手术后4周(二次手术后2周)的时间点,A组与B组或C组相比,差异均有统计学意义(P<0.05);A组与D组相比,差异无统计学意义(P>0.05);B组与C组相比,差异无统计学意义(P>0.05);B组或C组与D组相比,差异均有统计学意义(P<0.05,表4)。
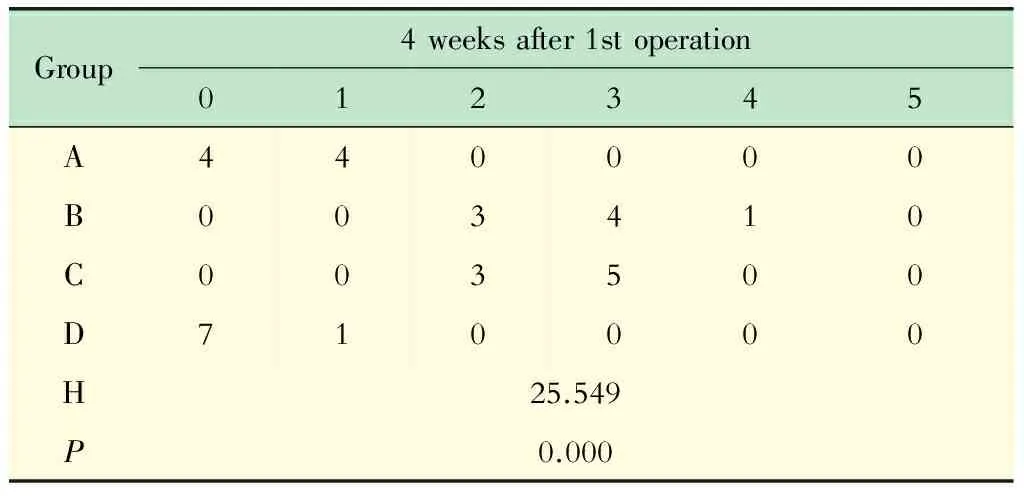
表4 术后4周组织学(HE染色)的IDD分级Tab 4 IDD grades of pathology (HE staining) at the time points of 4 weeks after the 1st operation (n)
The pathological changes of nucleus pulposus were graded according to the semiquantitative criterion from the literature[7]
讨 论
IDD动物模型的建立与评价方法 建立简单、经济、可靠、重复性好的动物模型。以提供良好的实验载体,对有关IDD的发病机制和修复策略的研究具有重要意义。虽然已有报道的用于建立IDD模型的实验动物有十余种,但由于伦理和经济因素等条件限制,灵长类、猪、犬等大型哺乳动物难以大量应用,故目前仍多以兔和大鼠作为构建IDD模型的常规实验动物。兔相对大鼠具有更能耐受手术创伤、更易获取椎间盘及分离髓核组织等优点,是用于构建IDD模型较为实用、可行的动物。通过外科手术方法损伤纤维环引发IDD是一种广泛应用的建模方法。传统的采用刀片直接损伤纤维环的方法可以较快引起椎间盘退变,但该方法不易控制损伤程度,所诱导的椎间盘退变过程往往周期短、进展快、可重复性差。近年来,Masuda等[8]提出使用普通针头穿刺纤维环的方法建立兔IDD模型,具有操作简便、实验周期短、成功率高等优点,使用较为广泛。通过穿刺可以直接损伤纤维环,从而降低了椎间盘内的静水压,继而引起蛋白聚糖及胶原成分的改变,使得椎间盘的载负能力下降,退变进行性加重,能比较真实地模拟人类IDD的过程。我们已通过以往的实验证实,采用纤维环穿刺法能成功建立IDD模型[9]。
X线能够提供椎间盘高度降低、骨赘形成及椎间盘钙化等病变信息,DHI是椎间盘前部、中部、后部三者高度的均数除以相邻椎体高度均数的结果[8],是定量分析IDD程度的重要指标。MRI能够提供清晰的椎间盘图像,对评估IDD非常有价值。IDD的变化反映在MRI上变现为,代表含水量的T2信号强度减弱并有椎间隙狭窄[10]。组织学方面,HE染色能够清晰显示各层组织结构;Masson染色可使胶原纤维呈现蓝色,能良好显示胶原纤维的变化;番红O染色主要反映蛋白聚糖含量及分布情况;通过免疫组织化学染色的观察,则可以了解Ⅱ型胶原的变化情况。正常椎间盘髓核主要由脊索细胞和软骨样细胞构成;纤维环内层主要为软骨样细胞,外层则为纤维样细胞。脊索细胞在维持椎间盘的完整性和基质的稳定性方面发挥至关重要的作用。IDD早期出现脊索细胞的减少,此时软骨样细胞增殖试图修复因脊索细胞减少引起的退变,这种修复进程一旦失败,则随着退变的进展,基质和软骨样细胞也逐渐减少;到了IDD晚期,髓核被纤维软骨替代并伴有周围广泛的骨赘形成[11]。
IDD的分子机制与生物学治疗策略 IDD的分子机制十分复杂,涉及到基因变异、细胞衰老、细胞外基质改变、降解酶生成增加、促炎因子表达、细胞凋亡、神经内生长等多个方面[2,12]。基因变异作为IDD的危险因素已得到广泛证实,目前已发现了部分可能与IDD进程相关的基因类型。通过对衰老相关酶的研究和对端粒长度的测量,发现在退变的椎间盘中细胞会加速衰老,压力诱导性早发衰老(stress-induced premature senescence,SIPS)可能是加速细胞衰老的原因。在退变的椎间盘中,最初Ⅱ型胶原合成会出现短暂代偿性上升,随后Ⅱ型胶原和Ⅸ型胶原的合成速度都会加速下降。基质合成下降伴随着胶原交联的减少,进而影响髓核结构的完整性。反之,Ⅰ型和Ⅹ型胶原的表达增加,导致髓核纤维化,髓核和纤维环分界不清。随着IDD进展,可能在细胞外基质的产生和修复过程中发挥作用的多种蛋白聚糖的表达也出现下降。细胞外基质生成减少与退变的椎间盘细胞中降解酶生成增加有关。基质金属蛋白酶(matrix metalloproteinase,MMP)家族不仅直接减少基质生成,还通过激活其他潜在酶间接引起IDD。带有血小板凝血酶敏感蛋白样模体的解整链蛋白金属蛋白酶家族在正常椎间盘中表达,在退变椎间盘中表达增加,提示其可能具有稳定活性,正常状态下维持基质代谢,在退变椎间盘中加速基质降解。促炎因子通过刺激椎间盘细胞产生炎性介质,从而在IDD进程中间接发挥作用。白细胞介素(interleukin,IL)-1是在椎间盘中表达的典型炎症因子。在正常椎间盘中,IL-1的激活受体IL-1RI和抑制受体IL-1Ra处于平衡状态,而在退变椎间盘中,平衡状态被打破,产生抑制细胞外基质生成、促进降解酶生成、建立正反馈促进炎症因子生成、间接启动细胞凋亡等作用。肿瘤坏死因子α(tissue necrosis factor-alpha,TNF-α)在退变椎间盘中的表达增加,其对代谢通路的影响方式与IL-1有相似之处,但引起疼痛的作用更加突出。正常代谢状态下椎间盘细胞结构的衰退,一定程度上是由细胞凋亡或称程序性细胞死亡(programmed cell death,PCD)引起的。在退变的椎间盘中,进入PCD的细胞比率明显升高,这可能是继发于多种机械因素或者生化因素的刺激。正常的椎间盘内无神经血管生长,而在退变的椎间盘中,可见神经血管沿着外层纤维环的裂隙向内生长,这些游离的神经末梢可通过释放神经递质P介导疼痛。正是基于对IDD分子机制认识的不断深入,国内外学者陆续提出了椎间盘细胞移植、干细胞移植、疼痛椎间盘去神经支配、注射治疗蛋白、基因治疗等生物学策略,但此类方法目前大多仍处于起步阶段[2]。
PRP修复IDD的机制与优点 近年来,有关PRP在骨、软骨、肌肉、肌腱等组织再生过程中的作用得到广泛关注,使其成为骨科、整形外科等领域的研究热点[4]。目前国内外有关PRP对IDD修复作用的研究仍局限于细胞试验和小型动物实验。Akeda等[13]经体外实验研究PRP对猪椎间盘细胞的蛋白聚糖和胶原合成的影响,发现PRP能有效地刺激细胞增殖和细胞外基质代谢,其对外层纤维环细胞的作用比对髓核细胞更明显。Nagae等[14]和Sawamura等[15]针对PRP对IDD的修复作用,应用部分髓核摘除的兔IDD模型进行体内实验,结果显示,单纯PRP可抑制椎间盘的进行性退变,而PRP结合明胶凝胶微球则可显著抑制IDD,与对照组相比,MRI影像可见椎间盘高度显著增加,组织学检查可见蛋白聚糖核心蛋白以及Ⅱ型胶原蛋白表达均增加。考虑到髓核摘除建立IDD模型的损伤程度严重,因此需要明胶凝胶微球作为PRP的载体,以延长作用时间、提供力学支持,充分发挥其治疗作用。
PRP修复IDD的具体机制目前尚未明确,可能与其包含的多种生长因子和其他细胞因子调控细胞功能、改善组织微环境、促进修复再生有关。PRP含有转化生长因子(TGF-β1和β2)、血小板源性生长因子(PDGF-AA、-AB和-BB)、血管内皮生长因子(VEGF A和C)、胰岛素样生长因子(IGF-1)和表皮生长因子(EGF)等在内的多种生长因子[4]。Chen等[16]研究表明,补充TGF-β1,尤其是剂量达到30 ng/mL时,能显著提高椎间盘髓核细胞生存能力、促进细胞增殖。Chen等[17]认为,TGF-β1介导的细胞通路可以特异性的激活磷酸化Smad2/3蛋白,上调包括Sox9、Ⅱ型胶原和蛋白聚糖在内的促软骨形成基因的表达,而PRP对Smad2/3蛋白磷酸化的激活作用比单纯的TGF-β1更强。Konttinen等[18]认为TGF-β和EGF具有较强的促增殖作用,而在退变的椎间盘中未能检测到TGF-β和EGF的表达,提示EGF在抑制IDD进程中可能发挥作用。Gruber等[19]研究证实,50~500 ng/mL的IGF-1或100 ng/mL的PDGF都能显著减少椎间盘内凋亡细胞的比例。由此可见,PRP对IDD的修复作用可能是多种生长因子共同参与的结果。
本实验采用纤维环穿刺法建立IDD模型,与Nagae等[14]和Sawamura等[15]采用髓核摘除建模的研究相比,损伤程度较轻。影像学检查的结果表明,PBS注射组和对照组的椎间盘高度均进行性下降,椎间盘信号强度不断减弱,符合IDD的过程;而PRP干预组的椎间盘高度和信号强度改变不明显,提示该组实验兔的IDD受到抑制。组织学检查的结果显示,随着时间的推移,PBS注射组和对照组的实验椎间盘组织病理学表现为髓核软骨细胞退行性变、坏死,形态不规则,分布不均匀,蛋白聚糖及Ⅱ型胶原减少,软骨基质逐步被纤维束取代;而PRP干预组的椎间盘组织形态未发生显著变化,蛋白聚糖及Ⅱ型胶原表达较PBS注射组和对照组明显增加,说明PRP早期干预可以抑制IDD进程。
本研究的局限性在于,从穿刺建立IDD模型到进行PRP注射干预的时间相对较短,虽然治疗效果满意,但对于晚期严重退变的椎间盘,单纯应用PRP是否具有较好的治疗作用还需研究。Obata等[20]报道了一项类似实验,与本研究选择注射干预后2周进行MRI检查不同的是,作者选取了注射干预后8周的时间点再进行MRI检查,结果显示虽然PRP干预组的椎间盘信号强度仍高于对照组,但差异无统计学意义。由此可见,单次注射PRP干预IDD是否具有持续的治疗效果,目前尚不明确。另外,虽然影像学和组织学检查提示,PRP早期干预可显著抑制IDD,但其对椎间盘源性腰腿痛是否具有缓解作用尚不明确。同时,PRP发挥作用的具体机制也有待进一步阐明。
综上所述,自体PRP椎间盘内注射治疗早期IDD的影像学及组织学评价满意,与对照组相比,经PRP干预后椎间盘高度和信号强度明显恢复,蛋白聚糖及Ⅱ型胶原表达明显增加,椎间盘组织形态接近正常椎间盘,说明PRP干预可以有效抑制早期IDD进程。
[1] Hughes SP,Freemont AJ,Hukins DW,etal.The pathogenesis of degeneration of the intervertebral disc and emerging therapies in the management of back pain[J].JBoneJointSurgBr,2012,94(10):1298-1304.
[2] Kepler CK,Anderson DG,Tannoury C,etal.Intervertebral disk degeneration and emerging biologic treatments[J].JAmAcadOrthopSurg,2011,19(9):543-553.
[3] Maidhof R,Alipui DO,Rafiuddin A,etal.Emerging trends in biological therapy for intervertebral disc degeneration[J].DiscovMed,2012,14(79):401-411.
[4] Alsousou J,Ali A,Willett K,etal.The role of platelet-rich plasma in tissue regeneration[J].Platelets,2013,24(3):173-182.
[5] Landesberg R,Roy M,Glickman RS.Quantification of growth factor levels using a simplified method of platelet-rich plasma gel preparation[J].JOralMaxillofacSurg,2000,58(3):297-300.
[6] Pfirrmann CW,Metzdorf A,Zanetti M,etal.Magnetic resonance classification of lumbar intervertebral disc degeneration[J].Spine(PhilaPa1976),2001,26(17):1873-1878.
[7] Nomura T,Mochida J,Okuma M,etal.Nucleus pulposus allograft retards intervertebral disc degeneration[J].ClinOrthopRelatRes,2001,(389):94-101.
[8] Masuda K,Aota Y,Muehleman C,etal.A novel rabbit model of mild,reproducible disc degeneration by an anulus needle puncture:correlation between the degree of disc injury and radiological and histological appearances of disc degeneration[J].Spine(PhilaPa1976),2005,30(1):5-14.
[9] 桂柯科,尹望平,张飚,等.纤维环穿刺法建立兔椎间盘退变模型[J].中国矫形外科杂志,2010,18(21):1814-1816.
[10] Marinelli NL,Haughton VM,Muoz A,etal.T2 relaxation times of intervertebral disc tissue correlated with water content and proteoglycan content[J].Spine(PhilaPa1976),2009,34(5):520-524.
[11] Sobajima S,Kompel JF,Kim JS,etal.A slowly progressive and reproducible animal model of intervertebral disc degeneration characterized by MRI,X-ray,and histology[J].Spine(PhilaPa1976),2005,30(1):15-24.
[12] Kepler CK,Ponnappan RK,Tannoury CA,etal.The molecular basis of intervertebral disc degeneration[J].SpineJ,2013,13(3):318-330.
[13] Akeda K,An HS,Pichika R,etal.Platelet-rich plasma (PRP) stimulates the extracellular matrix metabolism of porcine nucleus pulposus and anulus fibrosus cells cultured in alginate beads[J].Spine(PhilaPa1976),2006,31(9):959-966.
[14] Nagae M,Ikeda T,Mikami Y,etal.Intervertebral disc regeneration using platelet-rich plasma and biodegradable gelatin hydrogel microspheres[J].TissueEng,2007,13(1):147-158.
[15] Sawamura K,Ikeda T,Nagae M,etal.Characterization ofinvivoeffects of platelet-rich plasma and biodegradable gelatin hydrogel microspheres on degenerated intervertebral discs[J].TissueEngPartA,2009,15(12):3719-3727.
[16] Chen S,Emery SE,Pei M.Coculture of synovium-derived stem cells and nucleus pulposus cells in serum-free defined medium with supplementation of transforming growth factor-beta1:a potential application of tissue-specific stem cells in disc regeneration[J].Spine(PhilaPa1976),2009,34(12):1272-1280.
[17] Chen WH,Lo WC,Lee JJ,etal.Tissue-engineered intervertebral disc and chondrogenesis using human nucleus pulposus regulated through TGF-beta1 in platelet-rich plasma[J].JCellPhysiol,2006,209(3):744-754.
[18] Konttinen YT,Kemppinen P,Li TF,etal.Transforming and epidermal growth factors in degenerated intervertebral discs[J].JBoneJointSurgBr,1999,81(6):1058-1063.
[19] Gruber HE,Norton HJ,Hanley EN Jr.Anti-apoptotic effects of IGF-1 and PDGF on human intervertebral disc cellsinvitro[J].Spine(PhilaPa1976),2000,25(17):2153-2157.
[20] Obata S,Akeda K,Imanishi T,etal.Effect of autologous platelet-rich plasma-releasate on intervertebral disc degeneration in the rabbit anular puncture model:a preclinical study[J].ArthritisResTher,2012,14(6):R241.
Interentional effect of platelet-rich plasma (PRP) on a rabbit model of early-stage intervertebral disc degeneration (IDD)
GUI Ke-ke1, YU Yong-lin2△, REN Wei-min3, LI Xin4, DONG Jia-chun1, YIN Wang-ping1
(1DepartmentofOrthopaedics,3DepartmentofPathology,4DepartmentofRadiology,JinshanHospital,FudanUniversity,Shanghai201508,China;2DepartmentofOrthopaedics,HuashanHospital,FudanUniversity,Shanghai200040,China)
Objective To evaluate imaging and histological outcomes of a new approach for repair of degenerative intervertebral discs in rabbit models by annular puncture injection of autologous platelet-rich plasma (PRP) into the discs. Methods Sixteen healthy adult New Zealand white rabbits were randomly divided into 4 groups:group A,PRP intervention group (n=4); group B,phosphate buffered saline (PBS) injection group (n=4); group C,modeling group (n=4); group D,control group (n=4).Rabbits in A,B and C group were treated by intervertebral disc degeneration (IDD) models L4/5 and L5/6 by annular puncture.The intervention was repeated two weeks later.The animals in group A were administered PRP prepared from the arterial blood of rabbit ears according to a method developed by Landesberg.Next,0.1 mL PRP was injected into the discs according to models L4/5 and L5/6.Animals in group B were additionally injected with 0.1mL PBS into the same intervertebral spaces,while no further steps were taken for animals in group C.Two weeks after the second intervention,X-ray and magnetic resonance imaging (MRI) were performed.The animals were then euthanized and experimental disc tissues were removed.HE staining,Masson′s trichrome,Safranin O staining,and immunohistochemical staining of type Ⅱ collagen were performed to demonstrate the histological changes. Results All animals survived to the end of the experiment.The platelet count of PRP was approximately 3.69 times as much as that of peripheral blood.Over time,intervertebral space heights and disc signals decreased in group B and C,the differences of disc height index percentage (%DHI) and IDD classification of MRI between each time points were statistically significant (P<0.05).In group A and D,intervertebral space heights and disc signals had no significant changes,while at the time point of 4 weeks after first operation,the differences were statistically significant compared with group B and C (P<0.05).In group B and C,degeneration,necrosis,irregular,and uneven distribution of chondrocytes in the nucleus pulposus could be watched,cartilage matrix was gradually replaced by fiber bundles,proteoglycans and type Ⅱ collagen decreased.In group A and D,disc tissue morphology had no significant changes,while at the time point of 4 weeks after the first operation,the differences were statistically significant compared with group B and C (P<0.05). Conclusions The imaging and histological effects of autologous PRP injection on rabbit models of early-stage IDD are satisfactory.Early PRP intervention may effectively inhibit the progress of IDD.
platelet-rich plasma (PRP); intervertebral disc degeneration (IDD); biological therapy; rabbit
R 681.5
A
10.3969/j.issn.1672-8467.2015.02.010
2013-12-24;编辑:段佳)
上海市金山区科技创新基金(2012-03-05)
△Corresponding author E-mail:yuyonglin@fudan.edu.cn
*This work was supported by the Scientific and Technical Innovation Foundation of Science and Technology Commission of Jinshan District,Shanghai (2012-03-05).
