雌激素水平对大豆苷原(DAI)促成大鼠骨细胞分化作用的影响
2015-06-24丁巧灵王金凤徐小雅金慰芳王洪复高建军
丁巧灵 王金凤 徐小雅 周 轶 金慰芳 王洪复 高建军
(复旦大学放射医学研究所骨代谢研究室 上海 200032)
雌激素水平对大豆苷原(DAI)促成大鼠骨细胞分化作用的影响
丁巧灵 王金凤 徐小雅△周 轶 金慰芳 王洪复 高建军
(复旦大学放射医学研究所骨代谢研究室 上海 200032)
目的 观察基础雌激素(estrogen)水平对大豆苷原(daizein,DAI)促成骨细胞分化作用的影响。方法采用酶消化法分离培养新生SD大鼠头盖骨成骨细胞,通过培养液中添加17β-雌二醇改变培养微环境(包括空白对照)雌激素水平,应用MTT法和对硝基苯磷酸盐(p-nitropheny-phosate,PNPP)法检测细胞增殖率和碱性磷酸酶(alkaline phosphatase,ALP)活性,应用real-time PCR法检测其雌激素受体α(ERa)、雌激素受体β(ERβ)和过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR)γ的mRNA水平变化,研究雌激素基础水平变化对DAI促成骨细胞分化作用的影响。结果 培养环境中雌二醇水平升高致DAI的促分化作用减弱。其中100 nmol/L DAI组ALP比活性较对照组的增幅由雌激素补充前的23%分别降至8%(17β-雌二醇为100 pmol/L)和-11%(17β-雌二醇为1 000 pmol/L),显示基础雌激素水平对DAI促分化的拮抗作用。为避免培养液中血清雌激素的可能影响,进一步采用去激素血清培养(含2%去激素胎牛血清)。此时补充17β-雌二醇至100 pmol/L,DAI各剂量组细胞ALP比活性较对照组明显增加(16%~21%,P<0.05)。继续补充雌激素至1 000和10 000 pmol/L 时,其作用反而减弱。该结果显示,DAI促成骨细胞分化作用与雌激素基础水平有关,低雌激素状态(≤100 pmol/L)可增强其作用。为进一步探索其作用机制,我们初步观察了雌激素(100 pmol/L)和DAI(100 nmol/L)单独或联合作用下成骨细胞ERa、ERβ和PPARγ受体表达变化。结果显示,100 pmol/L 17β-雌二醇明显上调ERβ表达,并部分抵抗DAI下调ERβ的作用。结论 DAI的促成骨分化作用与基础雌激素水平有关,低雌激素(≤100 pmol/L)状态有利于DAI的促分化作用,而雌激素水平升高可减弱其促分化作用。
成骨细胞; 大豆苷原(DAI); 雌激素; 碱性磷酸酶(ALP); 大鼠
近年来,异黄酮(isoflavones)等植物雌激素(phytoestrogens,PE)对绝经后妇女骨质疏松(postmenopausal,PMOP)的防治作用受到普遍关注[1-3]。异黄酮可有效延缓卵巢切除动物的骨量丢失,但对其临床疗效仍存争议[3-4]。临床研究结果发现,异黄酮对绝经后妇女骨量丢失的保护作用可表现为有效、部分有效,甚至无效。疗效差异可能与受试者绝经时间等有关[4-5],但确切原因和机制仍未完全阐明。雌激素是绝经后妇女骨代谢调节的关键激素之一[6],异黄酮的作用差异是否与绝经后妇女体内雌激素水平变化有关等问题仍不明确。大豆苷原(daidzein,DAI)是一种异黄酮化合物,前期研究发现雌激素可影响其对成骨细胞受体的调节作用[7]。为进一步明确雌激素在基础水平对异黄酮促骨形成作用的影响,本研究以新生SD大鼠头盖骨成骨细胞为研究对象,观察不同雌二醇浓度的培养环境对DAI促成骨细胞分化作用的影响。
材 料 和 方 法
成骨细胞分离培养 参考文献[8],取新生SD大鼠颅盖骨,于0.25%胰蛋白酶(美国Amersco公司)中37 ℃下预消化20 min后,将骨片剪成约1 mm2的小块,于0.1%Ⅱ型胶原酶(美国Sigma公司)中37 ℃消化50 min,收集消化液。用新鲜胶原酶重复消化残留骨碎片1次。将两次收集的消化液离心(280×g,10 min),弃上清液,沉淀用MEM培养液重悬接种,其中含10%胎牛血清(FBS,美国Gibco公司)、100 IU/mL青霉素(华北制药有限公司)、100 μg/mL链霉素(上海新先锋药业有限公司)。于5%CO2、37 ℃、饱和湿度条件下培养,每2~3天换液1次。细胞汇合后,采用0.25%胰蛋白酶消化传代。培养期间用倒置相差显微镜观察成骨细胞的生长状况。
碱性磷酸酶染色 培养皿细胞用PBS洗2次,2.5%戊二醛固定10 min,蒸馏水漂洗3次,根据碱性磷酸酶(alkaline phosphatase,ALP)染色试剂盒(华美生物工程公司)说明书的要求,按NBT∶BCIP∶AP底物液为1∶1∶100的比例配制孵育液,37 ℃下反应30 min,蒸馏水清洗,晾干后甘油明胶封片,显微镜下观察。
药物干预 取第2继代细胞以3 000/孔接种于96孔培养板(美国Costar公司),培养24 h后更换为含2% FBS的MEM培养液。给予DAI(美国Sigma公司)1、100和10 000 nmol/L和等量MEM培养液(对照组)分别作用3和6天,采用对硝基苯甲酸(p-nitropheny-phosate,PNPP)法和MTT法检测细胞ALP活性和细胞增殖率。为观察雌激素状态的影响,通过添加17β-雌二醇(美国Sigma公司)至100、1 000和10 000 pmol/L以调整培养液的雌激素基础水平,给予不同浓度DAI作用6天,观察细胞ALP活性变化。为减少血清中雌激素样物质的影响,进一步采用含2%去激素胎牛血清(coat-striped FBS,CSFBS)(澳大利亚Serana公司)的MEM培养液,观察雌激素在基础水平对DAI作用的影响。
为研究低雌激素增强作用的机制,细胞分别接种于直径35 mm的培养皿,汇合后更换为含2% CSFBS的MEM培养液。随机分为4组,每组4皿,分别单独或合并给予100 nmol/L DAI和100 pmol/L 17β-雌二醇(DAI、DAI-E、E组)和等量MEM培养液(Ctrl组)。6 h后收获细胞,采用real-time PCR法检测雌激素受体(estrogen receptor,ER)α、ERβ和过氧化物酶体增殖物激活受体(peroxisome proliferator-actived receptor,PPAR)γ的表达水平。
细胞ALP活性 取96孔板培养的细胞,经药物干预后,分别采用PNPP法和MTT法检测总ALP活性和细胞增殖率,分别以D405/孔和D570/孔表示,并以D405/D570计算细胞ALP比活性。
real-time PCR分析细胞mRNA水平 以TRTzol(北京天根生化科技有限公司)一步法抽提成骨细胞总RNA,采用QuantiTect Rev.逆转录试剂盒(德国Qiagen公司)逆转录合成cDNA,采用QuantiTect SYBR Green PCR试剂盒(德国Qiagen公司)于Mx3000P实时定量PCR系统(品牌Stratagene,美国Agilent公司)进行目的基因real-time RT-PCR定量分析[8]。引物序列(正义链/反义链):ERa,5′-CCG-GTCTATGGCCAGTCGAGCATC-3′/5′-GTAGAAG-GCGGGAGGGCCGGTGTC-3′(240 bp,NM012689.1);ERβ,5′-TTCCCGGCAGCACCAGTAACC-3′/5′-TCCCTCTTTGCGTTTGGACTA-3′(262 bp,NM 012754.1);PPARγ,5′-TCAGGTTTGGGCGAA-TGC-3′/5′-TTTGGTCAGCGGGAAGGA-3′(152 bp,NM013124.3);GAPDH,5′-AAACCCATCA-CCATCTTCCA-3′/5′-GTGGTTCACACCCATCACA-A-3′(198 bp,DQ 403053)。实验操作按试剂盒说明,产物经融解曲线单峰验证,获得Ct值,计算各测试基因与内参基因GAPDH比值作相对量分析。
结 果
DAI促进体外培养成骨细胞的分化 体外培养大鼠成骨细胞于含2%FBS的MEM培养液生长良好(图1A),胞质呈ALP染色阳性(图1B)。加入1、100和10 000 nmol/L DAI作用3天,细胞增殖受抑,ALP比活性较对照组略有增加(P<0.05,图1C、D、E)。作用6天,细胞增殖受抑而ALP活性增强明显,ALP比活性较对照组增加14%~22%(P<0.001),其中以100 nmol/L剂量组增幅最大(图1F)。
DAI的促分化作用与基础雌激素水平有关 含2%FBS的MEM培养液中,通过添加17β-雌二醇调整雌激素基础水平后,观察不同浓度DAI对成骨细胞的作用。结果显示,在17β-雌二醇为100和1000 pmol/L的基础上各剂量DAI的增殖抑制作用明显缓解(图2B),同时其促分化作用减弱(图2C)。100 nmol/L DAI作用下细胞ALP比活性增幅由未添加基础雌激素的23%降至添加100 pmol/L17β-雌二醇时的8%和添加1 000 pmol/L雌二醇时的-11%(图2D)。当雌二醇基础含量达10 000 pmol/L时,未观察到DAI对细胞分化的影响(图2C、D)。
为去除血清中雌激素样物质的可能干扰,进一步培养细胞于含2% CSFBS的MEM培养液中,观察DAI对成骨细胞的作用。结果显示,在添加100 pmol/L 17β-雌二醇的培养条件下,DAI各剂量组细胞的ALP比活性较对照组增加15%~21% (P<0.01),增幅较未添加基础雌激素时放大2~8倍(图3C、D)。继续增加基础雌二醇含量至1 000和10 000 pmol/L,DAI作用减弱(图3C、D)。

图1 DAI对体外培养大鼠成骨细胞分化的作用Fig 1 The effects of DAI on the differentiation of rat calvarial osteoblasts in vitro

图2 常规培养下雌激素水平对DAI促成骨细胞分化作用的影响Fig 2 Influence of estrogen levels on the effects of DAI in osteoblast differentiation in normal culture
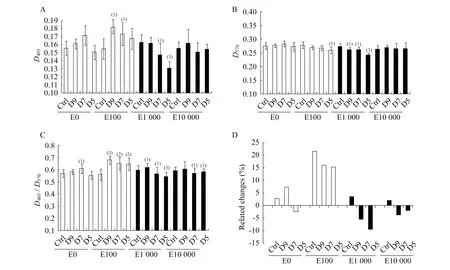
图3 去激素血清培养条件下雌激素对DAI作用的影响Fig 3 Influence of estrogen levels on DAI action on osteoblasts in MEM medium containing with 2% CSFBS

图4 成骨细胞受体ERα 、ERβ和PPARγ的mRNA水平变化Fig 4 The mRNA levels of ERα,ERβ and PPARγ in osteoblasts

低水平雌激素上调成骨细胞ERβ表达 成骨细胞ERα、ERβ和PPARγ介导DAI的生物学作用,其中ERβ的作用更值得重视[9]。为了解低水平雌激素增强DAI作用的机制,我们进一步观察100 pmol/L 17β-雌二醇作用下成骨细胞受体mRNA水平的变化。结果显示,雌激素作用6 h,成骨细胞ERα mRNA水平显著下调,仅为对照组的12%;而ERβ mRNA水平上调,约为对照组的2.5倍(图4A、B)。同时雌激素有效减弱DAI对ERβ mRNA水平下调作用。DAI组ERα 和ERβ mRNA水平分别为对照组的24%和18%。DAI-雌激素组ERα mRNA水平仍维持低水平,而ERβ mRNA恢复至对照组的67%。成骨细胞PPARγ mRNA水平在各组间的差异无统计学意义(图4C)。研究表明,低水平雌激素可能通过上调成骨细胞ERβ mRNA水平和抵抗DAI对其的下调作用,增强其结合DAI的能力。
讨 论
异黄酮类PE包括DAI、染料木黄酮(genistein)、黄豆黄素(glycitein)等,因具有雌激素样抑制骨吸收、促进骨形成作用而有望成为PMOP激素治疗的可能替代物[1-3]。动物实验研究表明异黄酮可以有效延缓卵巢切除鼠的骨量丢失[10],其中DAI的骨保护作用更明显[11-12]。与动物学试验相对一致的研究结果不同,PE延缓绝经后妇女骨量丢失的研究结果不尽相同,出现有效[13-15]、部分有效[16]和无效[4,17-19]等不同甚至相反的结论。差异的产生可能与受试者绝经时间、体重和基础骨量等有关[5,16],也可能与受试药物剂量(如总苷原需达到60~100 mg/d)和使用时间(如需达到2年)[2]以及药物代谢(如牛尿酚生成量)[20-21]等有关,但其确切机制尚不明确。
多位学者研究中发现植物雌激素的疗效与受试者绝经后时间有关[3-5]。在一项涉及202名60~75岁绝经后健康妇女、为期1年的双盲对照研究中,Kreijkamp等[4]通过以绝经年限分层分析发现,异黄酮(99 mg/天)干预后绝经<14年的人群骨密度值呈增加趋势,其中粗隆间骨密度增加有统计学意义,而在绝经>22年的人群骨密度值呈下降趋势。对此作者认为延缓骨量丢失较纠正已发生的骨量丢失更容易。Chen等[5]在一项针对203名48~62岁绝经后妇女、为期1年的干预研究中发现,异黄酮(80 mg/天)在绝经≥4年的妇女中显示出骨保护作用(全髋和大转子骨矿含量增加),而在绝经<4年的妇女中不显示该作用。作者认为异黄酮无法改善绝经早期快速的骨量丢失,而随着快速丢失期结束,异黄酮的作用开始显现。可见,PE对绝经妇女骨量丢失的改善作用可能存在窗口期(绝经后4~14年),窗口期干预多观察到PE的骨保护作用。Marini等[13]选取的受试者绝经时间分别为(69.5±47.4)个月(干预组,n=150)和(59.8±38.8)个月(对照组,n=154),经过2年的干预证实染料木黄酮(54 mg/天)可改善腰椎和股骨颈骨密度[13]。当受试者绝经时间分别为(7±6)年(干预组)和(6±5)年(对照组)时,经过1年的干预研究也观察到染料木黄酮改善腰椎和股骨颈骨密度等[20]。而当受试者绝经时间较短,如在一项涉及237名绝经妇女的多中心双盲对照研究中[平均年龄为(53±3)岁,绝经时间为(33±15)个月],Brink等[17]未观察到异黄酮(110 mg/天,1年)的骨保护作用。Zhu等[15]在一项多中心联合研究中将受试者绝经时间扩展至8~25年,结果显示仙灵骨葆胶囊可短期改善部分部位(腰椎)骨密度,疗效在6月后降低,此疗效的局限性是否与受试者绝经时间的跨度大有关等问题值得进一步分析。这些研究提示PE对绝经妇女骨量丢失的保护作用可能在绝经后4~14年间比较明显。
绝经后骨量经过3~5年快速丢失后逐渐进入年平均丢失1%的缓慢丢失阶段,尽管对该阶段骨量丢失机制仍有不同看法,雌激素无疑仍发挥重要调节作用[6]。绝经后雌激素水平下降。研究显示,当血清雌二醇水平低于40 pg/mL(约108 pmol/L)时就可能发生骨量丢失[21],故常以E2<100 pmol/L作为判断绝经与否或受试者入选条件之一。随着绝经时间延长,雌激素水平仍持续减低,如女性绝经时间为15~16年则血清E2仅为16~18 pmol/L[15]。绝经后基础雌激素水平的变动是否会影响PE的作用尚不清楚。
本课题组前期研究中观察到,DAI通过调节ER和PPARγ等受体基因表达可间接影响成骨细胞的药物反应,并且其受体调节作用受雌激素的影响[7]。为进一步观察雌激素状态的作用,我们通过添加17β-雌二醇以改变培养液的雌激素基础水平,观察DAI体外促大鼠成骨细胞分化的作用变化。结果显示,低雌激素状态有利于DAI促分化的作用。随着培养液中雌激素浓度增加(100~10 000 pmol/L),DAI的作用减弱。而当处于无激素或低激素状态下(采用含2%CSFBS培养液以去除血清中雌激素样物质),DAI促分化作用反而微弱,此时补充100 pmol/L 17β-雌二醇后,其作用明显增强。各剂量组细胞ALP比活性较对照组增加16%~21%,增幅较基础雌激素补充前放大3.6~7.5倍,显示一定量雌激素(~100 pmol/L)环境有利于DAI发挥作用。Sacco等[24]也观察到低剂量雌激素(17β-雌二醇,13 μg,90天缓释)增强亚麻籽延缓卵巢切除大鼠腰椎骨丢失的作用。继续补充雌激素至1 000和10 000 pmol/L 时,DAI的作用减弱并呈低剂量促进/高剂量抑制的双相变化趋势。
成骨细胞ER和PPARγ是PE的主要靶受体,分别介导促进和抑制细胞成骨作用[9]。由于与PE的高亲和力,ERβ介导的作用更突出[25-27]。为了解低雌激素(100 pmol/L)增强DAI作用的机制,我们初步观察了成骨细胞受体ERα、ERβ和PPARγ表达变化。结果显示,100 pmol/L 17β-雌二醇作用下ERα表达显著下调,而ERβ转录明显上调(约为对照组的2.5倍)。当与DAI共同作用下(DAI-E组),ERα表达维持低水平,而ERβ上升至对照组的67%(P>0.05),反映低浓度雌激素对成骨细胞ERβ表达的提升作用及对DAI下调作用的抵抗。上调的ERβ可能通过增强其结合DAI的能力[23-24]或抑制PPARγ信号传递[25]来促进成骨细胞分化。
本研究表明,DAI的促成骨分化作用与微环境中雌激素基础水平有关,低雌激素(≤100 pmol/L)环境有利于DAI发挥作用,而雌激素水平升高则减弱其促分化作用。尽管体外实验结果有一定的局限性,并且未涉及更低雌激素水平(<100 pmol/L)的影响,但本研究仍从细胞水平观察到雌激素状态对DAI促成骨作用的影响,提示雌激素基础水平可能影响PE骨改善作用的发挥,并为PE防治骨质疏松症的临床研究提供实验依据。
致谢 复旦大学放射医学研究所邵春林教授在基因分析过程中提供了帮助。
[1] Setchell KD,Lydeking-Olsen E.Dietary phytoestrogens and their effect on bone:evidence frominvitroandinvivo,human observational,and dietary intervention studies[J].AmJClinNutr,2003,78(3 Suppl):593S-609S.
[2] Branca F.Dietary phyto-oestrogens and bone health[J].ProcNutrSoc,2003,62(4):877-887.
[3] Coxam V.Phyto-oestrogens and bone health[J].ProcNutrSoc,2008,67(2):184-195.
[4] Kreijkamp-Kaspers S,Kok L,Grobbee DE,etal.Effect of soy protein containing isoflavones on cognitive function,bone mineral density,and plasma lipids in postmenopausal women:a randomized controlled trial[J].JAMA,2004,292(1):65-74.
[5] Chen YM,Ho SC,Lam SS,etal.Beneficial effect of soy isoflavones on bone mineral content was modified by years since menopause,body weight,and calcium intake:a double-blind,randomized,controlled trial[J].Menopause,2004,11(3):246-254.
[6] Khosla S,Melton LJ 3rd,Riggs BL.The unitary model for estrogen deficiency and the pathogenesis of osteoporosis:Is a revision needed?[J].JBoneMinerRes,2011,26(3):441-451.
[7] 王立芳,徐小雅,周轶,等.大豆苷原(DA)对成骨细胞雌激素受体(ER)和过氧化物酶体增殖物激活受体γ(PPARγ)[J].复旦学报:医学版,2012,39(1):12-17,24.
[8] Tang W,Wang L,Xu X,etal.Autocrine/paracrine action of vitamin D on FGF23 expression in cultured rat osteoblasts[J].CalcifTissueInt,2010,86(5):404-410.
[9] Dang Z,Löwik CW.The balance between concurrent activation of ERs and PPARs determines daidzein-induced osteogenesis and adipogenesis[J].JBoneMinerRes,2004,19(5):853-861.
[10] Coxam V.Prevention of osteopaenia by phyto-oestrogens:animal studies[J].BrJNutr,2003,89(Suppl 1):S75-S85.
[11] Picherit C,Coxam V,Bennetau-Pelissero C,etal.Daidzein is more efficient than genistein in preventing ovariectomy-induced bone loss in rats[J].JNutr,2000,130(7):1675-1681.
[12] Somjen D,Katzburg S,Kohen F,etal.Daidzein but not other phytoestrogens preserves bone architecture in ovariectomized female ratsinvivo[J].JCellBiochem,2008,103(6):1826-1832.
[13] Marini H,Minutoli L,Polito F,etal.Effects of the phytoestrogen genistein on bone metabolism in osteopenic postmenopausal women:a randomized trial[J].AnnInternMed,2007,146(12):839-847.
[14] Xu M,Qi C,Deng B,etal.Phytotherapy versus hormonal therapy for postmenopausal bone loss:a meta-analysis[J].OsteoporosInt,2009,20(4):519-526.
[15] Zhu HM,Qin L,Garnero P,etal.The first multicenter and randomized clinical trial of herbal Fufang for treatment of postmenopausal osteoporosis[J].OsteoporosInt,2012,23(4):1317-1327.
[16] Chen Y,Ho SC,Lam SH,etal.Soy isoflavones have a favorable effect on bone loss in Chinese postmenopausal women with lower bone mass:a double-blind,randomized,controlled trial[J].JClinEndocrinolMetab,2003,88(10):4740-4747.
[17] Brink E,Coxam V,Robins S,etal.Long-term consumption of isoflavone-enriched foods does not affect bone mineral density,bone metabolism,or hormonal status in early postmenopausal women:a randomized,double-blind,placebo controlled study[J].AmJClinNutr,2008,87(3):761-770.
[18] Kreijkamp-Kaspers S,Kok L,Grobbee DE,etal.Effect of soy protein containing isoflavones on cognitive function,bone mineral density,and plasma lipids in postmenopausal women:a randomized controlled trial[J].JAMA,2004,292(1):65-74.
[19] Tai TY,Tsai KS,Tu ST,etal.The effect of soy isoflavone on bone mineral density in postmenopausal Taiwanese women with bone loss:a 2-year randomized double-blind placebo-controlled study[J].OsteoporosInt,2012,23(5):1571-1580.
[20] Mathey J,Mardon J,Fokialakis N,etal.Modulation of soy isoflavones bioavailability and subsequent effects on bone health in ovariectomized rats:the case for equol[J].OsteoporosInt,2007,18(5):671-679.
[21] Srivastava K,Tyagi AM,Khan K,etal.Isoformononetin,a methoxydaidzein present in medicinal plants,reverses bone loss in osteopenic rats and exerts bone anabolic action by preventing osteoblast apoptosis[J].Phytomedicine,2013,20(6):470-480.
[22] Morabito N,Crisafulli A,Vergara C,etal.Effects of genistein and hormone-replacement therapy on bone loss in early postmenopausal women:a randomized double-blind placebo-controlled study[J].JBoneMinerRes,2002,17(10):1904-1912.
[23] Gomez RF,Svanes C,Bjornsson EH,etal.Hormone replacement therapy,body mass index and asthma in perimenopausal women:a cross sectional survey[J].Thorax,2006,61(1):34-40.
[24] Sacco SM,Jiang JM,Reza-Lopez S,etal.Flaxseed combined with low-dose estrogen therapy preserves bone tissue in ovariectomized rats[J].Menopause,2009,16(3):545-554.
[25] An J,Tzagarakis-Foster C,Scharschmidt TC,etal.Estrogen receptor beta-selective transcriptional activity and recruitment of coregulators by phytoestrogens[J].JBiolChem,2001,276(21):17808-17814.
[26] De Wilde A,Lieberherr M,Colin C,etal.A low dose of daidzein acts as an ERbeta-selective agonist in trabecular osteoblasts of young female piglets[J].JCellPhysiol,2004,200(2):253-262.
[27] Foryst-Ludwig A,Morani A,Gustafsson JK,etal.metabolic actions of estrogen receptor beta (ERβ) are mediated by a negative cross-talk with PPARγ[J].PLoSGenetics,2008,4(6):e1000108.
[28] Wang J,Xu J,Wang B,etal.Equol promotes rat osteoblast proliferation and differentiation through activating estrogen receptor[J].GenetMolRes,2014,13(3):5055-5063.
Influence of estrogen levels in medium on actions of daidzein (DAI) in osteoblast differentiation of ratsinvitro
DING Qiao-ling, WANG Jin-feng, XU Xiao-ya△, ZHOU Yi, JIN Wei-fang, WANG Hong-fu, GAO Jian-jun
(DepartmentofBoneMetabolism,InstituteofRadiationMedicine,FudanUniversity,Shanghai200032,China)
Objective To investigate the contribution of circulating estrogen to the action of daidzein (DAI) on osteoblast differentiationinvitro. Methods Osteoblasts were prepared from calvaria of neonatal SD rats by sequential collagenase digestion and treated with DAI in MEM medium supplied with 2% fetal bovine serum (FBS) or 2% coat-striped fetal bovine serum (CSFBS) respectively.17β-estradiol was added to all medium to modify the estrogen levels as required.The cell proliferation and activity of alkaline phosphatase (ALP) were measured by 3-(4,5-dimethythiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) and p-nitropheny-phosate (PNPP) assays respectively.The expression of ERa、ERβ and peroxisome proliferator-activated receptor (PPAR) γ were determined by real-time RT-PCR. Results Daidzein promoted osteoblasts differentiationinvitro,which was modified by estrogen levels in medium.Compared to the control,the cell ALP activity (D405/D570) was increased to 23% (P<0.001) by 100nmol/L of daidzein in medium containing with 2% FBS.The increase was fell down to 8% in presence of 100 pmol/L 17β-estradiol and -11% in presence of 1 000 pmol/L.When cultured in MEM medium containing with 2% CSFBS,the cell ALP activities,which were slightly increased by 1-100 nmol/L of daidzein,were obviously increased by 16%-21% (P<0.05) in presence of 100 pmol/L 17β-estradiol.The promotions was weaken by the continued increase of estrogen in medium.The expressions of ERα were dramatically down regulated by 100 nmol/L of daidzein alone or the combination with 100 pmol/L of estradiol.The transcriptional levels of ERβ were markedly increased (up to 2.5 times) by estradiol,but decreased to 18% (P<0.05) by daidzein,while back to 67% (P>0.05) by the combination.The expressions of PPARγ were not altered significantly in transcriptional levels. Conclusions The results indicated that effects of daidzein in osteogenesis was modified by the levels of estrogen in medium and the optimal lower level of estrogen (≤100 pmol/L) was in favour of daidzein in promoting osteoblast differentiation.
osteoblast; daidzein (DAI); estrogen; alkaline phosphatase (ALP); rat
R 336, R 589.5
A
10.3969/j.issn.1672-8467.2015.02.008
2013-10-19;编辑:段佳)
△Corresponding author E-mail:mulei80@sina.com
